Lactobacillus plantarum苯丙酮酸还原酶的异源表达及其在苯乳酸制备中的应用
2017-11-27袁风娇李雪晴李剑芳刘艳邬敏辰
袁风娇,李雪晴,李剑芳,刘艳,邬敏辰
1 (江南大学 食品学院,江苏 无锡,214122) 2 (江南大学 无锡医学院,江苏 无锡,214122)
Lactobacillusplantarum苯丙酮酸还原酶的异源表达及其在苯乳酸制备中的应用
袁风娇1,李雪晴1,李剑芳1,刘艳1,邬敏辰2*
1 (江南大学 食品学院,江苏 无锡,214122) 2 (江南大学 无锡医学院,江苏 无锡,214122)
构建产苯丙酮酸还原酶的基因工程菌E.coli/ppr,优化其目的蛋白表达条件,并利用全细胞催化制备光学纯的D-苯乳酸。以Lactobacillusplantarum的基因组DNA为模板,经PCR扩增出一种编码苯丙酮酸还原酶的基因 (ppr),并将其在大肠杆菌BL21中进行表达。以苯丙酮酸为底物,通过单因素和正交试验优化诱导表达条件,然后对E.coli/ppr全细胞制备苯乳酸的工艺进行研究。结果表明:E.coli/ppr在IPTG终浓度为0.5 mmol/L,20 ℃诱导8 h时具有最高的苯丙酮酸还原酶活性。由其催化制备苯乳酸的最佳条件为:反应温度40 ℃,反应初始pH 6.5,葡萄糖浓度20 mmol/L。在上述条件下增加苯丙酮酸的浓度至25 mmol/L,5 h后苯乳酸的最终产率达到98.4%,产物D-苯乳酸光学纯度eegt;99.9%。
苯丙酮酸还原酶;表达;苯乳酸;条件优化;全细胞催化
苯乳酸 (phenyllactic acid, PLA) 是一种新型的天然防腐剂,主要存在于蜂蜜和乳酸菌发酵制品中,具有较为宽广的抑菌谱,对大多数细菌和真菌均有明显的抑制作用[1-3]。与其他生物防腐剂相比,苯乳酸具有分子量低、亲水性强,能够在各种食品体系中均匀扩散等优点,因此作为广谱抑菌剂其应用前景十分广阔[1]。此外,还可以通过聚合反应将苯乳酸聚合成为聚苯乳酸,可作为一种潜在的替代聚乳酸的新型高分子材料,广泛应用于制药工程、组织工程和高分子材料等领域[4]。
苯乳酸可由多种微生物发酵而来,LAVERMICOCCA等[2]通过对酸面团中乳酸菌菌群进行抗真菌能力的研究,首次从1株Lactobacillusplantarum21B的发酵液中检测出苯乳酸。MU等[5-6]通过对发酵培养基的优化和恒定pH流加培养,Lactobacillussp. SK007产苯乳酸的量从2.42 g/L上升到17.38 g/L,产率和转化率分别达到0.241 g/(L·h)和51.1%,这是目前通过发酵法生产苯乳酸的最高纪录。RODRIGUEZ等[7]对5株发酵产生苯乳酸的乳酸菌进行研究,其中L.plantarumCECT-221苯乳酸的产量最高,以苯丙氨酸为底物对培养条件进行优化,在2 L的发酵罐中发酵培养158 h,产量由原来的0.23 g/L上升到0.7 g/L。随着研究的深入,多种来自不同家族的脱氢酶类被发现具有转化苯丙酮酸制备苯乳酸的活性,大部分来自乳酸菌,包括D和L两种构型[8-11]。苯丙酮酸还原酶是微生物合成苯乳酸的一种重要酶[11],基于苯乳酸较强的抑菌性能,筛选产酶活性较高的菌株,挖掘其能够产生高活性及高选择性的苯丙酮酸还原酶基因,生产纯度好、抑菌活性强的苯乳酸是未来研究亟待解决的问题。
由于乳酸菌 (Lactic acid bacteria, LAB)是公认为安全 (Generally Recognized As Safe, GRAS)的微生物,千百年来用于食品加工、保藏,更适于工业化生产。本研究选择Lactobacillusplantarum作为原始菌株,将来自Lactobacillusplantarum的苯丙酮酸还原酶 (phenylpyruvate reductase, ppr) 克隆表达至大肠杆菌E.coliBL21中,构建重组工程菌E.coli/ppr。以苯丙酮酸为底物,通过重组全细胞催化对目的蛋白诱导表达条件及苯乳酸的制备条件进行优化,旨在为进一步提高微生物合成苯乳酸的产率和底物转化率提供借鉴。
1 材料与方法
1.1材料
1.1.1 质粒和菌株
Lactobacillusplantarum、大肠杆菌 (E.coli) JM109、BL21(DE3) 和表达载体pET-28a(+):由作者所在实验室保藏;克隆载体pUCm-T:购自上海Sangon公司;重组质粒pUCm-T-ppr和pET-28a-ppr由本实验室构建和保藏。
1.1.2 主要试剂
SanPrep DNA胶回收试剂盒:购自上海Sangon公司;rTaqDNA聚合酶、限制性内切酶、T4DNA连接酶、DNA和蛋白质Marker:购自大连TaKaRa公司;D,L-苯乳酸标准品和苯丙酮酸标准品:购自上海Sigma公司;其他试剂均为国产或进口分析纯。
1.2方法
1.2.1 引物设计
根据NCBI中已知的L.plantarumD-苯丙酮酸还原酶基因 (D-ppr) 序列 (GenBank: LUXK01000001.1) 设计特异性引物如表1所示,由上海Sangon公司合成。
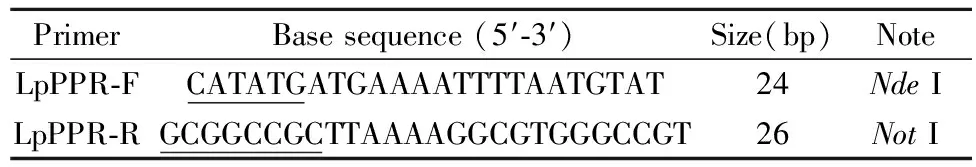
表1 扩增苯丙酮酸还原酶基因的引物
注:下划线为酶切位点。
1.2.2 重组表达质粒的构建
以提取的Lactobacillusplantarum的基因组DNA为模板扩增出目的基因 (ppr),PCR产物经1%凝胶电泳检测。将割胶回收的目的基因片段连接至pUCm-T载体上,转化E.coliJM109感受态细胞中。经蓝白斑筛选及菌液PCR鉴定后获得阳性克隆子E.coliJM109/pUCm-T-ppr,并送往上海Sangon公司测序。将测序正确的转化子用NdeI和NotI双酶切,经割胶回收获得目的基因ppr,与同样经双酶切的表达质粒pET-28a(+) 连接,并转化至E.coliBL21,经菌液PCR验证,获得重组大肠杆菌E.coli/ppr并送往上海Sangon公司进行测序。
1.2.3 苯丙酮酸还原酶诱导表达条件优化
分别挑取测序正确E.coli/pET-28a、E.coli/ppr和E.coliBL21的单菌落接种于2 mL LB液体培养基,37 ℃、220 r/min培养12~14 h。按2%的接种量 (体积分数) 转接入100 mL LB培养基中,37 ℃、220 r/min培养至OD600值为0.6~0.8,添加IPTG至终浓度为0.2 mmol/L,于25 ℃、220 r/min诱导8 h。离心收集细胞,用磷酸盐缓冲液 (100 mmol/L、pH 7.0) 制备一定浓度的菌悬液,用于SDS-PAGE分析。
采用单因素试验考察诱导温度、诱导剂浓度及诱导时间对全细胞合成苯乳酸的影响。重组大肠杆菌初始诱导条件为:添加IPTG至终浓度为0.2 mmol/L,25 ℃诱导8 h。根据单因素试验结果,设计3因素3水平的正交试验优化诱导表达条件 (如表2)。
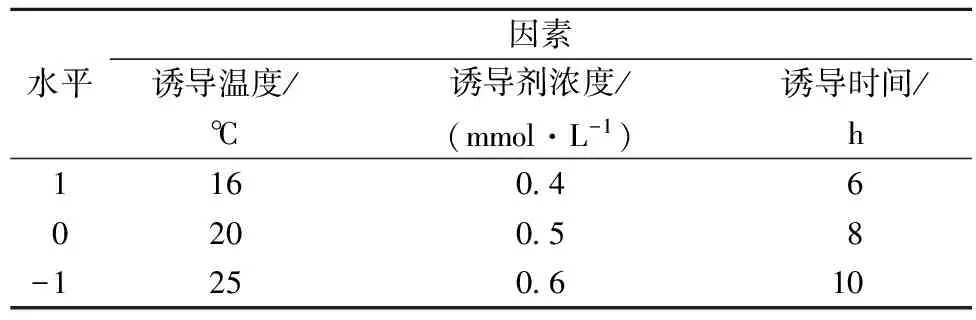
表2 正交实验因素水平表
1.2.4 高效液相色谱分析方法
反相色谱柱型号: ProntoSIL C18AQ(4.6 mm×250 mm,5 μm);优化后的HPLC条件为:流动相为均含有0.05%的三氟乙酸的甲醇 (A) 和水 (B) 的混合液,梯度洗脱程序为:0~15 min由20%A线性变化至65%A,15~16 min由65%A线性变化至100%并保持3 min,19~20 min由100%A线性变化至20%,流速1 mL/min,进样量为10 μL,检测器为紫外检测器,检测波长210 nm,柱温30 ℃。
通过正相HPLC分析苯乳酸的构型,正相色谱柱型号:Chiralcel OD-H (0.46 mm×250 mm,5 μm),流动相为含有0.05%三氟乙酸的正己烷/异丙醇 (98∶2) 混合液,流速1.0 mL/min,进样量10 μL,检测器为紫外检测器,波长为210 nm,柱温30 ℃。
1.2.5 重组大肠杆菌全细胞催化制备苯乳酸的工艺优化
在优化诱导表达条件的基础上,进一步考察pH、反应温度和葡萄糖浓度等因素对转化苯丙酮酸合成苯乳酸工艺的影响。初始转化条件为:pH 7.0,细胞湿重50 g/L,底物浓度10 mmol/L,葡萄糖浓度50 mmol/L,反应温度37 ℃,反应时间为20 min。
2 结果与讨论
2.1重组表达质粒的构建
以L.plantarum的基因组DNA为模板扩增出目的基因 (ppr),经T4DNA连接酶连接至pUCm-T,转化E.coliJM109,经蓝白斑筛选、菌液PCR验证筛选出阳性转化子并送往上海sangon测序。分别提取测序正确的转化子及E.coli/pET-28a的质粒,经NdeI和NotI双酶切后回收酶切产物,连接后转化至E.coliBL21感受态细胞。从转化子中提取重组质粒DNA利用通用引物进行PCR验证,获得大小约为1 400bp的片段 (如图1-a),与预期相符。同时,将提取的重组质粒进行双酶切验证获得大小分别为5 300 bp和1 000 bp的片段 (如图1-b),与理论值相符。将验证正确的转化子命名为E.coli/ppr,保藏并用于后续实验。
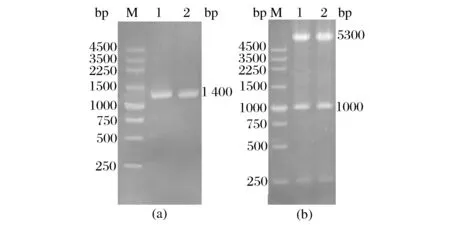
M:DNA Marker;(a)1-2:苯丙酮酸还原酶基因的PCR验证;(b)1-2:重组质粒的双酶切验证图1 重组大肠杆菌E. coli/ppr的验证Fig. 1 Identification of recombinant bacterium E. coli/ppr
2.2重组大肠杆菌的表达及SDS-PAGE分析
对经IPTG诱导后重组大肠杆菌E.coli/ppr、E.coli/pET-28a及原始菌株E.coliBL21进行SDS-PAGE电泳分析,结果如图1所示。与对照菌株相比,E.coli/ppr在约41.3 kDa处有明显条带,除去质粒上融合表达的融合标签,与预测目标蛋白大小一致,表明来自Lactobacillusplantarum的ppr在大肠杆菌中成功表达。
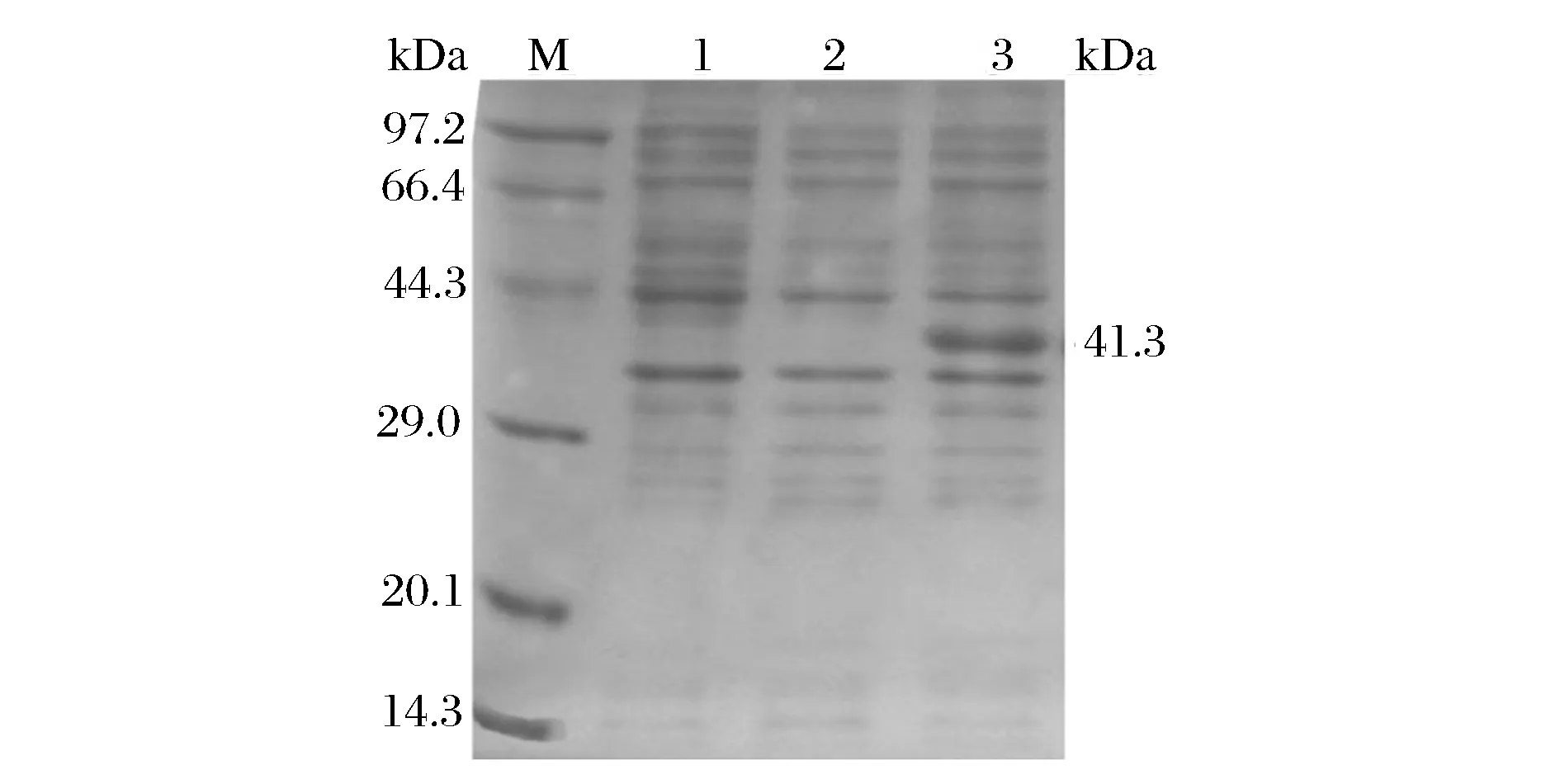
M:标准蛋白Marker;1:原始菌株;2:空质粒菌株;3:重组菌株图2 SDS-PAGE分析苯丙酮酸还原酶蛋白表达Fig.2 The analysis of phenylpyruvate reductase protein by SDS-PAGE
2.3HPLC检测重组大肠杆菌E.coli/ppr全细胞催化制备苯乳酸
全细胞转化实验表明,重组大肠杆菌E.coli/ppr具有明显的催化苯丙酮酸制备苯乳酸的能力,在37 ℃、220 r /min条件下转化20 min,10 mmol/L PPA经50 mg/mL (湿重) 重组大肠杆菌E.coli/ppr转化还原为4.35 mmol/L苯乳酸,底物、产物标品及样品的HPLC检测结果如图3-a。通过正相HPLC分析苯乳酸的构型检测结果如图3-b所示,经计算产物D-苯乳酸光学纯度eegt;99.9%。
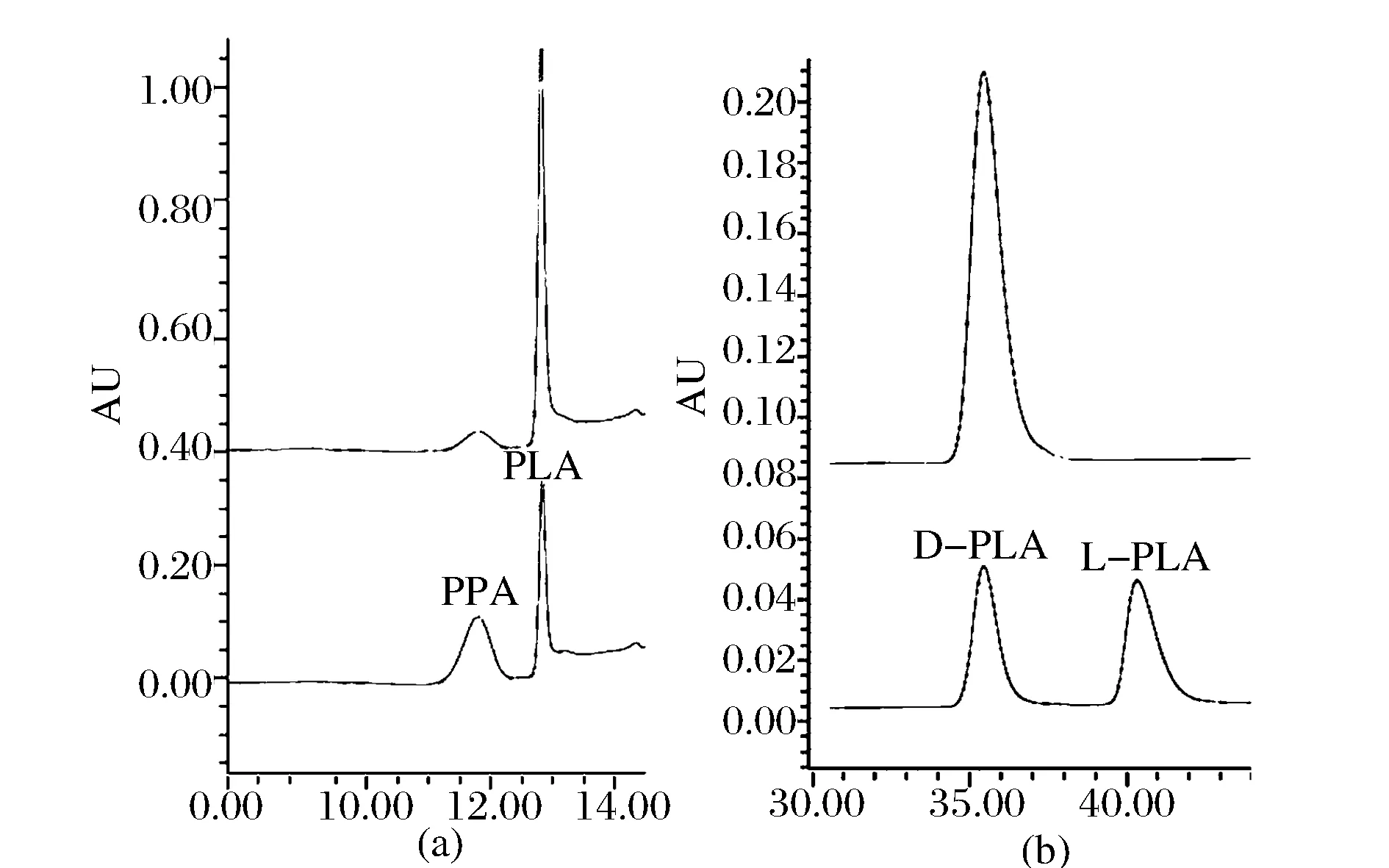
图3 HPLC分析重组大肠杆菌全细胞转化合成苯乳酸Fig.3 HPLC analysis of PLA production by whole cells of recombinant E. coli
2.4重组大肠杆菌诱导条件的优化
2.4.1 诱导温度对全细胞合成苯乳酸的影响
如图4-a所示,随着诱导温度的升高,苯乳酸的产量逐渐升高,而当温度高于20 ℃时,苯乳酸的产量迅速下降。可能是由于低温条件下,宿主菌体生长少,异源蛋白表达量低;温度较高时,宿主菌体生长量大,异源蛋白合成速率高,但高水平表达异源蛋白会影响其正确折叠而形成无活性的不溶性包涵体。另外,收集37 ℃诱导条件的菌体经超声破碎,离心收集上清液和沉淀,分别进行SDS-PAGE和酶活力分析。破碎上清液中无重组苯丙酮酸还原酶的目的条带且无活性,而沉淀在41.3 kDa处出现明显目的蛋白条带 (图略),表明重组蛋白在该条件下形成包涵体。因此,选定20 ℃为最佳诱导温度进行后续优化。
2.4.2 IPTG浓度对全细胞合成苯乳酸的影响
目的基因插入表达质粒pET28a(+) 的上游,T7启动子的下游,可以通过加入IPTG来诱导其表达。IPTG可调节异源蛋白的表达水平,促进包涵体的形成,并抑制大肠杆菌的生长[12]。如图4-b所示,在IPTG浓度为0.5 mmol/L时,苯乳酸产量最高,故选定0.5 mmol/L为最佳诱导浓度进行后续优化。
2.4.3 诱导时间对全细胞合成苯乳酸的影响
如图4-c所示,苯乳酸的产量随着诱导时间延长而增加,诱导时间大于8 h时,其产量略微降低但稳定在80%左右,可能是由于诱导时间延长,大肠杆菌进入衰亡期,产酶速率低于被蛋白酶降解的速率,从而导致活性降低。当诱导时间为8 h时,重组酶活力最高,故选定8 h为最佳诱导时间进行后续优化。
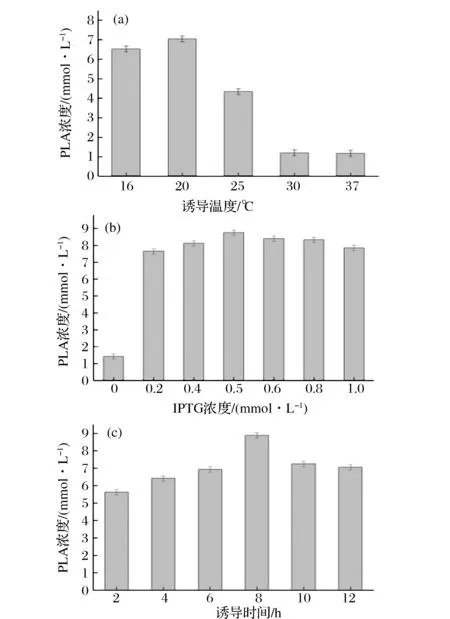
图4 诱导表达条件优化Fig.4 Optimization of induction condition
2.4.4 正交试验结果分析
根据上述单因素试验结果,设计3因素3水平的正交试验,研究各因素和水平之间的的相互关系。如表3所示,极差分析表明影响重组大肠杆菌产酶因素的重要性次序为:诱导温度(A)gt;诱导时间(C)gt;IPTG浓度 (B),其中诱导温度对苯乳酸的产量影响最大,IPTG浓度影响较小。故采用最佳的诱导条件为诱导温度20 ℃,IPTG终浓度0.5 mmol/L,诱导时间8 h,经验证后苯乳酸的产量达到7.85 mmol/L。
2.5全细胞生物催化合成苯乳酸的单因素试验
2.5.1 反应温度对合成苯乳酸的影响
全细胞催化反应其本质仍是酶促反应,因此温度也是影响全细胞催化反应的主要因素之一。在pH 7.0的反应体系下考察不同反应温度 (20、25、30、35、40、45、50、55、60、65 ℃) 对苯乳酸产量的影响。从图5-a可以看出,随着温度的升高,苯乳酸的量也逐渐升高,当温度达到40 ℃时,其产量达到最大,继续升高温度,苯乳酸的产量出现下降的趋势,原因可能是温度升高细胞膜的传质阻力减小,酶与底物间的有效碰撞增多,合成的产物也能更快渗透到胞外,但过高的温度会导致反应中的酶发生失活,催化反应速率随之降低。因此,本实验选择40 ℃作为苯乳酸合成的最佳反应温度。
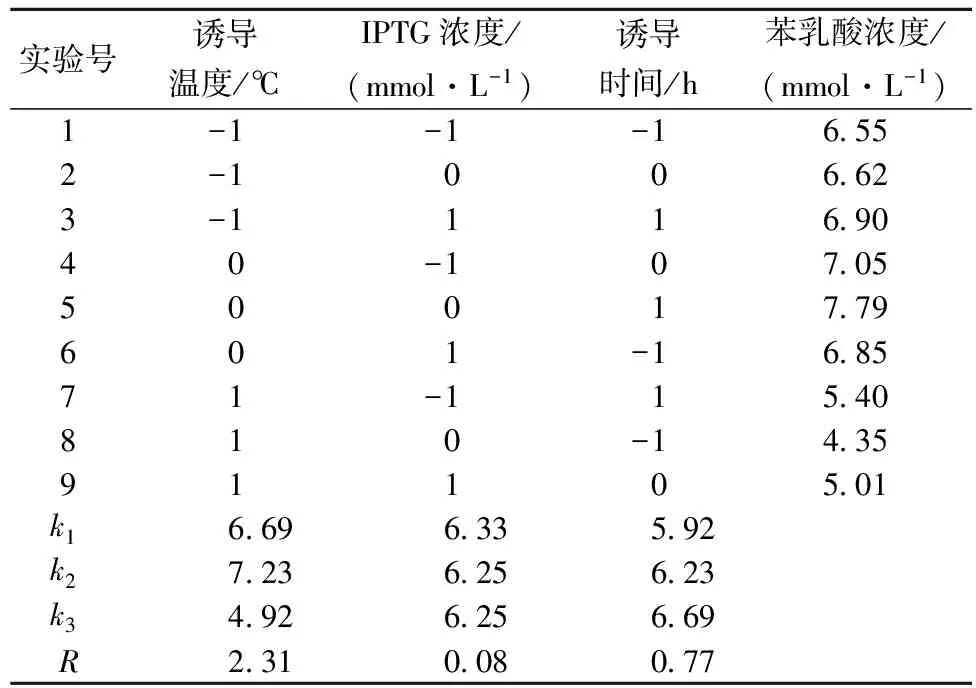
表3 正交试验结果分析表
2.5.2 反应体系pH对苯乳酸合成的影响
转化体系的pH值是影响生物催化反应的重要因素之一。本实验中设置转化缓冲液pH分别为4.0、5.0、5.5、6.0、6.5、7.0、7.5、8.0、9.0,其他试验条件同1.2.5,考察不同pH的反应体系对苯乳酸合成的影响,结果如图5-b所示。从图中可以看出,随着反应体系pH值的增大,合成苯乳酸的量也逐渐增大,当pH达到6.5时,苯乳酸的产量达到最高,继续增加反应体系的pH值,苯乳酸产量反而出现了下降,这可能是因为过高的pH值抑制了酶的活性,导致苯乳酸合成反应受阻。因此,选择pH 6.5为催化合成反应的最佳pH值。
2.5.3 反应体系中葡萄糖浓度对苯乳酸合成的影响
来自Lactobacillusplantarum的苯丙酮酸还原酶是NADH依赖型的还原酶,在转化苯丙酮酸的过程中,需要辅酶NADH的参与,通过胞内辅因子再生系统提高反应体系中NADH的浓度是提高苯乳酸产量的一种有效途径。葡萄糖作为常用的一种相对廉价的碳源,常作为辅助底物用于辅因子再生,维持胞内的氧化还原环境[13]。本研究考察了不同葡萄糖浓度 (0、20、40、60、80、100 mmol/L) 对苯乳酸合成的影响,其他条件同1.2.5,结果如图5-c所示。当加入20 mmol/L葡萄糖时,苯乳酸的产量显著增加。但随着葡萄糖浓度的增加,苯乳酸的产量增幅较小,因此,反应体系中葡萄糖的浓度为20 mmol/L时最佳。

图5 全细胞转化条件优化Fig.5 Optimization of bioconversion conditions
2.6进程曲线的测定
在以上最佳条件下测定反应的进程曲线,即反应温度40 ℃,反应体系pH为6.5,添加葡萄糖的量为20 mmol/L,并增加底物浓度至25 mmol/L。在此条件下转化需要5 h,最终转化率为98.38%。ZHANG等[14]对BacilluscoagulansSDM全细胞催化生产苯乳酸的工艺进行研究,在最优条件下通过底物流加反应20 h后苯乳酸的产量达到37.3 g/L,转化率为70%。LI等[15]研究表明LeuconostocmesenteroidesATCC 8293生长细胞转化合成苯乳酸的最佳底物浓度为35 mmol/L,转化率为75.2%~83.3%。本研究获得的重组工程菌相比于原始菌株具有转化体系简单,转化率高,转化速率快等优点,为苯乳酸的大规模生产及工业化应用奠定了基础。

图6 重组大肠杆菌E. coli pET-28a-ppr催化产生苯乳酸的进程曲线Fig.6 Time course production of PLA by the recombinant E. coli pET-28a-ppr
3 结论
本研究以重组大肠杆菌湿菌体为全细胞催化剂,通过单因素实验及正交实验对目的蛋白的诱导表达条件进行优化,在此基础上对重组大肠杆菌全细胞转化苯丙酮酸制备苯乳酸的条件进行优化。优化后的最适条件为转化温度为40 ℃,转化体系最初pH为6.5,葡萄糖浓度为20 mmol/L。在最佳反应条件下,增加底物的浓度至25 mmol/L,经过5 h反应后,苯乳酸产量达到4.15 g/L,转化率为98.38%,转化率和产量都远远大于通过发酵法生产苯乳酸的量。结果表明基因工程技术结合全细胞转化方法是一种高效可行的合成苯乳酸的途径。另外,采用全细胞催化合成苯乳酸,无需破碎细胞,工艺大大得到简化,同时,还减少了反应杂质,为后续苯乳酸的分离纯化提供了有利的条件。
[1] DIEULEVEUX V, VAN DER PYL D, CHATAUD J, et al. Purification and characterization of anti-Listeriacompounds produced byGeotrichumcandidum[J]. Applied and Environmental Microbiology, 1998, 64(2): 800-803.
[2] LAVERMICOCCA P, VALERIO F, EVIDENTE A, et al. Purification and characterization of novel antifungal compounds from the sourdoughLactobacillusplantarumstrain 21B[J]. Applied and Environmental Microbiology, 2000, 66(9): 4 084-4 090.
[3] LAVERMICOCCA P, VALERIO F, VISCONTI A. Antifungal activity of phenyllactic acid against molds isolated from bakery products[J]. Applied and Environmental Microbiology, 2003, 69(1): 634-640.
[4] FUJITA T, NGUYEN H D, ITO T, et al. Microbial monomers custom-synthesized to build true bio-derived aromatic polymers[J]. Applied Microbiology and Biotechnology, 2013, 97(20): 8 887-8 894.
[5] MU Wan-meng, LIU Feng-li, JIA Jiang-hua, et al. 3-Phenyllactic acid production by substrate feeding and pH-control in fed-batch fermentation ofLactobacillussp. SK007[J]. Bioresource Technology, 2009, 100(21): 5 226-5 229.
[6] MU Wan-meng, CHEN Chao, LI Xing-Feng, et al. Optimization of culture medium for the production of phenyllactic acid byLactobacillussp. SK007[J]. Bioresource Technology, 2009, 100(3): 1 366-1 370.
[7] RODRIGUEZ-PAZO N, VAZQUEZ-ARAUJO L, PEREZ-RODRIGUEZ N, et al. Cell-free supernatants obtained from fermentation of cheese whey hydrolyzates and phenylpyruvic acid byLactobacillusplantarumas a source of antimicrobial compounds, bacteriocins, and natural aromas[J]. Applied Biochemistry and Biotechnology, 2013, 171(4): 1 042-1 060.
[8] MU Wan-meng, YU Shu-huai, JIANG Bo, et al. Characterization of D-lactate dehydrogenase fromPediococcusacidilacticithat converts phenylpyruvic acid into phenyllactic acid[J]. Biotechnology Letters, 2012, 34(5): 907-911.
[9] 王颖,范铭,薛素妹,等. 全细胞催化合成L-苯基乳酸重组大肠杆菌的构建[J]. 食品与发酵工业,2015,41(12): 13-17.
[10] 张玲玲,许国超,倪晔. 不对称合成苯乳酸的酮酸还原酶基因克隆和表达[J]. 食品与生物技术学报,2016,35(9): 950-957.
[11] MU Wan-meng, YU Shu-huai, ZHU Lan-jun, et al. Recent research on 3-phenyllactic acid, a broad-spectrum antimicrobial compound[J]. Applied Microbiology and Biotechnology, 2012, 95(5): 1 155-1 163.
[12] MALAKAR P, VENKATESH K V. Effect of substrate and IPTG concentrations on the burden to growth ofEscherichiacolion glycerol due to the expression of Lac proteins[J]. Applied Microbiology and Biotechnology, 2012, 93(6): 2 543-2 549.
[13] BALZER G J, THAKKER C, BENNETT G N, et al. Metabolic engineering ofEscherichiacolito minimize byproduct formate and improving succinate productivity through increasing NADH availability by heterologous expression of NAD(+)-dependent formate dehydrogenase[J]. Metabolic Engineering, 2013, 20: 1-8.
[14] ZHENG Zhao-juan, MA Cui-qing, GAO Chao, et al. Efficient conversion of phenylpyruvic acid to phenyllactic acid by using whole cells ofBacilluscoagulansSDM[J]. PLoS One, 2011, 6(4): e19030.
[15] LI L, SHIN S-Y, LEE K W, et al. Production of natural antimicrobial compoundD-phenyllactic acid usingLeuconostocmesenteroidesATCC 8293 whole cells involving highly active D-lactate dehydrogenase[J]. Letters in Applied Microbiology, 2014, 59(4): 404-411.
HeterologousexpressionofphenylpyruvatereductasefromLactobacillusplantarumanditsapplicationinthepreparationofphenyllacticacid
YUAN Feng-jiao1, LI Xue-qing1, LI Jian-fang1, LIU Yan1, WU Min-chen2*
1(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China) 2(Wuxi Medical School, Jiangnan University, Wuxi 214122, China)
In order to construct a genetic engineering phenylpyruvate reductase strain (E.coli/ppr), the expression conditions and bioconversion medium were optimized to increase the production of PLA with whole-cell transformation. A phenylpyruvate reductase-encoding gene,ppr, was obtained by PCR from the genomic DNA ofLactobacillusplantarumand heterologously expressed inE.coliBL21 (DE3). Taking phenylpyruvic acid as the substrate, single factor and orthogonal experiments was used to optimized the induced expression and whole-cell catalysis conditions. Results showed that after induction with 0.5 mmol/L IPTG at 20 ℃ for 8 h,E.coli/pprdisplayed the highest LpPPR activity. When phenylpyruvic acid was added up to 25 mmol/L, the product enantiomeric excess percent was over 99.9% and the final yield of PLA could reach 98.38% at 5 h under the optimal catalytic conditions as follows: temperature 40 ℃, initial pH 6.5 and 20 mmol/L glucose.
Phenylpyruvate reductase; expression; phenyllactic acid; optimization; whole-cell catalysis
10.13995/j.cnki.11-1802/ts.015007
硕士研究生(邬敏辰教授为通讯作者,E-mail: biowmc@126.com)。
国家自然科学基金项目 (21676117); 江苏省普通高校研究生科研创新计划项目 (SJLX16-0472)
2017-06-22,改回日期:2017-07-13
