不同免疫方案建立实验性自身免疫性心肌炎小鼠模型的分析与评价
2017-11-27闫红梅
闫红梅,李 覃,周 欣
不同免疫方案建立实验性自身免疫性心肌炎小鼠模型的分析与评价
闫红梅1,2,李 覃3,周 欣2,4,赵季红2,4
目的探讨不同免疫方案建立Balb/c小鼠实验性自身免疫性心肌炎模型的优劣。方法取6周龄雄性Balb/c小鼠,设计三种造模方案,并均设正常对照组和模型组。经不同方案免疫动物后行动物超声影像系统检测心功能,病理形态观察心肌炎症和纤维化,并计算心指数和脾指数,qRT-PCR检测小鼠心脏和脾脏组织TLR2、TLR4基因的表达水平。结果与正常对照组相比,方案一中模型组小鼠心指数和脾指数无明显差异,超声检测中射血分数(EF)及各室壁厚度均无明显差异,心肌炎症改变不明显,纤维化不明显,TLR2、TLR4 mRNA的表达量无明显变化;方案二中模型组EF、左室舒张末内径(LVEDd)以及左室收缩末内径(LVEDs)明显降低,但舒张期室间隔厚度(IVSd)及收缩期室间隔厚度(IVSs)与对照组相比无统计学意义;病理形态观察可见心肌出现少量单核细胞浸润,心肌细胞肿胀,心肌间质及外膜可见少量的纤维化,同时脾指数明显增加,心脏与脾脏组织TLR2、TLR4的mRNA表达量无明显变化;方案三中模型组EF、LVEDd、LVEDs均明显降低,而IVSd及 IVSs未见显著改变,病理学检测可见心肌大量炎细胞浸润,心肌细胞肿胀,心肌间质及外膜可见少量的纤维化,伴有脾指数的显著增加,心脏与脾脏组织TLR2 mRNA的表达量升高,而TLR4的mRNA表达量无明显变化。结论与方案一模型组和方案二模型组相比,方案三模型组的造模效果更好,其免疫方案可用于自身免疫性心肌炎相关研究,具有较好的参考价值。
自身免疫性心肌炎;小鼠模型;TLR;心脏功能
心肌炎是指心肌的炎症性疾病,是导致扩张性心肌病(dilated cardiomyopathy,DCM)的首要原因[1]。病毒性心肌炎(viral myocarditis,VMC)是临床上最常见的类型,自身免疫在其发病机制中发挥重要作用。实验性自身免疫性心肌炎(experimental autoimmune myocarditis,EAM)在组织学上与VMC类似,因此,建立合理的EAM模型,可以为临床研究VMC及其预后评价和药物研发等方面提供基础。目前,EAM动物模型的建立方法差异较大,哪种方法能够达到更好的免疫效果尚待进一步发掘。本研究探索建立小鼠EAM模型的最佳方案,希望为临床上VMC的相关研究奠定物质基础。
1 材料与方法
1.1 材料 雄性Balb/c小鼠,6周龄,体重18 g~20 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。饲养条件为室温22°C~24°C,相对湿度45%~55%,自由饮水,适应性喂养 1 周后投入实验。鼠源性心肌肌球蛋白重链16肽段,购自吉尔生化(上海)有限公司;完全弗氏佐剂(CFA)购自sigma公司;异氟烷购自河北一品制药有限公司; Trizol 试剂盒、DNA marker、PCR试剂盒、反转录试剂盒均为TaKaRa公司产品;Vevo 2100高频小动物超声影像系统为Visualsonics公司产品;Leica石蜡切片机购自莱卡公司。
1.2 建立动物模型 36只Balb/c小鼠随机分为正常组(n=6)和模型组(n=6)。将心肌肌球蛋白重链16肽段溶于0.15 mol/L磷酸钾缓冲液,调浓度为1.0 mg/mL,并与等体积CFA充分乳化混匀。方案一:模型组小鼠分别于即刻、7 d背部多点皮下注射0.2 mL心肌肌球蛋白(100 μg);方案二:模型组小鼠即刻背部多点皮下注射0.3 mL心肌肌球蛋白(150 μg)。方案三:模型组小鼠分别于即刻、7 d背部多点皮下注射0.3 mL心肌肌球蛋白(150 μg)。三种造模方案均设置相应的正常对照组,按相应方案注射等量PBS缓冲液。以上三种方案均于第21天处死小鼠,心脏与脾脏称重,冻存备用。
1.3 高频小动物超声影像系统检测小鼠心功能 第21天用Vevo 2100小动物超声影像系统和40 MHz高频探头测定小鼠心功能。20 mL/min异氟烷麻醉小鼠,仰卧位固定,控制心律400次/min。分别取胸骨旁左室长轴(parasternal long axis,PSLAX)和胸骨旁乳头肌水平左室短轴切面(parasternal short axis,PSSAX)。M型超声模式记录反映心室收缩功能和舒张功能的射血分数(ejection fraction,EF)、左室舒张末内径(left ventricular end- diastolic dimension,LVEDd)、左室收缩末内径(ieft ventricular end- systolic dimension,LVEDs)、舒张期室间隔厚度(interventricular septumdiastolic,IVSd)、收缩期室间隔厚度(interventricular septum systolic,IVSs)等指标。将PSLAX与PSSAX的值求平均值,进行分析比较。
1.4 苏木精-伊红(Hamp;E)染色 在第21天处死小鼠后取心脏组织,从心尖部横切,4%多聚甲醛固定,常规脱水、石蜡包埋,切片(5 μm),常规Hamp;E染色,中性树胶封片,普通光镜下观察心脏组织形态学变化。每张切片随机选取5个视野,计算每个视野中炎症细胞浸润情况。心肌炎症程度根据Eriksson分级法分为0级~4级:0 无明显炎性细胞浸润;1级少量炎性细胞局灶性浸润;2级局灶性炎性细胞浸润(炎性细胞数gt;100个);3级浸润炎性细胞gt;10%;4级浸润炎性细胞gt;30%。
1.5 Masson染色 第21天处死小鼠后取心脏组织,从心尖部横切,4%多聚甲醛固定,常规脱水、石蜡包埋,切片(5 μm),予以常规Masson 三色染色,在200倍普通光镜视野下,分别对心内膜、心外膜以及间质进行观察,随机选取10个视野,进行图像采集。用Image Pro Plus 4.5软件进行图像分析,选出阳性区域,得到阳性区域面积(μm2),计算出阳性区域占总区域的百分比,求均值作为该标本心肌胶原容积分数(collage volume fraction,CVF),以此评估心肌纤维化程度。
1.6 实时定量PCR(Quantitative Real-Time PCR,qRT-PCR)检测 按照Trizol 试剂盒说明书操作,取1.5 μg总RNA,按照反转录试剂盒逆转录成cDNA,引物由北京中美泰和有限公司合成:β-actin(5’-CTAAGGCCAACCGTGAAAAG-3,5’-ACCAGAGGCATACAGGGACA-3’),TLR2(5’-TCTCTGGAGCATCCGAATTG-3’,5’-CCTGAGCAGAACAGCGTTTG-3’),TLR4(5’-ACCTGGCTGGTTTACACGTC-3’,5’-CTGCCAGAGACATTGCAGAA-3’),NLRP3(5’-CCCTTggAgACACAggACTC-3’,5’-gAggCTgCAgTTgTCTAATTCC-3’),qRT-PCR条件为:预变性94 ℃,5 min,变性94 ℃,1 min,退火60 ℃,30 s,延 伸72 ℃,1 min,40个循环后72 ℃延伸5 min。重复3次。设双复孔。β-actin作为内参。采用2-△△Ct方法计算目的基因的表达水平,△△Ct=(Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组。
1.7 脏器指数 免疫后第21天称取小鼠体重,取材前称取心脏重量,脾脏重量,分别计算心脏的重量(mg)/体重(g),脾脏的重量(mg)/体重(g),即心指数和脾指数。

2 结 果
2.1 小鼠心功能变化 方案一中模型组与对照组相比各项指标均无统计学意义(Pgt;0.05)。方案二中模型组EF、LVEDd及LVEDs与对照组相比,有统计学意义(Plt;0.05);而IVSd及 IVSs与对照组相比无统计学意义(Pgt;0.05)。方案三中,模型组EF、LVEDd、LVEDs较对照组明显下降(Plt;0.05);而IVSd及 IVSs与对照组相比无统计学意义(Pgt;0.05)。 方案三中模型组 LVEDd降低程度较方案一模型组更显(Plt;0.05),较方案二的EF值降低更显著(Plt;0.05)。详见图1、表1。
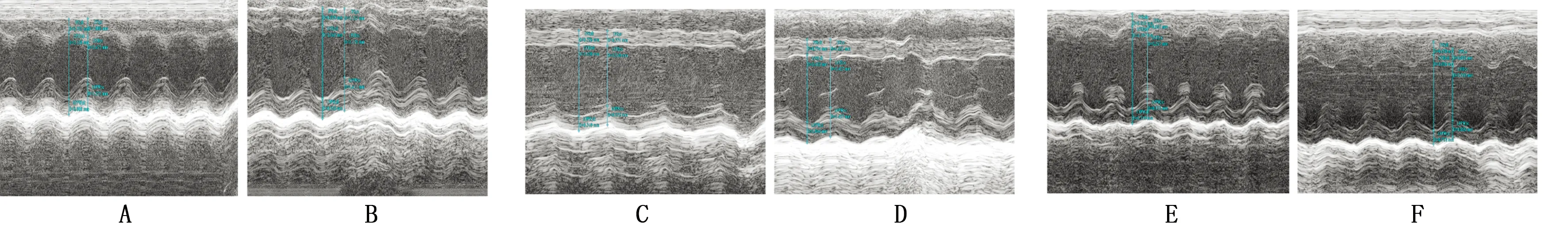
注:A为方案一对照组;B为方案一模型组;C为方案二对照组;D为方案二模型组;E为方案三对照组;F为方案三模型组。
图1小鼠超声心动图


免疫方案组别nEF(%)LVEDd(mm)LVEDs(mm)IVSd(mm)IVSs(mm)方案一对照组658.52±7.483.62±0.302.70±0.230.80±0.171.06±0.25模型组652.65±5.743.21±0.552.52±0.650.95±0.141.28±0.22方案二对照组658.66±5.653.65±0.143.00±0.180.77±0.081.04±0.10模型组651.53±2.161)3.31±0.341)2.53±0.171)0.81±0.091.10±0.11方案三对照组654.59±4.564.37±0.383.12±0.360.86±0.011.03±0.18模型组636.37±4.581)3.86±0.141)2.06±0.201)0.89±0.051.17±0.11 与相同方案对照组比较,1)Plt;0.05。
2.2 心肌组织病理学变化
2.2.1 HE染色结果 方案一、方案二以及方案三中模型组心脏外观与对照组相比,未见明显改变,未见明显心室扩大及室壁增厚或变薄。方案一、方案二以及方案三中对照组小鼠心肌细胞结构基本正常,心肌纤维排列整齐,胞浆均匀丰富,横纹清晰,间质无水肿,无炎症细胞浸润。方案一中模型组于光镜下几乎未见炎症细胞浸润以及心肌细胞肿胀,其心肌炎症评分与对照组相比,无统计学意义(Pgt;0.05)。方案二与方案三中模型组小鼠可见不同程度的炎症改变。方案二中模型组于光镜下可见心肌细胞肿胀,有少量单核细胞浸润,并可见少量淋巴细胞和中性粒细胞,炎症细胞浸润主要集中于心外膜及间质,方案三中模型组于光镜下可见心肌细胞肿胀,有大量单核细胞浸润,并可见少量的淋巴细胞和中性粒细胞,炎症细胞浸润主要集中于心外膜及间质。方案二以及方案三中模型组心肌炎症评分与相应对照组相比,具有统计学意义(Plt;0.01),方案二模型组心肌炎症评分与方案一模型组相比,具有统计学意义(Plt;0.01),方案三模型组心肌炎症评分与方案二模型组相比,具有统计学意义(Plt;0.01)。详见图2、表2。
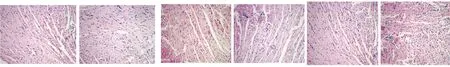
A B C D E F
2.2.2 Masson三色染色 采用三种不同免疫方案免疫小鼠后,两组小鼠心肌Masson染色示胶原纤维呈蓝色,肌纤维呈红色。 方案一中模型组小鼠未见明显纤维化,其模型组的CVF与对照组相比,无统计学意义(Pgt;0.05)。方案二以及方案三中模型组于心肌间质及外膜均可见少量的纤维化。方案二以及方案三中模型组 CVF与其对照组相比,差异具有统计学意义(Plt;0.05)。详见图3、表2。

A B C D E F
注:A为方案一对照组;B为方案一模型组;C为方案二对照组;D为方案二模型组;E为方案三对照组;F为方案三模型组。
图3心肌组织Masson染色(×200)

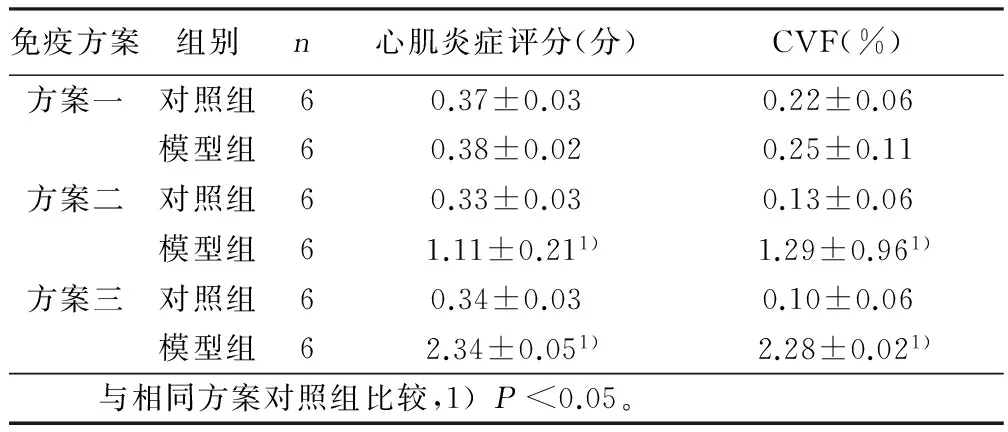
免疫方案组别n心肌炎症评分(分)CVF(%)方案一对照组60.37±0.030.22±0.06模型组60.38±0.020.25±0.11方案二对照组60.33±0.030.13±0.06模型组61.11±0.211)1.29±0.961)方案三对照组60.34±0.030.10±0.06模型组62.34±0.051)2.28±0.021) 与相同方案对照组比较,1)Plt;0.05。
2.3 脏器指数 方案一、方案二以及方案三中第21天心指数与对照组比较,均无统计学意义(Pgt;0.05)。方案一中模型组脾指数与对照组相比,无统计学意义(Pgt;0.05);方案二中模型组脾指数与其对照组相比,具有统计学意义(Plt;0.05)。详见表3。方案三中模型组脾指数与对照组相比,有统计学意义(Plt;0.01)。

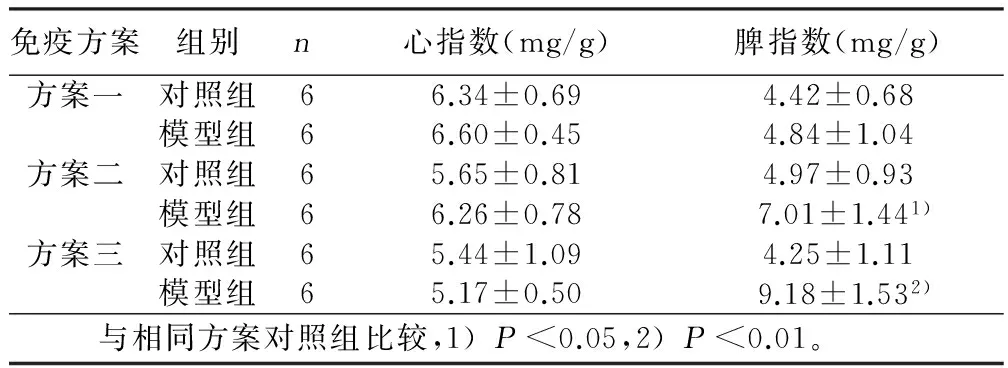
免疫方案组别n心指数(mg/g)脾指数(mg/g)方案一对照组66.34±0.694.42±0.68模型组66.60±0.454.84±1.04方案二对照组65.65±0.814.97±0.93模型组66.26±0.787.01±1.441)方案三对照组65.44±1.094.25±1.11模型组65.17±0.509.18±1.532) 与相同方案对照组比较,1)Plt;0.05,2)Plt;0.01。
2.4 qRT-PCR
2.4.1 心脏组织qRT-PCR检测结果 方案一以及方案二中模型组TLR2,TLR4 mRNA的表达量与对照组相比,无统计学意义(Pgt;0.05);方案三中模型组TLR2 mRNA的表达量与对照组相比,具有统计学意义(Plt;0.05),而模型组TLR4 mRNA的表达量与对照组相比,无统计学意义(Pgt;0.05)。详见图4。
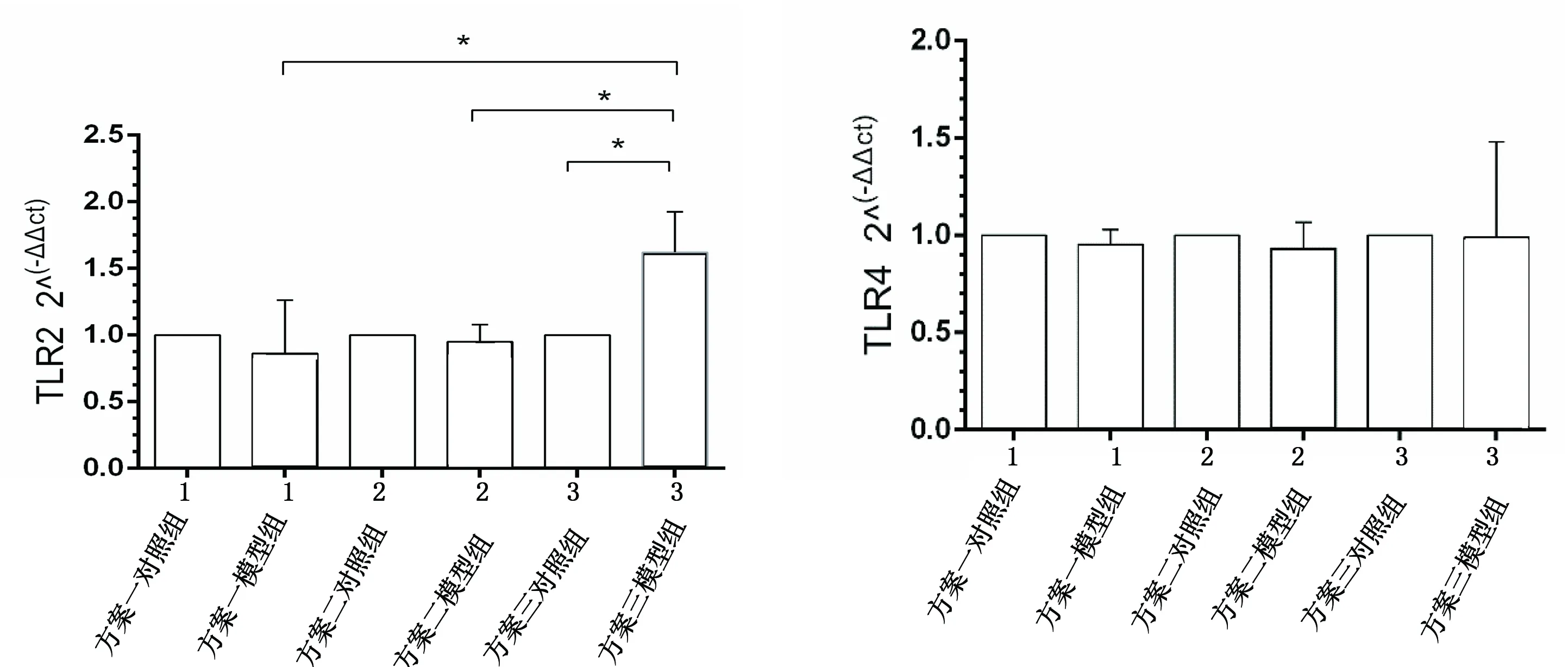
注:与相同方案对照组比较,*Plt;0.05。
图4心脏组织TLR2、TLR4的mRNA表达水平
2.4.2 脾脏组织qRT-PCR检测结果 脾脏组织与心脏组织qRT-PCR 检测结果一致,方案一以及方案二中模型组TLR2,TLR4 mRNA的表达量与对照组相比,无统计学意义(Pgt;0.05);方案三中模型组TLR2 mRNA的表达量与对照组相比,具有统计学意义(Plt;0.05),而模型组TLR4 mRNA的表达量与对照组相比,无统计学意义(Pgt;0.05)。详见图5。
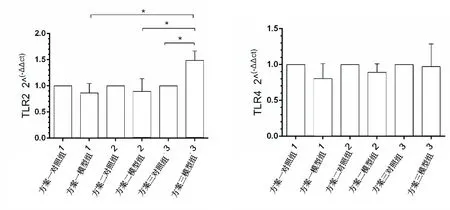
注:与相同方案对照组比较,*Plt;0.05。
图5脾脏组织TLR2、TLR4的mRNA表达水平
3 讨 论
EAM以心肌细胞的肿胀和坏死为特征,伴随着炎症细胞的浸润和纤维化改变。心脏肌球蛋白(cardiac myosin,CM)是心肌的结构蛋白,由两条重链和两条轻链组成,可诱导建立EAM,由CD4+T细胞介导,也是心肌炎的主要抗原,CM作为自身抗原可与抗原提呈细胞(antigen presenting cell,APC)表面的主要组织相容性抗原Ⅱ(major histocompatibility antigen Ⅱ,MHCⅡ)类分子结合,形成抗原肽-MHCⅡ类分子复合物,进而激活CD4+T细胞[2],其中CD4+Th1细胞分泌IL-2、IFN-γ等细胞因子,刺激细胞毒性T细胞增殖、激活巨噬细胞等,起到致炎作用。
本实验采用CM诱导小鼠建立EAM模型,组织病理学结果显示,方案一心肌组织中无明显炎症及纤维化改变,方案二中心肌细胞肿胀,出现少量单核细胞浸润,并可见少量的纤维化;方案三中心肌细胞肿胀,心肌组织可见大量的炎症细胞以及少量的纤维化。三种免疫方案出现不同的病理表现,可能与CM的剂量以及免疫次数有关,与此前相关文献报道一致[3-6]。第21天为EAM急性炎症期,肌球蛋白达到一定剂量并多次免疫小鼠,可引起持续的自身免疫反应,以及明显的心肌细胞损害,出现典型的心肌炎症改变,但该段时期心肌纤维化程度并不明显,提示心肌炎急性期可能尚未发生胶原的明显蓄积。超声心动图检测显示,方案二与方案三心肌炎小鼠EF,LVEDd,LVEDs明显降低,提示EAM急性炎症期心肌舒张与收缩功能受损,心功能明显降低,心肌亦伴随不同程度的炎症细胞浸润,说明EAM心功能与心肌炎症程度密切相关。
近年来,关于Toll样受体(Toll-like receptors,TLRs)在EAM中的作用越来越受到关注,TLRs在先天性和获得性免疫中起重要作用[7-8],TLR2和TLR4属于TLRs家族成员,会促进炎症介质产生。有研究表明,TLR2和TLR4在无菌性炎症反应条件下,在急性或慢性心血管疾病中起着关键作用[9]。本研究结果显示,EAM模型小鼠TLR2表达水平显著升高,其机制可能为CM促进心肌自身免疫反应,并经TLR活化NF-κB信号通路[8]。
本研究采用三种不同方案免疫Balb/c小鼠,并成功建立EAM动物模型,该模型稳定并与人类VCM相似,可为临床上VMC及DCM相关研究奠定物质基础,将这种免疫方案用于病毒性心肌炎的相关研究,具有较好的参考价值。
[1] Kindermann I,Barth C,Mahfoud F,et al.Update on myocarditis[J].J Am Coll Cardiol,2012,59(9):779-792.
[2] Gangaplara A,Massilamany C,Brown DM,et al.Coxsackievirus B3 infection leads to the generation of cardiac myosinheavy chain-α-reactive CD4+T cells in A/J mice[J].Clin Immunol,2012,144(3):237-249.
[3] Tajiri K,Imanaka YK,Matsubara A,et al.Suppressor of cytokine signaling 1 DNA administration inhibits inflammatory and pathogenic responses in autoimmune myocarditis[J].Immunol,2012,189(4):2043-2053.
[4] Tajiri K,Shimojo N,Sakai S,et al.Pitavastatin regulates helper T-cell differentiation and ameliorates autoimmune myocarditis in mice[J].Cardiovasc Drugs Ther,2013,27(5):413-424.
[5] Ashigaki N,Suzuki J,Ogawa M,et al.Periodontal bacteria aggravate experimental autoimmune myocarditis in mice[J].Am J Physiol Heart Circ Physiol,2013,304(5): H740-H748.
[6] Hoetzenecker K,Zimmermann M,Hoetzenecker W,et al.Mononuclear cell secretome protects from experimental autoimmune myocarditis[J].European Heart Journal,2015,36(11): 676-685.
[7] Roberts BJ,Moussawi M,Huber SA.Sex differences in TLR2 and TLR4 expression and their effect on coxsackievirus-induced autoimmune myocarditis[J].Exp Mol Pathol,2013,94(1): 58-64.
[8] Ishizuka EK,Filgueiras LR,Rios FJ,et al.PAFR activation of NF-κB p65 or p105 precursor dictates pro-and anti-inflammatory responses during TLR activation in murine macrophages [J].Sci Rep,2016,6:32092.
[9] Gross O,Poeck H,Bscheider M,et al.Sykkinase signaling couples to The Nlrp3 inflammasome for anti- fungal host defence [J].Nature,2009,459(7245): 433-436.
2016-11-15)
(本文编辑 王雅洁)
The Analysis and Evaluation of Experimental Autoimmune Myocarditis in Mouse Model Based on Different Immunization Programs
Yan Hongmei, Li Tan, Zhou Xin, Zhao Jihong
Graduate School, Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;Tianjin Key Laboratory of Cardiovascular Remodeling and Target Organ Injury, Cardiovascular Disease Institute, Tianjin 300162,China
Zhou Jihong//Tianjin Key Laboratory of Cardiovascular Remodeling and Target Organ Injury,Cardiovascular Disease Institute,Tianjin 300162,China;Affiliated Hospital of Logistics University of the Chinese People’s Armed Police Force, Tianjin 300162, China
ObjectiveTo explore the advantages and disadvantages of different immunization programs to establish experimental autoimmune myocarditis (EAM) mouse model.MethodsWe design three protocols to establish the experimental autoimmune myocarditis using Balb/c mice. The mice were assigned to normal control group and experimental group. Then, ultrasound imaging system was used to detect cardiac function, and quantitative real-time polymerase chain reaction (qRT-PCR) was used to detect the expression of toll-like receptor (TLR) 2 and TLR4 in heart and spleen tissues.Finally,the changes of inflammation and fibrosis were observed pathologically, and the heart/spleen indexes were calculated.ResultsThe results showed that there was no differences for the first immunization program,compared with the normal control group. For the second immunization program, the values of ejection fraction (EF), left ventricular systolic dysfunction (LVSDd ) and LVEDs were obviously reduced in experiment group, associated with a amount of mononuclear cell infiltration and fibrosis.Meanwhile the spleen index of experiment group was obviously increased. However, there were not obvious changes on the expressions of TLR2 and TLR4. For the third immunization program, the values of EF, LVEDd,and LVEDs were obviously reduced in experimental group. A large amount of mononuclear cell infiltration and fibrosis were seen in the myocardium and the outer membrane of the experimental group. The spleen index was also markedly increased, as well as overexpression of TLR2.ConclusionThe data indicate that the third program may be the best protocol for establishing EAM mouse model, which would provide a basis for EAM-related research.
autoimmune myocarditis;mouse model;toll-like receptor;cardiac function
R285.5
A
10.3969/j.issn.1672-1349.2017.21.007
1672-1349(2017)21-2684-06
国家自然科学基金(No.81202843,81570335),天津市应用基础与前沿技术研究计划(No.14JCZDJC36700),天津市心血管重塑与靶器官损伤重点实验室开放基金(No.TJC1402)
1.天津中医药大学研究生院(天津300193);2.天津市心血管重塑与靶器官损伤重点实验室; 3.天津武警后勤学院附属医院;4.天津武警后勤学院病原生物与免疫学教研室
赵季红,E-mail:zjhwj@163.com
信息:闫红梅,李覃,周欣,等.不同免疫方案建立实验性自身免疫性心肌炎小鼠模型的分析与评价[J].中西医结合心脑血管病杂志,2017,15(21):2684-2689.
