活体示踪BMSCs在大鼠癫痫模型中的可行性研究
2017-11-27龙乾发刘卫平高建忠罗强黑悦伊西才
龙乾发 刘卫平 高建忠 罗强 黑悦 伊西才
(1西安市中心医院神经外科,陕西 西安 710003; 2第四军医大学西京医院神经外科,陕西 西安 710032; 3榆林市第一医院神经外科,陕西 榆林 719000)
·神经损伤研究·
活体示踪BMSCs在大鼠癫痫模型中的可行性研究
龙乾发1刘卫平2*高建忠3罗强1黑悦2伊西才2
(1西安市中心医院神经外科,陕西 西安 710003;2第四军医大学西京医院神经外科,陕西 西安 710032;3榆林市第一医院神经外科,陕西 榆林 719000)
目的探索活体示踪骨髓间充质干细胞(BMSCs)在大鼠癫痫模型中的可行性。方法体外分离纯化SD大鼠BMSCs,超微超顺磁性氧化铁(USPIO)纳米颗粒标记,而后诱导大鼠癫痫模型并接受USPIO标记的BMSCs(U-BMSCs)移植,进而通过MRI检测U-BMSCs体内外影像,示踪U-BMSCs在癫痫模型中的分布,最后通过免疫组化验证USPIO标记对BMSCs抑制癫痫海马神经元损失的影响。结果USPIO体外标记BMSCs的效率为99.2%±1.24%,体内外MRI T2W2显示U-BMSCs为可与脑实质区别明显的低信号影像。细胞移植两周后发现U-BMSCs低信号影像可分布于癫痫模型脑实质包括海马,免疫组化结果示U-BMSCs移植组海马CA1和齿状回门区(DH)神经元数量明显多于PBS组(Plt;0.05),且与BMSCs移植组无明显区别(Pgt;0.05)。结论USPIO标记BMSCs可依赖MRI检测实现其在大鼠癫痫模型中的活体示踪且不影响其神经保护功能。
超微超顺磁性氧化铁; 骨髓间充质干细胞; 癫痫; 神经保护
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)作为来源发育早期中胚层和外胚层的多能干细胞,具有低免疫源性、低致瘤性、旁分泌作用和可塑性等特点已为众多疾病模型和临床研究所青睐[1]。大量研究表明BMSCs移植可能因其释放免疫调节因子或神经营养因子对海马神经元损伤具有明显的保护作用,且其治疗潜能在海马损伤模型包括癫痫中得以证实[2-3],但对BMSCs的示踪多停留在组织学研究上。为实现其临床应用潜能,BMSCs活体示踪研究显然具有重要支撑意义。核磁共振成像(magnetic resonance imaging, MRI)因其具有非侵入性和可直视性特点,已经成为神经科学研究与应用不可分割的部分。近来研究显示超微超顺磁性氧化铁(ultrasmall superparamagnetic iron oxide, USPIO)纳米颗粒(直径10~15 nm)因其无害于BMSCs一般生物学特性,USPIO作为对比剂在心肌缺血和中风等模型中为BMSCs活体示踪提供了良好支持方案[4-6],但是在癫痫模型中还鲜有报道。因此,本实验拟用USPIO标记BMSCs,探索其在大鼠癫痫模型中进行活体示踪的可行性。
材料与方法
一、材料
40只4~6 w雄性SD大鼠(170~220 g)购于第四军医大学实验动物中心,动物饲养及操作均遵循实验动物伦理学规定。USPIO纳米颗粒由中国科技大学生物医学工程中心邱本胜教授赠送。
二、BMSCs准备
BMSCs分离培养同我们前面所报道[3,7]。4只SD大鼠经10%水合氯醛麻醉后,75%酒精消毒,无菌解剖双下肢取股骨和胫骨骨髓,利用Histopaques-1077 (Sigma-Aldrich)分离液密度梯度离心收集单核细胞,用标准培养基含α最小必需培养基(α-minimum essential medium, αMEM)和10%胎牛血清(fetal bovine serum, FBS)培养纯化(37 ℃, 5% CO2),细胞融合达70%~80%传代。第三代BMSCs应用于本实验。BMSCs鉴定采用免疫荧光细胞化学方法,一抗包括兔抗分化抗原簇(cluster of differentiation, CD)105 、兔抗CD90、兔抗CD73和兔抗CD34(均购至于公司北京博奥森公司,使用浓度均为1∶100),4 ℃过夜,二抗应用驴抗兔A488 (1∶500) (Invitrogen, A-21206)室温孵育2 h,抗淬灭封片剂封片,荧光显微镜(BX53,奥林巴斯)照相,计数取20倍物镜下随机10个视野。
三、USPIO标记BMSCs
BMSCs在6孔板中生长至70% 融合状态,其标准培养及置换为无血清 α-MEM并含200 μg Fe/mL USPIO 纳米颗粒及443 ng/mL 多聚赖氨酸继续孵育24 h(37 ℃, 5% CO2)(按试剂说明),而后去掉培养基用PBS洗3遍即完成USPIO标记。USPIO标记效率检测采用普鲁士蓝染色,其具体方法参考HT20铁染色试剂盒(HT20-1KT, Sigma-Aldrich)说明书,同时未标记的BMSCs设为阴性对照。
四、大鼠癫痫模型建立及细胞移植
32只SD大鼠分别腹腔注射127 mg/kg氯化锂 (Sigma-Aldrich),18 h后,1 mg/kg甲基东莨菪碱皮下注射予以降低毛果芸香碱的外周胆碱能作用,30 min后,腹腔注射40 mg/kg的毛果芸香碱诱发癫痫,4~5级发作(抽搐不能站立或摔倒)持续1.5 h后10 mg/kg地西泮皮下注射终止发作,而后SD大鼠右侧脑室(中线旁开1.5 mm 前囟后1 mm,进针深度距硬膜4.5 mm)分别注射20 μL含5 × 106U-BMSCs(实验组,n=7),5×106BMSCs(对照组,n=7)和磷酸盐缓冲生理盐水)(phosphate buffered saline, PBS)(对照组Ⅱ,n=5),剩余4只未经处理的SD大鼠设为正常对照。
五、核磁共振成像(magnetic resonance imaging, MRI)
我国基层水利设施大都修建于20世纪六七十年代,受当时资金、技术等因素的制约,部分工程没有严格按照基建程序和遵守设计审批、竣工验收等制度进行建设,造成水利基础设施先天不足。同时,由于基层水利自身资产造血功能不足,经费短缺,我国基层水利设施普遍存在着工程老化失修、设施损坏严重等现象。截至2007年年底,我国自流灌区渠系的完好率只有36%,渠系建筑物完好率为51%;扬水灌区的设备完好率仅为35%,配套渠系的完好率为42%,渠系建筑物的完好率为47%;井灌区的机井完好率为59%,配套渠系的完好率为52%。
MRI使用西京医院影像科 3.0 T MRI 扫描仪 (SIEMENS Magnetom verio 3.0 T),MRI 参数设定为T2加权像(T2W2),视域6.4×6.4 cm,矩阵256×256,层厚1 mm,多重回波时间89 ms,重复时间3500 ms。U-BMSCs体外示踪用PBS直接制备5×106U-BMSCs悬液,未标记的5×106BMSCs设为对照,及时使用MRI扫描。U-BMSCs体内示踪选细胞移植后24 h和2 w,各组大鼠经10%水合氯醛麻醉充分后,置入大鼠线圈进行MRI扫描分析。
六、免疫组织化学
MRI检测完成后,各组SD大鼠断头取脑组织,4%多聚甲醛固定并石蜡包埋后冠状位切片,片厚30 μm。前囟后2.64~3.48 mm[3]的石蜡切片经二甲苯脱蜡和酒精水化后,柠檬酸高温高压修复抗原,3%过氧化氢处理后10%山羊血清封闭,后加兔抗神经元核抗原(neuronal nuclei, NeuN) (1∶1000; Millipore, MABN140) 4 ℃冰箱孵育过夜,PBS漂洗后滴加生物素标记二抗室温孵育1 h,ABC试剂处理1 h后用二氨基联苯氨(3, 3-diaminobenzidine, DAB)显色,酒精脱水和二甲苯透明后,中性树胶封片。染色中未应用一抗的组织切片设为阴性对照。显微镜观察照相,每组随机选取4张组织切片在20倍物镜下照相,Image J软件予以计数分析。
七、统计分析
结 果
一、BMSCs 鉴定及USPIO标记效率
二、体内外MRI检测
5×106BMSCs(图1A)和U-BMSCs(图1D)充分混悬,经MRI检测结果显示BMSCs混悬液呈现明显高信号(图1B,白色),而U-BMSCs混悬液呈现低信号(图1D,黑白相间,多为黑色)。细胞移植24 h,MRI 结果可见单纯BMSCs右侧脑室移植仅见脑室高信号(同脑脊液影像)(图1C),而USPIO标记的BMSCs移植后可见右侧脑室呈现与脑实质或脑脊液区别的低信号影像,并部分向脑室对侧及周围扩散(图1F)。综合提示USPIO的体外MRI低信号影像可应用于体内示踪研究。
三、体内MRI示踪
U-BMSCs移植2 w后,MRI 扫描(图2D)T2W2结果显示在右侧脑室内低信号明显减退,而脑室周围、皮层和海马均可在水平位(图2A),冠状位(图2B)和矢状位(图2C)图像上见散在低信号。而BMSCs移植组(对照组 Ⅰ)和PBS注射组(对照组 Ⅱ)和正常对照组(图2E和2F),低信号影像则不明显。因此提示USPIO标记可示踪BMSCs在大鼠癫痫模型内的迁移。
四、U-BMSCs对癫痫海马神经元的保护
免疫组化结果显示,相比正常SD大鼠CA1区(图3A)和齿状回门区(dentate gyrus hilus, DH)(图3E),毛果芸香碱诱导大鼠癫痫2 w后,NeuN阳性细胞在海马CA1区(图3B)和DH(图3F)出现明显下降。U-BMSCs移植两周结果显示,NeuN阳性细胞在海马CA1区(图3C)和DH(图3G)则明显多于PBS注射组,但跟BMSCs移植组海马CA1区(图3D)和DH(图3H)区别不明显。其one way ANOVA 分析结果显示各组NeuN阳性细胞数量在CA1(F=63.16,Plt;0.01)和DH(F=38.33,Plt;0.01)均具有明显差异,组间比较结果显示SD大鼠癫痫模型PBS注射后,CA1(Plt;0.01)和DH(Plt;0.01)区神经元(NeuN阳性细胞)数量较正常SD大鼠明显减少。U-BMSCs移植后, CA1(Plt; 0.01)和DH(Plt;0.05)神经元却明显多于PBS组,同时与BMSCs移植组CA1(Pgt;0.05)和DH(Pgt;0.05)区神经元数量却无明显差别。综合提示USPIO标记BMSCs不影响其对癫痫海马神经元的保护功能。

图1 体外MRI及早期体内示踪
Fig 1 In vitro and in vivo (early stage) tracking using MRI
A: Pre-suspension of 5×106BMSCs; B: MRI of suspended BMSCs; C: After BMSCs transplantation, the right ventricle presented white signal in T2W2MRI; D: Pre-suspension of 5×106U-MSCs; E: MRI of suspended U-MSCs; F: After U-MSCs transplantation, the right ventricle showed dark signal in T2W2MRI.
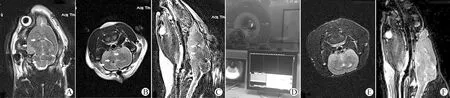
图2 体内MRI
Fig 2 MRI in vivo
A: Axial image of T2W2MRI after U-BMSCs transplantation for 2 w; B: Coronal image of T2W2MRI after U-BMSCs transplantation for 2 w; C: Sagittal image of T2W2MRI after U-BMSCs transplantation for 2 w; D: Ideograph of MRI scanning for rat; E: Coronal image of T2W2MRI in the normal SD rat; F: Sagittal image of T2W2MRI in the normal SD rat.

图3 海马区免疫组织化学
Fig 3 Immunohistochemistry in hippocampus
A, B, C and D: NeuN expression in the hippocampal CA1 region of normal SD rats, PBS group, U-BMSCs group and BMSCs group, respectively; E, F, G and H: NeuN expression in the hippocampal DH region of normal SD rats, PBS group, U-BMSCs group and BMSCs group, respectively.
Bar = 50 μm.
讨 论
研究表明USPIO标记干细胞不影响其表面抗原表达、增殖、分化等一般生物学特性,因此越来越多的学者应用USPIO作为干细胞对比剂在动物模型甚至临床试验中进行活体示踪研究[4, 8-10],但是应用USPIO标记示踪BMSCs在癫痫模型中的迁移趋向,以及U-BMSCs对神经元保护作用方面的研究仍然少见。BMSCs作为临床应用最有潜力的干细胞,国内外研究和我们前期报道均显示BMSCs对中枢神经系统海马神经元损伤具有重要保护作用,其作用机制可能为BMSCs向海马部位迁移后提供神经营养支持、抗氧化或免疫调节等[2,11],因此应用USPIO标记BMSCs进行活体示踪研究将为这些功能发挥提供更为直接的试验依据。
本实验首先通过免疫荧光细胞化学试验,依赖特异性抗体检测证实获取细胞符合BMSCs的一般抗原表达,为后续试验提供了可靠细胞源。USPIO纳米颗粒的干细胞标记应用已非常成熟,因此实验中仅按推荐浓度(200 μg Fe/mL),并未再次探索不同浓度的示踪影像,且本研究中普鲁士蓝染色证实该浓度的USPIO能高效标记BMSCs,可为后续试验提供示踪基础。本研究为探索BMSCs的体内示踪影像,首先按孟增东等[12]的实验方法制备U-BMSCs细胞悬液,通过U-BMSCs与未标记BMSCs对比,体外证实U-BMSCs在MRI T2W2中呈现低信号。而后进一步通过癫痫模型移植U-BMSCs与BMSCs的早期MRI T2W2对比,发现U-BMSCs的低信号影像呈现于侧脑室中,提示MRI可活体示踪U-BMSCs在癫痫模型中的迁移或分布。但是实验也发现一些不足,如高浓度的细胞移植充斥于脑室中,是否影响脑脊液循环尚待进一步研究探索;3.0T MRI检测U-BMSCs的分辨率还有待提高等。结合我们前期研究和国外报道[3,13],BMSCs移植后向脑实质迁移一般两周达到高峰,因此本实验体内示踪U-BMSCs在大鼠癫痫模型中的分布时间点设为移植后两周,MRI检测结果发现U-BMSCs可广泛分布于脑实质内,特别是能向海马部位迁移。同时考虑海马为癫痫形成的主要部位,综合提示侧脑室注射BMSCs后的细胞迁移为癫痫治疗提供了微环境,该迁移趋向也可能为BMSCs在海马神经元损伤中发挥一系列旁分泌作用提供直接证据。不仅如此,鉴于癫痫模型海马神经元损伤在CA1和DH尤为明显[14],实验进一步通过免疫组化染色发现,与未标记的BMSCs移植组相比较,USPIO纳米颗粒标记的BMSCs并不影响的海马CA1和DH区的NeuN阳性细胞数量,结果提示U-BMSCs在癫痫模型中具有与BMSCs相当的海马神经元保护功能,因此便于体内示踪研究和应用。综上所述,本实验证实USPIO标记BMSCs,可通过MRI实现BMSCs在癫痫模型中的活体示踪且不影响其对癫痫的神经保护功能。
1KOBOLAK J, DINNYES A, MEMIC A, et al. Mesenchymal stem cells: Identification, phenotypic characterization, biological properties and potential for regenerative medicine through biomaterial micro-engineering of their niche [J]. Methods, 2016, 99: 62-68.
2AGADI S, SHETTY A K. Concise review: prospects of bone marrow mononuclear cells and mesenchymal stem cells for treating status epilepticus and chronic epilepsy [J]. Stem Cells, 2015, 33(7): 2093-2103.
3LONG Q, QIU B, LIU W, et al. Functional recovery and neuronal regeneration of a rat model of epilepsy by transplantation of Hes1-down regulated bone marrow stromal cells [J]. Neuroscience, 2012, 212: 214-224.
4杨志军, 白妙春, 陈中灿, 等. USPIO标记大鼠骨髓源神经干细胞体外磁共振成像研究 [J]. 中华神经外科疾病研究杂志, 2016, 15(3): 230-233.
5CAO J, LI X, CHANG N, et al. Dual-modular molecular imaging to trace transplanted bone mesenchymal stromal cells in an acute myocardial infarction model [J]. Cytotherapy, 2015, 17(10): 1365-1373.
6TARULLI E, CHAUDHURI J D, GRETKA V, et al. Effectiveness of micron-sized superparamagnetic iron oxide particles as markers for detection of migration of bone marrow-derived mesenchymal stromal cells in a stroke model [J]. J Magn Reson Imaging, 2013, 37(6): 1409-1418.
7龙乾发, 汪平, 王安生, 等. Hes1基因沉默促进骨髓间充质干细胞向GABA能神经元分化的实验研究 [J]. 中华神经外科杂志, 2014, 30(2): 186-189.
8EAMEGDOOL S S, WEIBLE M W, 2ND, PHAM B T, et al. Ultrasmall superparamagnetic iron oxide nanoparticle prelabelling of human neural precursor cells [J]. Biomaterials, 2014, 35(21): 5549-5564.
9YILMAZ A, DENGLER M A, VAN DER KUIP H, et al. Imaging of myocardial infarction using ultrasmall superparamagnetic iron oxide nanoparticles: a human study using a multi-parametric cardiovascular magnetic resonance imaging approach [J]. Eur Heart J, 2013, 34(6): 462-475.
10王海龙, 张良, 郭艾. 超顺磁性氧化铁纳米颗粒的理化性质及其标记BMSCs的安全性、示踪时效性研究进展 [J]. 山东医药, 2015, 55(24): 99-101.
11LONG Q, HEI Y, LUO Q, et al. BMSCs transplantation improves cognitive impairment via up-regulation of hippocampal GABAergic system in a rat model of chronic cerebral hypoperfusion [J]. Neuroscience, 2015, 311: 464-473.
12孟增东, 邱伟, 胡彪, 等. 超顺磁性氧化铁纳米颗粒体外标记兔骨髓间充质干细胞的安全性以及MRI成像特征 [J]. 中国组织工程研究, 2012, 16(6): 951-957.
13LONGO B, ROMARIZ S, BLANCO M M, et al. Distribution and proliferation of bone marrow cells in the brain after pilocarpine-induced status epilepticus in mice [J]. Epilepsia, 2010, 51(8): 1628-1632.
14ZHANG S, KHANNA S, TANG F R. Patterns of hippocampal neuronal loss and axon reorganization of the dentate gyrus in the mouse pilocarpine model of temporal lobe epilepsy [J]. J Neurosci Res, 2009, 87(5): 1135-1149.
Feasibilityoftrackingbonemarrowmesenchymalstemcellsinaratmodelofepilepsy
LONGQianfa1,LIUWeiping2,GAOJianzhong,3LUOQiang1,HEIYue2,YIXicai2
1DepartmentofNeurosurgery,Xi'anCentralHospital,Xi'an710003;2DepartmentofNeurosurgery,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032;3DepartmentofNeurosurgery,FirstHospitalofYulin,Yulin719000, China
ObjectiveThe feasibility of real time tracking of bone marrow mesenchymal stem cells (BMSCs) in a rat model of epilepsy is explored.MethodsBMSCs were isolated from 4 SD rats and labeled with ultrasmall superparamagnetic iron oxide (USPIO) nanoparticles, and then the epileptic models were induced by Pilocarpine and
USPIO labeled BMSCs (U-BMSCs) administration. After that, MRI was performed to detect the U-BMSCs imaging in vitro and in vivo, as well as the distribution of U-BMSCs in a rat model of epilepsy. Finally, the neuroprotection of U-BMSCs on the epilepsy-induced hippocampal neuronal loss was verified by immunohistochemistry.ResultsPrussian blue staining results showed the uptaken efficiency of USPIO in BMSCs was 99.20%+1.24%. In vitro study manifested that U-BMSCs displayed as darker signal in MRI T2W2, and in vivo study showed that the darker signal distinguished from brain or cerebrospinal fluid imaging was observed in the right lateral after U-BMSCs transplantation for 24 h. After cell transplantation for 2 w, the darker signals of U-BMSCs were observed in the cortex, hippocampus and other areas of the brain. Furthermore, immunohistochemistry results showed that U-BMSCs transplantation prevented the neuronal loss in CA1 and dentate gyrus hilus (DH) of the hippocampus in comparison to PBS group (Plt;0.01), and no significant difference (Pgt;0.05) was shown between U-BMSCs and BMSCs transplantation in the epileptic model.ConclusionUSPIO labeling BMSCs can be detected in vivo using MRI and do not affect their neuroprotection in a rat model of epilepsy.
Ultrasmall superparamagnetic iron oxide; Bone marrow mesenchymal stem cells; Temporal lobe epilepsy; Neuroprotection
1671-2897(2017)16-115-05
R 329.2
A
陕西省科学技术研究发展计划基金资助项目(2014KJXX-29);榆林市科技计划基金资助项目(SF13-33)
龙乾发,副主任医师,E-mail: lonva@live.cn
*通讯作者: 刘卫平,教授、主任医师,E-mail: liuwp@fmmu.edu.cn
2016-08-14;
2016-10-17)
