HCN通道功能变化在SAH后早期脑损伤中的作用研究
2017-11-27赵彤李博袁绍纪卢培刚
赵彤 李博 袁绍纪 卢培刚
(1泰山医学院研究生处,山东 泰安 271000; 2济南军区总医院神经外科,山东 济南 250000)
·神经损伤研究·
HCN通道功能变化在SAH后早期脑损伤中的作用研究
赵彤1,2李博2袁绍纪2卢培刚2*
(1泰山医学院研究生处,山东 泰安 271000;2济南军区总医院神经外科,山东 济南 250000)
目的观察大鼠模型蛛网膜下腔出血(SAH)后早期脑内超极化激活-环核昔酸门控的阳离子(HCN)通道的表达变化。评估HCN通道功能变化在SAH后早期脑损伤发生中的作用。方法动物模型的建立及分组;大鼠神经功能评价;检测神经元凋亡情况及脑脊液(CSF)中谷氨酸(Glu)含量。结果给予HCN通道阻断剂(ZD7288)后进一步加重神经功能损害及神经元凋亡,CSF中Glu含量进一步增加;而给予非特异HCN通道激动剂(NO/Sp)后并未改善神经功能损害,未能显著缓解神经元凋亡情况及降低Glu含量。结论阻断HCN通道后,神经元损伤及神经功能损害进一步加重;给予NO/Sp干预后,神经元及神经功能损害情况并未显著改善。
蛛网膜下腔出血; 超极化激活-环核昔酸门控的阳离子通道(HCN通道); 神经元兴奋性; 神经元凋亡; 早期脑损伤
神经元兴奋性紊乱在蛛网膜下腔出血(subarachnoid hemorrhage, SAH)后早期脑损伤过程中扮演重要角色,并最终导致SAH后继发性神经功能损害的发生[1]。“超极化激活-环核苷酸门控的阳离子通道” (hyperpolarization-activated cyclic nucleotide-gated channel, HCN channel)在神经元兴奋性调节中发挥重要作用。前期体外研究结果显示SAH后HCN通道功能异常导致神经元兴奋性紊乱发生,从而可能直接加重了SAH后早期的脑损伤[2]。本实验拟在前期研究基础上,通过在体实验进一步评估HCN通道功能变化在模型大鼠SAH后早期脑损伤发生中的作用。
本研究旨在为将来以HCN通道为核心的、特异性的SAH后早期脑损伤治疗新策略和新药物的开发提供理论依据和实验数据,从而改变目前临床SAH继发性脑损伤治疗缺乏有效手段的现状。
材料与方法
一、实验动物
SPF级健康成年雄性Wistar大鼠,体重270~300 g(购于山东大学实验动物中心),经检疫符合实验动物标准,实验进行期间饲养于济南军区总医院动物房内。
二、主要试剂和仪器
Zeiss显微镜,小动物立体定向仪,双极电凝,1%戊巴比妥钠,谷氨酸专用酶联反应试剂盒(Glutamate Assay Kit),非特异性HCN通道激动剂一氧化氮/精胺(NO/Spermine, NO/Sp),HCN通道阻断剂ZD7288(ZD7288),末端脱氧核苷酸转移酶介导的生物素脱氧尿嘧啶核苷酸缺口末端标法(terminal deoxynucleotidyl transferase-mediated uridine 5'-triphosphate-biotin nick-end labeling/Neuronal Nuclei, TUNEL/NeuN)染色试剂盒。
三、大鼠线栓穿刺法蛛网膜下腔出血(SAH)模型的建立[3]
雄性Wistar大鼠(270~300 g),用1%戊巴比妥钠腹腔注射(50 mg/kg) 麻醉后仰卧,固定头部及四肢,常规消毒、铺巾,取颈部正中切口2 cm,解剖手术显微镜下操作分离暴露右侧颈总动脉、颈内动脉、颈外动脉,电凝切断颈外动脉近分叉处的分支,包括枕动脉、甲状腺上动脉及咽升动脉,分离结扎并切断颈外动脉,使颈外动脉近心端成一约5 mm长的残端,把颈外动脉残端往下拉,使其与颈内动脉成一直线。用二个无损伤动脉夹分别夹闭颈总动脉和颈内动脉,随后在颈外动脉起始段约2~3 mm处用眼科剪剪一“V”型小切口,再将一长约3 cm 4-0尼龙线从颈外动脉上的“V”型小切口导入,经右侧颈总动脉达颈内动脉,松开颈内动脉上的动脉夹,顺着颈内动脉向远端继续插入尼龙线至颈内动脉颅内段,遇有小的阻力感后再插入约2~3 mm刺破颈内动脉分叉部,然后迅速抽出尼龙线,用动脉夹夹住颈外动脉残端,松开颈总动脉上的动脉夹让血流恢复,结扎颈外动脉残端,缝合颈部切口。假手术组除了不刺破颈内动脉分叉处血管壁外,其余操作均与模型组一致。
四、实验分组
依据已建立的SAH大鼠模型将大鼠分为四组:假手术组;SAH模型组;注射HCN通道阻断剂组;注射HCN通道非特异性激动剂组;每组5只大鼠。其中,后两组于造模成功3 h内分别向侧脑室微量注射ZD7288 (10 mM, 5 μL)和NO/Sp (10 mM, 5 μL),速度0.25 μL/min。
五、神经行为学评价
对模型大鼠SAH后24 h时的神经功能损害程度评分。
六、免疫组织化学
TUNEL/NeuN检测模型大鼠SAH后24 h时海马和前额叶皮层的神经元坏死情况。按1%戊巴比妥钠腹腔注射(50 mg/kg) 麻醉,之后用100 mL生理盐水和500 mL左右4%多聚甲醛溶液经心脏灌注。灌注结束后完整取出脑组织,放入蔗糖溶液中进行脱水,先放入20%蔗糖溶液中静置2 d,之后转移至30%蔗糖溶液中,再静置2 d。用冰冻切片机切下切片,切片厚度25 μm。然后取海马和前额叶皮层区脑组织并按照TUNEL/NeuN试剂盒说明进行染色,染色后在荧光显微镜下观察并拍照。
七、谷氨酸含量检测
枕大池(Cisterna Magna)抽取脑脊液,具体方法如下:动物麻醉后头部固定于立体定位仪,使头颈部约成130°钝角,剪去颈背部毛,两耳根的连线处剪开一横切口(2 cm),在其中点纵向剪开,将皮分离用止血钳拉向两侧。紧贴大鼠颅底用镊子和止血钳逐层钝性分离各层肌肉,暴露出寰枕筋膜。用事先拉制好的毛细玻璃管(内径约0.5 mm)刺入寰枕筋膜进入枕大池,玻璃管尖端与水平面呈20°~30°,强烈突破感后脑脊液通过虹吸作用进入玻璃管内。将取好的脑脊液(20~50 mL)保存于-80 ℃冰箱,应用谷氨酸专用酶联反应试剂盒检测脑脊液中谷氨酸含量。
八、数据处理及统计学分析

结 果
一、神经行为学评价模型大鼠SAH后24 h时的神经功能损害程度
实验组SAH出血分级均在12~14分之间(图1A),神经行为学评分:假手术组为16分,SAH组评分明显下降。侧脑室给予HCN通道阻断剂ZD7288之后,神经行为学评分进一步下降(图1B,n=6,Plt;0.05)。给予HCN通道非特异性激动剂NO/Sp后大鼠神经行为学评分虽有改善趋势,但并无统计学差异(图1B,n=6,Pgt;0.05)。
二、免疫组织化学
使用TUNEL/NeuN免疫荧光双标检测模型大鼠SAH后24 h海马和前额叶皮层神经元的凋亡情况。如图2所示,SAH后24 h模型大鼠海马脑区调亡神经元数目显著增加,给予ZD7288阻断HCN通道后进一步加重了神经元的凋亡情况,表现为凋亡神经元数目再次急剧上升(n=6,Plt;0.05);而给予HCN通道非特异性激动剂NO/Sp后,神经元凋亡情况虽有一定改善,但仍无统计学意义(n=6,Pgt;0.05)。SAH后24 h后前额叶皮层神经元凋亡变化情况亦同上(图3)。

图1 SAH后24 h各组大鼠神经行为学评分
Fig 1 Neurological examination at 24 h after SAH
A: SAH granding at 24 h after SAH; B: Neurological examination (Modified Garcia) at 24 h after SAH.
aPlt;0.01,vsSAH+vehicle group;bPlt;0.05,vsSAH+vehicle group.
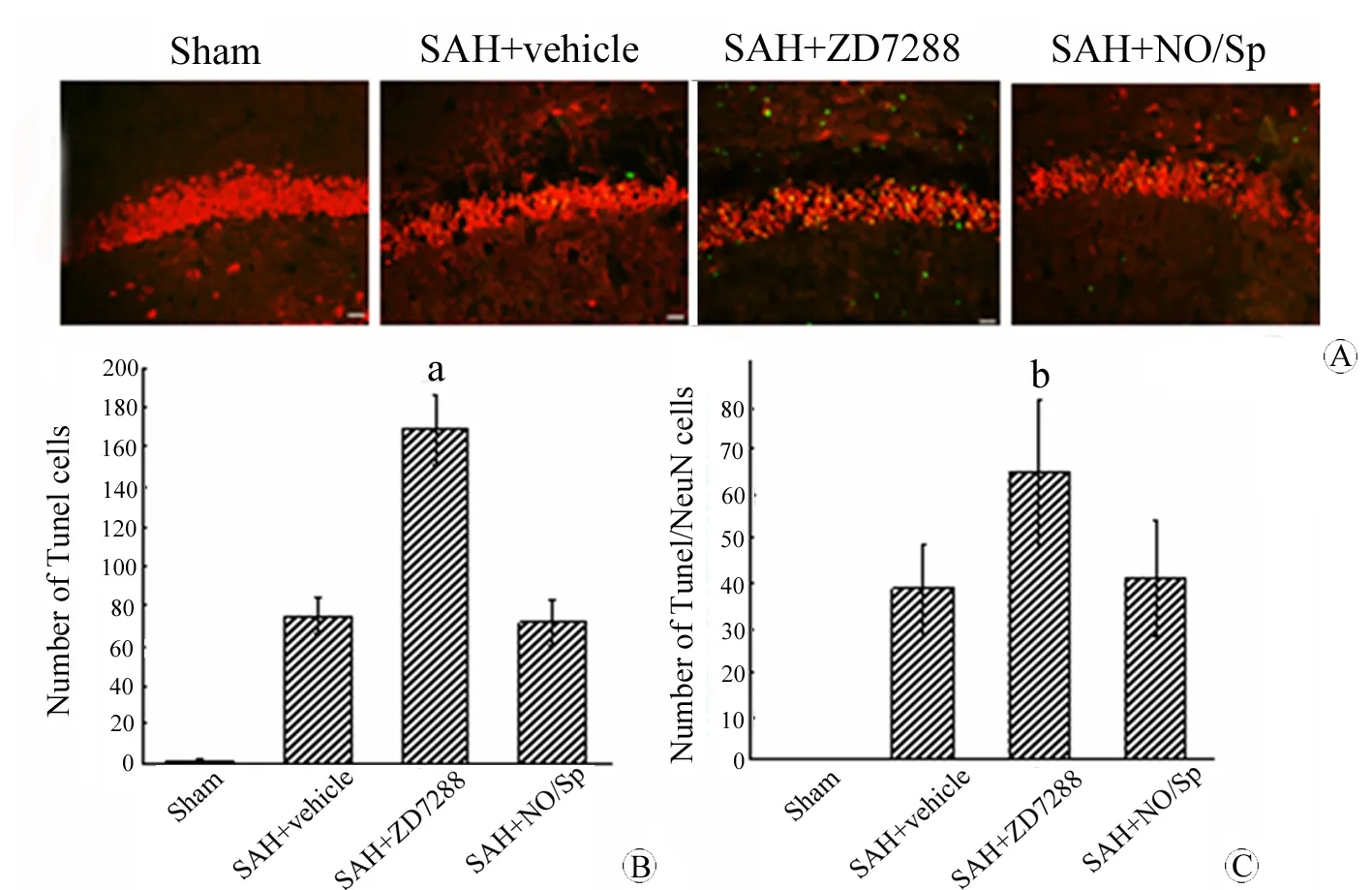
图2 SAH后24 h 各组模型动物海马区神经元凋亡情况
Fig 2 Cell death of hippocampus detection at 24 h after SAH
A: TUNEL-positive cells showed green fluorescence; NeuN-positive cells showed red fluorescence; TUNEL/NeuN-positive cells showed yellow fluorescence; B: Number of TUNEL-positive cells; C: Number of TUNEL/NeuN-positive cells.
aPlt;0.01,vsSAH+vehicle group;bPlt;0.05,vsSAH+vehicle group.

图3 SAH后24 h 各组模型动物前额叶皮层神经元凋亡情况
Fig 3 Cell death detection of PFC at 24 h after SAH
A: TUNEL-positive cells showed green fluorescence; NeuN-positive cells showed red fluorescence; TUNEL/NeuN-positive cells showed yellow fluorescence;B: Number of TUNEL-positive cells; C: Number of TUNEL/NeuN-positive cells.
aPlt;0.01,vsSAH+vehicle group.
三、谷氨酸检测
如图4所示,大鼠SAH后24 h脑脊液中Glu含量显著增加,给予侧脑室注射ZD7288脑脊液中Glu含量有增加趋势(n=4,Plt;0.05);给予NO/Sp后并未能显著影响脑脊液中Glu含量变化。

图4 SAH后24 h各组模型动物细胞外谷氨酸含量比较 (n=4)
Fig 4 CSF Glu assessment at 24 h after SAH (n=4)
aPlt;0.05,vsSAH+vehicle group.
讨 论
蛛网膜下腔出血是最常见的出血性脑血管意外之一,主要为颅内动脉瘤破裂所致。颅内动脉瘤本身多可通过外科手术或介入治疗获得治愈,但其伴发的SAH 却导致超过40%的患者死残,为制约破裂动脉瘤疗效的关键环节及研究热点[4]。SAH后继发性脑损伤机制至今尚未阐明。既往大部分研究着眼于SAH后颅内大动脉的痉挛上[5-6]。但近些年研究显示大动脉痉挛并不是SAH后迟发性缺血性神经功能障碍及临床不良结果的主要原因[7]。因此,国际上最近又提出了SAH后“早期脑损伤”理论,认为在SAH后早期(72 h内)机体一系列病理过程即已启动。其中,以“皮质播散性去极化”为代表的神经元兴奋性紊乱可能在SAH后继发性脑损伤中扮演重要的角色[8-9]。
“超极化激活/环核苷酸依赖(HCN)通道”电流在上个世纪七十年代最早被记录发现,三十多年来,其电生理功能的多样性一直吸引着众多科学家对其进行深入研究。近年来,其在中枢神经系统兴奋性维持中的重要作用已备受关注。目前普遍观点认为HCN通道是神经环路兴奋性稳态调控的重要靶点,并将其比喻为神经系统中的“制动器(brake)”[10],尤其值得注意的是在某些中枢神经系统疾病(例如癫痫、脑缺血等)中,HCN通道的功能状态变化将直接导致或者参与了相关神经环路兴奋性紊乱的发生[11-12]。我科长期以来从事SAH后继发性脑损伤的临床与基础研究,从2010年开始,在国家自然科学基金(NO.81000506)的支持下,以HCN通道为切入点,研究其在SAH后神经元兴奋性紊乱中的作用及其相关机制,离体脑组织片研究结果显示在“血性(含Hb)”脑脊液灌流条件下,海马CA1区锥体神经元异常放电,同时伴有记录神经元HCN通道电流的减小,并且此过程可以受NO/cGMP信号通路调节[13]。本实验是在前期研究基础上,通过在体实验重点评估由HCN通道功能变化在大鼠模型SAH后早期脑损伤发生中的作用,并进一步深入探讨以HCN通道为靶点的干预手段在SAH 后早期脑损伤中的治疗作用,旨在为SAH继发性脑损伤治疗新策略和新药物的开发提供重要理论依据和实验数据。
本实验采用的大鼠线栓穿刺法蛛网膜下腔出血(SAH)模型,更好的模拟了人类动脉瘤破裂导致的蛛网膜下腔出血的真实过程,更适合于对SAH后早期脑损伤的研究[8]。HCN通道功能改变与SAH后早期脑损伤有着密不可分的联系[13],HCN通道功能下调,失去制动器(brake)作用,使得神经兴奋性异常增加,导致早期脑损伤的发生。本实验中阻断HCN通道进一步加重了早期脑损伤,在生理病理生化上表现为神经元凋亡增加,脑脊液中谷氨酸含量增加。前额叶皮层和海马脑区作为神经元活动最丰富的区域,是SAH早期脑损伤的敏感区。此结果进一步验证了HCN通道的功能变化在早期脑损伤中的重要作用。
HCN通道功能下调导致SAH后早期脑损伤,因此,我们推测纠正HCN通道功能紊乱可以有效缓解神经兴奋性异常,进而阻止早期脑损伤的发生。但是,当给予HCN通道非特异性激动剂NO/Sp后,神经元凋亡情况虽有一定改善,但仍无统计学意义(n=6,Pgt;0.05),也并未能显著影响脑脊液中Glu含量变化(n=5,Pgt;0.05)。我们分析原因如下:①在体SAH动物模型实验与体外细胞组织实验不同,其整体性与复杂性更强。②动脉瘤破裂后的血液成分更加复杂,并且氧合血红蛋白对HCN通道功能的影响及NO的消耗是持续存在的,因而一次性注入的NO/Sp并不一定能够弥补消耗的NO量,更谈不上有效上调HCN通道功能。也就是说,给予一定量的NO/Sp并不能使HCN通道功能紊乱得到改善,所以不能有效防治早期脑损伤的发生。那么,我们如何去解决这些问题呢,我们觉得可以从以下几个方面入手:①增加NO/Sp的给予量,并且延长作用时长。保证HCN通道功能恢复到生理水平。②寻找HCN通道激活链下游的调定点,比如(cGMP/Camp),他们不受血液降解产物的直接影响。或许能够更好的激动HCN通道。③通过基因手段,使HCN通道过表达。
总之,HCN通道功能改变在SAH早期脑损伤中扮演极其重要的角色,本实验表明在体情况下,HCN通道功能下调所致的神经元兴奋性紊乱将直接加重神经元的损伤,并可能最终导致SAH后继发性神经功能损害的发生。
1IADECOLA C. Bleeding in the brain: killer waves of depolarization in subarachnoid bleed [J]. Nat Med, 2009, 15(10): 1131-1132.
2DREIER J P. The role of spreading depression, spreading depolarization and spreading ischemia in neurological disease [J]. Nat Med, 2011, 17(4): 439-447.
3LI B, HE Y, XU L, et al. Progranulin reduced neuronal cell death by activation of sortilin 1 signaling pathways after subarachnoid hemorrhage in rats [J]. Crit Care Med, 2015, 43(8): e304-311.
4SUAREZ J I, TARR R W, SELMAN W R. Aneurysmal subarachnoid hemorrhage [J]. N Engl J Med, 2006, 354(4): 387-396.
5HANSEN-SCHWARTZ J, VAJKOCZY P, MACDONALD R L, et al. Cerebral vasospasm: looking beyond vasoconstriction [J]. Trends Pharmacol Sci, 2007, 28(6): 252-256.
6田卫东, 赵冬, 许晖, 等. 大鼠蛛网膜下腔出血后早期脑损伤模型的建立 [J]. 中华神经外科疾病研究杂志, 2012,11(2): 128-131.
7CONNOLLY E S, Jr, RABINSTEIN A A, CARHUAPOMA J R, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association [J]. Stroke, 2012, 43(6): 1711-1737.
8SEHBA F A, HOU J, PLUTA R M, et al. The importance of early brain injury after subarachnoid hemorrhage [J]. Prog Neurobiol, 2012, 97(1): 14-37.
9CHEN S, FENG H, SHERCHAN P, et al. Controversies and evolving new mechanisms in subarachnoid hemorrhage [J]. Prog Neurobiol, 2014, 115: 64-91.
10LEWIS A S, CHETKOVICH D M. HCN channels in behavior and neurological disease: too hyper or not active enough? [J]. Mol Cell Neurosci, 2011, 46(2): 357-367.
11POWELL K L, NG C, O'BRIEN T J, et al. Decreases in HCN mRNA expression in the hippocampus after kindling and status epilepticus in adult rats [J]. Epilepsia, 2008, 49(10): 1686-1695.
12HUANG Z, WALKER M C, SHAH M M. Loss of dendritic HCN1 subunits enhances cortical excitability and epileptogenesis [J]. J Neurosci, 2009, 29(35): 10979-10988.
13LI B, LUO C, TANG W, et al. Role of HCN channels in neuronal hyperexcitability after subarachnoid hemorrhage in rats [J]. J Neurosci, 2012, 32(9): 3164-3175.
TheroleofHCNchannelsinearlybraininjuryafterSAH
ZHAOTong1, 2,LIBo2,YUANShaoji2,LUPeigang2
1PostgraduateDepartmentofTaishanMedicalUniversity,Tai'an271000;2DepartmentofNeurosurgery,GeneralHospitalofJinanMilitaryCommand,Jinan250000, China
ObjectiveThe role of hyperpolarization-activated cyclic nucleotide-gated (HCN) channels in early brain injury after subarachnoid hemorrhage (SAH) was discussed and evaluated.MethodsSAH models (the arterial puncture model) in Wistar rats were established and divided into four groups with 5 rats in each including Sham group, SAH+vehicle group, SAH+ZD7288 group, and SAH+NO/Spermine (NO/Sp) group. SAH Grading and neurological examination (Modified Garcia) were performed at 24 h after SAH in different groups. Cell death detection were performed at 24 h after SAH in different groups. Assessment of cerebrospinal fluid (CSF) and Glutamic acid (Glu) concentration were performed at 24 h after SAH in different groups.ResultsInhibition of HCN channel further aggravated neurological impairment at 24 h after SAH. However unfortunately, there was no amelioration for neurological function after the treatment of NO/Sp. Neurons apoptosis in hippocampus and medial prefrontal cortex (mPFC) was observed at 24 h after SAH, especially in hippocampus. Inhibition of HCN channel by ZD7288 increased the amount of neuronal apoptosis at 24 h after SAH. However, there was no change for neuronal apoptosis between SAH and NO/Sp-treament groups. Inhibition of HCN channel by ZD7288 had a trend of increasing the Glu concentration in CSF at 24 h after SAH.ConclusionHCN channels play an important role in early brain injury after SAH. Neuronal excitability disorders caused by its function cut will directly result in the neuronal damage and eventually lead to nerve function damage after SAH. Inhibition of HCN channels will promote the vicious cycle, further aggravate the neuronal damage and neurological deficits; however, giving HCN channels nonspecific agonists does not significantly improve this ( the neuronal damage and neurological damage) situation. So this still needs further experimental research.
SAH; HCN channels; Neuronal excitability; Neurons apoptosis; Early brain injury
1671-2897(2017)16-105-05
R 651
A
国家自然科学基金资助项目(81471214);济南军区总医院院长基金资助项目(2014-01)
赵彤,硕士研究生,E-mail:whateveryouknow@126.com
*通讯作者: 卢培刚,主任医师,硕士生导师,E-mail:pglu912@126.com
2016-08-11;
2016-12-12)
