盐生草HgNHX1基因启动子的克隆及功能验证
2017-11-24邹兰杨轲徐先良汪军成任盼荣姚立蓉孟亚雄李葆春马小乐王化俊
邹兰,杨轲,徐先良,汪军成,任盼荣,姚立蓉,孟亚雄,李葆春,马小乐,王化俊*
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃省干旱生境作物学重点实验室,甘肃 兰州730070;2.甘肃农业大学农学院,甘肃 兰州 730070;3.甘肃农业大学生命科学技术学院,甘肃 兰州730070)
盐生草HgNHX1基因启动子的克隆及功能验证
邹兰1,2**,杨轲1,2**,徐先良1,2,汪军成1,2,任盼荣1,2,姚立蓉1,2,孟亚雄1,2,李葆春1,3,马小乐1,2,王化俊1,2*
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃省干旱生境作物学重点实验室,甘肃 兰州730070;2.甘肃农业大学农学院,甘肃 兰州 730070;3.甘肃农业大学生命科学技术学院,甘肃 兰州730070)
为了进一步探明盐生草HgNHX1基因启动子的功能,从盐生草基因组中克隆了HgNHX1基因上游 5′侧翼调控区1523 bp的序列,即HgNHX1基因启动子(pHgNHX1)序列,并利用PlantCARE、PLACE等在线软件对HgNHX1基因5′ 端上游序列进行预测和分析,发现该启动子中除具有TATA-box、CAAT-box等核心启动子元件外,还含有多个与盐、干旱、缺水、冷、伤害等逆境胁迫诱导有关的作用元件;同时具有生长素、脱落酸、赤霉素及乙烯等植物激素诱导响应的功能元件,表明分离得到的DNA片段具有典型启动子的一般特征。构建pBI-HgNHX1启动子植物表达载体并转化拟南芥和烟草,利用组织染色法鉴定转基因烟草和拟南芥的 β-葡萄糖苷酸酶基因(GUS)表达模式,发现在转基因拟南芥的各个器官均有GUS 酶的活性,说明pHgNHX1具有一定的组成型启动子活性。
盐生草;HgNHX1基因;启动子;GUS
土壤盐渍化是一个世界性的资源和生态问题,是严重影响农作物产量和质量的主要非生物胁迫之一。据联合国教科文组织和粮农组织的不完全统计,全世界约有9.54亿hm2的土地存在不同程度的盐碱化,占世界总耕地面积的20%,超过世界土地面积的6%[1-2]。因此,合理开发利用盐碱地、改善土地盐碱化程度以及提高作物耐盐性是未来农业可持续发展急需解决的重大课题。
土壤盐害可抑制种子萌发、生长发育以及光合作用等,刘爱荣等[3]研究表明,盐胁迫会引起彩叶草(Coleusscutellarioides)离子稳态被破坏并发生渗透胁迫,对生长产生抑制作用。而Na+/H+逆向转运蛋白对于植物体的离子平衡、耐盐性以及植株的整个发育过程,都起到非常重要的作用。高等植物Na+/H+逆向转运蛋白位于液泡膜和质膜上,分别以V型H+-ATPase和H+-PPiase、P型H+-ATPase,通过水解ATP和PPi,形成跨膜质子梯度,来驱动Na+进入液泡或排出细胞,以维持体内离子平衡[4-5]。植物抵御盐胁迫的有效策略之一是通过液泡膜Na+/H+逆向转运蛋白(vacuolar Na+/H+exchanger or antiporter,简称NHX)将细胞质中过多的Na+区域化在液泡,一方面降低Na+对细胞质的毒害,另一方面又可将Na+作为一种渗透调节剂来降低细胞的渗透势[6-7],从而使植物能更好地适应盐渍生境。植物液泡膜NHX1类蛋白大多由500多个氨基酸组成,具有12个推测的高度保守的跨膜区[8]。拟南芥(Arabidopsisthaliana)基因组数据库中有16个基因被标注为编码推测的Na+/H+逆向转运蛋白,Yokoi等[9]通过分析这16个产物与AtNHX1的氨基酸序列和拓扑相似性发现,AtNHX基因家族包括6个成员AtNHX1~AtNHX6。在NaCl胁迫下拟南芥叶中,AtNHX1基因的转录表达水平比对照高出4倍,而根中则与对照无明显差异,表明液泡Na+/H+逆向转运蛋白基因的表达具有组织特异性[10]。He等[11]发现200 mmol/L NaCl处理条件下,棉花(Gossypiumspp.)过量表达AtNHX1,其植株产量会增加,且能产生更多的棉纤维。可见,Na+/H+逆向转运蛋白基因的遗传研究对植物的耐盐胁迫意义重大。
启动子是调控基因表达的重要元件,通常仅位于基因上游,可以指导全酶与模板的正确结合,能够与RNA聚合酶相互识别、结合,从而开启基因的转录过程,是植物基因转录调控的中心[12]。启动子核心区域中含有RNA聚合酶识别位点CAAT-box和RNA聚合酶结合位点TATA-box[13],具有一些能与转录因子相结合的顺式作用元件,从而调节基因的转录。启动子按其调控基因的表达方式可分为组成型启动子、诱导型启动子和组织器官特异性启动子3种。目前,大多数转基因植物所用的启动子是组成型启动子(如35S启动子),它能够在组织中非特异性和高效表达,可以满足人类的需求,但是外源基因的这种表达方式打破了植物原有的代谢平衡,影响了植物的正常生长。为了减少这种不利影响,克隆新的启动子对其进行功能验证以寻求具有组织特异性的启动子就显得尤为重要[14]。
盐生草(Halogetonglomeratus)为藜科(Chenopodiaceae)盐生草属一年生双子叶植物,广泛分布于我国西北旱区及半干旱区,其茎、叶高度肉质化,可以在高度盐碱化的环境中正常生长。Wang 等[15-16]研究表明,盐生草具有很强的耐盐性,其最主要的耐盐机制是将毒性离子(主要为Na+、Cl-)区隔化在叶片细胞液泡中。是植物耐盐基因挖掘及研究耐盐调控机理的良好材料,对改良作物抗逆性及培育耐盐碱作物具有重要的应用价值。而当前关于盐生草耐盐相关启动子的研究还属空白,基于此,本实验以盐生草为材料,克隆了HgNHX1基因启动子,通过农杆菌介导法转化烟草(Nicotianatabacum)和拟南芥,并利用GUS表达进行功能验证,阐明了pHgNHX1具有一定的启动子活性,为其通过基因工程手段培育耐盐植物育种中的运用提供了理论支撑。
1 材料与方法
1.1植物材料
实验所用盐生草种子采自甘肃省会宁县河滩盐碱地。于2015年播种于装有蛭石与细沙(体积比1∶1混合)的花盆中,在甘肃农业大学麦类实验室人工气候室培养,每天浇灌适量1/2 Hoagland’s 营养液,待幼苗长至2个月后,利用200 mmol/L NaCl进行盐胁迫处理48 h,挑取长势较好的盐生草叶片提取DNA。
1.2主要试剂
PCR扩增所用的Ex Taq酶、DNA Marker、琼脂糖凝胶纯化回收试剂盒、限制性内切酶、T4DNA Ligase均购自大连宝生物工程有限公司,PCR引物合成和样品测序均由上海生工生物科技有限公司完成,Kan、Amp、IPTG、X-gal、Rif等均为进口分析纯级试剂。
1.3菌株和载体
大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;农杆菌菌株LBA4404、植物表达载体pBI121均由麦类实验室保存(甘肃省作物遗传改良与种质创新重点实验室)。PMD19-T Vector购自大连宝生物工程有限公司。
1.4盐生草基因组DNA的提取
基因组总DNA的提取采用CTAB法,参照文献[17],略有改动。
1.5盐生草HgNHX1基因启动子的克隆
本实验利用TAIL-PCR方法[18-19]从盐生草基因组DNA中分离HgNHX1基因起始密码子(ATG)的上游片段。特异引物均由Oligo 7软件设计,并添加酶切位点BamHI和保护碱基;随机简并引物参考Li等[20],并添加酶切位点ScaI及保护碱基。扩增5′端上游序列所用随机简并引物及特异性引物如表1所示,其中N=A/G/C/T,W=A/T,S=G/C。序列送上海生工生物科技有限公司合成,PCR产物经回收后克隆到PMD19-T载体中,序列测定由上海生工生物科技有限公司进行。

表1 试验所用引物Table 1 Primers used in experiment
1.6表达载体的构建
用ScaI和BamHI双酶切表达载体pBI121质粒,同时双酶切已经转入了目的基因的大肠杆菌菌液所提的质粒,利用 T4连接酶连接到pBI121载体,替换pBI121 载体上的 CaMV35S 启动子。连接体系为 PCR 片段 6 μL,载体 DNA 1 μL,10×T4DNA Ligase Buffer 1 μL,T4DNA Ligase 1 μL,ddH2O 1 μL,除过T4DNA Ligase,上述其他反应物加入后,在65 ℃条件下保温3 min,然后迅速转入冰中冷却数秒,加入T4DNA Ligase, 16 ℃过夜连接,连接体系转化大肠杆菌 DH5α 感受态,测序确定pBI-HgNHX1启动子表达载体构建成功。将构建好的表达载体转化农杆菌LBA4404感受态细胞,挑取单菌落进行PCR验证,阳性克隆保存菌液待用。
1.7拟南芥遗传转化及转基因植株的筛选
利用浸花法[21]转化拟南芥,将含重组质粒的农杆菌菌液在28 ℃,200 r/min的YEP液体培养基(Yeast extract Tryptone medium)中振荡培养至OD600=1.2~1.6,离心弃上清,用5%蔗糖悬浮至OD600=0.8,浸染前加入Silwet-77 至终浓度为0.05%,混合均匀。拟南芥浸染前保证有大量未成熟的花序,将花序浸入菌液中5~10 s,用黑色塑料袋罩住浸染后植株暗培养16~24 h,之后正常培养,待种子成熟将其收集。
1.8烟草遗传转化和检测
烟草种子经75%乙醇和5%次氯酸钠消毒,无菌水洗净后播于MS培养基上生长4~5周,利用叶盘法[22]转化烟草。取烟草叶片,剪成小块(0.5 cm×0.5 cm)在MS分化培养基中25 ℃预培养两天,将保存的携带有pBI-HgNHX1启动子表达载体的农杆菌菌液于28 ℃,200 r/min振荡培养至OD600=0.6~0.8,5000 r/min离心5 min,弃上清,用MS液体培养基悬浮菌体。将预培养两天的烟草叶片浸在菌液中5~10 min,取出后吸干多余菌液接于MS分化培养基上28 ℃共培养2~3 d,用含Cef的无菌水洗叶片2次,再用含MS的液体培养基洗1次,吸干多余液体,转入含Kan和Cef的分化培养基进行抗性筛选,待抗性芽1 cm左右时,将丛生芽切下放入生根培养基进行生根培养,将生根后的幼苗移入盛有无菌土的花盆,温室常规管理。
利用CTAB法[17]提取转基因烟草叶片的 DNA,利用上下游引物进行 PCR 检测,阳性烟草和原始烟草留苗继续生长以待用。
1.9GUS组织化学染色
将抗性筛选的拟南芥植株和阳性烟草叶片加入 GUS 染液,并设置野生型拟南芥和烟草为对照,37 ℃保温数小时,然后用70%乙醇冲洗浸泡,观察GUS染色结果并照相。
2 结果与分析
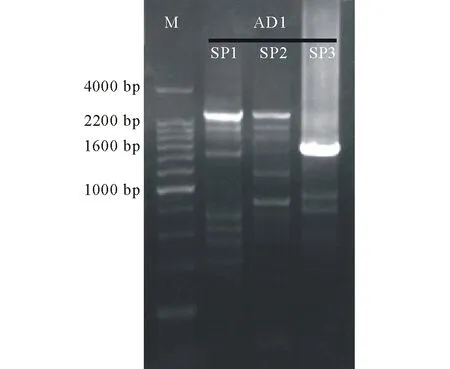
图1 TAIL-PCR扩增产物Fig.1 Products of TAIL-PCR M: DL4000 marker; SP1:第1轮扩增PCR产物Primary PCR product; SP2:第2轮扩增PCR产物Secondary PCR product; SP3: 第3轮扩增PCR产物Tertiary PCR product; AD1:随机兼并引物Arbitrary degenerate primer.
2.1HgNHX1启动子的克隆
以盐生草基因组DNA为模板,利用TAIL-PCR方法经过三轮巢式反应后将三轮扩增产物一起进行电泳检测,选取PCR产物大小差别与特异性引物位置差异相符的DNA片段回收。电泳结果如图1。
将目的片段连接克隆载体后测序,得到HgNHX1基因上游全长为1523 bp的序列。通过将该序列ATG上游区域的Blast比对发现,它与无翅猪毛菜(Salsolakomarovii)NHX1基因(SkNHX1)5′ UTR区同源性较高。并将该序列与引物设计序列比对,发现其3′ 端111个碱基与HgNHX1基因5′ 端序列基本相符。通过以上分析初步证明扩增得到的DNA片段是HgNHX1基因5′ 端上游序列。
2.2HgNHX1基因启动子区域及其顺式作用元件分析
利用PlantCARE、PLACE等在线软件对HgNHX1基因5′ 端上游序列进行预测和分析,结果表明该启动子中除具有TATA-box、CAAT-box等核心启动子元件外,还含有多个与盐、干旱、缺水、冷、伤害等逆境胁迫诱导有关的顺式作用元件及转录因子结合位点;同时具有多个植物激素诱导响应的功能元件,预测的功能元件在序列中的具体位置及元件功能分析见图2和表2。
2.3pBI-HgNHX1启动子表达载体的构建
如图3,为了检测HgNHX1基因启动子的活性,将HgNHX1启动子构建到pBI121载体,替换掉CaMV35s 启动子,与报告基因 GUS 融合。对构建的pBI-HgNHX1 启动子载体转化大肠杆菌DH5α,在大肠杆菌内大量扩增,进行菌液PCR鉴定阳性转化(图4),可知pHgNHX1已成功转入大肠杆菌中,可进行下一步实验。
2.4pBI-HgNHX1启动子的农杆菌转化及鉴定
将携带有pHgNHX1的大肠杆菌菌液提质粒转化农杆菌LBA4404,在附加Rif与Kana的YEP固体培养基上进行筛选,挑取单菌落,菌液PCR 筛选阳性克隆并送出测序。测序结果与原序列一致,如图5,表明表达载体pBI-HgNHX1启动子已成功导入农杆菌中,可进行后续的农杆菌介导转化烟草和拟南芥实验。
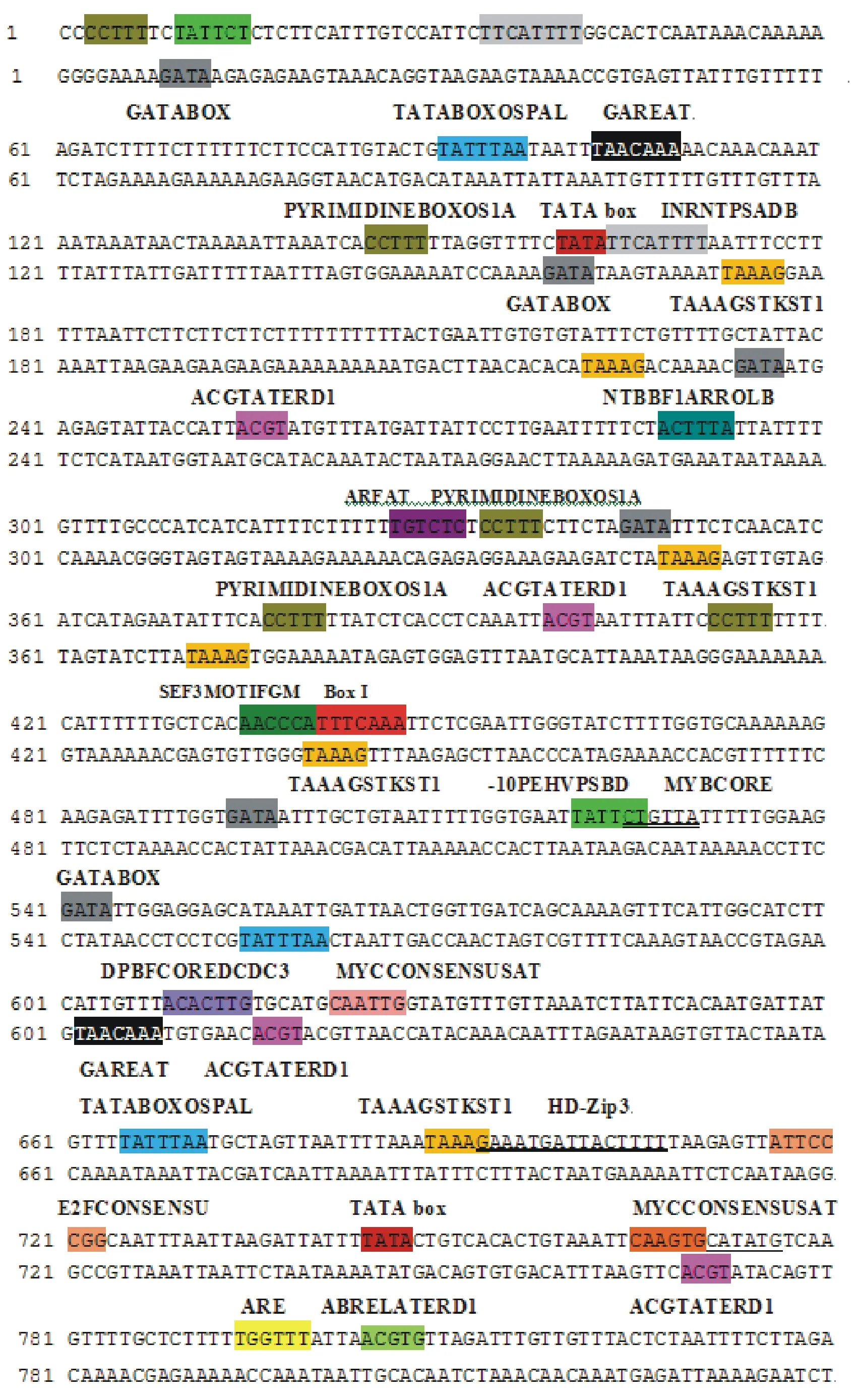
图2 HgNHX1启动子上的顺式作用元件分布Fig.2 Distribution of cis-elements in HgNHX1 promoter

续图2 HgNHX1启动子上的顺式作用元件分布Continued Fig.2 Distribution of cis-elements in HgNHX1 promoter
2.5转基因烟草的获得
为了探索HgNHX1启动子在烟草中的表达,利用农杆菌介导烟草叶片以获得转基因苗。如图6A,将预培养两天的烟草叶片用活化好的农杆菌菌液浸染,共培养后转至含有Kan和Cef的分化培养基(图6B),进行抑菌培养及抗性筛选,由图6C可看出,在抗性筛选过程中大多数愈伤组织逐渐发生褐化而死亡,未转化细胞生成的芽则会发生芽白化或花叶现象,转化后切口处能分化出绿色抗性小芽的只有少数。待抗性芽长出,将这些小芽切下移至生根培养基(图6D),待其进一步分化、生根,直至长成转基因苗(图6E)。

表2 HgNHX1基因启动子所含元件的具体功能Table 2 Function of cis-elements including in HgNHX1 promoter

续表2 Continued Table 2

图3 HgNHX1基因启动子与 GUS 基因融合示意图 Fig.3 Schematic structure of GUS gene under the control of the HgNHX1 promoter

图4 pBI-HgNHX1启动子载体的PCR分析Fig.4 PCR analysis of pBI-HgNHX1 vector
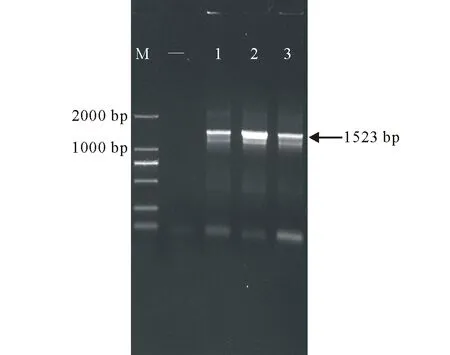
图5 农杆菌菌液的PCR鉴定Fig.5 PCR detection of agrobacterium tumefaciens
1~3:载体转化大肠杆菌菌液PCR产物PCR-amplified product;-:阴性对照Negative control;M:DL2000 marker. 1~3:农杆菌菌液PCR产物PCR-amplified product; -:阴性对照Negative control;M:DL2000 marker.
2.6HgNHX1启动子在烟草叶片中的表达
转基因烟草叶片及茎经X-Gluc染色和脱色后,观察GUS组织化学染色情况。结果显示,与对照烟草相比,转基因烟草的叶片和茎在X-Gluc染液中均变蓝(图7),说明该启动子片段具有启动子活性并可指导GUS报告基因在烟草叶片及茎中表达。

图6 转基因烟草植株的获得Fig.6 Obtain the transgenic tobacco A:转化后叶盘; B:愈伤筛选; C、D:抗性芽; E:转基因株系。A:Leaf disc after transformation; B:Callus on selective medium; C,D:Resistance shoots; E:Transgenic plants.

图7 转基因烟草的 GUS 染色Fig.7 GUS staining of the transformed tobacco lines A,B:转基因烟草叶片; C:野生型烟草叶片; D:转基因烟草茎; E:野生烟草茎。A,B: Leaves of transgenic tobacco; C: Leaves of wild type tobacco; D: Stems of transgenic tobacco; E: Stems of wild type plants.
2.7HgNHX1启动子在拟南芥中的表达分析

图8 转基因拟南芥幼苗的 GUS 染色Fig.8 GUS staining of the transformed A. thaliana seedlings lines A:转基因拟南芥; B: 转基因拟南芥叶片(5×);C: 转基因拟南芥根茎(5×);D:野生型拟南芥; E: 野生拟南芥叶片(5×); F: 野生拟南芥根茎(5×)。A: Transgenic A. thaliana; B: Leaves of transgenic plants (5×); C: The roots and stems of transgenic plants (5×); D: Wild type A. thaliana; E: Leaves of wild type plants (5×); F: The roots and stems of wild type plants (5×).
为了探索HgNHX1启动子在拟南芥特异部位表达的性质,用含HgNHX1启动子质粒的农杆菌侵染拟南芥野生型植株,将得到的T0代种子经消毒后播种于含有50 mg/L Kan的MS培养基中进行筛选。对筛选出的抗性植株的花序及不同生长阶段的抗性株系进行GUS染色,分析HgNHX1启动子引导的GUS基因在拟南芥中的表达部位。对转基因拟南芥GUS染色分析结果可看出,拟南芥花序及不同生长时期的株系在X-Gluc染液中都变为蓝色(图8和图9),表明该启动子片段可指导GUS报告基因在转基因拟南芥各个器官中都可表达。

图9 转基因拟南芥的 GUS 染色Fig. 9 GUS staining of the transformed A. thaliana lines A,B:转基因拟南芥; C:野生拟南芥; D:转基因拟南芥花序; E:野生拟南芥花序。A,B: Transgenic A. thaliana; C: Wild type A. thaliana; D: Inflorescence of transgenic plants; E: Inflorescence of wild type plants.
3 讨论
启动子是一段RNA聚合酶特异性识别和结合的位于结构基因5′端上游区的DNA序列,是转录水平上基因表达调控的关键部位。植物基因启动子中包含多种重要的顺式作用元件,在转录水平上参与调控下游相应基因表达,从而使植物能够抵御外界环境胁迫[23]。启动子上的顺式作用元件通常含有TATA-box、CAAT-box 和 GC-box 元件,其中 TATA-box 是启动子上最具特征的序列[24]。本研究利用 Plant CARE、PLACE 等在线软件对HgNHX1基因5′ 端上游序列进行预测和分析,发现该启动子中具有TATA-box、CAAT-box 等核心启动子元件,表明其具有典型启动子的特征。
不同的启动子都具有自己特异的调节序列,杨国栋[25]利用TAIL-PCR方法克隆得到棉花GhNHX1基因的启动子片段。序列分析表明,该启动子中存在与冷、干旱胁迫、盐胁迫诱导有关的顺式作用元件,包括MYB识别位点、MYC识别位点以及GT1GMSCAM4。杨云尧等[26]得到的新牧1号苜蓿(Medicagosativa)MvNHX1基因启动子包含MYC、G-box以及TC重复区等多个水分胁迫相关作用元件,表明其可能是一个与干旱、脱水诱导有关的启动子。大多数绿色植物都包含若干个光应答元件, 如 G-box[27]、I-box[28]、GT1 元件(或 GATA元件)[29]、Z-box[27]等,这些作用元件对光调控的转录激活是必需的[30]。在pHgNHX1中也含有一些光应答元件,如AE-BOX、Box I等,预示着pHgNHX1的表达调控可能会受到光信号的影响。
本研究对获得的启动子进行生物信息学分析发现,该启动子具有多个与非生物逆境胁迫及植物激素诱导有关的调控元件。包括盐诱导元件GAAAAA,伤害诱导元件TGACY,抗寒、抗冻、缺水和脱落酸诱导元件CANNTG,脱落酸诱导元件ACACNNG,脱水反应相关元件ACGTG、CNGTTR、ACGT等与逆境胁迫相关的调控元件;还包括乙烯响应元件AWTTCAAA,生长素响应顺式作用元件TGTCTC,以及赤霉素响应顺式元件CCTTTT、TAACAAR等与激素诱导有关的调控元件。这与文献[25-26]中报道的NHX1基因启动子中的功能元件具有一定的一致性,预示着HgNHX1基因启动子可能是一个受逆境胁迫和激素诱导的启动子。
本实验利用农杆菌介导法转化烟草后,对转基因植株的叶片和茎进行GUS组织化学染色,酒精脱色后发现与对照相比,烟草叶片和茎均被染成蓝色,结果表明克隆的HgNHX1启动子序列具有启动子活性。然后用同样的方法侵染拟南芥,并对转基因拟南芥花序和不同生长时期的株系进行GUS染色分析,结果发现该序列不仅能正确启动GUS基因表达,而且在转基因拟南芥生长的各个时期、各个器官中都可表达,说明pHgNHX1具有一定的组成型启动子活性。下一步工作是对该启动子序列进行系列缺失,并构建包含不同长度启动子缺失片段的植物表达载体,导入烟草叶片和拟南芥植株进行功能验证,并确定核心启动子区域,通过研究该启动子在植物耐盐方面的功能,进一步研究HgNHX1在盐胁迫中的作用,提高作物的耐盐性,并对培育耐盐作物具有重要意义。
References:
[1] Liu X J, Liu M Y. Regional Agricultural Sustainable Development and Utilization of Halophytes[M]. Beijing: China Meteorological Press, 2002: 1-9.
刘小京, 刘孟雨. 盐生植物利用与区域农业可持续发展[M]. 北京: 气象出版社, 2002: 1-9.
[2] Munns R, Tester M. Mechanisms of salinity tolerance. Annual Review of Plant Biology, 2008, 59: 651-681.
[3] Liu A R, Zhang Y B, Zhong Z H,etal. Effects of salt stress on the growth and osmotica accumulation ofColeusblumei. Acta Prataculturae Sinica, 2013, 22(2): 211-218.
刘爱荣, 张远兵, 钟泽华, 等. 盐胁迫对彩叶草生长和渗透调节物质积累的影响. 草业学报, 2013, 22(2): 211-218.
[4] Najmeh N, Ehsan S, Ghorbanali N. Assessment of Na+/H+antiporters and H+-ATPase pumps transcnptional changes inAeluropuslittoralisdealing with salt stress. Advances in Environmental Biology, 2012, 6(5): 1769-1773.
[5] Zhou S, Zhang Z, Tang Q,etal. Enhanced V-ATPase activity contributes to the improved salt tolerance of transgenic tobacco plants overexpressing vacuolar Na+/H+antiporterAtNHX1. Biotechnology Letters, 2011, 33(2): 375-380.
[6] Ashnest J R, Huynh D L, Dragwidge J M,etal.Arabidopsisintracellular NHX-type sodium-proton antiporters are required for seed storage protein processing. Plant amp; Cell Physiology, 2015, 56(11): 2220-2233.
[7] Reguera M, Bassil E, Tajima H,etal. pH regulation by NHX-type antiporters is required for receptor-mediated protein trafficking to the vacuole inArabidopsis. The Plant Cell, 2015, 27(4): 1200-1217.
[8] Shi H, Ishitani M, Kim C,etal. TheArabidopsisthalianasalt tolerance geneSOS1 encodes a putative Na+/H+antiporter. Proceedings of the National Academy of Sciences, 2000, 97(12): 6896-6901.
[9] Yokoi S, Quintero F J, Cubero B,etal. Differential expression and function ofArabidopsisthalianaNHX Na+/H+antiporters in the salt stress response. The Plant Journal, 2002, 30(5): 529-539.
[10] Quintero F J, Blatt M R, Pardo J M. Functional conservation between yeast and plant endosomal Na+/H+antiporters. FEBS Letters, 2000, 471(2): 224-228.
[11] He C X, Yan J Q, Shen G X,etal. Expression of anArabidopsisvacuolar sodium/proton antiporter gene in cotton improves photosynthetic performance under salt conditions and increases fiber yield in the field. Plant Cell Physiology, 2005, 46(11): 1848-1854.
[12] Li J, Zhang F C, Wang W Q,etal. Advance in the study of higher plant promoter. Letters Biology Technology, 2006, 17(4): 658-661.
李杰, 张福城, 王文泉, 等. 高等植物启动子的研究进展. 生物技术通讯, 2006, 17(4): 658-661.
[13] Wu R R. The Cloning and Function Analysis ofSuaedasalsaSsHKT1 Promotor[D]. Jinan: Shandong Normal University, 2011.
吴蕊蕊. 盐地碱蓬SsHKT1 基因启动子的克隆及功能分析[D]. 济南: 山东师范大学, 2011.
[14] Li Y M, Feng Y J, Cao X W,etal. Cloning and transient expression of theGGPPSgene promoter from the energy plantTaraxacumkok-saghyz. Acta Prataculturae Sinica, 2016, 25(12): 180-187.
李永梅, 冯玉杰, 曹新文, 等. 能源橡胶草GGPPS基因启动子的克隆及瞬时表达研究. 草业学报, 2016, 25(12): 180-187.
[15] Wang J C, Meng Y X, Li B C,etal. Physiological and proteomic analyses of salt stress response in the halophyteHalogetonglomeratus. Plant, Cell and Environment, 2015, 38: 655-669.
[16] Wang J C, Yao L R, Li B C,etal. Comparative proteomic analysis of cultured suspension cells of the halophyteHalogetonglomeratusby iTRAQ provides insights into response mechanisms to salt stress. Frontiers in Plant Science, 2016, 7: 1-12.
[17] Andrew H P, Curt L B, Jonathan F W. A rapid method for extraction of cotton (Gossypiumspp.) genomic DNA suitable for RFLP for PCR analysis. Plant Molecular Biology Reporter, 1993, 11(2): 122-127.
[18] Liu Y G, Mitsukawa N, Oosumi T,etal. Efficient isolation and mapping ofArabidopsisthalianaT-DNA insert junctions by thermal asymmetric interlaced PCR. The Plant Journal, 1995, 8(3): 457-463.
[19] Liu Y G, Whittier R F. Thermal asymmetric interlaced PCR: automatable amplification and sequencing of insert end fragments from P1 and YAC clones for chromosome walking. Genomics, 1995, 25(3): 674-681.
[20] Li Z T, Gray D J. Isolation by improved thermal asymmetric interlaced PCR and characterization of a seed-specific 2S albumin gene and its promoter from grape (VitisviniferaL.). Genome, 2005, 48(2): 312-320.
[21] Clough S J, Bent A F. Floral dip: a simplified method forAgrobacterium-mediated transformation ofArabidopsisthalina. The Plant Journal, 1998, 16: 735-743.
[22] Ma L L. Optimization of Tissue Culture System for Barley Mature embryos, Construction of Expression Vector and Genetic Transformation ofHgNHX1 Gene[D]. Lanzhou: Gansu Agricultural University, 2015.
马玲珑. 大麦成熟胚离体培养条件的优化及HgNHX1 基因表达载体的构建和遗传转化[D]. 兰州: 甘肃农业大学, 2015.
[23] Nie L N, Xia L Q, Xu Z S,etal. Progression cloning and functional study of plant gene promoters. Journal of Plant Genetic Resources, 2008, 9(3): 385-391.
聂丽娜, 夏兰琴, 徐兆师, 等. 植物基因启动子的克隆及其功能研究进展. 植物遗传资源学报, 2008, 9(3): 385-391.
[24] Zheng L, Shi L M, Tian H Y,etal. Cloning and functional analysis of peanutAhDGAT2apromoter. Acta Agronomica Sinica, 2016, 42(7): 1094-1099.
郑玲, 史灵敏, 田海莹, 等. 花生AhDGAT2a基因启动子的克隆和功能验证. 作物学报, 2016, 42(7): 1094-1099.
[25] Yang G D. Isolation and Characterization of a Salt InducibleGhNHX1 Promoter fromGossypiumhirsutum[D]. Taian: Shandong Agriculture University, 2007.
杨国栋. 棉花耐盐基因GhNHX1启动子的克隆及功能分析[D]. 泰安: 山东农业大学, 2007.
[26] Yang Y X, Ren Y P, Su Y M,etal. Cloning and analysis of two promoters of stress-related genes inMedicagovariaXinmu-1. Pratacultural Science, 2012, 29(12): 1887-1893.
杨云尧, 任燕萍, 苏豫梅, 等. 新牧1号苜蓿两个抗逆相关基因启动子的克隆及分析. 草业科学, 2012, 29(12): 1887-1893.
[27] Gangappa S N, Maurya J P, Yaday V,etal. The regulation of the Z-Box and G-Box containing promoters by light signaling components, SPA1 and MYC2, inArabidopsis. Plos One, 2012, 8(4): 7377-7382.
[28] Li H F, Wang X F, Ran K,etal. Expression and protein interaction analysis of light responsive bZIP transcription factor MdHY5. Scientia Agricultura Sinica, 2014, 21: 4318-4327.
[29] Kumar A. Characterisation of Promoter and Transcription Factors ofCoffeasp. with Special Reference to Caffeine Metabolism[D]. Karnataka: University of Mysore, 2015.
[30] Yaday V, Kundu S, Chattopadhyay D,etal. Light regulated modulation ofZ-boxcontaining promoters by photoreceptors and downstream regulatory components, COP1 and HY5, inArabidopsis. The Plant Journal, 2002, 31: 741-753.
CloningandfunctionalanalysisofhalophyteHalogetonglomeratusHgNHX1promoter
ZOU Lan1,2**, YANG Ke1,2**, XU Xian-Liang1,2, WANG Jun-Cheng1,2, REN Pan-Rong1,2, YAO Li-Rong1,2, MENG Ya-Xiong1,2, LI Bao-Chun1,3, MA Xiao-Le1,2, WANG Hua-Jun1,2*
1.Gansu Provincial Key Lab of Aridland Crop Science, Gansu Key Lab of Crop Improvement amp; Germplasm Enhancement, Lanzhou 730070, China; 2.College of Agronomy, Gansu Agricultural University, Lanzhou 730070, China; 3.College of Life Sciences and Technology, Gansu Agricultural University, Lanzhou 730070, China
In order to test the function ofpHgNHX1, the promoter sequence of theHgNHX1 gene fromHalogetonglomeratuswas cloned and a 1523 bp fragment flanking 5′-upstream ofHgNHX1 was isolated and namedpHgNHX1. The software PlantCARE and PLACE were used to predict and analyze the elements ofpHgNHX1. The results showed that besides the TATA-box and CAAT-box, a number of potential cis-elements and transcription binding motifs related to stress responses were found, including salt, dehydration, cold and wound responsive elements. Other potential cis-elements responsive to phytohormones, including auxin, abscisic acid, gibberellin and ethylene were also found in the sequence. Sequence analysis indicated that it had the general characteristics of typical promoter. In order to evaluate the activity ofpHgNHX1, we constructed pBI-pHgNHX1 expression vector and introduced it into tobacco and Arabidopsis using agrobacterium mediated transformation. The expression pattern was monitored using GUS histochemical staining. Results showed that GUS activity driven by thepHgNHX1 was detected in almost all vegetative and reproductive tissues, indicating thatpHgNHX1 has a constitutive promoter activity.
Halogetonglomeratus;HgNHX1 gene; promoter; GUS
10.11686/cyxb2017018http//cyxb.lzu.edu.cn
邹兰, 杨轲, 徐先良, 汪军成, 任盼荣, 姚立蓉, 孟亚雄, 李葆春, 马小乐, 王化俊. 盐生草HgNHX1基因启动子的克隆及功能验证. 草业学报, 2017, 26(11): 57-68.
ZOU Lan, YANG Ke, XU Xian-Liang, WANG Jun-Cheng, REN Pan-Rong, YAO Li-Rong, MENG Ya-Xiong, LI Bao-Chun, MA Xiao-Le, WANG Hua-Jun. Cloning and functional analysis of halophyteHalogetonglomeratusHgNHX1 promoter. Acta Prataculturae Sinica, 2017, 26(11): 57-68.
2017-01-18;改回日期:2017-03-14
973计划前期研究专项(2014CB160313),国家大麦青稞产业技术体系(CARS-05)和国家自然科学基金地区项目(31460347)资助。
邹兰(1992-),女,甘肃会宁人,在读硕士。E-mail:956805769@qq.com。杨轲(1983-),男,甘肃兰州人,在读博士。Email:yk_831116@163.com。**共同第一作者These authors contributed equally to this work.
*通信作者Corresponding author. E-mail:whuajun@yahoo.com
