外源SA对盐胁迫下颠茄生理生化、氮代谢及次生代谢的影响
2017-11-24扈雪欢宁欢欢刘光照吴能表
扈雪欢,宁欢欢,刘光照,吴能表,2*
(1.西南大学生命科学学院,重庆 400715;2.三峡库区生态环境教育部重点实验室,重庆 400715)
外源SA对盐胁迫下颠茄生理生化、氮代谢及次生代谢的影响
扈雪欢1,宁欢欢1,刘光照1,吴能表1,2*
(1.西南大学生命科学学院,重庆 400715;2.三峡库区生态环境教育部重点实验室,重庆 400715)
采用无土栽培的方式,研究0.75 mmol/L 水杨酸(SA)对100 mmol/L NaCl胁迫下颠茄幼苗生理生化、氮代谢与次生代谢的影响。结果表明,外源SA处理后:颠茄叶片叶绿素含量增多,最大光化学效率(Fv/Fm)、PSⅡ的潜在活性(Fv/Fo)、PSⅡ激发能捕获效率(Fv′/Fm′)、表观光合电子传递速率(ETR)、PSⅡ实际光化学效率(ΦPSⅡ)、光化学猝灭系数(qP)显著升高,初始荧光(Fo)、非光化学猝灭系数(qN)明显降低;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性明显增强,丙二醛(MDA)含量明显降低;可溶性蛋白含量显著升高,脯氨酸和可溶性糖含量降低;NO3-含量增加,NH4+含量减少,谷氨酰胺合成酶(GS)和谷氨酸合成酶(GOGAT)活性提高,谷氨酸脱氢酶(GDH)活性降低;次生代谢产物莨菪碱和东莨菪碱含量显著提升。说明0.75 mmol/L外源SA能显著改善100 mmol/L NaCl胁迫下颠茄幼苗的光合性能,调节有机渗透物质含量,提高抗氧化酶活性,减小膜脂过氧化程度,以缓解盐胁迫造成的伤害。并使氮代谢相关酶活性恢复或增强,为生物碱的合成提供更多的前体物质和能量,从而直接或间接地促进了次生代谢产物的合成与积累。
颠茄;盐胁迫;水杨酸;氮代谢;次生代谢
颠茄(Atropabelladonna)是我国药典规定的唯一托品烷类生物碱的药源植物,同时也是商业化生产东莨菪碱(scopolamine)和莨菪碱(hyoscyamine)的主要药源植物。其中,东莨菪碱可用于阻断副交感神经,也可用作中枢神经系统抑制剂,是托品烷类生物碱中药理作用强且副作用小的一种生物碱,但其在野生颠茄内的含量很低[1]。土壤盐渍化是现代化农业面临的严峻问题之一。随着人类耕作活动的增加,盐渍化土壤面积逐年呈不可逆的形式升高,预计到2050年,可用耕地的50%将面临盐渍化[2]。因此,如何提高植物的抗(耐)盐能力,培育抗(耐)盐植株,必将成为未来农业科学研究的热点问题。
水杨酸(salicylic acid,SA)是一种广泛存在于植物体内的激素,作为信号分子,SA可通过复杂的信号转导网络调节植物对各种逆境的反应[3]。目前,SA 在盐胁迫下对不同植物的保护作用已有大量报道:Ganege等[4]研究发现外源SA处理能诱导盐胁迫下非洲菊(Gerberajamesonii)植株的抗氧化反应;张林青[5]发现SA能显著改善盐胁迫下番茄(Lycopersiconesculentum)的多种生理指标,从而提高番茄的耐盐能力;王立红等[6]在棉花(Gossypiumhirsutum)幼苗上也得到了一致的研究结果。此外,有研究表明,SA还可作为诱导子,影响东莨菪碱的合成与积累:虞珍珍[7]将SA 添加到东莨菪碱植物的细胞培养体系中,发现东莨菪碱的含量提高;Kang等[8]发现水杨酸处理能显著提高韩国山莨菪(Scopoliatangutica)的东莨菪碱含量,Lee等[9]也得出了相似的结果。因此,研究外源SA对盐胁迫下颠茄的缓解效应和对次生代谢产物积累的影响,对选育高产莨菪碱、东莨菪碱的颠茄有重要意义。
本试验通过探究外源SA对盐胁迫下颠茄生理生化、氮代谢及次生代谢的影响,为人工调控颠茄的耐盐性、扩大颠茄的种植范围及氮代谢与次生代谢产物调控的相关研究提供理论参考。
1 材料与方法
1.1材料
颠茄种子来源于西南大学“三峡库区生态环境教育部重点实验室”,2015年6月种于该实验室内。选取健康、饱满的种子,用50 mmol/L的赤霉素溶液浸泡2 d后,平铺于湿润的滤纸上萌发,期间保持滤纸湿润。一周后将萌发的种子播种于装有珍珠岩的营养钵中,每个处理10钵,每钵3株。在人工培养室内培养,每天于7:00-19:00期间光照,光照强度为5000 lx;温度为白天25 ℃,夜晚20 ℃;相对湿度:60%~70%。
2015年7月待颠茄幼苗长至10 cm左右时进行试验。NaCl溶液浓度参考文献[10-15] 研究结果,设定为100 mmol/L,浇灌量为5 mL。SA处理采用对叶片喷施SA溶液(内含0.02% Tween-20)的方式,CK和仅NaCl组喷施等量蒸馏水。其中,NaCl溶液和SA溶液皆由1/2 Hoagland完全营养液配制而成。第一批试验设7个处理:CK(无NaCl和SA)、100 mmol/L NaCl+0 mmol/L SA、100 mmol/L NaCl+0.25 mmol/L SA、100 mmol/L NaCl+0.5 mmol/L SA、100 mmol/L NaCl+0.75 mmol/L SA、100 mmol/L NaCl+1 mmol/L SA、100 mmol/L NaCl+1.25 mmol/L SA,试验采用随机区组设计,每个处理取3个重复。试验第15 天取样测定逆境生理指标,根据结果确定最佳SA浓度后再进行第二批试验。第二批试验设4个处理:CK、100 mmol/L NaCl、SA、100 mmol/L NaCl+SA,试验第15 天取样测定各项指标。
1.2方法
1.2.1逆境生理 脯氨酸(proline,Pro)含量采用酸性水合茚三酮显示法测定[16];丙二醛(malondialdehyde,MDA)含量采用硫代巴比妥酸(thiobarbituric acid,TBA)检测法测定[17];可溶性糖含量的测定参照张志良等[18]的苯酚法;可溶性蛋白含量的测定采用考马斯亮蓝法[18];过氧化氢酶(catalase,CAT)活性采用紫外分光光度法测定[19];过氧化物酶(peroxidase,POD)活性采用愈创木酚法测定[18];超氧化物歧化酶(superoxide dismutase,SOD)活性根据氮蓝四唑(NBT)光还原法测定[20]。
1.2.2光合特性 叶绿素荧光参数测定利用 PAM-2100荧光仪(Walz,德国)预先编好的测定程序Run 3进行。晚上将待测样品充分暗处理30 min,然后测定初始荧光(Fo)、最大荧光(Fm)、稳态荧光产量(Fs)、作用光打开时的最大荧光产量(Fm′)、作用光关闭时的原初荧光产量(Fo′)、光合电子传递速率(ETR)、光化学猝灭系数(qP)和非光化学猝灭系数(qN),取3次数据的平均值分析;计算以下指标:可变荧光(Fv)=Fm-Fo,PSⅡ潜在活性(Fv/Fo)=(Fm-Fo)/Fo,PSⅡ激发能捕获效率(Fv′/Fm′)=(Fm′-Fo′)/Fm′,实际光化学效率(ΦPSⅡ)=(Fm′-Fs)/Fm′[21];叶绿素含量的测定参照张宪政[22]的方法。
1.2.3氮代谢 硝态氮含量测定参照李合生[23]的方法;铵态氮含量的测定参照汤章程[24]的方法;谷氨酰胺合成酶(glutamine synthetase,GS)活性的测定参照王小纯等[25]的方法;谷氨酸合成酶(glutamate synthetase,GOGAT)活性的测定参照汤章程[24]的方法;谷氨酸脱氢酶(glutamate dehydrogenase,GDH)活性的测定参照Majerowicz等[26]的方法。
1.2.4次生代谢产物 参照Zárate等[27]的方法,提取颠茄叶片的莨菪碱、东莨菪碱。高效液相色谱法(high performance liquid chromatography,HPLC)采用日本岛津(Shimadzu)LC-60A 高效液相色谱仪(泵:LC-20AD;控制器:SPD-20A;柱温箱:CTO-10AS vp);Ultimate XB-C18液相色谱柱(5 μm,4.6 mm×250 mm);流动相:甲醇∶醋酸缓冲液(20 mmol/L 醋酸铵,0.1%甲酸,pH 4.0)=1∶4;检测波长:226 nm;流速:1.0 mL/min;柱温:40 ℃;进样量:10 μL。精密称取对照品进行HPLC测定,绘制峰面积(Y)和浓度(X)的标准曲线,并计算出莨菪碱、东莨菪碱的含量 。
1.3数据分析
用Microsoft Excel 2010和SPSS 17.0对数据进行统计分析和方差检验,数据均以平均值±标准误差表示。
2 结果与分析
2.1SA浓度的确定
研究不同浓度SA对100 mmol/L NaCl胁迫下颠茄幼苗逆境生理指标的影响,以筛选本试验的最适SA浓度,结果显示(表1),盐胁迫下,MDA含量升高,表明膜脂过氧化程度加剧。外施SA后显著降低了MDA含量,其中0.75 mmol/L SA效果最好,较胁迫组减少了33.48%。抗氧化酶能自行清除自由基,盐胁迫下,CAT、POD、SOD的活性均有所增强;添加不同浓度SA后,酶活性有不同程度的提升,其中0.75 mmol/L SA处理组的CAT、POD、SOD活性最高,升高幅度最大,分别为胁迫组的2.47、1.18和1.55倍,即0.75 mmol/L SA对盐胁迫下颠茄的抗氧化能力提升效果最好。单纯盐处理,脯氨酸和可溶性糖的含量均呈上升趋势,可溶性蛋白含量降低,说明颠茄幼苗受到渗透胁迫。施加不同浓度的SA后,上升或降低的趋势得到不同程度的缓解。其中0.75 mmol/L SA的效果最佳,脯氨酸、可溶性糖的含量较盐胁迫组分别降低了30.14%、31.14%,可溶性蛋白含量较胁迫组升高了16.97%。因此,本试验选取0.75 mmol/L为SA处理浓度。
2.2外源SA对盐胁迫下颠茄幼苗叶片光合色素含量的影响
100 mmol/L NaCl处理使颠茄叶片中叶绿素a、叶绿素b、叶绿素总量及类胡萝卜素含量均呈下降趋势,较CK分别降低了40.46%、46.37%、44.79%和44.96%。施加0.75 mmol/L SA后,叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素的含量分别较胁迫组显著提高了79.58%、72.58%、68.93%、83.10%,说明外源SA能有效改善盐胁迫下颠茄的光合性能。与CK相比,单独SA处理各指标均有提高,只有叶绿素a达到显著水平,可能是叶绿素a对SA比较敏感(表2)。
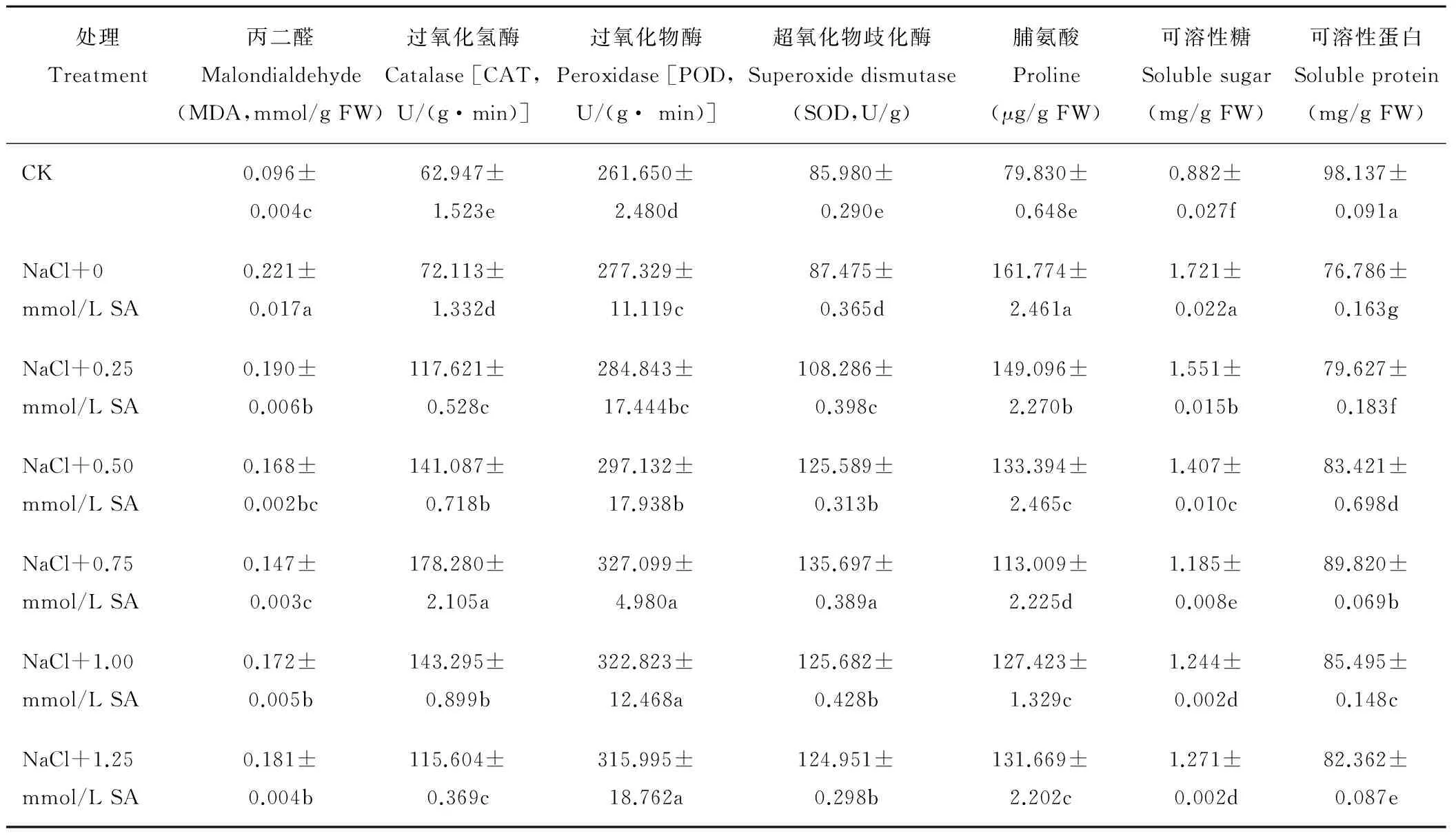
表1 外源水杨酸(SA)对盐胁迫下颠茄幼苗叶片逆境生理指标的影响Table 1 Effect of salicylic acid (SA) on stress physiological index of A. belladonna leaves under NaCl stress
注:同列不同小写字母表示差异显著(Plt;0.05),下同。
Notes:Different lowercase letters within the same column show significant difference (Plt;0.05). The same below.

表2 外源SA对盐胁迫下颠茄幼苗叶片光合色素含量的影响Table 2 Effect of SA on photosynthetic pigment content of A. belladonna leaves under NaCl stress mg/g FW
2.3外源SA对盐胁迫下颠茄幼苗叶片叶绿素荧光参数的影响
2.3.1外源SA对盐胁迫下颠茄幼苗叶片暗适应荧光参数的影响 盐胁迫下,Fo显著升高,为CK的1.71倍,添加0.75 mmol/L SA后降低了21.43%。盐胁迫下,Fm显著降低,仅为CK的38.46%,添加外源SA后提高了20.41%。盐胁迫下,Fv/Fm、Fv/Fo较CK分别降低了43.80%、87.39%;加SA处理后,Fv/Fm、Fv/Fo分别升高为胁迫组的1.35和2.07倍。仅SA处理组与CK无显著差异。说明100 mmol/L NaCl胁迫下,PSⅡ反应中心的活性降低,光合作用受抑制,0.75 mmol/L SA能显著缓解盐胁迫对颠茄光合系统的伤害(表3)。
2.3.2外源SA对盐胁迫下颠茄幼苗叶片光适应荧光参数的影响 100 mmol/L NaCl胁迫下,颠茄幼苗的Fv′/Fm′、ΦPSⅡ、ETR、qP较CK分别降低了79.63%、90.89%、33.76%、66.91%,qN升高为CK的2.28倍。添加SA后,Fv′/Fm′、ΦPSⅡ、qP显著升高为胁迫组的3.15、3.11和2.57倍,ETR提高了23.32%,qN降低了40.43%,缩小了与CK的差距。除qP外,仅SA处理与CK差异不显著。说明0.75 mmol/L SA能缓解盐胁迫导致的PSⅡ反应中心活性降低,减少热耗散的份额(表4)。

表3 外源SA对盐胁迫下颠茄幼苗叶片暗适应荧光参数的影响Table 3 Effect of SA on dark adaptation fluorescence parameters of A. belladonna leaves under NaCl stress
注:Fo表示初始荧光,Fm表示最大荧光,Fv/Fm表示最大光化学效率,Fv/Fo表示PSⅡ的潜在活性。
Notes:Forepresents initial fluorescence,Fmrepresents maximum fluorescence,Fv/Fmrepresents maximal photochemical efficiency,Fv/Forepresents potential activity of PSⅡ.

表4 外源SA对盐胁迫下颠茄幼苗叶片光适应荧光参数的影响Table 4 Effect of SA on light adaptation fluorescence parameters of A. belladonna leaves under NaCl stress
注:Fv′/Fm′表示PSⅡ激发能捕获效率,ΦPSⅡ表示PSⅡ实际光化学效率,ETR表示表观光合电子传递速率,qP表示光化学荧光猝灭系数,qN表示非光化学荧光猝灭系数。
Notes:Fv′/Fm′ represents the efficiency of excitation energy capture by open PSⅡcenters,ΦPSⅡrepresents actual PSⅡ photochemical efficiency,ETR represents photosynthetic electron transport rate,qPrepresents photochemical quenching coefficient,qNrepresents non-photochemical quenching coefficient.
2.4外源SA对盐胁迫下颠茄幼苗叶片氮代谢的影响
100 mmol/L NaCl胁迫下,颠茄幼苗叶片GS、GOGAT活性较CK分别显著降低了56.40%、48.19%,而GDH活性显著升高60.8%;外源SA处理后,GS、GOGAT活性分别较胁迫组上升了52.00%、47.84%,GDH活性下降了13.5%。仅SA处理下,酶活性的变化均不明显。说明0.75 mmol/L SA能较明显地逆转盐胁迫造成的氮代谢酶活性紊乱,使酶活性恢复正常水平(表5)。
100 mmol/L NaCl胁迫下,颠茄幼苗叶片NO3-含量较CK降低51.18%,用外源SA处理后,NO3-含量提高了57.69%,说明0.75 mmol/L SA能促进盐胁迫下颠茄对硝态氮的吸收。盐胁迫使NH4+含量显著升高,是CK的2.13倍,NH4+的积累易使植物受氨毒害;用外源SA处理后,NH4+含量降低了31.74%。仅SA处理时,含量变化均不明显。上述结果表明,外施0.75 mmol/L SA溶液能提高盐胁迫下颠茄幼苗对氮素的利用,使氮代谢正常进行(表5)。
2.5外源SA对盐胁迫下颠茄幼苗叶片次生代谢产物的影响
经不同处理后,颠茄幼苗中的东莨菪碱、莨菪碱含量与CK相比均有提高。100 mmol/L NaCl处理下,东莨菪碱、莨菪碱含量分别为CK的1.38和2.10倍;添加0.75 mmol/L外源SA后,东莨菪碱、莨菪碱含量继续上升,分别为CK的1.63和2.53倍;仅SA处理下,东莨菪碱、莨菪碱含量分别为CK的1.20和1.62倍(表6)。

表5 外源SA对盐胁迫下颠茄幼苗叶片氮代谢指标的影响Table 5 Effect of SA on nitrogen metabolism index of A. belladonna leaves under NaCl stress
注:GS表示谷氨酰胺合成酶,GOGAT表示谷氨酸合成酶,GDH表示谷氨酸脱氢酶,NADH表示烟酰胺腺嘌呤二核苷酸。
Notes:GS represents glutamine synthetase,GOGAT represents glutamate synthetase,GDH represents glutamate dehydrogenase,NADH represents nicotinamide adenine dinucleotide.
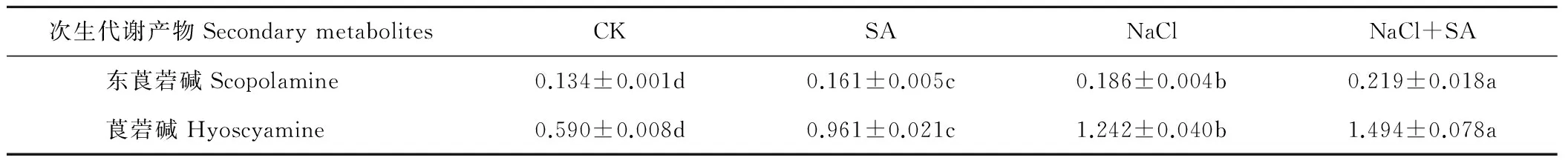
表6 外源SA对盐胁迫下颠茄幼苗叶片次生代谢产物含量的影响Table 6 Effect of SA on secondary metabolites content of A. belladonna leaves under NaCl stress mg/g DW
注:同行不同小写字母表示差异显著(Plt;0.05)。
Notes:Different lowercase letters within the same row show significant difference (Plt;0.05).
3 讨论
3.1外源SA对盐胁迫下颠茄幼苗光合特性的影响
一般地,NaCl胁迫会诱发膜脂过氧化,破坏类囊体膜的超微结构,从而引起叶绿体的解体,导致光合色素含量的下降[28]。本试验中,盐胁迫下,叶绿素和类胡萝卜素含量均显著降低。叶绿素含量的降低导致捕获的光能减少,光能转化受阻;类胡萝卜素含量降低使其在细胞内吸收剩余能、淬灭活性氧的能力下降,膜脂过氧化加剧[29]。施加外源SA后,光合色素含量明显升高,说明外源SA能有效缓解颠茄由于盐胁迫造成的光合色素含量下降,可能与外源SA缓解了膜脂的过氧化程度有关。这在夏枯草(Prunellavulgaris)[28]、黄连(Coptischinensis)[29]上也得到了证明。
许多研究已证明PSⅡ是光抑制的重要部位,盐碱可以使光能利用效率下降,从而使植物更易受到光抑制的伤害[29]。本研究中,盐胁迫下,Fv/Fm、Fv/Fo、ΦPSⅡ、Fv′/Fm′、ETR显著下降,Fo升高,表明盐胁迫使颠茄遭受光抑制,颠茄PSⅡ反应中心遭到破坏,光合电子传递受阻,光能转化率降低。qP显著降低,qN明显升高,表明颠茄叶片PSⅡ热耗散的份额增多,碳同化的能量来源不足。施加0.75 mmol/L SA后,Fo、qN下降,Fm、Fv/Fm、Fv/Fo,Fv′/Fm′、ΦPSⅡ、qP、ETR显著提高,说明SA不是通过增多颠茄热耗散的方式来保护光合机构,可能是通过调整PSⅡ的能量分配,将捕获的光能更多的用于光化学转化,增大盐胁迫下PSⅡ反应中心的开放程度,加快原初电子受体QA(primary quinone electron acceptor of PSⅡ)还原态的氧化,促进电子传递,从而缓解盐胁迫对PSⅡ反应中心的伤害,提高光能转化效率应对胁迫。孙德智等[30]的研究也得出了相似的结论。
综上,0.75 mmol/L外源SA能提高盐胁迫下颠茄的光合色素含量,缓解盐胁迫对光合机构的破坏,调整PSⅡ能量分配,缓解反应中心的伤害,使更多能量用于光化学转化,从而增强光合作用,以积累干物质抵御逆境。
3.2外源SA对盐胁迫下颠茄逆境生理的影响
盐胁迫对植物的次生伤害为渗透胁迫[31]。植物体通过积累渗透调节物质,降低渗透势,使其在低渗透势生境仍能吸收水分[31]。本试验中,盐胁迫下,脯氨酸和可溶性糖含量上升,以维持细胞一定的含水量。外施SA后,两者含量降低,表明SA可缓解NaCl引起的渗透胁迫,使水分代谢达到平衡,这与周旋等[32]、王宝增等[3]的研究结果一致。本试验中,盐胁迫使颠茄幼苗叶片中可溶性蛋白含量降低,添加外源SA后能有效升高可溶性蛋白含量,这与姚侠妹等[33]对栀子(Gardeniajasminoides)幼苗的研究结果相似,表明0.75 mmol/L SA可增加盐胁迫下蛋白质的合成,提高颠茄叶片吸收水分的效率,减少了渗透调节的耗能,使颠茄的抗逆性增强。
MDA是膜脂过氧化的终产物,是膜系统受伤害的重要标志之一[34]。盐胁迫下,MDA含量明显上升,说明膜系统受到一定程度的损伤,质膜透性增大。外施SA后,MDA含量明显降低,说明SA能抑制膜脂过氧化,维护膜结构稳定性,增强颠茄对盐胁迫的抵抗能力,与在荞麦(Fagopyrumesculentum)幼苗上的研究结果相似[34]。研究表明,在胁迫初期,植物体内的活性氧清除系统被激活,表现为SOD、POD、CAT 3种抗氧化酶活性的暂时升高,维持活性氧产生与清除的动态平衡[35]。本试验及樊瑞苹等[36]的研究都证实了这一点。经SA处理后,抗氧化酶活性显著升高,说明SA能有效促进盐胁迫下颠茄幼苗抗氧化能力的提升,减轻自由基积累造成的氧化损伤,提高颠茄的抗逆性。
综上,0.75 mmol/L外源SA 可以通过调节盐胁迫下颠茄幼苗的渗透物质含量,诱导抗氧化酶活力维持在较高水平,降低细胞的膜脂过氧化程度,提高颠茄的耐盐能力,对颠茄抵抗盐害具有重要意义。
3.3外源SA对盐胁迫下颠茄幼苗叶片氮代谢的影响
植物的氮代谢包括无机氮的还原、同化及有机含氮化合物的转化、合成等过程,谷氨酰胺合成酶(GS)/谷氨酸合成酶(GOGAT)循环是氨同化的主要途径[37]。本试验结果表明,盐胁迫下GS、GOGAT酶活性降低,NH4+含量显著升高,与张扬欢[38]的研究结果相似,说明盐胁迫会使颠茄细胞内铵态氮积累增加,易产生氨毒,抑制幼苗的正常生长和代谢。孙菲菲等[39]认为,盐胁迫下,植物为使氨毒害作用降到最低,可能通过减少硝态氮的吸收,减缓硝态氮向铵态氮的还原而相应造成硝态氮含量下降,是植物的自我适应机制。另外,Cl-和NO3-的竞争性抑制也会使植物对硝态氮的吸收减少。本试验的结果与此一致。添加外源SA后,GS、GOGAT酶活性均明显增强,NO3-含量升高明显,NH4+含量显著降低,说明SA可能通过提升盐胁迫下颠茄对无机氮的吸收,以减轻因氮源不足造成的伤害,并通过诱导GS、GOGAT酶活性的恢复,加强对铵态氮的同化,促进氮代谢恢复正常。这与周万海等[40]对苜蓿(Medicagosativa)的研究结果相似。研究发现,暗处理、盐胁迫或重金属中毒等都会导致谷氨酸脱氢酶(GDH)活性的升高,而此时GS的活性是下降的,因此,推测GDH可能作为GS在不利情况下的一种补偿[41]。本试验盐胁迫下GDH、GS活性变化的趋势与此一致。添加SA后,GDH酶活性降低,说明SA能使颠茄幼苗抵御盐胁迫的能力增加。
综上,氮代谢失调是盐胁迫下颠茄幼苗受伤害的原因之一。0.75 mmol/L外源SA能提升盐胁迫下颠茄对无机氮的吸收能力,使氮代谢相关酶的活性恢复或增强,加速铵态氮同化,解除氨毒害,增强颠茄幼苗的抗逆能力。
3.4外源SA对盐胁迫下颠茄幼苗叶片次生代谢的影响
植物的次生代谢是植物在长期进化中与环境相互作用的结果,次生代谢产物的积累与植物抗逆性的增强息息相关。目前普遍认为,在植物正常生长条件下,其体内生物碱含量较低,而在一定的胁迫条件下,能量在次生代谢上的投入提高,生物碱含量增加[42]。本试验盐胁迫下莨菪碱、东莨菪碱含量上升的结果与此一致。此外,梅兴国等[43]、郭肖红等[44]研究发现,添加外源物(诱导子)能够有效促进植物细胞中次生代谢物的合成,这往往伴随着相关酶的合成或活性的提高。本试验施加外源SA后,颠茄次生代谢产物含量增加,氮代谢水平升高,而莨菪碱和东莨菪碱是一类含氮的有机物,其合成机制与氮代谢关系密切,推测氮代谢相关酶活性的改变影响了生物碱的积累。一方面,外源SA增强了GS、GOGAT等酶活性,促进体内吸收的无机氮向有机氮转化,而这一循环产生的谷氨酰胺和谷氨酸是植物体内合成氨基酸、核酸等含氮有机物的前体物质[45],谷氨酸在GOT等转氨酶作用下形成的天冬氨酸[11],最终可以参与到鸟氨酸循环中生成鸟氨酸,而鸟氨酸是托品烷类生物碱的底物。另一方面,盐胁迫及外施SA后,GDH活性均比CK强,GDH可催化谷氨酸+NADP→α-酮戊二酸+NADPH+NH4+,合成的α-酮戊二酸是鸟氨酸的前体物,会在一定程度上促进次生代谢产物的合成与积累;生物碱作为高含氮化合物,合成需大量的能量投入[42],GDH脱氨形成的NAD(P)H,为体内的生命活动及次生代谢提供了能量[11]。因此,氮代谢的增强能为莨菪碱和东莨菪碱合成提供更多的代谢前体物及能量。
综上,氮代谢与次生代谢关系密切,0.75 mmol/L外源SA能通过使氮代谢相关酶活性的恢复和增强直接或间接影响次生代谢产物的积累,期间合成的产物为颠茄叶片中莨菪碱、东莨菪碱的合成提供了底物和能量。
4 结论
100 mmol/L NaCl胁迫下,颠茄幼苗的自由基增多,使颠茄幼苗叶片的膜脂过氧化程度加剧,细胞膜及叶绿体等细胞器膜的稳定性下降,光合机构遭到破坏,光化学效率下降;Cl-和NO3-的竞争性抑制,使无机氮吸收受阻,氮代谢紊乱,NH4+积累产生氨毒,颠茄的生长受抑制。0.75 mmol/L外源SA能显著缓解盐胁迫对颠茄幼苗的伤害,提高了颠茄的耐盐能力,通过提高抗氧化酶活性,增强清除自由基的能力,以维持膜结构的稳定性;通过增加渗透调节物质的含量,提高了颠茄的渗透调节能力;通过调整光系统Ⅱ的能量分配,缓解光抑制;通过使氮代谢相关酶活性恢复或增强,为生物碱的合成提供更多的前体物质和能量,从而直接或间接地促进了次生代谢产物的合成与积累。因此,叶面喷施SA溶液能为实际生产中缓解盐胁迫对颠茄的伤害、提高东莨菪碱和莨菪碱的含量提供理论参考。
References:
[1] Wang Z P, Qin B F, Qiang W,etal. Cloning and expression analysis on arginine decarboxylase genes inAtropabelladonna. Chinese Traditional and Herbal Drugs, 2016, 47(15): 2734-2741.
王中平, 秦白富, 强玮, 等. 颠茄精氨酸脱羧酶基因的克隆与表达分析. 中草药, 2016, 47(15): 2734-2741.
[2] Kou J T, Kang W J, Miao Y Y,etal. Effect of exogenous 2,4-epibrassinolide on the uptake, transport, and disputation of ions, and photosynthetic characteristics ofMedicagosativaseedlings under NaCl stress. Acta Prataculturae Sinica, 2016, 25(4): 91-103.
寇江涛, 康文娟, 苗阳阳, 等. 外源2,4-表油菜素内酯对NaCl胁迫下紫花苜蓿幼苗光合特性及离子吸收、运输和分配的影响. 草业学报, 2016, 25(4): 91-103.
[3] Wang B Z, Zhang Y M, Zhang J L,etal. Effects of salicylic acid on growth ofAstragalusadsurgensseedlings under salt stress. Acta Prataculturae Sinica, 2016, 25(8): 74-80.
王宝增, 张一名, 张江丽, 等. 水杨酸对盐胁迫下沙打旺幼苗生长的影响. 草业学报, 2016, 25(8): 74-80.
[4] Ganege D K, Xia Y P, Zhu Z J,etal. Effects of exogenous salicylic acid on antioxidative enzyme activities and physiological characteristics in gerbera (GerberajamesoniiL.) grown under NaCl stress. Journal of Zhejiang University, 2010, 36(6): 591-601.
[5] Zhang L Q. The effects of SA on the physiological index of tomato seedlings. Northern Horticulture, 2011, (21): 36-38.
张林青. 水杨酸对盐胁迫下番茄幼苗生理指标的影响. 北方园艺, 2011, (21): 36-38.
[6] Wang L H, Li X X, Sun Y Y,etal. Effects of exogenous salicylic acid on the physiological characteristics and growth of Cotton seedlings under NaCl stress. Acta Botanica Boreali-Occidentalia Sinica, 2017, 37(1): 154-162.
王立红, 李星星, 孙影影, 等. 外源水杨酸对NaCl胁迫下棉花幼苗生长生理特性的影响. 西北植物学报, 2017, 37(1): 154-162.
[7] Yu Z Z. Effects of Elicitors on Secondary Metabolism and Molecular Cloning of Chalcone Synthase Gene inSaussureamedusa[D]. Beijing: The Institute of Botany, Chinese Academy of Sciences, 2006.
虞珍珍. 诱导子对水母薛莲次生代谢的影响及雪莲查尔酮合成酶基因克隆[D]. 北京: 中国植物科学院研究所, 2006.
[8] Kang S M, Jung H Y, Kang Y M,etal. Effects of methyl jasmonate and salicylic acid on the production of tropane alkaloids and the expression of PMT and H6H in adventitious root cultures ofScopoliaparviflora. Plant Science, 2004, (166): 751-754.
[9] Lee K T, Hirano H, Yamakawa T,etal. Responses of transformed root culture ofAtropabelladonnato salicylic acid stress. Journal of Bioscience and Bioengineering, 2001, (91): 586-589.
[10] Chai M W, Pan X, Shi F C. Physiological characteristics of new exotic plantFlaveriabidentisunder salt stress. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(4): 754-760.
柴民伟, 潘秀, 石福臣. 不同盐胁迫对外来植物黄顶菊生理特征的影响. 西北植物学报, 2011, 31(4): 754-760.
[11] Luo C K, Xiao G J, Zhang F J,etal. Effects of different salt stresses on rice yield and quality. Journal of Arid Land Resources and Environment, 2017, 31(1): 137-142.
罗成科, 肖国举, 张峰举, 等. 不同浓度复合盐胁迫对水稻产量和品质的影响. 干旱区资源与环境, 2017, 31(1): 137-142.
[12] Sun L, Zhou Y F, Li F X,etal. Impacts of salt stress on characteristics of photosynthesis and chlorophyll fluorescence of Sorghum seedlings. Scientia Agricultura Sinica, 2012, 45(16): 3265-3272.
孙璐, 周宇飞, 李丰先, 等. 盐胁迫对高粱幼苗光合作用和荧光特性的影响. 中国农业科学, 2012, 45(16): 3265-3272.
[13] Li Y, Liu G B, Gao H W,etal. A comprehensive evaluation of salt-tolerance and the physiological response ofMedicagosativaat the seedling stage. Acta Prataculturae Sinica, 2010, 19(4): 79-86.
李源, 刘贵波, 高洪文, 等. 紫花苜蓿种质耐盐性综合评价及盐胁迫下的生理反应. 草业学报, 2010, 19(4): 79-86.
[14] Zhou J, Xu Q, Zhang T. Effects of NaCl stress on physiological characteristics of seedlings of different pepper varieties. Journal of Northwest Sci-Tech University of Agriculture and Forestry (Natural Science Edition), 2015, 43(2): 120-124.
周静, 徐强, 张婷. NaCl胁迫对不同品种辣椒幼苗生理生化特性的影响. 西北农林科技大学学报(自然科学版), 2015, 43(2): 120-124.
[15] Liu Q, Dong Y J, Liu S,etal. Effects of exogenous salicylic acid on growth, chlorophyll content and mineral nutrients absorption of cotton seedlings under salt stress. Journal of Soil and Water Conservation, 2013, 27(6): 167-170.
刘庆, 董元杰, 刘双, 等. 外源SA对盐胁迫下棉花幼苗生长、叶绿素含量及矿质元素吸收的影响. 水土保持学报, 2013, 27(6): 167-170.
[16] Gao J F. Plant Biology Experiment Guide[M]. Beijing: Higher Education Press, 2006: 208-230.
高俊凤. 植物生物学试验指导[M]. 北京: 高等教育出版社, 2006: 208-230.
[17] Zhao S J, Xu C C, Zou Q,etal. Improvements of method for measurement of malondialdehvde in plant tissues. Plant Physiology Communication, 1994, 30(3): 207-210.
赵世杰, 许长成, 邹琦, 等. 植物组织中丙二醛测定方法的改进. 植物生理学通讯, 1994, 30(3): 207-210.
[18] Zhang Z L, Qu W J, Li X F. Plant Physiology Test Guide[M]. Beijing: Higher Education Press, 2009: 48-128.
张志良, 瞿伟菁, 李小芳. 植物生理学试验指导[M]. 北京: 高等教育出版社, 2009: 48-128.
[19] Wang X K. Principle and Technology of Plant Physiology and Biochemistry Experiment[M]. Beijing: Higher Education Press, 2006.
王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
[20] Giannopolitis C N, Ries S K. Superoxide didmutases I. Occurrence in higher plants. Plant Physiology, 1977, 59(2): 309-314.
[21] Wu X X, Yu L, Zhu W M,etal. Effect of exogenous nitric oxide on chlorophyll fluence characteristics in tomato seedling under NaCl stress. Chinese Journal of Eco-Agriculture, 2009, 17(4): 746-751.
吴雪霞, 于力, 朱为民, 等. 外源一氧化氮对NaCl 胁迫下番茄幼苗叶绿素荧光特性的影响. 中国生态农业学报, 2009, 17(4): 746-751.
[22] Zhang X Z. Determination of chlorophyll content in plants by acetone ethanol mixture. Liaoning Agricultural Sciences, 1986, 3: 26-28.
张宪政. 植物叶绿素含量测定--丙酮乙醇混合液法. 辽宁农业科学, 1986, 3: 26-28.
[23] Li H S. Principle and Technology of Plant Physiology and Biochemistry Experiment[M]. Beijing: Higher Education Press, 2000: 164-169.
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 164-169.
[24] Tang Z C. Modern Plant Physiology Experiment Guide[M]. Beijing: Science Press, 2004.
汤章程. 现代植物生理学实验指南[M]. 北京: 科学出版社, 2004.
[25] Wang X C, Xiong S P, Ma X M. Effects of different nitrogen forms on key enzyme activity involved in nitrogen metabolism and grain protein content in speciality wheat cultivars. Acta Ecologica Sinica, 2005, 25(4): 802-807.
王小纯, 熊淑萍, 马新明. 不同形态氮素对专用型小麦花后氮代谢关键酶活性及籽粒蛋白质含量的影响. 生态学报, 2005, 25(4): 802-807.
[26] Majerowicz N, Kerbauy G B, Nievola C C,etal. Growth and nitrogen metabolism ofCataseturnfimbriaturn(Orchidaceae) grown with different nitrogen sources. Environmental and Experimental Botany, 2000, 44: 195-206.
[27] Zárate R, Hermosin B, Cantos M,etal. Tropane alkaloid distribution inAtropabaeticaplants. Journal of Chemical Ecology, 1997, 23(8): 2059-2066.
[28] Chang Q S, Zhang L X, Yang W,etal. Effects of exogenous nitric oxide on antioxidant activity and photosynthetic characteristics ofPrunellavulgarisseelings under NaCl stress. Acta Prataculturae Sinica, 2016, 25(7): 121-130.
常青山, 张利霞, 杨伟, 等. 外源NO对NaCl胁迫下夏枯草幼苗抗氧化能力及光合特性的影响. 草业学报, 2016, 25(7): 121-130.
[29] Zhang C P. Study on the Mechanism of Salinity Tolerance ofCoptischinensisFranch. Seeds and Seedlings Induced with Different Exogenous Substances under Salt Stress[D]. Chongqing: Southwest University, 2012: 63-92.
张春平. 不同外源物质提高盐胁迫下黄连种子及幼苗抗逆性机理研究[D]. 重庆: 西南大学, 2012: 63-92.
[30] Sun D Z, Han X R, Peng J,etal. The effect of exogenous salicylic acid on PSⅡ photochemical efficiency and distribution and utilization of luminous energy in Tomato seedlings. Acta Horticulturae Sinica, 2016, 43(8): 1482-1492.
孙德智, 韩晓日, 彭靖, 等. 外源水杨酸对NaCl胁迫下番茄幼苗PSⅡ光化学效率及光能分配利用的影响. 园艺学报, 2016, 43(8): 1482-1492.
[31] Liu A R, Zhang Y B, Zhong Z H,etal. Effects of salt stress on the growth and osmotica accumulation ofColeusblumei. Acta Prataculturae Sinica, 2013, 22(2): 211-218.
刘爱荣, 张远兵, 钟泽华, 等. 盐胁迫对彩叶草生长和渗透调节物质积累的影响. 草业学报, 2013, 22(2): 211-218.
[32] Zhou X, Shen L, Jin Y,etal. Effects of exogenous salicylic acid on growth and physiological characteristics of tea plant (Camelliasinensis) under salt stress. Journal of Northwest Sci-Tech University of Agriculture and Forestry (Natural Science Edition), 2015, 43(7): 162-169.
周旋, 申璐, 金媛, 等. 外源水杨酸对盐胁迫下茶树生长及主要生理特性的影响. 西北农林科技大学学报(自然科学版), 2015, 43(7): 162-169.
[33] Yao X M, Ou C, Zhang R E,etal. Ameliorating effects of exogenous salicylic acid onGardeniajasminoidesseedlings under salt stress. Acta Agriculturae Zhejiangensis, 2015, 27(11): 1939-1944.
姚侠妹, 偶春, 张瑞娥, 等. 外源水杨酸对盐胁迫栀子幼苗的缓解效应. 浙江农业学报, 2015, 27(11): 1939-1944.
[34] Yang H B, Sun P. Effects of exogenous salicylic acid and jasmonic acid on physiological traits of salt tolerance in Buckwheat (FagopyrumesculentumMoench) seedlings. Plant Physiology Journal, 2012, 48(8): 767-771.
杨洪兵, 孙萍. 外源水杨酸和茉莉酸对荞麦幼苗耐盐生理特性的效应. 植物生理学报, 2012, 48(8): 767-771.
[35] Feng J Y, Pang M H, Liu Y C,etal. Effects and early mechanisms of complex salt and alkali conditions on seed germination and seedling growth ofFlaveriabidentis. Acta Prataculturae Sinica, 2010, 19(5): 77-86.
冯建永, 庞民好, 刘颖超, 等. 复杂盐碱对黄顶菊种子萌发和幼苗生长的影响及机理初探. 草业学报, 2010, 19(5): 77-86.
[36] Fan R P, Zhou Q, Zhou B,etal. Effects of salinization stress on growth and the antioxidant system of tall fescue. Acta Prataculturae Sinica, 2012, 21(1): 112-117.
樊瑞苹, 周琴, 周波, 等. 盐胁迫对高羊茅生长及抗氧化系统的影响. 草业学报, 2012, 21(1): 112-117.
[37] Zhang H M, Li J J, Hei G G,etal. Effects of exogenous betaine on the secondary metabolites ofPinelliaternataunder drought stress. Acta Prataculturae Sinica, 2014, 23(4): 229-236.
张红敏, 李姣姣, 黑刚刚, 等. 外源甜菜碱处理对干旱胁迫下半夏氮代谢及相关酶活性的影响. 草业学报, 2014, 23(4): 229-236.
[38] Zhang Y H. Studies on the Regulation of Enhanced UV-B Radiation and Drought Stress on Carbon and Nitrogen Metabolism and Alkaloid Content inCatharanthusroseus[D]. Chongqing: Southwest University, 2011.
张扬欢. 增强UV-B辐射及干旱复合处理对长春花碳氮代谢及生物碱含量的调控[D]. 重庆: 西南大学, 2011.
[39] Sun F F, Wang D S, Chen H,etal. The influence on nitrogen metabolism of Chinese cabbage under NaCl stress. Jangsu Agricultural Sciences, 2012, 40(4): 160-162.
孙菲菲, 王东升, 陈欢, 等. NaCl胁迫对白菜叶片氮代谢的影响. 江苏农业科学, 2012, 40(4): 160-162.
[40] Zhou W H, Shi S L, Kou J T. Effects of exogenous nitric oxide on the growth and nitrogen metabolism of alfalfa seedings under salt stress. Chinese Journal of Applied Ecology, 2012, 23(11): 3003-3008.
周万海, 师尚礼, 寇江涛. 盐胁迫下外源 NO对苜蓿幼苗生长及氮代谢的影响. 应用生态学报, 2012, 23(11): 3003-3008.
[41] Qi Q Q, Luo A, Liu Z S,etal. The research about enzyme mechanism on the nitrogen metabolism and effect of manganese in soybean. Journal of Heilongjiang August First Land Reclamation University, 2008, 20(6): 12-15.
祁倩倩, 罗奥, 刘志生, 等. 大豆氮代谢酶作用机理及锰水平对其影响研究进展. 黑龙江八一农垦大学学报, 2008, 20(6): 12-15.
[42] Wang J Y. Effects of Salt Stress and Plant Growth Substance on the Growth and Indole Alkaloid Metabolism ofCatharanthusroseus[D]. Nanjing: Nanjing Agricultural University, 2009.
王景艳. 盐胁迫与植物生长物质对长春花生长及生物碱代谢的影响[D]. 南京: 南京农业大学, 2009.
[43] Mei X G, Wu D. Effects of metabolic regulators on the biosynthesis of taxol and its related compounds. Natural Product Research and Development, 2001, 13(1): 17-20.
梅兴国, 武栋. 代谢调节剂对紫杉醇及其相关化合物生物合成的影响. 天然产物研究与开发, 2001, 13(1): 17-20.
[44] Guo X H, Gao W Y, Chen H X,etal. Effects of mineral cations on the accumulation of tanshinone ⅡAand protocatechuic aldehyde in the adventitious root culture ofSalvianiltiorrhiza. China Journal of Chinese Materia Medica, 2005, 30(12): 885-887.
郭肖红, 高文远, 陈海霞, 等. 金属离子对丹参酮ⅡA和原儿茶醛生物合成的影响. 中国中药杂志, 2005, 30(12): 885-887.
[45] Sun Y Y, Sun Y J, Wu H Z,etal. Effects of water stress on activities of nitrogen assimilation enzymes and photosynthetic characteristics of rice seedlings. Plant Nutrition and Fertilizer Science, 2009, 15(5): 1016-1022.
孙园园, 孙永健, 吴合洲, 等. 水分胁迫对水稻幼苗氮素同化酶及光合特性的影响. 植物营养与肥料学报, 2009, 15(5): 1016-1022.
EffectofexogenousSAonthephysiologicalbiochemistry,nitrogenmetabolismandsecondarymetabolismofAtropabelladonnaunderNaClstress
HU Xue-Huan1, NING Huan-Huan1, LIU Guang-Zhao1, WU Neng-Biao1,2*
1.School of Life Science, Southwest China University, Chongqing 400715, China; 2.Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing 400715, China
This study investigated the effect of exogenous salicylic acid (SA) on the physiology, biochemistry, nitrogen metabolism and secondary metabolism ofAtropabelladonnaseedlings under NaCl stress. We cultivatedA.belladonnaseedlings using soilless culture, treated with 100 mmol/L NaCl; 0.75 mmol/L SA was also sprayed onto the surface of the leaves. After application of SA, chlorophyll content increased and maximal photochemical efficiency (Fv/Fm), potential activity of PSⅡ (Fv/Fo), the efficiency of excitation energy capture by open PSⅡ centers (Fv′/Fm′), photosynthetic electron transport rate (ETR), actual PSⅡ photochemical efficiency (ΦPSⅡ) and photochemical quenching coefficient (qP) were all greatly enhanced, while initial fluorescence (Fo) and non-photochemical quenching coefficient (qN) significantly decreased. The activities of superoxide dismutase (SOD), catalase (CAT) and peroxidase (POD) dramatically increased, while malondialdehyde (MDA) content decreased dramatically. Soluble protein content notably increased, while the contents of proline and soluble sugar decreased. The NO3-content increased, while the NH4+content decreased. The activities of glutamine synthetase (GS) and glutamate synthetase (GOGAT) increased, while glutamate dehydrogenase (GDH) activity decreased. The secondary metabolites, scopolamine and hyoscyamine, were increased significantly. The study indicated that exogenous SA could enhance photosynthesis inA.belladonna, adjust organic osmotic content, increase antioxidant enzyme activities and reduce the degree of membrane lipid peroxidation, alleviating the damage of NaCl stress. The recovery or enhancement of the enzyme activities of nitrogen metabolism promoted the synthesis and accumulation of secondary metabolites directly or indirectly by providing more precursors and energy for the synthesis of tropane alkaloids.
Atropabelladonna; NaCl stress; salicylic acid; nitrogen metabolism; secondary metabolism
10.11686/cyxb2017043http//cyxb.lzu.edu.cn
扈雪欢, 宁欢欢, 刘光照, 吴能表. 外源SA对盐胁迫下颠茄生理生化、氮代谢及次生代谢的影响. 草业学报, 2017, 26(11): 147-156.
HU Xue-Huan, NING Huan-Huan, LIU Guang-Zhao, WU Neng-Biao. Effect of exogenous SA on the physiological biochemistry, nitrogen metabolism and secondary metabolism ofAtropabelladonnaunder NaCl stress. Acta Prataculturae Sinica, 2017, 26(11): 147-156.
2017-02-16;改回日期:2017-05-04
国家自然科学基金项目(30500041)和国家大学生创新创业训练项目(201510635010)资助。
扈雪欢(1995-),女,广西柳州人,本科。E-mail: hu_xuehuan@foxmail.com
*通信作者Corresponding author. E-mail: wunb@swu.edu.cn
