NaCl胁迫对夏枯草幼苗抗氧化能力及光合特性的影响
2017-11-24张利霞常青山侯小改刘伟李晓鹏高宇航张秀丽丁生运肖瑞雪张耀邓永恒
张利霞,常青山,侯小改,刘伟,李晓鹏,高宇航,张秀丽,丁生运,肖瑞雪,张耀,邓永恒
(1.河南科技大学农学院,河南 洛阳471023;2.河南科技大学林学院,河南 洛阳471023)
NaCl胁迫对夏枯草幼苗抗氧化能力及光合特性的影响
张利霞1,常青山2*,侯小改1,刘伟1,李晓鹏1,高宇航1,张秀丽1,丁生运1,肖瑞雪1,张耀1,邓永恒1
(1.河南科技大学农学院,河南 洛阳471023;2.河南科技大学林学院,河南 洛阳471023)
研究NaCl胁迫对夏枯草幼苗抗氧化能力与光合特性的影响,为夏枯草栽培管理、抗盐育种提供理论依据。以夏枯草幼苗为材料,采用营养液培养的方法研究不同浓度NaCl(0、20、40、60、80 mmol/L)胁迫对夏枯草幼苗抗氧化酶、渗透调节物质、叶绿素、光合特性的影响。结果表明,随着盐胁迫浓度的升高,夏枯草叶片的超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、可溶性蛋白含量呈先上升后下降的趋势;过氧化物酶(POD)、可溶性糖含量、丙二醛(MDA)含量与电导率呈不断升高的趋势;叶绿素 a和b、叶绿素a/b、类胡萝卜素及总叶绿素均呈逐渐下降的趋势;净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)均表现下降的趋势,胞间二氧化碳浓度(Ci)则表现为先下降后上升的趋势,而气孔限制值(Ls)表现为先升高后降低的趋势。在20~60 mmol/L NaCl处理下,夏枯草叶片光合速率的下降主要是由气孔限制引起的,在80 mmol/L NaCl处理下叶片光合速率的下降则主要是由非气孔限制引起的。NaCl胁迫下,夏枯草通过提高抗氧化酶的活性、渗透调节物质的含量来保护光合机构,从而提高夏枯草幼苗对盐胁迫的适应性。
夏枯草;NaCl胁迫;光合;抗氧化酶
土壤的盐渍化问题现已成为一个世界性难题。全球有盐渍土地9.55亿hm2,我国约有9913万hm2的盐渍土地,且盐渍化土壤面积仍然在不断增加[1]。盐胁迫下,植物根系容易受盐胁迫危害进而影响地上部分的生长[2]。目前,土壤的盐渍化问题已严重地制约着中药材产业的发展。研究药用植物的耐盐机理,提高其耐盐能力,筛选药用植物耐盐品种已成为当前中药材栽培过程中的重要课题之一。
夏枯草(Prunellavulgaris)是唇形科夏枯草属一种多年生草本植物,主要分布在欧亚温带地区及热带山区;在我国分布广泛,在淮河流域与长江中下游流域有野生种分布[3]。夏枯草是一种传统中药材,主要成分有三萜及苷类、黄酮类、香豆素等成分[4],有清火明目,散结消肿等功效,常用于治疗高血压、肝炎等疾病[5],在中成药与保健品行业应用比较广泛[6]。作为具有重要药用价值与医疗保健价值的夏枯草,目前有限的野生资源已不能满足医药与保健品市场的大量需要,人工种植成为夏枯草药材生产的一个现实选择[7],但是由于农艺措施不当引起的次生盐渍化成为影响夏枯草生产的一个重大问题。开展夏枯草的盐胁迫相关研究对于培育夏枯草耐盐品种、扩大夏枯草种植区域及提高盐渍土地资源的利用率均具有重要意义。
目前,针对夏枯草盐胁迫相关研究仅见于盐胁迫对夏枯草种子萌发的影响[8],外源物质对盐胁迫下夏枯草种子与幼苗的影响[9-10],及种子引发对夏枯草耐盐能力的提高[11]等方面,而夏枯草幼苗对盐胁迫耐受特性的研究比较匮乏,夏枯草幼苗的叶片与根系抗氧化酶、叶片色素含量与光合能力等对盐胁迫的响应机制尚不明确。因此,本实验以夏枯草幼苗为实验材料,采用不同浓度NaCl溶液对HoagLand营养液培养的夏枯草幼苗进行盐胁迫处理,探究在不同盐胁迫处理下夏枯草抗氧化酶、渗透调节物质及光合特性的变化特征,以期探明夏枯草幼苗的耐盐特性,为夏枯草人工种植、耐盐品种选育及在盐渍土地进行夏枯草的推广种植提供借鉴。
1 材料与方法
1.1实验材料与培养
实验所用夏枯草种子采于南京青龙山。实验于2015年10月到2016年6月在河南科技大学农学院农学与生物学实验中心和校内大棚进行。于2015年10月进行夏枯草种子消毒,消毒之后的种子播种于穴盘中采用营养土基质育苗。2016年待幼苗长到四叶期,取长势良好,形态一致的幼苗,采用泡沫板悬浮法,转栽至规格相同的周转箱中进行营养液培养。设置5组水箱进行营养液培养,以1/2 Hoagland营养液为基础营养液,采用HCl或KOH调节营养液pH至6.0,在自然光照条件下生长,环境温度为(25±5) ℃。幼苗水培期间每天用电动气泵供氧12 h,每4 d换一次营养液。
1.2实验设计
当夏枯草幼苗生长到6~8叶期时,每个处理选用40株长势相对一致的幼苗。采用前期预实验筛选出的盐胁迫浓度对夏枯草幼苗进行处理:1)CK组(1/2 Hoagland营养液);2) 20 mmol/L NaCl(1/2 Hoagland营养液+20 mmol/L NaCl);3) 40 mmol/L NaCl (1/2 Hoagland营养液+40 mmol/L NaCl);4) 60 mmol/L NaCl (1/2 Hoagland营养液+60 mmol/L NaCl);5) 80 mmol/L NaCl (1/2 Hoagland营养液+80 mmol/L NaCl),根据前期试验夏枯草对NaCl的耐受程度,设定20 mmol/L NaCl为低浓度盐胁迫,40 mmol/L NaCl为中等浓度盐胁迫,60 mmol/L NaCl为较高浓度盐胁迫,80 mmol/L NaCl为高浓度盐胁迫。连续盐胁迫处理5 d后进行夏枯草生理与光合指标的测定。
1.3测定指标及方法
采用氮蓝四唑(NBT)还原法测定超氧化物歧化酶(superoxide dismutase, SOD)活性[12],愈创木酚法测定过氧化物酶(peroxidase, POD)活性[12],分光光度计法测定抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性[13];考马斯亮蓝G-250法测定可溶性蛋白含量[12],蒽酮乙酸乙酯试剂法测定可溶性糖含量[12],采用硫代巴比妥酸法测定丙二醛(malondialdehyde, MDA)含量[12],电导仪法测定电导率[14],采用80%的丙酮浸泡法测定叶绿素(chlorophyll,Chl)含量[12],每个处理重复3次。
气体交换参数的测定:采用便携式LI-6400光合作用测定系统(LI-COR,Lincon,NE,USA)于晴朗无云的上午9:00-11:00进行测定,设置 CO2浓度为380 μmol/mol,叶室温度为25 ℃,测定光强为1000 μmol/(m2·s)[10]。在此设定条件下测定夏枯草幼苗倒数第2~3片功能叶片的净光合速率(net photosynthetic rate,Pn)、胞间CO2浓度(intercellular CO2concentration,Ci)、气孔导度(stomatal conductance,Gs)与蒸腾速率(transpiration rate,Tr)。气孔限制值 (Ls):Ls= 1-Ci/Ca(Ca为大气CO2浓度)。每个处理重复4次,结果取平均值。
1.4数据统计分析
采用软件SPSS 16.0与Excel 2010进行方差分析与数据计算,Duncan法进行多重比较分析。
2 结果与分析
2.1不同浓度NaCl胁迫对夏枯草叶片抗氧化酶活性的影响
由表1可知,NaCl胁迫下夏枯草幼苗的SOD活性,均显著高于对照组CK下夏枯草幼苗的SOD活性。随着NaCl浓度的升高先增大后减小,夏枯草幼苗的SOD活性在60 mmol/L NaCl浓度处理下达到最大值,相对于CK增加了48.84%,在80 mmol/L NaCl浓度处理下降低,但仍显著高于对照CK。
夏枯草幼苗叶片的POD活性随着NaCl胁迫浓度的增加一直呈上升的趋势,NaCl胁迫处理下的POD活性均高于对照组(CK),其中40~80 mmol/L NaCl处理下POD活性显著高于CK,分别比CK增加了3.70,13.06与14.52倍,且80 mmol/L NaCl处理下POD活性显著高于其他各处理。
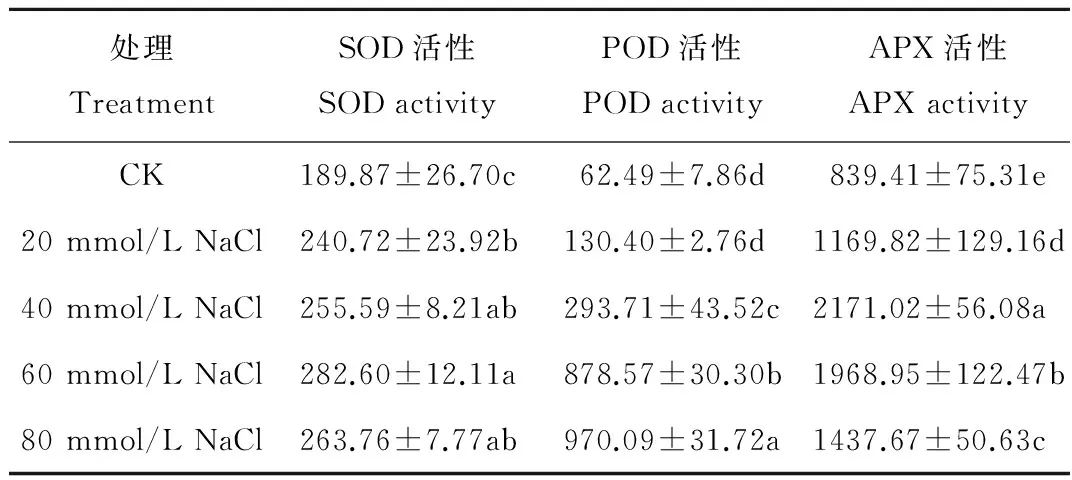
表1 不同浓度NaCl胁迫对夏枯草幼苗叶片SOD活性、POD活性和APX活性的影响Table 1 Effects of different concentration of NaCl stress on the activity of SOD, POD and APX in the leaves of P. vulgaris seedlings U/(g·min)
注: 同列不同小写字母表示0.05水平差异显著,下同。
Notes: Different small letters in the same column mean significant difference at 0.05 level, the same below.
夏枯草幼苗的APX活性随着NaCl胁迫浓度的升高呈先升高后降低的趋势,NaCl胁迫处理下APX活性均显著高于CK处理,在20~40 mmol/L NaCl处理下呈上升趋势,当NaCl浓度为40 mmol/L时POD活性最大,比CK增加了1.59倍;在60~80 mmol/L NaCl处理下呈下降趋势,但仍显著高于CK处理。
2.2不同浓度NaCl胁迫对夏枯草叶片可溶性蛋白与可溶性糖的影响
由表2可知,随着盐胁迫浓度的升高,夏枯草叶片的可溶性蛋白含量呈先升高后下降的趋势,在20~40 mmol/L NaCl处理下的可溶性蛋白含量增幅不大,与CK处理相比差异不显著。在60~80 mmol/L NaCl处理下增幅较大,均显著高于CK,在60 mmol/L NaCl处理下可溶性蛋白的含量达到最大值,相对于CK增加了32.29%。
夏枯草叶片的可溶性糖含量则随着盐胁迫浓度增加呈一直升高的趋势,在20 mmol/L NaCl处理下可溶性糖含量与对照CK相比差异不显著,在40~80 mmol/L NaCl处理均显著高于对照CK,且在80 mmol/L NaCl处理下,可溶性糖含量达到最高,比CK增加了1.70倍。

表2 不同浓度NaCl胁迫对夏枯草叶片的可溶性蛋白、可溶性糖、MDA、电导率的影响Table 2 Effects of different concentration of NaCl stress on soluble protein, soluble sugar, MDA and electric conductivity in the leaves of P. vulgaris seedlings
2.3不同浓度NaCl胁迫对夏枯草叶片MDA含量与电导率的影响
由表2可知,夏枯草叶片MDA含量与电导率随着盐胁迫浓度的增加均表现出一直升高的趋势,均在20 mmol/L NaCl处理下与对照CK差异不显著,在40~80 mmol/L NaCl处理下均显著高于对照,其中MDA含量分别比对照CK增长了64.03%、89.19%与1.55倍,电导率分别比CK增长了37.27%、81.13%和1.06倍。夏枯草MDA含量与电导率均在80 mmol/L NaCl处理下增加幅度最大,且显著高于其他各处理。
2.4不同浓度NaCl胁迫对夏枯草叶绿素含量的影响
由表3可以看出,夏枯草幼苗叶绿素a、叶绿素b、类胡萝卜素、总叶绿素含量和叶绿素a/b均随着NaCl浓度的升高而呈下降趋势,而且不同NaCl胁迫处理下的色素含量与叶绿素 a/b均低于对照组CK。不同浓度NaCl胁迫处理下的叶绿素a含量与对照CK相比均显著下降,其中60~80 mmol/L NaCl处理的下降幅度较大,分别比对照降低了32.40%与45.60%。不同浓度NaCl胁迫处理下的叶绿素b含量仅在80 mmol/L NaCl处理下与CK相比显著降低了30.58%。夏枯草叶片的叶绿素 a/b在20~40 mmol/L NaCl处理下与对照CK相比差异不显著,在60~80 mmol/L NaCl处理下则显著低于CK,分别比CK降低15.18%与20.56%。夏枯草叶片的类胡萝卜素含量在不同盐胁迫下均显著低于CK处理,随着盐胁迫浓度的增加分别降低了17.35%、24.42%、40.38%与50.38%,且彼此相比均达差异显著水平。夏枯草叶片的总叶绿素含量在不同盐胁迫处理下均显著低于CK处理,分别比CK降低了16.72%、26.63%、29.59%与42.44%。
2.5不同浓度NaCl胁迫对夏枯草叶片光合指标的影响
由表4可知,随着盐胁迫浓度的升高,夏枯草叶片的Pn、Gs与Tr均呈现下降趋势,且均显著低于对照CK。夏枯草叶片的Ci则表现为先下降后上升的趋势,Ls表现为先升高后降低的趋势。随着盐胁迫浓度的升高,60~80 mmol/L NaCl处理下Pn、Gs、Tr下降幅度最大,Pn分别比CK降低了76.42%与86.73%,Gs分别降低了85.00%与85.78%,Tr分别降低了78.08%与80.31%。在 20~60 mmol/L盐胁迫处理下Ci与对照CK相比均有不同程度的下降,但在盐胁迫浓度为80 mmol/L时Ci则高于CK,但差异不显著。对于Ls来说,20~60 mmol/L NaCl胁迫处理下Ls均高于CK,其中60 mmol/L NaCl处理显著高于对照CK处理,而在80 mmol/L NaCl胁迫处理下的Ls则低于对照CK。
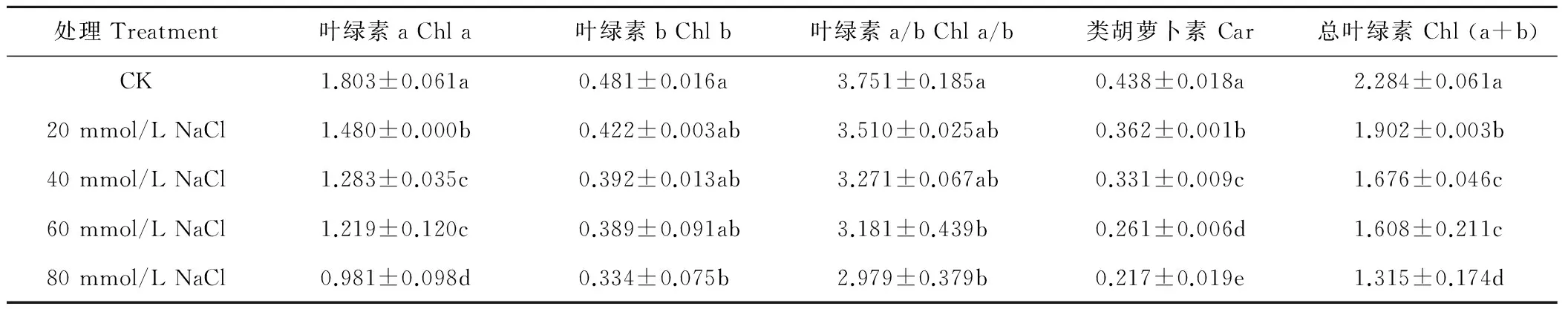
表3 不同浓度NaCl胁迫对夏枯草叶绿素含量的影响Table 3 Effects of different concentration of NaCl stress on chlorophyll content in the leaves of P. vulgaris seedlings mg/g FW

表4 不同浓度NaCl胁迫对夏枯草叶片Pn、Gs、Ci、Tr和Ls的影响Table 4 Effects of different concentration of NaCl stress on Pn, Gs, Ci, Tr and Ls in the leaves of P. vulgaris seedlings
3 讨论
植物在盐胁迫下产生的大量活性氧自由基会引起植物的膜脂过氧化,表现为膜脂过氧化产物MDA的增加;同时质膜通透性增强引起电解质的渗漏,导致电导率的升高,使植物代谢产生紊乱[15]。本研究结果表明,夏枯草幼苗的MDA与电导率均随着NaCl处理浓度的升高而不断增加,且NaCl胁迫浓度越高,MDA与电导率值增加越显著。在20 mmol/L的NaCl处理下MDA和电导率与对照CK相比差异不显著,说明低浓度盐胁迫对夏枯草叶片细胞质膜的伤害较小,电解质渗漏较轻。高浓度的NaCl处理下,MDA和电导率显著高于对照,说明夏枯草幼苗叶片的质膜在高浓度NaCl胁迫下受到盐胁迫的严重损害,细胞膜内电解质的渗漏达到了较为严重的程度。对盐胁迫下紫穗槐(Amorphafruticosa)与海滨雀稗(Paspalumvaginatum)的研究表明,盐胁迫浓度的增加导致了MDA的升高,并加剧了对植物细胞膜的破坏,本研究与前人研究一致[16-17]。
可溶性蛋白与可溶性糖是植物体内重要的渗透调节物质,可溶性蛋白含量的增加可以提高植物细胞的持水力,降低细胞的渗透势[18];可溶性糖含量的增加可以降低植物细胞的渗透势,提高细胞汁液浓度,促进根系对水分的吸收,同时降低离子毒害,起到稳定与保护细胞膜的作用[19]。本研究中,可溶性蛋白含量随着盐胁迫浓度的升高呈先升高后下降的趋势,在高浓度NaCl胁迫处理下夏枯草叶片的可溶性蛋白含量降低,原因可能在于盐胁迫浓度超出了夏枯草叶片本身的耐受极限,可溶性蛋白含量因而下降,本研究与刘凤歧等[20]和张怀山等[21]的研究类似。在本研究中,夏枯草叶片的可溶性糖含量随着盐胁迫浓度的增加而不断上升,与刘炳响等[22]对白榆(Ulmuspumila)和韩宇等[23]对药用红花(Carthamustinctorius)的研究一致,本研究说明在20~60 mmol/L的盐浓度下,盐胁迫可以促进可溶性蛋白与可溶性糖合成代谢,提高可溶性蛋白与可溶性糖的含量,增强夏枯草对盐胁迫的适应能力。而在80 mmol/L的NaCl胁迫下,夏枯草叶片的可溶性蛋白含量下降,而可溶性糖含量依旧升高,说明较高浓度的NaCl胁迫可能已超过了夏枯草的耐受极限,抑制了蛋白质的合成或促进了其分解[20-24],而可溶性糖含量的持续升高意味着其成为主要的渗透调节物质[23]。
当植物处于盐胁迫时,活性氧产生和清除的动态平衡模式就会被打破,迅速积累的活性氧会引起膜脂过氧化,使植物受到伤害死亡[25]。植物为防御活性氧带来的伤害,可以通过植物体内SOD、POD与APX等抗氧化酶来清除植物体内的多余活性氧,来维持膜的稳定性,减少活性氧对植物细胞膜脂过氧化产生的伤害[26]。在本试验中,经不同浓度的NaCl胁迫后,夏枯草幼苗叶片的SOD与APX活性先升高后降低,POD活性则不断升高。原因可能在于植物细胞对活性氧耐受存在一个阈值,在阈值内抗氧化酶的活性可以不断提高,一旦超过这个阈值,多余的活性氧可能会对抗氧化酶本身造成伤害,降低酶的活性[27-28],本研究中SOD与APX下降的盐胁迫浓度不同反映这两个酶的耐受阈值可能存在不同,而POD活性的持续升高反映该酶可能具有较高的耐受阈值,类似的研究也出现在朱金方等[28]与郭巧生等[29]的研究中。在本研究中,不同浓度的盐胁迫可以提高夏枯草叶片的SOD、POD与APX活性,说明夏枯草通过提高抗氧化酶的活性来平衡体内活性氧的水平,提高植物的耐盐性[30]。
叶绿素是植物进行光合作用的主要色素物质,其含量的变化是衡量植物盐害程度的重要生理指标之一。本研究结果表明,夏枯草叶片色素含量在盐胁迫下降低,且盐胁迫浓度越高,叶绿素含量下降幅度越大。原因可能在于盐胁迫导致叶片中的离子含量升高,降低了色素与色素蛋白之间的结合能力,引起类囊体膜超微结构的破坏,导致叶绿体的解体,促进叶绿素的降解[31-33],另一个原因可能在于盐胁迫下夏枯草叶片类胡萝卜素含量显著减少,降低了对活性氧的淬灭能力,引起活性氧自由基的增加,进一步加速了叶绿素的分解[34]。在本研究中,叶绿素 a的下降幅度高于叶绿素b, 原因可能在于叶绿素a对盐胁迫处理下产生活性氧的敏感性强于叶绿素b,从而导致叶绿素a/b随盐胁迫浓度的增加而不断下降[35]。
光合作用是反映植物对盐胁迫响应有效生理指标之一,分析叶片光合作用下降的原因通常为气孔限制与非气孔限制。当Ci与Gs同时下降,且Ls值升高时,一般认为气孔因素引起Pn的下降;当Ci升高而Gs下降,且Ls降低时,认为非气孔因素是引起Pn下降的主要原因[36-37]。本实验中,在20~60 mmol/L NaCl胁迫处理下,Ci和Gs与CK相比同时下降,且Ls值升高,说明20~60 mmol/L NaCl浓度处理下的Pn下降主要是由于气孔因素引起。与CK相比,在80 mmol/L NaCl胁迫处理下,Ci升高而Gs下降,且Ls降低,说明该处理下Pn的下降主要是由非气孔因素引起的,这可能是由于高浓度盐胁迫引起细胞内盐离子的过量积累,使得叶片的超微结构受到破坏,造成光合器官受到损伤,而盐胁迫下夏枯草叶片叶绿素含量的降低,削弱了叶片对光能的传递与吸收能力,叶肉细胞光合活性因而降低,导致光合能力的最终下降[38]。前人研究表明,气孔与非气孔因素对于光合作用的影响并非相互独立,而是随着盐胁迫时间与强度呈现动态的变化[39],结合本研究说明引起夏枯草光合作用下降的影响因素发生转变的原因可能与盐胁迫的强度有关。在20~60 mmol/L浓度盐胁迫下,夏枯草叶片光合受抑制主要是气孔限制,在高浓度盐胁迫下,夏枯草叶片的光合受到抑制主要由于非气孔因素引起的,本研究与杨淑萍等[38]在海岛棉(Gossypiumspp.)、袁军伟等[40]在‘马瑟兰’葡萄(Vitisspp.)上的研究类似。
在低浓度20~40 mmol/L NaCl胁迫下,夏枯草可以通过体内抗氧化酶系统缓解盐胁迫对叶片产生的伤害,避免叶片光合结构受到损害,维持较强的光合能力。而高浓度80 mmol/L NaCl处理对夏枯草叶片细胞造成严重伤害,破坏光合结构,造成叶绿素降解,最终严重影响叶片的光合能力。由此可知,夏枯草对盐胁迫极为敏感,对于中低浓度的盐胁迫危害有一定的耐受性,属于一种轻度耐盐植物。
References:
[1] Ma C, Ma L Y, Liu T X,etal. Research progress on saline land improvement technology. World Forestry Research, 2010, 23(2): 28-32.
马晨, 马履一, 刘太祥, 等. 盐碱地改良利用技术研究进展. 世界林业研究, 2010, 23(2): 28-32.
[2] Liu F Z, Yang J. Mitigation effect of exogenous sucrose on root growth of licorice seedlings under salt stress conditions. Chinese Traditional and Herbal Drugs, 2015, 46(18): 2781-2787.
柳福智, 杨军. 外源蔗糖对盐胁迫条件下甘草幼苗根系生长的缓解效应. 中草药, 2015, 46(18): 2781-2787.
[3] Yang W. Study on Reproductive Characteristics and Growth ofPrunellavulgarisL.[D]. Nanjing: Nanjing Agricultural University, 2013.
杨伟. 夏枯草的繁殖及生长特性研究[D]. 南京: 南京农业大学, 2013.
[4] Wang Y X, Yin J B, Guo Q S,etal. Dynamic change of active component content in different parts ofPrunellavulgaris. China Journal of Chinese Materia Medica, 2011, 36(6): 741-745.
王玉霞, 尹金宝, 郭巧生, 等. 夏枯草不同部位活性成分含量动态研究. 中国中药杂志, 2011, 36(6): 741-745.
[5] Chinese Pharmacopoeia Commission. Pharmacopoeia of People’s Republic of China[M]. Beijing: China Medical Science Press, 2010.
国家药典委员会. 中华人民共和国药典一部[M]. 北京: 中国医药科技出版社, 2010.
[6] Chen Y H, Guo Q S, Wang C Y. Textual research on change of medicinal parts and herbalmedicine ofPrunellavulgaris. China Journal of Chinese Materia Medica, 2010, 35(2): 242-246.
陈宇航, 郭巧生, 王澄亚. 夏枯草本草及其入药部位变化的考证. 中国中药杂志, 2010, 35(2): 242-246.
[7] Yu M M, Liu L, Guo Q S,etal. Influence of nitrogen forms ratio on growth and photosynthetic characteristics inPrunellavulgaris. China Journal of Chinese Materia Medica, 2011, 36(5): 530-534.
于曼曼, 刘丽, 郭巧生, 等. 氮素不同形态配比对夏枯草苗期生长及光合特性的影响. 中国中药杂志, 2011, 36(5): 530-534.
[8] Zhang L X, Chang Q S, Hou X G,etal. Effects of different sodium salt stress on seed germination ofPrunellavulgaris. Acta Prataculturae Sinica, 2015, 24(3): 177-186.
张利霞, 常青山, 侯小改, 等. 不同钠盐胁迫对夏枯草种子萌发特性的影响. 草业学报, 2015, 24(3): 177-186.
[9] Chang Q S, Zhang L X, Huang Q Z,etal. Effect of exogenous NO onPrunellavulgarisseed germination under NaCl stress. Northern Horticulture, 2016, (11): 155-160.
常青山, 张利霞, 黄青哲, 等. 外源NO供体硝普钠对NaCl胁迫下夏枯草种子萌发的影响. 北方园艺, 2016, (11): 155-160.
[10] Chang Q S, Zhang L X, Yang W,etal. Effects of exogenous nitric oxide on antioxidant activity and photosynthetic characteristics ofPrunellavulgarisseedlings under NaCl stress. Acta Prataculturae Sinica, 2016, 25(7): 121-130.
常青山, 张利霞, 杨伟, 等. 外源NO对NaCl胁迫下夏枯草幼苗抗氧化能力及光合特性的影响. 草业学报, 2016, 25(7): 121-130.
[11] Zhang X X, Guo Q S, Shen X L. Effects of seed priming on salt tolerance inPrunellavulgarisseed germination under saline conditions. China Journal of Chinese Materia Medica, 2009, 34(8): 944-947.
张贤秀, 郭巧生, 沈雪莲. 种子引发对夏枯草种子耐盐性的影响. 中国中药杂志, 2009, 34(8): 944-947.
[12] Li H S. Experimental Principle and Technology of Plant Physiology and Biochemistry[M]. Beijing: Higher Education Press, 2004.
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2004.
[13] Tang S H, Luo C. Plant Physiology Experiment Course[M]. Chongqing: Southwestern Normal University Press, 2012.
汤绍虎, 罗充. 植物生理学实验教程[M]. 重庆: 西南师范大学出版社, 2012.
[14] Chang Q S, Zhang L X, Wan T,etal. Effects of Ca2+on germination characteristics ofFestucaarundinaceaseeds under simulated acid rain stress. Pratacultural Science, 2012, 29(12): 1903-1909.
常青山, 张利霞, 万涛, 等. 模拟酸雨胁迫下钙离子对高羊茅种子发芽的影响. 草业科学, 2012, 29(12): 1903-1909.
[15] Fan H F, Guo S R, Jiao Y S,etal. The effects of exogenous nitric oxide on growth, active oxygen metabolism and photosynthetic characteristics in cucumber seedlings under NaCl stress. Acta Ecologica Sinica, 2007, 27(2): 546-553.
樊怀福, 郭世荣, 焦彦生, 等. 外源一氧化氮对NaCl胁迫下黄瓜幼苗生长、活性氧代谢和光合特性的影响. 生态学报, 2007, 27(2): 546-553.
[16] Zou L N, Zhou Z Y, Yan S Y,etal. Effect of salt stress on physiological and biochemical characteristics ofAmorphafruticosaseedlings. Acta Prataculturae Sinica, 2011, 20(3): 84-90.
邹丽娜, 周志宇, 颜淑云, 等. 盐分胁迫对紫穗槐幼苗生理生化特性的影响. 草业学报, 2011, 20(3): 84-90.
[17] Jia X P, Deng Y M, Sun X B,etal. Impacts of salt stress on the growth and physiological characteristics ofPaspalumvaginatum. Acta Prataculturae Sinica, 2015, 24(12): 204-212.
贾新平, 邓衍明, 孙晓波, 等. 盐胁迫对海滨雀稗生长和生理特性的影响. 草业学报, 2015, 24(12): 204-212.
[18] Yao J, Liu X B, Cui X,etal. Effects of NaCl stress on substances linked to osmotic adjustment and on photosynthetic physiology ofMelilotoidesruthenicain the seedling stage. Acta Prataculturae Sinica, 2015, 24(5): 91-99.
姚佳, 刘信宝, 崔鑫, 等. 不同NaCl胁迫对苗期扁蓿豆渗透调节物质及光合生理的影响. 草业学报, 2015, 24(5): 91-99.
[19] Lü J H, Ren L, Li Y F,etal. Responses to salt stress among different genotypes of tea Chrysanthemum. Chinese Journal of Plant Ecology, 2013, 37(7): 656-664.
吕晋慧, 任磊, 李艳锋, 等. 不同基因型茶菊对盐胁迫的响应. 植物生态学报, 2013, 37(7): 656-664.
[20] Liu F Q, Liu J L, Zhu R F,etal. Physiological responses and tolerance of four oat varieties to salt stress. Acta Prataculturae Sinica, 2015, 24(1): 183-189.
刘凤歧, 刘杰淋, 朱瑞芬, 等. 4种燕麦对NaCl胁迫的生理响应及耐盐性评价. 草业学报, 2015, 24(1): 183-189.
[21] Zhang H S, Zhao G Q, Li M F,etal. Physiological responses ofPennisetumlongissimumvar.intermediumseedlings to PEG, low temperature and salt stress treatments. Acta Prataculturae Sinica, 2014, 23(3): 180-188.
张怀山, 赵桂琴, 栗孟飞, 等. 中型狼尾草幼苗对PEG、低温和盐胁迫的生理应答. 草业学报, 2014, 23(2): 180-188.
[22] Liu B X, Wang Z G, Liang H Y,etal. Effects of salt stress on physiological characters and salt-tolerance ofUlmuspumilain different habitats. Chinese Journal of Applied Ecology, 2012, 23(6): 1481-1489.
刘炳响, 王志刚, 梁海永, 等. 盐胁迫对不同生境白榆生理特性与耐盐性的影响. 应用生态学报, 2012, 23(6): 1481-1489.
[23] Han Y, Sheng Y F, Luo X,etal. Physiological mechanism ofCarthamustinctoriusL. seedlings in response to salt stress. Chinese Journal of Ecology, 2014, 33(7): 1833-1838.
韩宇, 生艳菲, 罗茜, 等. 药用红花幼苗对盐胁迫的生理响应机制. 生态学杂志, 2014, 33(7): 1833-1838.
[24] Li X Y, Song Z W, Dong Z X. Plant physiological response to salt stress. Journal of Northwest Normal University(Natural Science), 2004, 40(3): 106-111.
李晓燕, 宋占午, 董志贤. 植物的盐胁迫生理. 西北师范大学学报(自然科学版), 2004, 40(3): 106-111.
[25] Chen T, Wang G M, Shen W W,etal. Effect of salt stress on the growth and antioxidant enzyme activity of kenaf seedlings. Plant Science Journal, 2011, 29(4): 493-501.
陈涛, 王贵美, 沈伟伟, 等. 盐胁迫对红麻幼苗生长及抗氧化酶活性的影响. 植物科学学报, 2011, 29(4): 493-501.
[26] Yang M S, Wang Y F, Gan X X,etal. Effects of exogenous nitric oxide on growth, antioxidant system and photosynthetic characteristics in seedling of cotton cultivar under chilling injury stress. Scientia Agricultura Sinica, 2012, 45(15): 3058-3067.
杨美森, 王雅芳, 干秀霞, 等. 外源一氧化氮对冷害胁迫下棉花幼苗生长、抗氧化系统和光合特性的影响. 中国农业科学, 2012, 45(15): 3058-3067.
[27] Peng L X, Zhou L J, Feng T,etal. Effects of salt stress on activities of antioxidant enzymes and membrane lipid peroxidation ofElaeagnusangustifoliaL. seedlings. Journal of Tianjin Agricultural University, 2009, 16(4): 1-4.
彭立新, 周黎君, 冯涛, 等. 盐胁迫对沙枣幼苗抗氧化酶活性和膜脂过氧化的影响. 天津农学院学报, 2009, 16(4): 1-4.
[28] Zhu J F, Liu J T, Lu Z H,etal. Effects of salt stress on physiological characteristics ofTamarixchinensisLour. seedlings. Acta Ecologica Sinica, 2015, 35(15): 5140-5146.
朱金方, 刘京涛, 陆兆华, 等. 盐胁迫对中国柽柳幼苗生理特性的影响. 生态学报, 2015, 35(15): 5140-5146.
[29] Guo Q S, Wu Y G, Lin Y F,etal. Effect of NaCl stress on growth and antioxidant systems ofPogostemoncablin. China Journal of Chinese Materia Medica, 2009, 34(5): 530-534.
郭巧生, 吴友根, 林尤奋, 等. 广藿香苗期生长及其抗氧化酶活性对盐胁迫的响应. 中国中药杂志, 2009, 34(5): 530-534.
[30] Chen J, Li N Y, Liu Q,etal. Antioxidant defense and photosynthesis for non-indigenous mangrove speciesSonneratiaapetalaandLagunculariaracemosaunder NaCl stress. Chinese Journal of Plant Ecology, 2013, 37(5): 443-453.
陈坚, 李妮亚, 刘强, 等. NaCl处理下两种引进红树的光合及抗氧化防御能力. 植物生态学报, 2013, 37(5): 443-453.
[31] Li X C, Wu Y G, Yang D M,etal. Respond of salt stress on ultrastructure of mesophyll cells inPogostemoncablin. Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(2): 300-304.
李贤超, 吴友根, 杨东梅, 等. 海南广藿香叶肉细胞超微结构对盐胁迫的响应. 江西农业大学学报, 2014, 36(2): 300-304.
[32] Qin L, Kang W H, Qi Y L,etal. Effects of salt stress on mesophyll cell structures and photosynthetic characteristics in leaves of wine grape (Vitisspp.). Scientia Agricultura Sinica, 2012, 45(20): 4233-4241.
秦玲, 康文怀, 齐艳玲, 等. 盐胁迫对酿酒葡萄叶片细胞结构及光合特性的影响. 中国农业科学, 2012, 45(20): 4233-4241.
[33] Pardo J M. Biotechnology of water and salinity stress tolerance. Current Opinion in Biotechnology, 2010, 21(2): 185-196.
[34] Sakaki T, Kondo N, Sugaliara K. Breakdown of photosynthetic pigments and lipids in spinach leaves with ozone fumigation role of active oxygens. Physiologia Plantarum, 1983, 59(1): 28-34.
[35] Ott T, Clarke J, Birkes K,etal. Regulation of the photosynthetic electron transport chain. Planta, 1999, 209(2): 250-258.
[36] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33(3): 317-345.
[37] Chang Q S, Zhang L X, Chen Y,etal. Characteristics of photosynthesis and spectra properties of thylakoid membranes in the yellow-green leaf mutant of chrysanthemum. Scientia Silvae Sinicae, 2013, 49(2): 72-78.
常青山, 张利霞, 陈煜, 等. 菊花黄绿叶突变体的光合与类囊体膜光谱. 林业科学, 2013, 49(2): 72-78.
[38] Yang S P, Wei C Z, Liang Y C. Effects of NaCl stress on the characteristics of photosynthesis and chlorophyll fluorescence at seedlings stage in different sea island cotton genotypes. Scientia Agriculture Sinica, 2010, 43(8): 1585-1593.
杨淑萍, 危常州, 梁永超. 盐胁迫对不同基因型海岛棉光合作用及荧光特性的影响. 中国农业科学, 2010, 43(8): 1585-1593.
[39] Zhang J, Jiang C D, Ping J C. Research advances about the effect of salt stress on photosynthesis of plant. Journal of Agricultural Sciences, 2008, 29(3): 74-80.
张娟, 姜闯道, 平吉成. 盐胁迫对植物光合作用影响的研究进展. 农业科学研究, 2008, 29(3): 74-80.
[40] Yuan J W, Li M M, Liu C J,etal. Analysis on photosynthetic physiological and chlorophyll fluorescence parameters between Marselen/101-14 and own-rooted Marselen grapes under different salt stresses. Acta Agriculturae Boreali-Occidentalis Sinica, 2016, 25(5): 758-762.
袁军伟, 李敏敏, 刘长江, 等. 盐胁迫下马瑟兰/101-14嫁接苗和自根苗光合生理及叶绿素荧光参数的差异. 西北农业学报, 2016, 25(5): 758-762.
EffectsofNaClstressonantioxidantcapacityandphotosyntheticcharacteristicsofPrunellavulgarisseedlings
ZHANG Li-Xia1, CHANG Qing-Shan2*, HOU Xiao-Gai1, LIU Wei1, LI Xiao-Peng1, GAO Yu-Hang1, ZHANG Xiu-Li1, DING Sheng-Yun1, XIAO Rui-Xue1, ZHANG Yao1, DENG Yong-Heng1
1.College of Agriculture, Henan University of Science and Technology, Luoyang 471023, China; 2.College of Forestry, Henan University of Science and Technology, Luoyang 471023, China
The effects of salt stress on antioxidant capacity and photosynthetic characteristics ofPrunellavulgarisseedlings were studied to provide a theoretical understanding to aid cultivation and management, and the breeding of salt resistant varieties ofP.vulgaris.P.vulgarisseedlings were incubated in nutrient solution, the seedlings were treated with NaCl concentrations of 0, 20, 40, 60 and 80 mmol/L. Antioxidant enzyme activities, osmolyte concentrations, chlorophyll content, and photosynthesis parameters were quantified after the treatment. The results showed that with increasing salt concentration, superoxide dismutase, ascorbate peroxidase, and soluble protein content increased with increasing salt concentration to 40 or 60 mmol/L and then decreased as concentration rose further; peroxidase, soluble sugar content, malondialdehyde content and electric conductivity showed a continuously rising trend; chlorophyll a and chlorophyll b, chlorophyll a/b, carotenoid and total chlorophyll declined with every increase in salt concentration, as did net photosynthetic rate, transpiration rate and stomatal conductance. Intercellular CO2concentration first decreased as NaCl concentration increased, with the lowest value at 60 mmol/L salt concentration and the highest at 80 mmol/L NaCl. The stomatal limit value steadily increased from 0.26 in CK to 0.38 in 60 mmol/L NaCl, and then decreased to 0.24 at 80 mmol/L. The decrease in net photosynthetic rate caused by 20-60 mmol/L NaCl stress was considered to be a result of stomatal restriction, the decrease of net photosynthetic rate caused by 80 mmol/L NaCl stress was mainly attributable to non-stomatal limitation. Under NaCl stress,P.vulgarisincreased the activity of antioxidant enzymes and the contents of osmolytes, and thus increased salt stress tolerance.
Prunellavulgaris; NaCl stress; photosynthesis; antioxidant enzyme
10.11686/cyxb2016397http//cyxb.lzu.edu.cn
张利霞, 常青山, 侯小改, 刘伟, 李晓鹏, 高宇航, 张秀丽, 丁生运, 肖瑞雪, 张耀, 邓永恒. NaCl胁迫对夏枯草幼苗抗氧化能力及光合特性的影响. 草业学报, 2017, 26(11): 167-175.
ZHANG Li-Xia, CHANG Qing-Shan, HOU Xiao-Gai, LIU Wei, LI Xiao-Peng, GAO Yu-Hang, ZHANG Xiu-Li, DING Sheng-Yun, XIAO Rui-Xue, ZHANG Yao, DENG Yong-Heng. Effects of NaCl stress on antioxidant capacity and photosynthetic characteristics ofPrunellavulgarisseedlings. Acta Prataculturae Sinica, 2017, 26(11): 167-175.
2016-11-01;改回日期:2017-07-25
河南省科技攻关计划项目(162102110095),河南科技大学学科提升振兴A计划项目(13660001),河南省高等学校重点科研资助项目(15A180037, 16A220005),河南科技大学高级别项目培育基金(2015GJB029),河南科技大学博士科研启动基金资助项目(4024-13480054,4026-13480038)和河南科技大学大学生研究训练计划(SRTP)项目(2014254,2014281, 2015152,2016136)资助。
张利霞(1982-),女,河南荥阳人,讲师,博士。E-mail: hkdzlx @126.com
*通信作者Corresponding author. E-mail: hkdcqs @126.com
