无机熔融盐电解质在锂空气电池的应用
2017-11-24陈婉琦黄云辉
陈婉琦,张 旺,尹 微,王 朵,沈 越,黄云辉
无机熔融盐电解质在锂空气电池的应用
陈婉琦,张 旺,尹 微,王 朵,沈 越,黄云辉
(华中科技大学材料与科学工程学院,湖北武汉 430074)
采用双氟磺酰亚氨锂-双氟磺酰亚氨钾-双氟磺酰亚氨铯(LiFSA-KFSA-CsFSA)(LKC)三元无机熔融盐作为锂空气电池电解质。通过电化学阻抗谱(EIS)、燃烧实验和循环伏安法(CV)来考察LKC熔融盐的电化学性质与物理特性。此外,通过充放电测试并结合扫描电子显微镜(SEM)、X射线衍射(XRD)等表征手段来分析LKC熔融盐基锂空气电池的电化学性能。结果表明,LKC熔融盐具有高离子电导率,电化学性质稳定。LKC熔融盐电解质为无机物,不含碳元素,不会燃烧,同时避免了在电池的循环过程中由电解质分解导致副产物碳酸锂的生成。LKC熔融盐基锂空气电池在50 mA/g的电流密度下,电池首圈放电容量为4258 mA·h/g,充电平台为3.83 V,库仑效率约为95%,优于一般有机电解液基锂空气电池。
双氟磺酰亚胺盐;锂空气电池;熔融盐电解质;碳酸锂
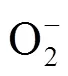
目前大多数有机电解液电化学性质不稳定,易分解形成多种副产物,影响电池的可逆性[16]。例如,常用的碳酸酯类电解液易受超氧根自由基的攻击而分解[6,17-18]。MIZUNO等[18]通过傅里叶变换红外光谱(FT-IR)和拉曼光谱(Raman)检测发现,以双三氟甲基磺酰亚胺锂(LiTFSI)/碳酸丙烯酯(PC)作电解液的锂空气电池的主要放电产物为Li2CO3和烷基碳酸锂[RO—(C==O)—OLi],未检测到Li2O2的存在。稳定性优于碳酸酯类的醚类电解液也被证实在锂空气电池体系中电化学性质不稳定[19-21]。BRUCE等[19]通过FT-IR测试发现,醚类电解液如四氢呋喃(THF)、四乙二醇二甲醚(TEGDME)、1, 3-二氧环戊烷(DOL)、二甲醚(DME)等在循环过程中会发生分解形成CO2Li、CH3CO2Li、Li2CO3等副产物。耐亲核攻击的酰胺类电解液也被应用在锂空气电池中[1,21-23],CHEN等[1]以0.1 mol/L LiClO4-二甲基甲酰胺(DMF)为电解液,并使用纳米多孔金作正极材料,研究结果发现碳酸盐副产物随着电池循环圈数的增加而出现。
针对上述现象,本实验选取双氟磺酰亚氨锂-双氟磺酰亚氨钾-双氟磺酰亚氨铯(LKC)三元无机熔融盐作电解质并应用在锂空气电池中。LKC熔融盐电解质不含碳元素,避免在电池充放电过程中因电解质分解而形成难溶、难分解的含碳副产物,在一定程度上改善电池的可逆性。LKC三元无机盐在Li∶K∶Cs的比例为0.30∶0.35∶0.35时,熔点为323 K,电化学窗口为0~5.4 V[24]。同时LKC熔融盐电解质不挥发、不燃烧的特性,提高了电池使用的安全性。本实验对LKC无机熔融盐电解质的电化学性能进行了研究,并探索LKC熔融盐基锂空气电池的充放电性能。
1 实验材料和方法
1.1 实验材料
LiFSA和CsFSA均购于成捷离子液体,纯度≥99.7%;氟化铯(CsF)Sigma-Aldrich,纯度≥99.95%;四乙二醇二甲醚(TEGDME)、二甲亚砜(DMSO)和乙腈(AC)均购于Sigma-Aldrich,分析纯;乙醇购于国药集团,纯度≥99.7%;金属锂购于武汉远闻公司,纯度≥99.9%;碳纳米管海绵(CNTs)购于先丰纳米,分析纯;玻璃纤维隔膜购于GE生命科学,平均孔径为0.7 μm;实验用水为双重去离子水,电阻<18 mΩ。
1.2 材料表征与测试
采用拉曼光谱(Raman)(LabRAM HR 800)对目标产物CsFSA进行定性分析。测试条件如下:激光波长532 nm,功率5 mW,曝光时间30 s。测试频率范围为100~2000 cm−1。采用扫描电子显微镜(Sirion 200,FEI)对电极片进行形貌观察。采用X射线衍射仪(X'Pert PRO-DY2198)对电极片进行成分分析。测试条件:X射线束为Cu-Kα1(= 1.5406×10-10m),测试角度为10°~80°,测试速度为4(°)/min。电化学工作站,上海辰华仪器有限公司;Land CT2001A型电池测试仪,武汉市蓝电金诺电子股份有限公司。
1.3 CsFSA盐的制备
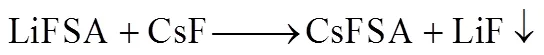
CsFSA则采用简单的一步化学反应合成,化学反应如式(1)所示。具体实验流程如下:首先将5 g LiFSA加入10 mL的乙醇中并不断搅拌至溶解。同时将3.8 g的CsF加入20 mL的乙醇中,不断搅拌至完全溶解,随后将其逐滴加入溶解了LiFSA的乙醇溶液中,随着溶液滴入的同时出现LiF白色沉淀。待溶液全部加入完毕再持续搅拌半小时,过滤掉白色沉淀,获得含有CsFSA的乙醇溶液。最后将该溶液置于真空干燥箱中,于45 ℃下干燥8 h,最终获得CsFSA。
1.4 LKC熔融盐电解质离子电导率测试
采用电化学阻抗谱(EIS)测试LKC熔融盐电解质的离子电导率。在直径为14 mm的两片金属锂之间放置厚度为30 μm,直径为18 mm的浸润了LKC熔融盐电解质的聚丙烯隔膜,并组装成CR2032扣式电池。采用恒温烘箱进行加热保温。本次实验以45 ℃为起始温度,以2 ℃/min和3 ℃/min速度进行升温,在每个设定温度下保温30 min之后进行EIS测试,直至70 ℃结束。通过EIS测试获得上述体系的电阻,利用式(2)计算(为离子电导率,S/cm;为电阻,Ω;为截面积,cm2;为金属锂之间的距离,cm)计算得到LKC熔融盐电解质的离子电导率。
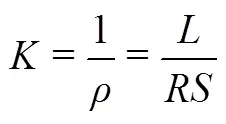
1.5 LKC熔融盐电解质的燃烧实验
采用燃烧实验来证明LKC熔融盐电解质不燃烧的安全特性,并使用锂空气电池常用的有机溶剂四乙二醇二甲醚(TEGDME)、二甲亚砜(DMSO)进行对比实验。本实验将TEGDME、DMSO和LKC熔融盐电解质分别浸润在3张直径为18 mm、厚度约为1 mm的玻璃纤维隔膜上,然后将上述玻璃纤维隔膜放置于酒精灯火焰中,观察其是否燃烧。
1.6 LKC熔融盐电解质循环伏安法CV测试
采用循环伏安法(CV)来研究LKC熔融盐在55 ℃的工作温度下的电化学特性。本次CV测试体系采用的是两电极体系,分别在充满惰性气体(氩气)和氧气的环境下进行测试。其中,以金属锂作为对电极,碳纳米管海绵作为工作电极,扫描电压范围为2~4.5 V(Li/Li+),扫速为0.1 mV/s,起始电位为开路电位。利用恒温烘箱对测试体系进行加热和保温。
1.7 锂空气电池的组装及电化学性能测试
本实验以LKC熔融盐作为锂空气电池的电解质,碳纳米管海绵作为正极材料,组装成扣式锂空气电池进行测试,本实验所有电池组装流程均在充满氩气惰性气体的手套箱中进行,其中H2O和O2含量均低于0.0001‰。首先配制LKC熔融盐电解质。实验流程具体如下:将LiFSA、KFSA、CsFSA置于60 ℃真空干燥箱中干燥6 h,除去微量水分,随后LiFSA∶KFSA∶CsFSA按摩尔比0.3∶0.35∶0.35来称取3种盐的质量,然后将三者于研钵中混合并研磨均匀,最后置于加热搅拌台上,在55 ℃下加热并不断搅拌至电解质呈熔融态。然后进行电池组装,程序如下:取20 μL熔融盐电解质并浸润直径为18 mm的玻璃纤维隔膜,同时取微量熔融盐电解质浸润碳纳米管海绵。然后将上述隔膜、正极材料、锂片以及集流体(泡沫镍)组装成扣式电池。本实验采用CR2032型扣式电池。在正极一侧的金属壳表面均匀分布19个直径为1.0 mm的孔洞,以利于氧气向电池内部扩散。
将组装好的扣式电池密封在电池测试盒中并放置于箱式炉中,在55 ℃下保温,并保持以8 mL/min的速率向电池测试盒中通入高纯氧气。采用LAND CT2001A电池测试系统进行恒流充放电测试。
2 实验结果与讨论
2.1 CsFSA表征结果分析
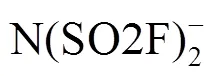
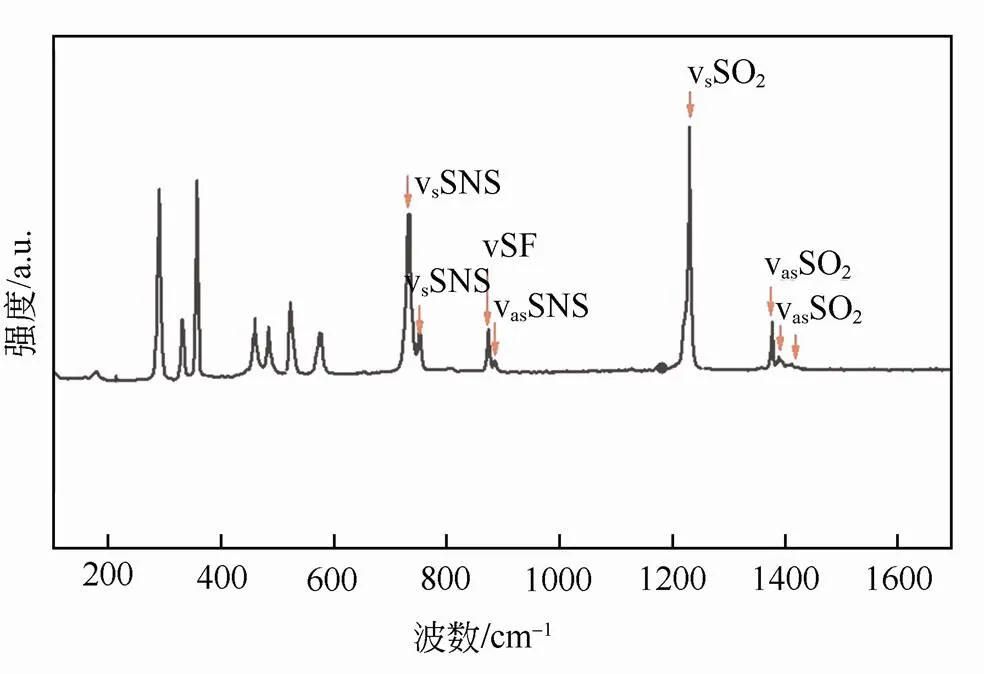
图1 CsFSA的拉曼光谱图
2.2 LKC熔融盐电解质的离子电导率
LKC熔融盐在不同温度下的离子电导率如图2所示。在图中可以看到随着温度的不断升高,熔融盐电解质的离子电导率不断增加。在45~50 ℃范围内,离子电导率变化不大,50 ℃之后电导率随温度增加上升明显。原因在于50 ℃下的LKC三元盐从固态完全转化为液态,随后温度不断升高,离子电导率直线上升。本次实验最终选择55 ℃为工作温度,在此温度下LKC熔融盐电解质具有足够高的离子电导率,为0.262 S/cm, 比锂空气电池常用的有机电解液的离子电导率高1~2个数量级[2,27]。
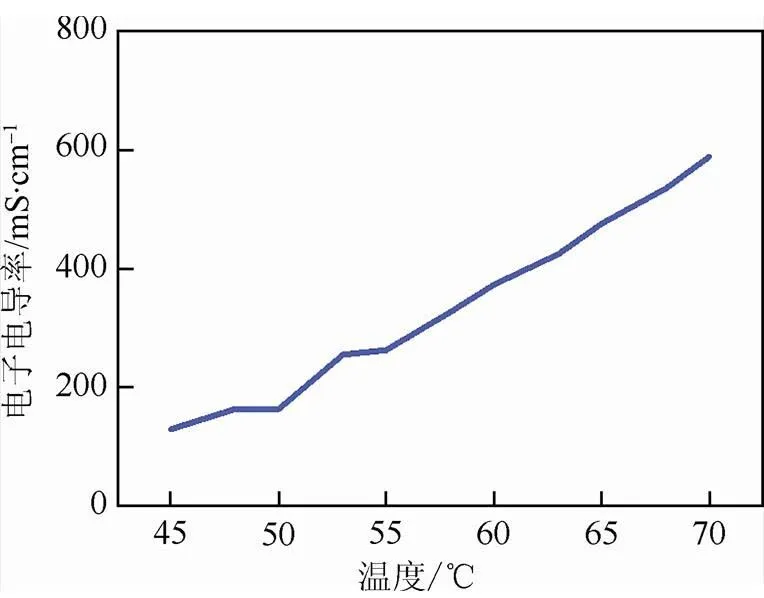
图2 LKC熔融盐温度-离子电导率曲线
2.3 LKC熔融盐电解质的燃烧实验
图3所示为含有机溶剂TEGDME、DMSO和LKC熔融盐电解质的玻璃纤维隔膜置于酒精灯火焰中的图片。图3(a)~(b)中,有机溶剂TEGDME与DMSO发生剧烈燃烧现象,并迸发大面积的火焰,表明TEGDME、DMSO这类具有高含碳量和强挥发性的有机溶剂在高温下极易燃烧,不利于锂空气电池在纯氧环境下长期安全工作。图3(c)中,玻璃纤维上未产生明显火焰,即LKC熔融盐不可燃烧。LKC熔融盐因其为无机物、不含碳元素而无法燃烧,因此LKC熔融盐在锂空气电池的应用将完全杜绝电解液燃烧的安全隐患。

图3 浸润了(a)TEGDME、(b)DMSO、(c)LKC熔融盐的玻璃纤维隔膜的图片
2.4 LKC熔融盐电解质循环伏安法CV测试
LKC熔融盐在氩气和氧气环境下的CV曲线如图4所示。从图中可以看到,在氩气气氛下,CV曲线无明显氧化峰和还原峰,表明在2~4.5 V(Li/Li+)电压范围内LKC熔融盐电化学性质稳定。在氧气气氛下,在2~2.7 V(Li/Li+)范围内有明显的还原电流,电流密度随着电压的降低不断增加,此段曲线对应着氧气的还原反应(ORR),即锂空气电池的放电过程(Li2O2的形成)。随着电压不断上升,从3.2 V(Li/Li+)开始出现氧化电流,并在3.5 V左右可以观察到一明显的氧化峰,对应着氧气的释放(OER),即锂空气电池的充电过程(Li2O2的分解)。
LKC熔融盐在氧气环境下的CV曲线只有一对可逆的氧化还原反应峰,即锂空气电池的ORR和OER过程,无其它氧化还原反应产生。另外在CV曲线上可以看到还原电流部分的曲线积分比氧化电流部分大2~3倍,此结果表明Li2O2的分解不完全。分析原因可能是由于Li2O2不导电,影响放电反应的可逆性。综上所述,LKC熔融盐电解质在锂空气电池工作范围内电化学性质稳定,即LKC熔融盐的电化学性质符合锂空气电池的使用要求。
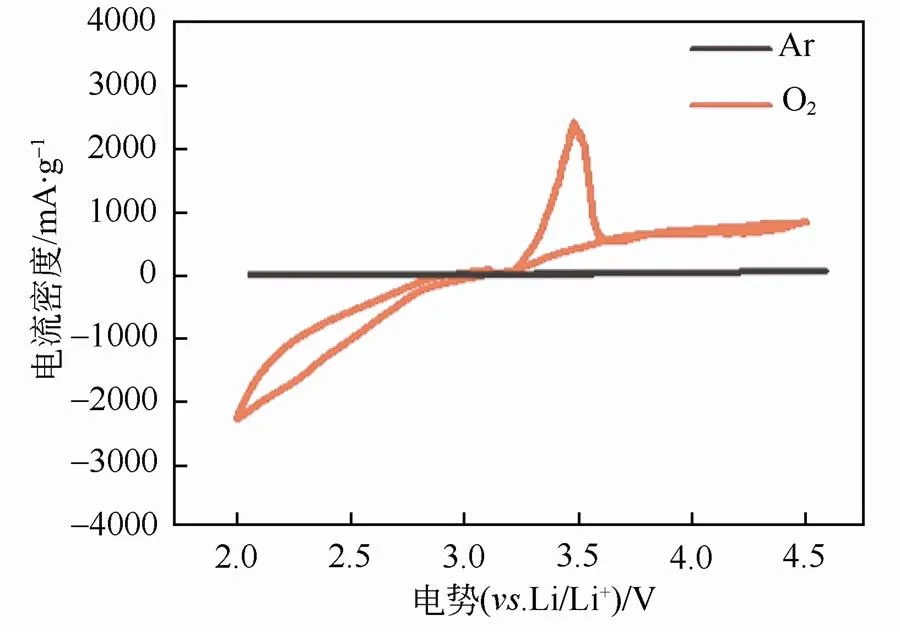
图4 LKC三元熔融盐在55℃下的CV曲线
2.5 LKC熔融盐电解质基锂空气电池的电化学性能
图5(a)所示为以LKC熔融盐作电解质的锂空气电池在55℃温度、不同电流密度下的放电曲线,电压范围为2~4.5 V(Li/Li+)。本次实验所选电流密度分别为50 mA/g、60 mA/g、80 mA/g、100 mA/g。从图中曲线可以看到,随着电流密度的增加,放电容量逐渐减少且电压平台逐渐降低。在50 mA/g的电流密度下,电池放电容量为2473 mA·h/g,电压平台为2.5~2.6 V(Li/Li+)。而在60 mA/g的电流密度下,电池放电容量为1680 mA·h/g,容量减小一半,且电压平台不够稳定,不断下滑。当电流密度更高时,电池容量大大缩减,这是由于高电流密度下放电促使Li2O2快速覆盖住电极材料表面,阻止氧气的继续扩散,放电过程提前终止[28]。因此本次实验选择50 mA/g为后续电池充放电测试的电流密度,在此电流密度下放电电压平台平稳,且放电容量较高。
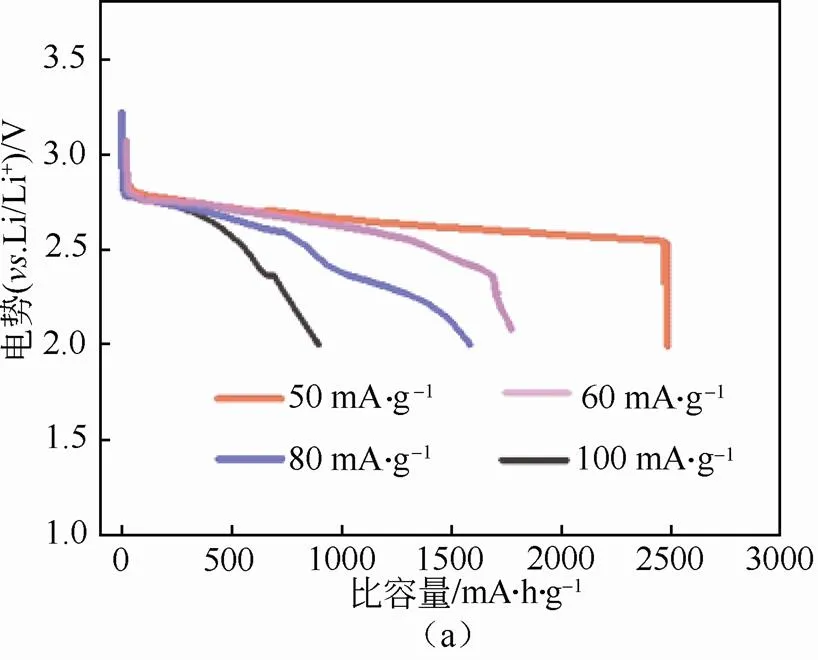
图5(b)所示为分别使用有机电解液(TEGDME基和DMSO基)和LKC熔融盐作电解质的锂空气电池的首圈充放电曲线,电流密度为50 mA/g。从图中可以看到LKC熔融盐基锂空气电池的首圈充电性能优势较为明显,其充电电位较低(3.83 V左右),且库仑效率达到95%。而有机电解液基锂空气电池的充电电位较高,其中TEGDME基锂空气电池的充电平台在4.24 V左右,DMSO基锂空气电池的充电平台在4.37 V左右。其库仑效率(TEGDME基为71%,DMSO基为80%)也低于LKC熔融盐基锂空气电池。虽然使用LKC熔融盐作电解质的充电性能有所改善,但其放电性能还有所不足,其首圈放电容量为4258 mA·h/g,低于有机电解液TEGDME基与DMSO基锂空气电池的放电容量。其放电容量较低可能是由于氧气在熔融盐电解质中的溶解度较低与传输速率较慢所导致。图5(c)所示为LKC熔融盐基锂空气电池在55 ℃下的完全充放电循环曲线。在充放电进行至第2圈,容量保持率为61%,之后电池容量快速衰减,在第5圈充放电时电池基本衰竭。后续可以寻求合适的液态催化剂或者优化正极材料来改善LKC熔融盐基电池的充放电性能和循环性能,增加电池寿命。
在锂空气电池中常用的有机电解液会在电池的充放电循环中发生分解,产生Li2CO3等难溶、难分解的副产物,这些副产物的电阻要远远大于放电产物Li2O2[29],导致充放电过电位很高,电池寿命极大缩短[30]。选择LKC熔融盐作电解质可以避免含碳副产物的产生,如Li2CO3,部分降低充放电过电位。后续通过XRD和SEM检测充放电结束后的电极片上是否存在副产物Li2CO3。
2.6 电池放电产物的表征与分析
电池充放电结束后,用乙腈将正极材料碳管海绵进行三次清洗,干燥过后样品待测。图6为原始电极片、第一次放电过后的电极片和第5圈充电过后的电极片的SEM图片和XRD衍射图谱。
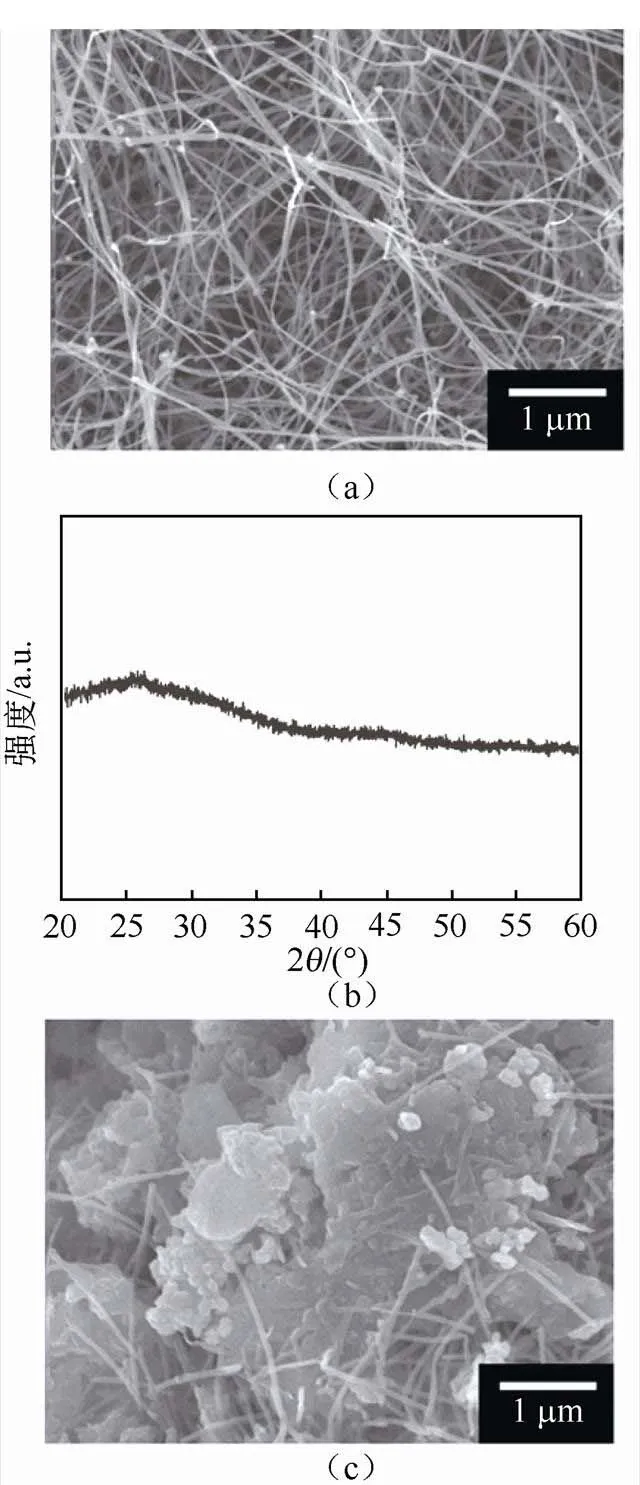
图6(a)~(b)所示为原始电极片形貌图片及XRD衍射图谱。如图6(c)~(d)所示,XRD结果显示首圈放电后电极片上物质主要为Li2O2,同时SEM图中可以看到碳管上存在一些颗粒状的Li2O2和大面积的片层状Li2O2。如图6(e)~(f)所示,XRD结果显示第5圈充电结束后的电极片上并未检测到Li2CO3的存在,即充电过程中无副产物Li2CO3的生成。SEM图中则可以看到碳管上基本无Li2O2存在。上述现象说明LKC三元熔融盐基锂空气电池经过多圈充放电循环之后不会产生副产物Li2CO3,原因在于LKC熔融盐电解质为无机物,不含碳元素。
杜绝副产物Li2CO3的形成一定程度上缓解了电池过高的充放电过电位,库仑效率有所改善。LKC熔融盐基锂空气电池首圈充电平台为3.83 V,库仑效率约为95%,而使用一般有机电解液(无氧化还原介质或催化剂,碳纳米管海绵为正极材料)过电位在4.2 V以上,且充电效率低于80%[8,30-34]。
3 结 论
LiFSA-KFSA-CsFSA三元熔融盐电解质具有高离子电导率,55 ℃下离子电导率高达0.262 S/cm,比常用的有机电解液高1~2个数量级。LKC熔融盐电解质为无机物、不含碳,不会产生因电解液分解而形成的副产物Li2CO3,避免了难溶、难分解的Li2CO3堵塞住正极材料的多孔结构,从而改善电池的可逆性。LKC熔融盐基锂空气电池,在50 mA/g的电流密度下,放电容量为4258 mA·h/g,首圈充电平台为3.83 V,库仑效率约为95%。另外,LKC熔融盐电解质不会燃烧,杜绝了锂空气电池中电解液在高纯氧工作环境下发生燃烧的安全隐患。
[1] CHEN Y H, FREUNBERGER S A, PENG Z P, et al. Li-O2battery with a dimethylformamide electrolyte[J]. Journal of the American Chemical Society, 2012, 134(18): 7952-2957.
[2] ADAMS B D, BLACK R, WILLIAMS Z, et al. Towards a stable organic electrolyte for the lithium oxygen battery[J]. Advanced Energy Materials, 2014, 5(1): 1614-1624.
[3] XU D, WANG Z L, XU J J, et al. A stable sulfone based electrolyte for high performance rechargeable Li-O2batteries[J]. Chemical Communications, 2012, 48(95): 11674-11676.
[4] BRYANTSEV V S, UDDIN J, GIORDANI V, et al. The identification of stable solvents for nonaqueous rechargeable Li-air batteries[J]. Journal of the Electrochemical Society, 2013, 160(1): A160-A171.
[5] GRANDE L, PAILLARD E, KIM G T, et al. Ionic liquid electrolytes for Li-air batteries: Lithium metal cycling[J]. International Journal of Molecular Sciences, 2014, 15(5): 8122-8137.
[6] FREUNBERGER S A, CHEN Y H, PENG Z P, et al. Reactions in the rechargeable lithium-O2battery with alkyl carbonate electrolytes[J]. Journal of the American Chemical Society, 2011, 133(20): 8040-8047.
[7] CHALASANI D, LUCHT B L. Reactivity of electrolytes for lithium-oxygen batteries with Li2O2[J]. Ecs Electrochemistry Letters, 2012, 1(2): A38-A42.
[8] LIM H D, PARK K Y, SONG H, et al. Enhanced power and rechargeability of a Li-O2battery based on a hierarchical-fibril CNT electrode[J]. Advanced Materials, 2013, 25(9): 1348-1352.
[9] LUO Z K, LIANG C S, WANG F, et al. Optimizing main materials for a lithium-air battery of high cycle life[J]. Advanced Functional Materials, 2014, 24(14): 2101-2105.
[10] LI Q, XU P, GAO W, et al. Graphene/graphene-tube nanocomposites templated from cage-containing metal-organic frameworks for oxygen reduction in Li-O2batteries[J]. Advanced Materials, 2014, 26(9): 1378-86.
[11] MCCLOSKEY B D, BETHUNE D S, SHELBY R M, et al. Solvents’ critical role in nonaqueous lithium-oxygen battery electrochemistry [J]. Journal of Physical Chemistry Letters, 2011, 2(10): 1161-1166.
[12] YOUNESI R, HAHLIN M, BJÖREFORS F, et al. Li-O2battery degradation by lithium peroxide (Li2O2): A model study[J]. Chemistry of Materials, 2013, 25(1): 77-84.
[13] XU D, WANG Z L, XU J J, et al. Novel DMSO-based electrolyte for high performance rechargeable Li-O2batteries[J]. Chemical Communications, 2012, 48(55): 6948-6950.
[14] XU W, XIAO J, WANG D, et al. Crown ethers in nonaqueous electrolytes for lithium/air batteries[J]. Electrochemical and Solid-State Letters, 2010, 13(4): A938-A945.
[15] TRAHAN M J, MUKERJEE S, PLICHTA E J, et al. Studies of Li-air cells utilizing dimethyl sulfoxide-based electrolyte[J]. Journal of the Electrochemical Society, 2012, 160(2): A259-A267.
[16] 蒋颉, 刘晓飞, 赵世勇, 等. 基于有机电解液的锂空气电池研究进展[J]. 化学学报, 2014, 72(4): 417-426.
JIANG J, LIU X F, ZHAO S Y, et al. Research progress of organic electrolyte based lithium-air batteries[J]. Acta Chimica Sinica, 2014, 72(4): 417-426.
[17] XU W, XU K, VISWANATHAN V V, et al. Reaction mechanisms for the limited reversibility of Li-O2chemistry in organic carbonate electrolytes[J]. Journal of Power Sources, 2011, 196(22): 9631-9639.
[18] MIZUNO F, NAKANISHI S, KOTANI Y, et al. Rechargeable Li-air batteries with carbonate-based liquid electrolytes[J]. Electrochemistry, 2010, 78(5): 403-405.
[19] FREUNBERGER S A, CHEN Y, DREWETT N E, et al. The lithium-oxygen battery with ether-based electrolytes[J]. Angewandte Chemie International Edition in English, 2011, 50(37): 8609-8613.
[20] WEN R, HONG M, BYON H R.AFM imaging of Li-O2electrochemical reaction on highly oriented pyrolytic graphite with ether-based electrolyte[J]. Journal of the American Chemical Society, 2013, 135(29): 10870-10876.
[21] BRYANTSEV V S, FAGLIONI F. Predicting autoxidation stability of ether- and amide-based electrolyte solvents for Li-air batteries[J]. The Journal of Physical Chemistry A, 2012, 116(26): 7128-7138.
[22] SHARON D, HIRSBERG D, AFRI M, et al. Reactivity of amide based solutions in lithium-oxygen cells[J]. The Journal of Physical Chemistry C, 2014, 118(28): 15207-15213.
[23] WALKER W, GRORDANI V, UDDIN J, et al. A rechargeable Li-O2battery using a lithium nitrate/,-dimethylacetamide electrolyte[J]. Journal of the American Chemical Society, 2013, 135(6): 2076-2079.
[24] KUBOTA K, NOHIRA T, GOTO T, et al. Novel inorganic ionic liquids possessing low melting temperatures and wide electrochemical windows: Binary mixtures of alkali bis(fluorosulfonyl)amides[J]. Electrochemistry Communications, 2008, 10(12): 1886-1888.
[25] BERAN M, PŘÍHODA J, ŽÁK Z, et al. A new route to the syntheses of alkali metal bis(fluorosulfuryl)imides: Crystal structure of LiN(SO2F)2[J]. Polyhedron, 2006, 25(6): 1292-1298.
[26] BERAN M, PŘÍHODA J. A new method of the preparation of imido-bis(sulfuric acid) dihalogenide, (F, Cl), and the potassium salt of imido-bis(sulfuric acid) difluoride[J]. Zeitschrift für Anorganische und Allgemeine Chemie, 2005, 631(1): 55-59.
[27] REITER J, PAILLARD E, GRANDE L, et al. Physicochemical properties of-methoxyethyl--methylpyrrolidinum ionic liquids with perfluorinated anions[J]. Electrochimica Acta, 2013, 91(28): 101-107.
[28] ZHANG G Q, ZHENG J P, LIANG R, et al. Lithium-air batteries using SWNT/CNF buckypapers as air electrodes[J]. Journal of the Electrochemical Society, 2010, 157(8): A953-A956.
[29] SHAO Y, DING F, XIAO J, et al. Making Li-air batteries rechargeable: Material challenges[J]. Advanced Function Materials, 2013, 23(8): 987-1004.
[30] YOON T H, PARK Y J. Carbon nanotube/Co3O4composite for air electrode of lithium-air battery[J]. Nanoscale Research Letters, 2012(7): https://doi.org/10.1186/1556-276X-7-28.
[31] CHAN K L, YONG J P. Polyimide-wrapped carbon nanotube electrodes for long cycle Li-air batteries[J]. Chemistry Communication, 2015, 51(7): 1210-1213.
[32] KWAK W J, KANG T G, SUN Y K, et al. Iron-cobalt bimetal decorated carbon nanotubes as cost-effective cathode catalysts for Li-O2batteries[J]. Journal of Materials Chemistry A, 2016(4): 7020-7026.
[33] LUO W B, CHOU S L, JIA Z W, et al. A facile approach to synthesize stable CNTs@MnO electrocatalyst for high energy lithium oxygen batteries[J]. Scientific Reports, 2015(5): 8012-8019.
[34] ZHAO G, ZHANG L, PAN T, et al. Preparation of NiO/multiwalled carbon nanotube nanocomposite for use as the oxygen cathode catalyst in rechargeable Li-O2batteries[J]. Journal of Solid State Electrochemistry, 2013, 17(6): 1759-1764.
Application of inorganic melting salt electrolyte in lithium-air battery
CHEN Wanqi,ZHANG Wang,YIN Wei,WANG Duo,SHEN Yue,HUANG Yunhui
(School of Materials Science and Engineering, Huazhong University of Science and Technology, Wuhan 430074, Hubei, China)
Ternary molten salt based on bis(fluoroalkylsulfonyl)amide anions (LiFSA-KFSA-CsFSA) as a new class of electrolyte was applied in lithium-air batteries. Electrochemical impedance spectroscopy (EIS), cyclic voltammetry (CV) and combustion experiments were employed to explore the electrochemical and physical properties of this molten salt electrolyte. The electrochemical performance of molten salt-based lithium air battery was analyzed by means of charge-discharge measurement coupled with scanning electron microscopy (SEM) and X-ray diffraction (XRD). The results indicat that LiFSA-KFSA-CsFSA(LKC)molten salt has much higher ionic conductivity and showed good electrochemical stability. With no carbon component, LKC inorganic molten salt was nonflammable. Furthermore, LKC salt could prevent the formation of insulate and insoluble lithium carbonate originated from electrolyte decomposition during cycling. The lithium-air batteries based on LKC molten salt had an initial discharge capacity of 4 258 mA·h·g-1, a charge potential of 3.83 V and the coulombic efficiency was 95% at 50 mA·g-1, performing better than the common organic electrolyte-based lithium air battery.
bis(trifluoromethylsulfonyl)amides; lithium-air battery; molten salt electrolyte; lithium carbonate
10.12028/j.issn.2095-4239.2017.0062
TM 911
A
2095-4239(2017)06-1273-07
2017-05-18;
2017-05-23。
国家自然科学基金项目(51672098,51361130151),长江学者与大学创新研究团队计划项目(IRT14R18)。
陈婉琦(1992—),女,硕士研究生,研究方向为锂空气电池,E-mail:chenwanqi2016@163.com;
沈越,副教授,主要研究方向为锂空气电池,E-mail:shenyue1213@mail.hust.edu.cn。
