利奈唑胺及其衍生物的研究进展
2017-11-24许志强李心怡
王 丹,许志强,李心怡,宫 雪
(辽宁大学 药学院,辽宁 沈阳 110036)
利奈唑胺及其衍生物的研究进展
王 丹,许志强,李心怡,宫 雪*
(辽宁大学 药学院,辽宁 沈阳 110036)
利奈唑胺是一类具有噁唑烷酮类结构的药物,在临床中作为抗菌药物用于抗菌治疗,但长期使用会导致菌株产生耐药性影响治疗效果.因此,对其进行结构改造,得到新型高效的抗菌药物具有广阔的应用价值.研究表明,对化合物利奈唑胺C环进行结构修饰改造,能够显著影响药物的活性.就利奈唑胺结构中C环结构改造与药理作用之间的关系进行了综述.
利奈唑胺 ;噁唑烷酮;C环改造
0 引言
随着抗生素的广泛使用,甚至滥用,细菌的耐药性问题日益严重,其中最严重的耐药菌是耐甲氧西林的金葡萄菌(MRSA)和耐万古霉素的肠球菌(VRE),因此寻找结构新颖,耐药性强的新化合物迫在眉睫.美国杜邦公司于1978年发现噁唑烷酮类化合物具有良好的抗菌作用,最终因其毒性作用过大而放弃该研究.美国普强公司于1996年开发出新的噁唑烷酮类药物:利奈唑胺(linezolid).利奈唑胺对革兰氏阳性菌的抗菌谱非常广,对耐甲氧西林葡萄球菌(MRSA)、耐万古霉素肠球菌(VRE)、耐万古霉素葡萄球菌、耐青霉素肺炎球菌和厌氧菌均有抗菌活性[1].然而,在利奈唑胺应用于临床治疗后不久,便出现了对其耐药的菌株,因此研究人员对其进行了大量的结构改造.
利奈唑胺是一种具有噁唑烷酮结构的药物(如图1),结构分为A环、B环和C环3部分,其中,A环的唑烷酮以及C5位R构象为活性必需基团,5位C原子引入酰胺、硫代酰胺、硫代氨基甲酸酯或硫脲,通常可提高药物的体外抗菌活性;B环多为苯环,利用生物电子等排原理可替换成吡啶环和吡咯环,但替换后的衍生物仅对分枝杆菌有明显抑制作用,若换为其他杂环,对于常见的革兰阳性菌活性均大大降低,苯环上由吸电子基团氟原子取代,常见的包括单氟、双氟、三氟取代或无氟取代,其中双氟取代的活性较高,能显著增加化合物的抗菌活性;C环为吗啉环,不是对细菌核糖体起作用的必需基团,用不同的官能团替代C环对其抗菌活性影响较小,所以对C环进行改造意义最大,是结构优化的一个重要位点[2].
利奈唑胺C环的结构修饰包括:改变结构单元C环与B环的连接方式;或者将吗啉环的O原子替换为C原子,在所替换的位点上连接新的取代基,如羟基、甲氧基、卤素等,所得化合物较利奈唑胺相比,对粪肠球菌和万古霉素中度耐药金黄色葡萄球菌有双重活性;此外,诸如其他一些呋喃环、吡啶、吡唑、氮唑、吲哚、噻吩并吡啶及哌嗪等杂环均可替换吗啉环.研究结果表明,环状磺酰胺替换吗啉环后所得化合物在抗革兰氏阳性菌、甲氧西林金黄色葡萄球菌等方面具有与利奈唑胺相当或更高的活性[3].近年来,针对利奈唑胺C环的结构改造已进入临床研究的新型药物主要包括雷得唑来(Radezolid)、泰地唑胺(Torezolid)、PNU-100480、RWJ-416457这四种.现对几种化合物进行综述如下:
1 雷得唑来(Radezolid)
金黄色葡萄球菌感染容易引发慢性疾病,难以治疗,且病菌容易反复感染,不易康复.针对这种菌,科研人员研究出了抗生素利奈唑胺,该药的作用机制是抑制细菌感染过程中的积累和表达.利奈唑胺进入细胞内很难在胞内聚集,对细胞内金黄色葡萄球菌的抑制作用较差,因此研究人员研发了新型抗菌药雷得唑来Radezolid(INN,codenamed RX-1741)(如图2),该药由Melinta Therapeutics公司研发,现已完成临床二期试验.其结构中具有联芳环结构,并连有三氮唑环.其中含氮原子的化学键具有相似的偶极矩,可以作为潜在的弱氢键受体.
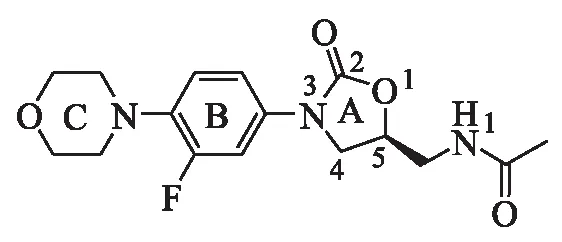
图1 利奈唑胺的结构

图2 雷得唑来的结构
实验结果显示[4],和利奈唑胺(linezolid)相比,radezolid对金黄色葡萄球菌的药效较linezolid更强,且细菌产生的耐药性更低,这可能和药物在吞噬细胞过程中的不断积累有关,且radezolid的最低抑菌浓度(MIC)也低于利奈唑胺(表1).因此,就安全性而言radezolid明显好于linezolid.
2 泰地唑胺(Torezolid)
Torezolid(泰地唑胺/TR-700)为第2代噁唑烷酮类抗生素,于2014年6月20日获美国FDA批准上市,商品名为:Sivextro(磷酸泰地唑胺)(图4).磷酸泰地唑胺为泰地唑胺的前药,该药进入人体后,在体内磷酸酶的作用下转化为具有生物活性的泰地唑胺,从而发挥药效.

表1 利奈唑胺与雷得唑来的MIC比较
泰地唑胺化学名称为(R)-3-(4-(2-(2-甲基四唑-5-基)吡啶-5-基)-3-氟苯基)-5-羟甲基噁唑烷-2-酮,分子式:C17H15FN6O3,结构式(见图3)[5].泰地唑胺磷酸盐作为泰地唑胺的前药,磷酸化后形成的泰地唑胺磷酸盐能够显著改善其在水中的溶解性,提高口服生物利用度,同时掩蔽了C-5羟基与单胺氧化酶(MAO)作用.研究表明,药物磷酸基团易被血液磷酸酶裂解,但不减弱抗菌效力[6].
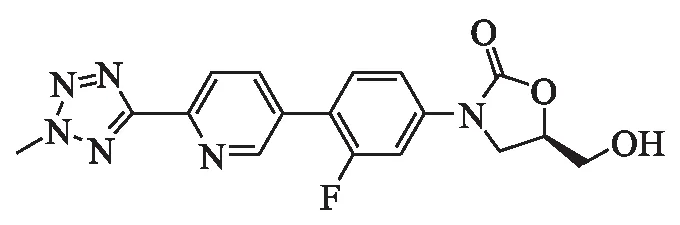
图3 泰地唑胺的结构
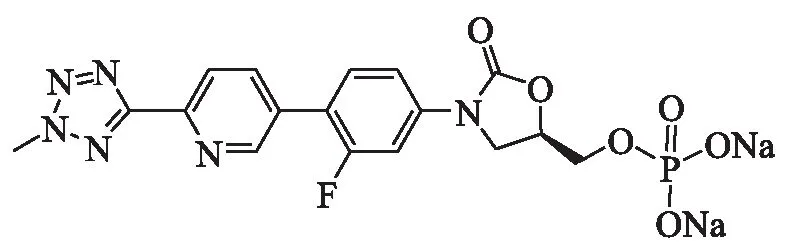
图4 磷酸泰地唑胺的结构
研究结果显示(表2),对于葡萄球菌,肠球菌和链球菌这三个菌种,torezolid的MIC值均低于利奈唑胺,说明torezolid的抑菌活性显著提高.
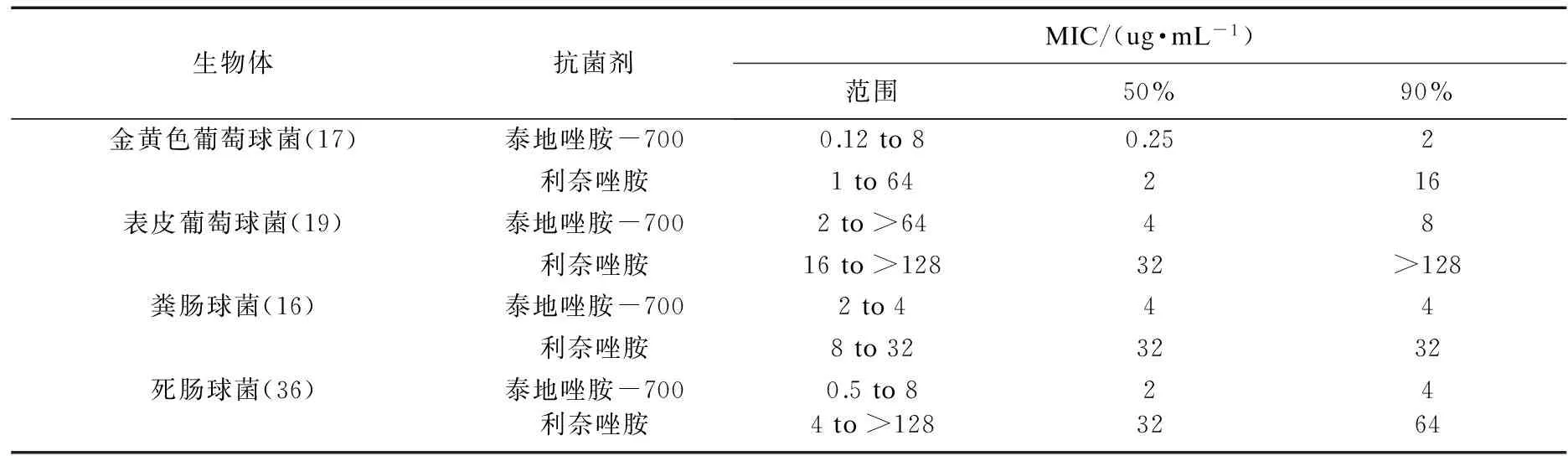
表2 利奈唑胺与泰地唑胺-700的MIC比较
3 PNU-100480
人工合成的噁唑烷酮类抗生素利奈唑胺具有良好的抗结核菌活性,但在最近几年,随着人口的流动增加及艾滋病的愈发频繁,使得结核病菌及非结核分支杆菌的耐药性大大增强,感染人数也逐年上升,研制新型抗结核菌噁唑烷酮类药物显得尤为迫切,也成为现代科学家研究的热点.20世纪90年代中期辉瑞公司的研发人员将利奈唑胺C环氧原子替换为硫原子(如图5)开发的新型化合物PNU-100480,目前已经进入二期临床研究[1].
研究表示,PNU-100480具有良好的抗菌活性,尤其是结核分支杆菌,其最低抑菌浓度(MIC)相较于利奈唑胺活性的3.2倍(表3);临床研究亦表明,该药可耐受性良好,受试者口服1 200 mg/d时仍呈现耐受性[7].服用本药进行结核病治疗,每天服用800~1 200 mg即可达最佳治疗效果,将本药与其他一线抗结核药作为复方制剂联合使用效果更加明显.
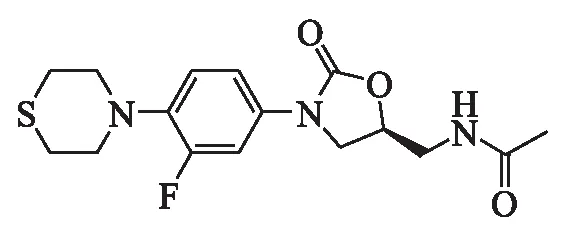
图5 PNU-100480的结构
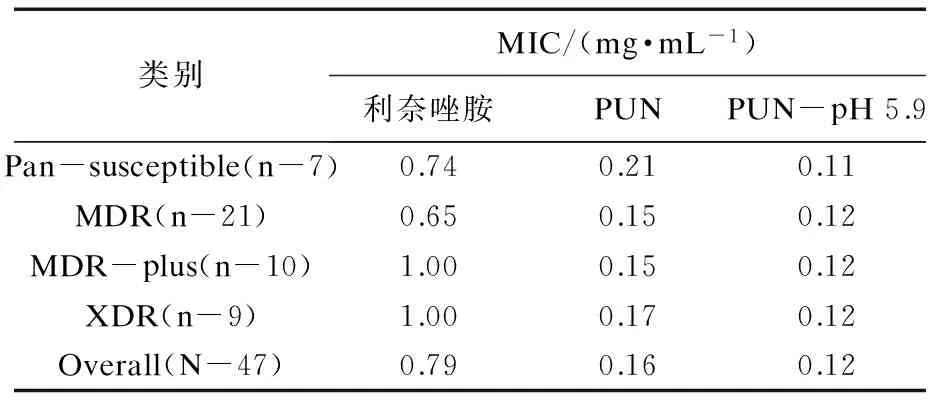
类别MIC/(mg·mL-1)利奈唑胺PUNPUN-pH5.9Pan-susceptible(n-7)0.740.210.11MDR(n-21)0.650.150.12MDR-plus(n-10)1.000.150.12XDR(n-9)1.000.170.12Overall(N-47)0.790.160.12
4 REJ-416457
德玛西亚-普强公司用二氢异噁唑环取代了噁唑烷酮环,合成一系列二氢异噁唑衍生物,从中发现仅当5位碳原子为手性碳且为R构型时化合物才具有抗菌活性,如化合物(图6未命名).然而西班牙laboratorios salvat公司研究人员发现化合物REJ-416457(图7)对葡萄糖球菌、链球菌、肠球菌这三种菌落均有活性,是利奈唑胺的2.4倍.所得结果与普强公司的说法相矛盾,究其原因可能是化合物REJ-416457的C5取代位的噻唑氨甲基侧链与甲基咪唑基增加了化合物与核糖体结合位点间的氢键的相互作用.

图6 未命名

图7 REJ-416457的结构
研究结果表明(表4),改造后的新化合物REJ-416457的最低抑菌浓度显著降低,具有良好的抗菌活性,主要用于革兰氏阳性菌,包括耐甲氧西林金黄色葡萄球菌等,目前该药已结束临床一期试验[8].
5 总结与展望
综上所述,尽管抗菌药物的种类很多,但是病原体微生物的数量也不在少数,而且随着时间的延长,不少病原微生物也出现耐药性,所以研究出抗菌谱广及抗耐药菌活性强的药物显得尤为重要.噁唑烷酮类抗菌药作为一种新型抗菌药,具有很好的发展前景.相信噁唑烷酮类抗菌药以其独特的作用机制及广谱抗革兰氏阳性菌活性,必将在感染性疾病的治疗中有所建树.

表4 REJ-416457和利奈唑胺的MIC比较
[1] Diekena D,Jones R.Oxazolidinones:a review[J].Drugs,2000,59(1):7-16.
[2] 杨月,毕小玲.利奈唑胺C环结构改造研究进展[J].药学进展,2014,38(4):274-278.
[3] 秦文灵,肖尚友,夏之宁.噁唑烷酮抗菌剂构效关系研究进展[J].中国药学杂志,2010,45(13):961-965.
[4] Lemaire S,Kosowska-Shick K,Appelbaum P,et al.O31 Radezolid(RX-1741),a novel oxazolidinone,accumulates extensively within human macrophages and PMNs and shows activity towards intracellular linezolid-sensitive and linezolid-resistant Staphylococcus aureus.International[J].Journal of Antimicrobial Agents,2009,34:12-12.
[5] 曹玉婷,刘骞峰,沈宁,等.抗菌药物泰地唑胺的构效关系及合成研究进展[J].中国新药杂志,2016,25(9):1024-1028.
[6] Flanagans,Bartizalk,Minassiansl,et al.In vitro,in vivo,and clinical studies of tedizolid to assess the potential for peripheral or central mono-amine oxidasinteractions[J].Antimicrob Agents Chemother,2013,57(7):3060-3066.
[7] 许寅,孟现民,张永信.耐药结核病流行现状及抗结核药物研究进展[J].上海医药,2013,34(13):3-7.
[8] 王吕鸣,刘敏,沈思思,等.恶唑烷酮类抗菌药物研究进展[J].中国药物化学杂志,2013,23(3):218-225.
(责任编辑李超)
DevelopmentsofLinezolidanditsDerivatives
WANG Dan,XU Zhi-qiang,LI Xin-yi,GONG Xue*
(Schoolofpharmacy,LiaoningUniversity,Shenyang110036,China)
Linezolid is a drug with oxazolidinone structure,which is used as clinical antibiotics.However,serious drug resistance is caused by its long-term use.Previous studies showed that the ring C structure qualification of linezolid reduce the minimum inhibitory of the drug obviously.In this paper,the structure qualification of linezolid ring C and its pharmacological effects were overviewed.
linezolid;oxazolidinone;ring C
R 969
A
1000-5846(2017)04-0333-04
2017-03-14
王丹(1981-),女,汉族,辽宁沈阳人,博士,实验师,从事药理学研究,E-mail:wangdan@lnu.edu.cn.
*
宫雪(1996-),女,汉族,辽宁大连人,本科,制药工程专业.
