卵巢储备功能减退患者应用脱氢表雄酮预处理的有效性研究
2017-11-22许晓璐刘芸黄吴键何凌云薛雪梅林琳
许晓璐,刘芸,黄吴键,何凌云,薛雪梅,林琳
(福州总医院妇产科生殖医学中心,福州 350001)
卵巢储备功能减退患者应用脱氢表雄酮预处理的有效性研究
许晓璐,刘芸*,黄吴键,何凌云,薛雪梅,林琳
(福州总医院妇产科生殖医学中心,福州 350001)
目的 探讨脱氢表雄酮(DHEA)预处理在卵巢储备功能减退(DOR)患者IVF-ET治疗过程中的应用价值。 方法 回顾性分析2012年12月至2015年12月在我院生殖中心行IVF-ET治疗至少2个周期的55例DOR患者的临床资料,前1周期未使用DHEA处理,视为处理前组;进入再次治疗周期前给予DHEA口服预处理的治疗周期为处理组,进行自身对照研究,比较前后周期的促排卵情况及妊娠结局。 结果 处理前组与处理组的基本情况比较均无显著性差异(P>0.05);前后周期的Gn天数、Gn总量、HCG日激素水平比较亦无显著性差异(P>0.05);处理组HCG日≥14 mm卵泡数、获卵数及MⅡ卵数显著高于处理前组(P<0.05);前后周期的受精率、卵裂率、优质胚胎数及优质胚胎率比较均无显著性差异(P>0.05)。 结论 DHEA预处理可能增加DOR患者的获卵数及成熟卵母细胞数,但其是否能改善IVF-ET治疗的妊娠结局有待进一步研究。
辅助生殖技术; 卵巢储备功能减退; 脱氢表雄酮
卵巢储备功能指卵巢内存留卵泡的数量和质量,反映女性的生殖能力。女性年龄是体现生殖能力的最敏感指标[1],随着年龄增加,卵巢内存留的可募集卵泡数量减少、卵母细胞质量下降,称为卵巢储备功能减退(DOR)。进行IVF-ET治疗过程中DOR表现为卵巢低反应(POR),即控制性促排卵(COH)过程中卵巢对外源性促性腺激素(Gn)刺激反应低下,临床表现为所需Gn剂量增加、获卵数减少、卵母细胞质量下降、胚胎着床率低、流产率增加、分娩率下降[2]。DOR给辅助生殖技术(ART)带来了巨大挑战。近年来脱氢表雄酮(DHEA)在DOR患者ART治疗中的应用引起人们关注,但其对临床结局的影响尚存在争议。本研究回顾性分析55例DOR患者临床资料,对DHEA预处理前后周期进行对照研究,探讨DHEA在DOR患者IVF-ET治疗过程中的应用价值。
一、资料与方法
1.研究对象:回顾性分析2012年12月至2015年12月在我院生殖中心行IVF-ET治疗至少2个周期的DOR患者的临床资料。纳入标准:男方指标正常,由于女方因素导致的符合卵巢低反应博洛尼亚标准[3]的不孕症患者。共55例患者纳入研究,年龄24~42岁。本研究经医院医学伦理委员会批准。
本研究采用回顾性分析自身对照。前1周期未使用DHEA预处理,视为处理前组;所有患者未妊娠,进入再次治疗周期前使用DHEA(25 mg/片,NATROL,美国)口服预处理25 mg/次,3次/d,30~120 d,即处理组。同一患者前后周期使用相同的COH方案,两次COH周期间隔时间3~24个月。
2.COH方案:所有患者前后周期均采用促性腺激素释放激素激动剂(GnRH-a)短效长方案。于黄体中期开始应用GnRH-a(醋酸曲普瑞林,达菲林,0.1 mg/支,博福-益普生,法国)0.05 mg/d皮下注射共14~16 d,垂体达降调节标准(FSH<5 U/L、LH<5 U/L、E2<110 pmol/L、子宫内膜厚度<5 mm)后添加Gn促排卵,根据卵泡生长情况及血清激素水平调整Gn用量,当主导卵泡直径达18 mm或2个卵泡直径达17 mm时,于当晚肌肉注射人绒毛膜促性腺激素(HCG,2 000 U/瓶,上海丽珠制药)6 000 U后34~36 h取卵。
3.IVF-ET及随访:按IVF-ET常规进行取卵、授精、胚胎培养、胚胎评分,选择合适胚胎进行移植,取卵术后当日开始每日肌肉注射黄体酮注射液(20 mg/支,浙江仙琚制药)40 mg或阴道使用黄体酮凝胶(雪诺酮,90 mg/支,默克,美国,)90 mg行黄体支持。移植术后14 d根据血清HCG水平判断是否妊娠;移植术后28 d根据超声检查判断是否为临床妊娠,同时计数孕囊数。
4.观察指标:观察患者的不孕类型、不孕原因,年龄,体重指数(BMI),基础血清FSH、LH、E2、催乳素(PRL)、睾酮(T)水平,窦卵泡数(AFC);促排卵情况及妊娠结局:Gn总量、Gn天数,HCG日E2、P、LH水平,HCG日≥14 mm卵泡数,获卵数,成熟卵母细胞数(MⅡ卵数),受精率,卵裂率,优质胚胎率,临床妊娠情况。
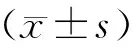
二、结果
1.患者一般情况及DHEA处理前后卵巢储备功能参数比较:55例患者中原发不孕23例,继发不孕32例;IVF指征为输卵管因素39例,子宫内膜异位症8例,不明原因不孕8例。患者处理前的平均年龄为(33.36±4.09)岁,DHEA预处理的平均时间为(72.29±40.57)d。患者前后周期的BMI、基础性激素水平及双侧卵巢AFC比较均无统计学差异(P均>0.05)(表1)。
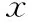
表1 患者行DHEA处理前后一般情况及卵巢功能参数比较(-±s)
2.患者DHEA处理前后促排卵情况及妊娠结局比较:所有患者DHEA预处理前后的Gn总量、Gn天数、HCG日E2、P、LH水平比较,差异均无统计学意义(P均>0.05);处理组HCG日≥14 mm卵泡数、获卵数及MⅡ卵数显著高于处理前组(P<0.05);处理组与处理前组的受精率、卵裂率、优质胚胎数及优质胚胎率比较,差异均无统计学意义(P均>0.05)(表2)。纳入本研究的患者共有9例获得临床妊娠,临床妊娠率为16.36%,其中6例宫内单胎妊娠、2例宫内双胎妊娠、1例输卵管妊娠、1例妊娠8周流产,最终5例单胎活产、1例双胎活产、1例双胎单胎活产。
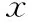
表2 患者DHEA处理前后促排卵情况及妊娠结局比较[(-±s),%]
注:与处理前组比较,*P<0.05
讨 论
如何让DOR患者在ART助孕治疗中获得满意的妊娠结局一直是困扰生殖领域医生的难题,近年在DOR患者中应用雄激素辅助治疗逐渐成为热点,治疗方法包括睾酮凝胶、睾酮贴及DHEA口服等,其中应用最广泛的是DHEA口服[4],但其有效性仍存在一定争议[5]。
DHEA是甾体激素合成的必需底物,体内几乎所有雄激素和雌激素均来自DHEA,其分泌无负反馈调节机制,当机体缺乏DHEA时,可通过外源性给予补充[6]。在外源性Gn诱导排卵期间,DHEA作为雄激素前体可提高卵泡内雄激素浓度,小窦状卵泡中的雄激素浓度对其发育至关重要,Gleicher等[7]纳入213例DOR患者的研究显示,DOR患者血清T水平较低,补充DHEA可提高患者体内T水平。Yeung等[8]对22例原发性卵巢功能不全(POI)患者进行研究发现,口服DHEA后其E2、T及硫酸脱氢表雄酮(DHEA-S)水平均显著高于安慰剂组。本研究显示口服DHEA后血清T水平有增高趋势但差异无统计学意义[(135.43±60.76)nmol/L vs.(128.15±53.20)nmol/L,P>0.05]。田海清等[9]研究认为没有证据支持补充DHEA可以促使DOR女性抗苗勒管激素(AMH)水平升高及FSH水平下降,Yeung等[8]的研究中亦发现原发性卵巢功能不全患者口服DHEA后血清AMH水平和FSH水平差异均无统计学意义(P>0.05)。而宋晖等[10]研究则发现DHEA预处理后FSH值下降,AFC增加,认为DHEA可明显改善DOR患者卵巢储备功能的结论,与聂明月等[11]结论相似。本研究结果显示DHEA预处理后患者FSH没有下降,AFC没有增加,与Agarwal等[12]研究结果相同,提示从理论上讲卵巢衰竭的卵泡池不能恢复,口服DHEA后反映卵巢储备功能的指标并不会改善,但Agarwal等[12]研究结果显示口服DHEA后患者AMH水平升高,其具体的作用机制还需要进一步分析讨论。
本研究结果显示DHEA处理后获卵数、成熟卵数均显著增加(P<0.05),但受精率、卵裂率、优质胚胎数及优质胚胎率与前一周期无显著性差异(P>0.05),提示在DOR患者进行IVF治疗前使用DHEA预处理可能改善DOR患者卵巢反应性,增强促排卵效果。Hyman等[13]研究显示32例DOR患者口服DHEA后获卵数及MⅡ卵数均显著增加,但优质胚胎数差异无统计学意义,本研究结果与其相似;且提出DHEA可能通过减少卵泡闭锁而非增加窦卵泡的募集发挥作用。Kara等[14]研究提示在IVF治疗中添加DHEA并未提高获卵数及卵母细胞的质量,临床妊娠率也没有改善,与Vlahos等[15]前瞻性队列研究结果相似。一般认为增加获卵数及提高卵母细胞质量能增加DOR患者的妊娠率,但是目前关于有效提高DOR患者卵母细胞质量的方法尚无统一结论。本研究显示DHEA预处理后DOR患者仅获卵数增加,但受精率、卵裂率、优质胚胎数及优质胚胎率并未提高,因此,DHEA是否有利于DOR患者IVF-ET的妊娠结局,其发挥作用的具体机制及使用的安全性等尚需后期进一步研究讨论。
本研究仅对本中心某一阶段的治疗进行回顾性分析并对临床资料进行统计分析,可能存在一定的局限性,有待后期进一步设计严谨的多中心大样本前瞻性随机对照实验,为临床应用DHEA辅助治疗提供参考。
[1] 徐阳.女性生育的最佳时期[J].实用妇产科杂志,2016,32:242-244.
[2] Practice Committee of the American Society for Reoroductive Medicine.Aging and infertility in women[J].Fertil Steril,2006,86(5 Suppl 1):S248-S252.
[3] Ferraretti AP,La Marca A,Fauster BC,et al.ESHRE consensus on the definition of “poor response”to ovarian stimulation for in vitro fertilization:the Bologna criteria[J].Hum Reprod,2011,26:1616-1624.
[4] 何嘉欣,叶云,吴日然,等.雄激素在辅助生殖技术中的应用[J].中国优生与遗传杂志,2014,22:131-133.
[5] 许晓璐,刘芸.脱氢表雄酮在卵巢储备功能减退患者中的应用研究进展[J].生殖医学杂志,2017,26:382-386.
[6] 魏代敏,郁琦.脱氢表雄酮在绝经后妇女中的作用[J].协和医学杂志,2013,4:58-62.
[7] Gleicher N,Kim A,Weghofer A,et al.Starting and resulting testosterone levels after androgen supplementation determine at all ages in vitro fertilization(IVF)pregnancy rates in women with diminished ovarian reserve(DOR)[J].J Assist Reprod Genet,2013,30:49-62.
[8] Yeung TW,Li RH,Lee VC,et al.A randomized double-blind placebo-controlled trial on the effect of dehydroepiandrosterone for 16 weeks on ovarian response markers in women with primary ovarian insufficiency[J].J Clin Endocrinol Metab,2013,98:380-388.
[9] 田海清,毛新敏,巩晓芸,等.在IVF中卵巢储备低下患者添加脱氢表雄酮(DHEA)有效性的Meta分析[J].生殖与避孕,2014,34:997-1003.
[10] 宋晖,武雁,田国华,等.脱氢表雄酮预处理对卵巢低反应患者体外受精-胚胎移植结果的影响[J].生殖医学杂志,2015,24:622-625.
[11] 聂明月,杨晓葵,王树玉.脱氢表雄酮对卵巢储备功能降低患者体外受精-胚胎移植结局的影响[J].中国优生与遗传杂志,2014,22:114-116.
[12] Agarwal R,Shruthi R,Radhakrishnan G,et al.Evaluation of dehydroepiandrosterone supplementation on diminished ovarian reserve:a randomized,double-binded,placebo-controlled study[J].J Obstet Gynaecol India,2017,67:137-142.
[13] Hyman JH,Margalioth EJ,Rabinowitz R,et al.DHEA supplementation may improve IVF outcome in poor responders:a proposed mechanism[J].Eur J Obstet Gynecol Reprod Biol,2013 168:49-53.
[14] Kara M,Aydin T,Aran T,et al.Does dehydroepiandrosterone supplementation really affect IVF-ICSI outcome in women with poor ovarian reserve?[J].Eur J Obstet Gynecol Reprod Biol,2014,173:63-65.
[15] Vlahos N,Papalouka M,Triantafyllidou O,et al.Dehydroe-piandrosterone administration before IVF in poor responders:a prospective cohort study[J/OL].Reprod Biomed Online,2015,30:191-196.
[编辑:郭永]
10.3969/j.issn.1004-3845.2017.11.020
2017-04-08;
2017-06-23
福建省自然科学基金(2016J01589)
许晓璐,女,福建漳州人,硕士研究生,医师,妇产科学专业.(*
,Email:liuyunfj@126.com)
