河南省猪、鸡源粪肠球菌的分离鉴定
2017-11-22李金磊狄元冉方忠意高延玲吴志明
于 辉,李金磊,狄元冉,王 丹,董 鹏,方忠意,高延玲,吴志明
(1.河南省动物卫生监督所,河南 郑州 450008;2.河南省兽药饲料监察所;3.焦作市畜产品质量安全监测中心)
实验研究
河南省猪、鸡源粪肠球菌的分离鉴定
于 辉1,李金磊2,狄元冉2,王 丹3,董 鹏2,方忠意2,高延玲2,吴志明2
(1.河南省动物卫生监督所,河南 郑州 450008;2.河南省兽药饲料监察所;3.焦作市畜产品质量安全监测中心)
为了掌握河南省猪、鸡源粪肠球菌的分布情况,从规模化猪、鸡场分别抽取样品300批和180批,通过对细菌的分离培养、纯化,采用PCR和BDPhoenix自动微生物鉴定系统对分离的粪肠球菌进行鉴定.结果共分离菌株254,分离率为52.9%,其中猪源分离率为51.3%(154/300),鸡源分离率为55.6%(100/180).试验结果表明,河南省规模化养殖场鸡源粪肠球菌的分离率高于猪源,为今后的进一步研究提供了数据.
粪肠球菌;分离;鉴定
粪肠球菌是一种革兰氏阳性菌,是重要的条件致病菌[1],广泛分布于自然界中,常栖居于人和动物的肠道中.前期研究认为粪肠球菌是人和动物的共生菌,但近些年来粪肠球菌已逐渐成为人和动物体革兰氏阳性菌感染中仅次于葡萄球菌的第二大病原菌[2].粪肠球菌可以导致动物和人多个脏器的感染,包括皮肤软组织感染、尿路感染、盆腔感染、伤口感染、腹腔感染、心内膜炎、菌血症和心内膜炎脑膜炎[3].在兽医临床研究中,由肠球菌引起的动物疾病日益增多[4],猪和鸡感染粪肠球菌发病以及死亡的报道也越来越多[5].感染猪的肠球菌主要是屎肠球菌和粪肠球菌,它们也是医院里感染的优势菌群,这给人畜临床抗感染治疗带来极大的挑战.因此,对猪、鸡源粪肠球菌的分离、鉴定,掌握其分布情况,对临床防治由该菌引起的感染具有重要意义.该试验从河南省规模化猪、鸡场抽取样品进行粪肠球菌分离、鉴定,以期掌握河南省猪、鸡源粪肠球菌的分布情况,为粪肠球菌的控制预防提供数据支撑.
1 材料与方法
1.1 主要试验材料
1.1.1 菌株
肠球菌标准菌株ATCC29212,购自中国兽医药品监察所.
1.1.2 样品来源
2016年1月至2016年12月抽取河南省A、B、C、D4个地区规模化猪场肛门拭子样品300批,规模化鸡场肛门拭子180批,具体抽样数量见表1.
1.1.3 培养基与试剂
一次性无菌采样棒(BHI)购自郑州君越科莱特健康科技有限公司,革兰氏阳性细菌鉴定板(购自BD公司),K-F链球菌琼脂、营养琼脂、脑心浸液琼脂(购自北京路桥技术有限公司).
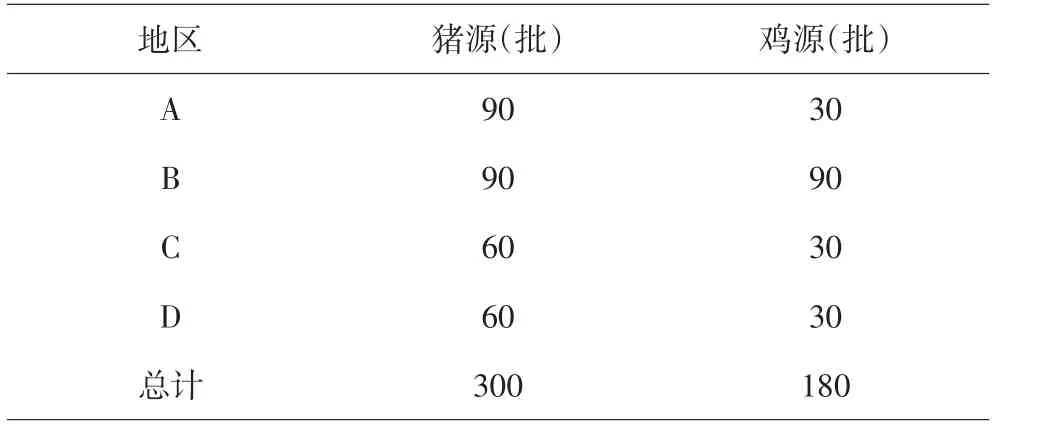
表1 2016年样品抽样数量统计
1.1.4 仪器设备
低温可叠放摇床;细菌浊度仪自动细菌鉴定/药敏系统;梯度PCR仪,凝胶成像系统.
1.1.5 引物
粪肠球菌引物P1:5'-ACTTATGTGACTAAC TTAACC-3',P2:5'-TAATGGTGAATCTTGGTTTG G-3',扩增片段长度为326bp.
1.2 方法
1.2.1 预增菌
将一次性无菌采样棒采集的样品尽快送到实验室,37℃培养16~20h,同时设阳性和阴性对照.
1.2.2 样品的分离、纯化
取预增菌菌液1~2环,划线于K-F链球菌琼脂上,37℃培养16~20h,选取单个典型菌落进行纯化,最后将纯化好的菌落划线接种于营养琼脂培养基.
1.2.3 菌株的鉴定
1.2.3.1 PCR鉴定
用灭菌棉签挑取纯化好的菌落,加入装有无菌生理盐水的1.5ml离心管中,反复冷冻煮沸2~3次,12000rpm离心取上清作为PCR扩增模板.同时设阳性对照、阴性对照和空白对照.
50μl总反应体系为:

预混酶ddH2O P1 P2模板25μl 18μl 1μl 1μl 5μl
反应条件为:95℃预变性5min;95℃变性30s,60℃退火30s,72℃延伸30s,35个循环;72℃后延伸5min;4℃保存.同时设置阳性对照、阴性对照和空白对照.
PCR结束后,取8μlPCR产物,用1.5%琼脂糖进行电泳,15V/cm电泳20~30min,凝胶成像系统观察结果.
1.2.3.2 鉴定系统鉴定
对PCR鉴定为粪肠球菌阳性的样品,取营养琼脂上纯化好的菌落,用稀释液调整到0.5MCF,加入到革兰氏阳性细菌鉴定板中,采用全自动细菌鉴定/药敏系统进一步鉴定.
2 结果
2.1 菌株鉴定结果
经预增菌培养,K-F链球菌琼脂分离纯化,最后经PCR及全自动细菌鉴定/药敏系统鉴定,粪肠球菌在K-F链球菌琼脂上形成暗红色至粉红色菌落,边缘整齐,琼脂表面下菌落呈椭圆或晶体状.
2.2 不同动物来源分离情况
河南地区规模化猪、鸡场共分离粪肠球菌254株,分离率为52.9%(254/480),其中猪源、鸡源分离率分别为51.3%(154/300)、55.6%(100/180).具体情况见表2.
2.3 不同地区分离情况
A、B、C、D四个地区粪肠球菌总体分离率分别为55.0%(66/120)、41.7%(75/180)、66.7%(60/90)、58.9%(53/90),其中A地区猪源、鸡源分离率分别为50.0%(45/90)、70.0%(21/30),B地区猪源、鸡源分离率分别为44.4%(40/90)、38.9%(35/90),C地区猪源、鸡源分离率分别为55.0%(33/60)、90.0%(27/30),D地区猪源、鸡源分离率分别为60.0%(36/60)、56.7%(17/30),具体结果见表2.
3 讨论
该研究通过对河南省规模化猪场、鸡场的粪肠球菌进行分离纯化,鉴定,共分离粪肠球菌254株,分离率52.9%,与赵丽青[6]等研究的山东青岛分离率82.1%和黄雁[7]等研究的福建某鸡场的粪肠球菌分离率为77.8%相比,相对较低,比苏崴艺[8]等从辽宁省鸡场分离率为24.0%要高.这种差异可能是由样品的来源不同所致,也可能是不同地区养殖环境的不同所致.
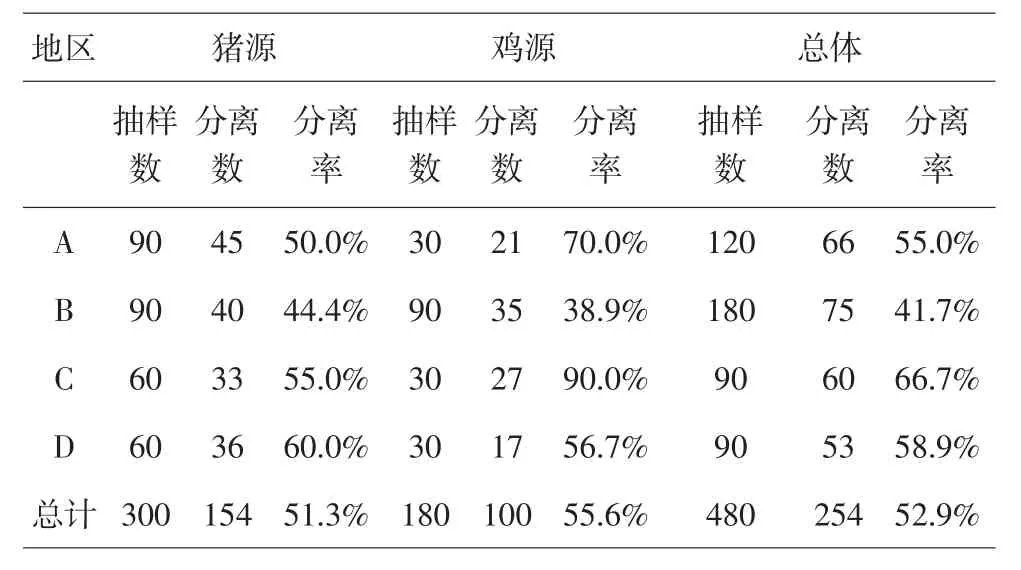
表2 2016年河南省各地区猪、鸡源粪肠球菌分离情况
总体而言,猪源粪肠球菌的分离率51.5%(154/300)比鸡源粪肠球菌的分离率55.6%(100/180)较低.4个地区猪源粪肠球菌分离率最高的是D地区,分离率为60.0%(36/60),其次是C和A地区,分离率分别为55.0%(3/60)和50.0%(45/90),最低的为B地区,分离率为44.4%(40/90);鸡源粪肠球菌分离率最高的是C地区,分离率为90.0%(27/30),其次是A和D地区,分离率分别为70.0%(21/30)和56.7%(17/30),最低的为B地区,分离率为38.9%(35/90);就不同地区不同来源之间来说,A和C地区的鸡源粪肠球菌分离率高于猪源,B和D地区鸡源粪肠球菌的分离率低于猪源.该试验结果表明不同动物来源的粪肠球菌分离率存在差异,不同地区之间粪肠球菌的分离率也存在差异,这种差异可能是由于菌株的偏好所致,也可能是不同地区养殖环境及用药情况不同所致.
该试验通过对河南省猪源、鸡源粪肠球菌的分离、鉴定,初步掌握了猪、鸡源粪肠球菌的分布情况,为下一步制定防控措施提供了数据.
[1]王亚宾,陈丽颖,胡慧,等.猪源粪肠球菌和屎肠球菌多重PCR快速鉴定方法的建立[J].中国兽医学报,2011,31(8):1123-1127.
[2]幸文定.江西部分地区猪源粪肠球菌耐药性及毒力基因检测与分析[D].江西农业大学,2016.
[3]商军,顾欣,张文刚,等.猪、鸡源分离粪肠球菌的核糖体分型及耐药性分析[J].中国抗生素杂志,2017,42(3):230-236.
[4]朱娜,方超,周成捷,等.湖南省猪源肠球菌的分离鉴定[J].湖南畜牧兽医,2016,(2):41-44.
[5]钱晓璐,商军,田恺,等.猪、鸡源分离粪肠球菌的核糖体分型及耐药性分析[J].中国畜牧兽医,2016,43(8):2176-2182.
[6]赵丽青,雷质文,王树峰,等.动物源性肠球菌的分离鉴定及耐药性分析[J].中国动物检疫,2008,25(1):31-32.
[7]黄雁,刘美容.福建某鸡场粪肠球菌耐药情况调查[J].国外畜牧兽医学(猪与禽),2008,(4):91-93.
[8]苏崴艺,李欣南,韩镌竹.某养殖场鸡源粪肠球菌分离鉴定及耐药性研究[J].现代畜牧兽医,2014,(4):48-50.
S852.61+1
B
1004-5090(2017)09-0007-02
2017-07-20)
