酸碱中和滴定曲线图像考点分析
2017-11-22山东省北镇中学2015级17班卢士杰指导教师刘树领
■山东省北镇中学2015级17班 卢士杰(指导教师 刘树领)
酸碱中和滴定曲线图像考点分析
■山东省北镇中学2015级17班 卢士杰(指导教师 刘树领)
酸碱中和滴定是中学化学最重要的定量实验之一,其滴定图像不但能直接体现反应过程、反应体积、溶液酸碱性等功能,而且还隐含着考查数形结合、微观粒子与宏观性质相结合思想的功能。
一、考查电解质的强弱判断
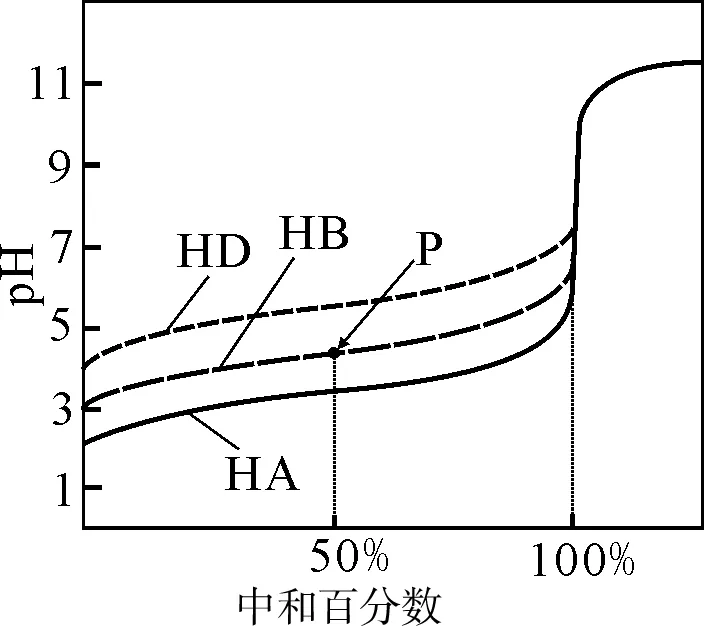
图1
例1室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三 种酸(HA、HB和HD)溶液,滴定的曲线如图1所示,下列判断错误的是( )。
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至 P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
解析:由图像中和百分之百时的pH突跃可知酸性最强的是HA,最弱的是HD,故三种酸的电离常数HA、HB、HD是依次变小的,A项正确。P点对应的溶液中含有NaB、HB两种溶质,且其浓度相等,又因P点时溶液呈酸性,故可知HB的电离程度大于NaB的水解程度,故存在c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),B项正确。由于三种酸完全反应时生成的盐水解程度依次增强,故pH等于7时三种酸消耗的氢氧化钠溶液依次减少,依据电荷守恒可知c(A-)>c(B-)>c(D-),C项错。中和百分数达100%时,属于三种等浓度的钠盐溶液等体积混合,故存在电荷守恒c(A-)+c(B-)+c(D-)+c(OH-)=c(Na+)+c(H+),物料守恒为c(A-)+c(B-)+c(D-)+c(HA)+c(HB)+c(HD)=c(Na+),进而整合消去c(Na+)可得质子守恒式c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),D项正确。
答案:C
二、考查溶液中粒子浓度大小关系
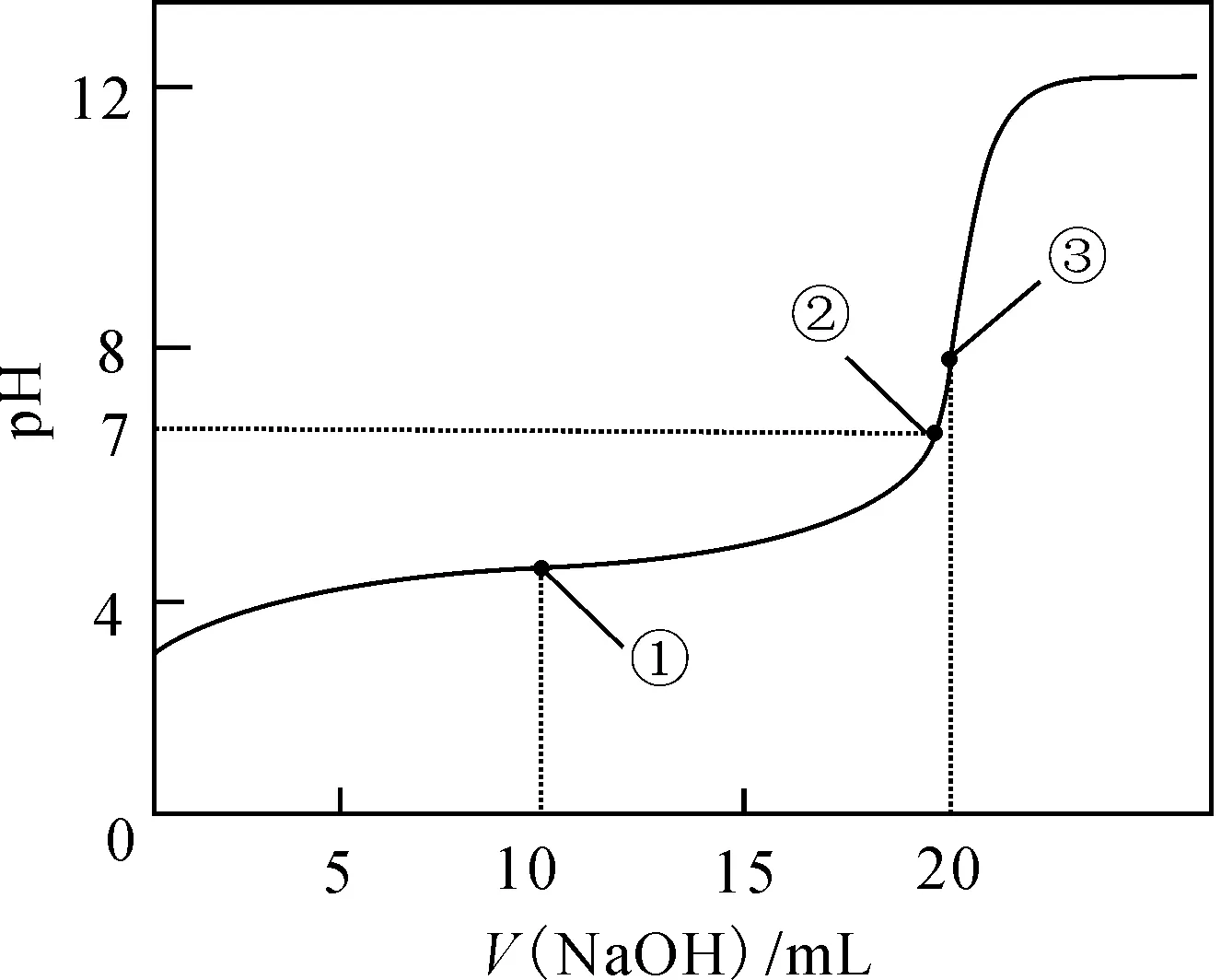
图2
例2常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL 0.1000mol·L-1CH3COOH溶液所得滴定曲线如图2所示。下列说法正确的是( )。
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
解析:这是属于用强碱滴加弱酸的pH图像。点①时溶液含有等浓度的醋酸、醋酸钠,根据电荷守恒c(CH3COO-)+c(OH-)=c(H+)知A项错。因醋酸钠能水解导致溶液呈碱性,在点②时pH=7推知溶液中含有醋酸、醋酸钠,即酸过量,c(Na+)<c(CH3COOH)+c(CH3COO-),故B项错。在点③时说明醋酸与氢氧化钠溶液恰好两者完全反应生成醋酸钠,因醋酸钠水解程度较弱,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C项错。在滴定过程中,可以经过氢氧化钠少、恰好、过量等过程,当氢氧化钠较少量即剩余醋酸远远多于醋酸钠时,则可以出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D项正确。
答案:D
(责任编辑 谢启刚)
