五味子甲素通过ATP结合盒转运子B1逆转胶质瘤干/祖细胞耐药性研究
2017-11-22魏子龙狄冲楼美清赵耀东
魏子龙 狄冲 楼美清 赵耀东
·基础研究·
五味子甲素通过ATP结合盒转运子B1逆转胶质瘤干/祖细胞耐药性研究
魏子龙 狄冲 楼美清 赵耀东
目的探讨五味子甲素对胶质瘤干/祖细胞耐药性的影响及作用机制。方法自人胶质瘤细胞系SHG⁃44中分离培养胶质瘤干/祖细胞SHG⁃44s,予五味子甲素0、12.50、25.00和50.00 μmol/L 联合长春新碱400、800和1200 nmol/L,细胞活性检测试剂盒CCK⁃8细胞毒性实验检测SHG⁃44s细胞增殖活性,罗丹明123染色检测SHG⁃44s细胞泵出药物能力,实时聚合酶链反应(PCR)和Western blotting法检测SHG⁃44s细胞ATP结合盒转运子B1(ABCB1)基因转录和翻译能力。结果五味子甲素50 μmol/L即可抑制SHG⁃44s细胞增殖活性(P=0.001,0.001,0.039),剔除这一浓度后无论长春新碱浓度为400、800或1200 nmol/L,联合应用五味子甲素均可抑制SHG⁃44s细胞增殖活性(长春新碱400 nmol/L组:P=0.007,0.001;长春新碱800 nmol/L组:P=0.001,0.000;长春新碱1200 nmol/L组:P=0.000,0.000)。倒置荧光显微镜观察,五味子甲素12.50 μmol/L组和25.00 μmol/L组SHG⁃44s细胞可见明显绿色荧光。流式细胞术显示,随着五味子甲素浓度的增加,SHG⁃44s细胞罗丹明123染色阳性细胞比例分别为10.40%、39.20%和45.20%。实时PCR法显示,五味子甲素12.50 μmol/L组和25.00 μmol/L组SHG⁃44s细胞ABCB1基因表达水平较 0 μmol/L组降低(P=0.027,0.006),尤以 25.00 μmol/L组显著(P=0.034)。Western blotting法显示,随着五味子甲素浓度的增加,SHG⁃44s细胞P⁃糖蛋白表达水平下降。结论五味子甲素通过抑制胶质瘤干/祖细胞表面已存在的ABCB1基因编码的P⁃糖蛋白泵出药物能力并降低ABCB1基因转录和翻译能力,逆转胶质瘤干/祖细胞耐药性。
五味子素; ATP结合匣式转运子; 神经胶质瘤; 肿瘤干细胞; 药物耐受性; 显微镜检查,荧光; 流式细胞术; 聚合酶链反应; 免疫印迹法; 肿瘤细胞,培养的
胶质瘤是临床最常见的原发性中枢神经系统肿瘤(约占50%),患者预后较差。尽管随着现代医学的发展,胶质瘤诊断与治疗技术有较大提高,但近20年患者预后并未获得显著改善,成为困扰临床医师的难题。近年来,癌症干细胞(CSCs)假说的提出和胶质瘤干/祖细胞(GSPCs)的发现,为胶质瘤的治疗提供新的切入点[1]。研究证实癌症干细胞在肿瘤发生、发展、转移和复发中发挥关键作用[2]。五味子甲素是从五味子果实中分离出来的具有生物活性的木脂素。国内多项研究显示,五味子粗提取物及其有效成分五味子甲素具有逆转肿瘤细胞[3]特别是结肠癌细胞[4]和乳腺癌细胞[5]耐药性的作用。但是对于五味子甲素能否逆转癌症干细胞特别是胶质瘤干/祖细胞耐药性及其作用机制尚不清楚。本研究以胶质瘤干/祖细胞系SHG⁃44s为研究对象,采用细胞活性检测试剂盒(CCK⁃8)细胞毒性实验、罗丹明123(Rhodamine 123)荧光染色、实时聚合酶链反 应(real time⁃PCR)和 免 疫 印 迹 法(Western blotting),探讨五味子甲素对胶质瘤干/祖细胞耐药性的影响及其作用机制。
材料与方法
一、实验材料
1.细胞系来源 人胶质瘤细胞系SHG⁃44购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所,来源于1例32岁女性额叶星形细胞瘤(WHOⅡ~Ⅲ级)患者,经分离、体外培养、鉴定和扩增,传代129代。
2.试剂与仪器 (1)主要试剂:五味子甲素和长春新碱购自上海源叶生物科技有限公司。罗丹明123(20 μg/ml)由上海碧云天生物技术有限公司提供。DMEM/F12无血清培养基(体积比1∶1)、B27培养基添加剂和碱性纤维母细胞生长因子(bFGF,20 ng/ml)均购自美国Gibco公司。表皮生长因子(EGF,20 ng/ml)由美国Invitrogen公司提供。免疫试剂Ⅰ抗工作液中兔抗人CD133单克隆抗体购自美国Bioworld公司,小鼠抗人巢蛋白(Nes)单克隆抗体、兔抗人ATP结合盒转运子B1(ABCB1)单克隆抗体和小鼠抗人β⁃肌动蛋白(β⁃actin)单克隆抗体均购自美国Abcam公司;工作浓度均为1∶1000。山羊抗兔荧光Ⅱ抗和山羊抗小鼠荧光Ⅱ抗购自美国Abcam公司,3H⁃吲哚菁染料Cy3标记的山羊抗兔IgGⅡ抗购自美国BD Biosciences公司,异硫氰酸荧光素(FITC)标记的山羊抗小鼠IgGⅡ抗购自美国Miltenyi Biotec公司,工作浓度均为1∶2500。二氨基联苯胺(DAB)显色试剂盒为北京中杉金桥生物技术有限公司产品。CCK⁃8试剂盒由日本Dojindo化学研究所提供。(2)主要仪器:TCS SP2激光扫描共聚焦显微镜为德国Leica公司产品。XDS⁃220C型倒置相差显微镜购自上海蔡康光学仪器有限公司。Nikon ECLIPSE TE2000⁃U型倒置荧光显微镜购自日本Nikon公司。多功能酶标仪由美国BioTek公司提供。FCASCalibur流式细胞仪为美国BD公司产品。Odyssey红外双色激光成像系统由美国LI⁃COR公司提供。
二、实验方法
1.胶质瘤干/祖细胞分离与培养 将SHG⁃44细胞置于37℃、含5%二氧化碳的饱和湿度培养箱中培养,培养基为含10%胎牛血清(FBS)的DMEM/F12培养基,细胞生长至覆盖培养瓶底部表面大部分(>80%)时,胰蛋白酶消化后传代培养。参照文献[6]方法,将SHG⁃44细胞置于干细胞培养基[含DMEM/F12无血清培养基(体积比1∶1)、B27培养基添加剂(体积比1∶50)、20 ng/ml碱性纤维母细胞生长因子和20 ng/ml表皮生长因子]中培养,以CD133免疫磁珠分离克隆出胶质瘤干/祖细胞SHG⁃44s,并经免疫组织化学检测鉴定。将SHG⁃44s细胞置于37℃、含5%二氧化碳的饱和湿度培养箱中培养,培养基为干细胞培养基。每3天半量换液1次,7~10 d传代1次,于倒置相差显微镜下观察SHG⁃44s细胞形态,传代33代。
2.CCK⁃8细胞毒性实验检测SHG⁃44s细胞增殖活性 当干细胞培养基中SHG⁃44s细胞球生长至约100个细胞时(通常4~5 d),以离心半径5.50 cm、1000 r/min离心5 min,弃上清,培养基重悬细胞,吸管反复吹打,制备单细胞悬液。分别予不同浓度五味子甲素(0、12.50、25.00和50.00 μmol/L共4组),以细胞密度为2×103/100 μl接种于96孔培养板,每组3孔。培养72 h后每孔加入10 μl CCK⁃8试剂,37℃恒温3 h,于450 nm波长处测定光密度值(OD值)。然后将不同浓度五味子甲素组(0、12.50和25.00 μmol/L共3组)进一步分为3个亚组,每亚组各1孔,分别予以不同浓度长春新碱(400、800和1200 nmol/L),共培养72 h,于450 nm波长处测定OD值,代表肿瘤细胞增殖活性。每孔重复3次,取平均值。
3.罗丹明123荧光染色检测SHG⁃44s细胞泵出药物能力 将处于对数生长期的SHG⁃44s细胞制备成100×103/ml的细胞悬液,以细胞密度为200×103/2 ml接种于6孔板,分别予以不同浓度五味子甲素(0、12.50和 25.00 μmol/L),培养 48 h,以离心半径5.50 cm、2000 r/min离心5 min,弃上清液,收集沉淀细胞,吸管反复吹打,制备单细胞悬液。以4℃预冷的磷酸盐缓冲液(PBS)洗涤(×3次),加入40 μg罗丹明123,于37℃孵育30 min,磷酸盐缓冲液洗涤(×2次),流式细胞仪(激发波长488 nm、发射波长525 nm)计数SHG⁃44s细胞中荧光染色阳性细胞比例,倒置荧光显微镜观察SHG⁃44s细胞荧光强度。重复实验3次,取平均值。
4.实时聚合酶链反应检测ABCB1基因表达变化 将处于对数生长期的SHG⁃44s细胞提取RNA,逆转录合成cDNA,进行聚合酶链反应(PCR),ABCB1基 因 上 游 引 物(P1)序 列 :5'⁃AAGGCCTAATGCCGAACACA⁃3'、下游引物(P2)序列:5'⁃GTCTGGCCCTTCTTCACCTC⁃3',内参照物甘油醛⁃3⁃磷酸脱氢酶(GAPDH)上游引物序列:5'⁃ACGGATTTGGTCGTATTGGG⁃3'、下游引物序列:5'⁃CGCTCCTGGAAGATGGTGAT⁃3'。PCR 扩增条件:95℃ 10 min;SYBR GreenⅠ荧光染色反应95℃15 s,60℃ 1 min,共40个循环;溶解曲线分析反应95℃ 15 s,60℃ 1 min,95 ℃ 30 s,60 ℃ 15 s,37 ℃15 min,85℃ 5 s。绘制实时PCR扩增和溶解曲线,计算目的基因相对表达量2-△△Ct,代表ABCB1基因表达水平。重复实验3次,取平均值。
5.Western blotting法检测P⁃糖蛋白表达变化
将处于对数生长期的SHG⁃44s细胞制备成100×103/ml的细胞悬液,以细胞密度为200×103/2 ml接种于6孔板,分别予不同浓度五味子甲素(0、12.50和 25.00 μmol/L),培养 48 h,以离心半径 5.50 cm、2000 r/min离心5 min,弃上清液,收集沉淀细胞,向细胞沉淀中加预冷的含蛋白酶抑制剂苯甲基磺酰氟(PMSF)的细胞裂解液RIPA,0℃冰浴5~10 min,冰上超声2 min,以12 000×g离心10 min,收集上清液,即为P⁃糖蛋白(P⁃gp)。目标蛋白行十二烷基磺酸钠⁃聚苯稀酰胺凝胶电泳(SDS⁃PAGE),湿转至聚偏二氟乙烯(PVDF)膜,以质量分数为5%脱脂奶粉封闭PVDF膜1 h,滴加兔抗人ABCB1单克隆抗体(1∶1000)1 ml,4℃孵育过夜,TBST洗膜(×3次),滴加山羊抗兔 IgGⅡ抗(1∶2500)2 ml,孵育 1 h,TBST洗膜(×3次),电化学发光(ECL)显色,Odyssey红外双色激光成像系统检测目标蛋白电泳条带。重复实验3次,取平均值。
6.统计分析方法 采用SPSS 20.0统计软件进行数据处理与分析。计量资料以均数±标准差(x±s)表示,采用单因素方差分析,两两比较行SNK⁃q检验。以P≤0.05为差异具有统计学意义。

表1 不同浓度五味子甲素组SHG⁃44s细胞增殖活性的比较(x± s,OD450nm)Table 1. Comparison of proliferative activity of SHG⁃44s cells among different concentrations of schizandrin A(x±s,OD450nm)
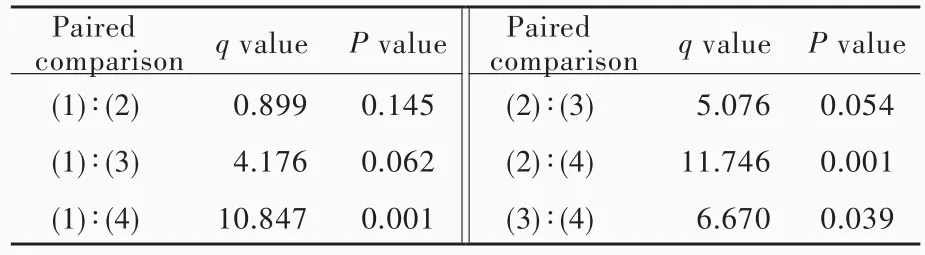
表2 不同浓度五味子甲素组SHG⁃44s细胞增殖活性的两两比较Table 2. Paired comparison of proliferative activity of SHG ⁃44s cells among different concentrations of schizandrin A
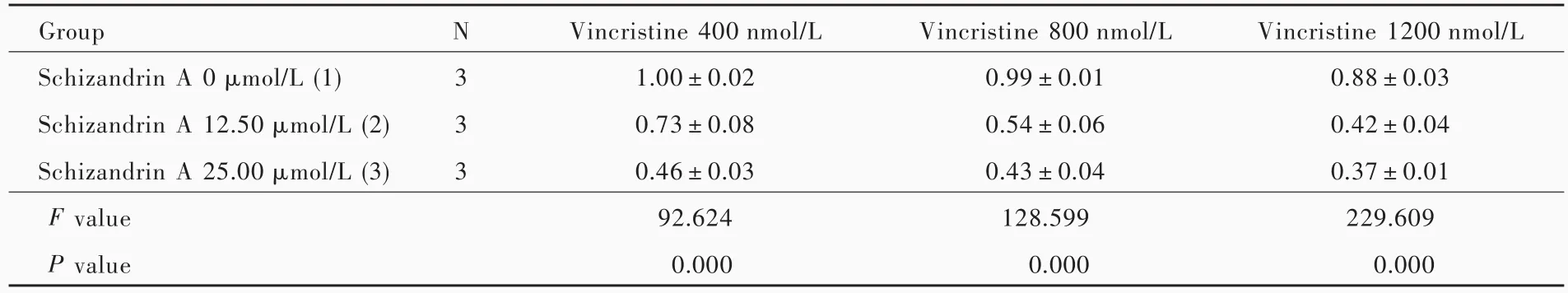
表3 不同浓度五味子甲素联合长春新碱亚组SHG⁃44s细胞增殖活性的比较(x±s,OD450nm)Table 3. Comparison of proliferative activity of SHG⁃44s cells among different concentrations of schizandrin A and vincristine(x±s,OD450nm)
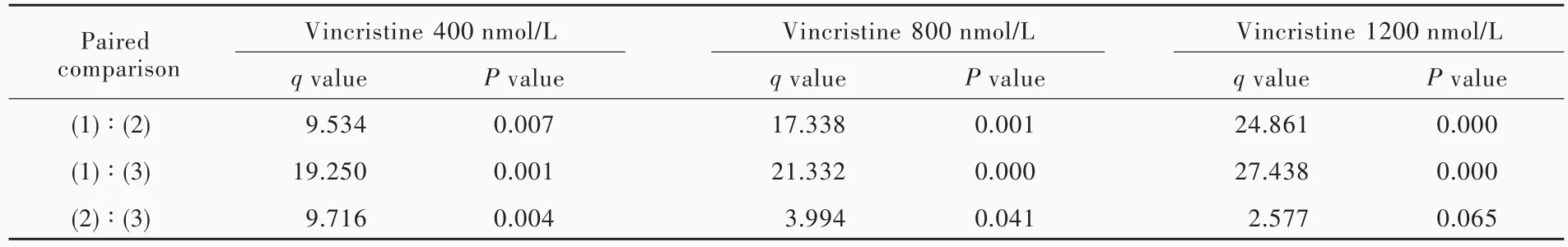
表4 不同浓度五味子甲素联合长春新碱亚组SHG⁃44s细胞增殖活性的两两比较Table 4. Paired comparison of proliferative activity of SHG⁃44s cells among different concentrations of schizandrin A combining with vincristine
结 果
一、胶质瘤干/祖细胞增殖活性
以含不同浓度五味子甲素的干细胞培养基培养SHG⁃44s细胞,结果显示,五味子甲素50 μmol/L即可抑制SHG⁃44s细胞增殖活性(P=0.001,0.001,0.039;表1,2)。因此,后续的研究剔除五味子甲素50 μmol/L组,以排除自身毒性作用。将不同浓度五味子甲素(0、12.50和 25.00 μ mol/L)和长春新碱(400、800和 1200 nmol/L)共同作用于 SHG⁃44s细胞,结果显示,无论长春新碱浓度为400、800或1200 nmol/L,联合五味子甲素均可以抑制SHG⁃44s细胞增殖活性(长春新碱400 nmol/L组:P=0.007,0.001;长春新碱 800 nmol/L 组:P=0.001,0.000;长春新碱1200 nmol/L组:P=0.000,0.000;表3,4)。
二、胶质瘤干/祖细胞泵出药物能力
罗丹明123是一种能够穿透细胞膜并在细胞内蓄积的荧光染料,其荧光强度可以反映肿瘤细胞经药泵蛋白泵出药物能力。倒置荧光显微镜观察显示,五味子甲素0 μmol/L组SHG⁃44s细胞罕见绿色荧光,五味子甲素12.50 μmol/L组和25.00 μmol/L组SHG⁃44s细胞可见明显绿色荧光(图1a~1c)。流式细胞术显示,五味子甲素 0 μmol/L 组、12.50 μmol/L组和25.00 μmol/L组SHG⁃44s细胞罗丹明 123染色阳性细胞比例逐渐增加,分别为10.40%、39.20%和45.20%(图2a~2c)。
三、胶质瘤干/祖细胞ABCB1基因转录和翻译能力
实时PCR法显示,与五味子甲素0 μmol/L组相比,五味子甲素 12.50 μmol/L 组和 25.00 μmol/L 组SHG⁃44s细胞ABCB1基因表达水平降低(P=0.027,0.006),尤以五味子甲素 25.00 μmol/L组显著(P=0.034),表明随着五味子甲素浓度的增加,对ABCB1基因的抑制作用逐渐增强(表5,6)。Western blotting法显示,随着五味子甲素浓度的增加(0、12.50和 25.00 μmol/L),SHG⁃44s细胞 P⁃糖蛋白表达水平逐渐降低(图3)。
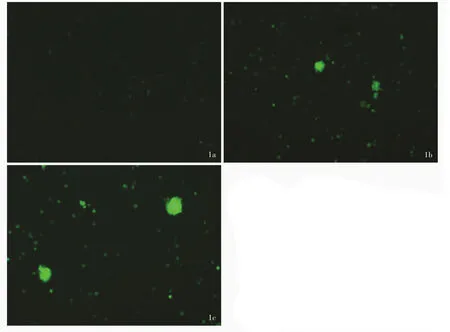
图1 倒置荧光显微镜观察所见 罗丹明123染色 ×100 1a 五味子甲素0 μmol/L组SHG⁃44s细胞罕见绿色荧光 1b 五味子甲素12.50 μmol/L组SHG⁃44s细胞可见绿色荧光 1c 五味子甲素25.00 μmol/L组SHG⁃44s细胞可见明显绿色荧光Figure 1 Inverted fluorescence microscopy findings Rhodamine 123 staining ×100 SHG⁃44s cells rarely showed green fluorescence in schizandrin A 0 μ mol/L group (Panel 1a). SHG ⁃44s cells showed green fluorescence in schizandrin A 12.50 μ mol/L group(Panel 1b).SHG⁃44s cells showed obvious green fluorescence in schizandrin A 25.00 μmol/L group(Panel 1c).
讨 论
胶质瘤是临床常见的原发性中枢神经系统肿瘤,约占中枢神经系统肿瘤的50%,预后较差。随着癌症干细胞理论的提出和研究的深入,目前认为癌症干细胞是恶性肿瘤复发的根源,其中重要特征是放射治疗耐受性和多药耐药性(MDR)[2]。多药耐药性系指细胞对作用不同的药物具有抗药性现象。导致癌症干细胞多药耐药性的原因有多种,除因其常处于G0期外,还与ATP结合盒(ABC)转运蛋白高表达以及凋亡和自噬减弱等机制有关[7⁃10]。ABC转运蛋白是跨膜蛋白,是介导多药耐药性家族的重要一员,通过ATP释放的能量将药物转运至细胞外,避免细胞毒性作用[11]。目前与多药耐药性有关的ABC转运蛋白主要包括乳腺癌耐药蛋白(BCRP/ABCG2)、多药耐药相关蛋白(MRP)和 P⁃糖蛋白,是肿瘤多药耐药性中最关键的途径[12⁃13],其中,ABCB1蛋白介导的多药耐药性机制最为重要。ABCB1蛋白作为药物泵,可以将多种药物泵出细胞外,使细胞内药物蓄积减少,减轻细胞毒性作用,从而产生多药耐药性[14]。
国内多项研究显示,五味子粗提取物及其有效成分五味子甲素具有逆转耐药性的作用[3⁃4],但是对于五味子甲素能否逆转肿瘤干/祖细胞(TSPCs)尤其是胶质瘤干/祖细胞耐药性及其作用机制尚不清楚。本研究结果显示,低浓度五味子甲素(0、12.50和25.00 μmol/L)对SHG⁃44s细胞未产生明显的增殖抑制作用,当五味子甲素达50 μmol/L时方表现出增殖抑制作用,因此本研究采用低浓度五味子甲素(0、12.50和25.00 μmol/L)进行实验。CCK⁃8细胞毒性实验显示,SHG⁃44s细胞在五味子甲素和长春新碱联合作用下较单纯长春新碱增殖活性明显下降,表明五味子甲素可以部分逆转SHG⁃44s细胞对化疗药物的耐药性。
多数细胞可以蓄积荧光染料,如Hoechst 33342和罗丹明123。ABC转运蛋白如ABCG2和ABCB1蛋白可以通过泵出药物作用,将二者像化疗药物一样泵出细胞外而使细胞不着色,与普通细胞分离。这些不着色的肿瘤细胞称为侧群细胞(SP细胞),研究证实多种肿瘤细胞中均存在侧群细胞[15]。本研究对不同浓度五味子甲素组SHG⁃44s细胞进行罗丹明123染色,倒置荧光显微镜观察和流式细胞术显示,随着五味子甲素浓度的增加,SHG⁃44s细胞荧光强度增加、荧光染色阳性细胞比例增加,表明五味子甲素可以抑制ABCB1蛋白泵出药物能力。
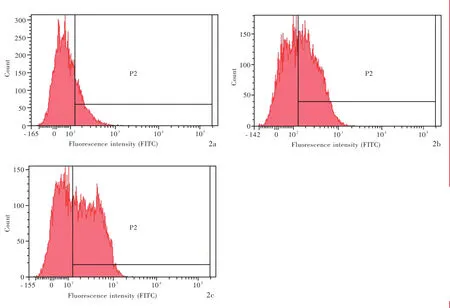
图2 流式细胞术所见 2a 五味子甲素0 μmol/L组SHG⁃44s细胞罗丹明123染色阳性细胞比例为10.40% 2b 五味子甲素12.50 μmol/L组SHG⁃44s细胞罗丹明123染色阳性细胞比例为39.20% 2c 五味子甲素25.00 μmol/L组SHG⁃44s细胞罗丹明123染色阳性细胞比例为45.20%Figure 2 Flow cytometry findings The percentage of positive SHG⁃44s cells by Rhodamine 123 staining was 10.40% in schizandrin A 0 μ mol/L group(Panel 2a). The percentage of positive SHG⁃44s cells by Rhodamine 123 staining was 39.20%in schizandrin A 12.50 μmol/L group(Panel 2b).The percentage of positive SHG⁃44s cells by Rhodamine 123 staining was 45.20%in schizandrin A 25.00 μmol/L group(Panel 2c).

图3 Western blotting法显示,随着五味子甲素浓度的增加(0、12.50和 25.00 μmol/L),SHG⁃44s细胞 P⁃糖蛋白表达水平逐渐降低Figure 3 Western blotting showed that the expression of P⁃gp in SHG⁃44s cells was gradually decreased with the increasing of schizandrin A concentration(0,12.50 and 25.00 μmol/L).

表5 不同浓度五味子甲素组SHG⁃44s细胞ABCB1基因表达水平的比较(x±s)Table 5. Comparison of ABCB1 expression in SHG⁃44s cells among different concentrations of schizandrin A(x±s)
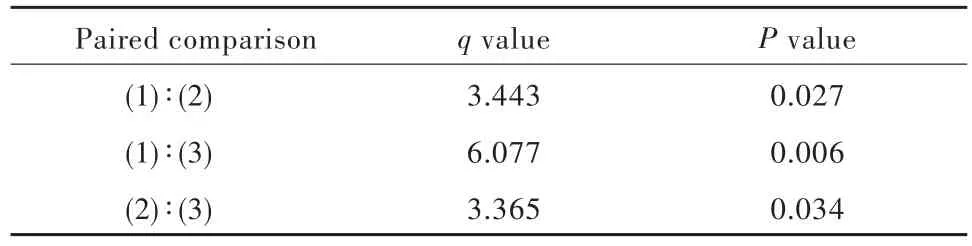
表6 不同浓度五味子甲素组SHG⁃44s细胞ABCB1基因表达水平的两两比较Table 6. Paired comparison of ABCB1 gene expression in SHG⁃44s cells among different concentrations of schizandrin A
本研究采用实时PCR和Western blotting法对ABCB1基因及其编码的P⁃糖蛋白表达变化进行检测,结果显示,予五味子甲素后SHG⁃44s细胞ABCB1基因转录和翻译能力均下降。研究显示,尼卡地平作为多药耐药基因ABCG2的作用底物具有逆转其功能的作用[13,16]。五味子甲素通过抑制胶质瘤干/祖细胞表面已存在的ABCB1基因编码的P⁃糖蛋白泵出药物能力并降低ABCB1基因转录和翻译能力,从而发挥逆转胶质瘤干/祖细胞耐药性的作用。尼卡地平与五味子甲素联合作用是否能够进一步提高胶质瘤疗效尚待进一步研究。
综上所述,五味子甲素可以抑制胶质瘤干/祖细胞表面已存在的ABCB1基因编码的P⁃糖蛋白泵出药物能力,还可以通过降低ABCB1基因转录和翻译能力,进一步逆转胶质瘤干/祖细胞的耐药性。
[1]Singh SK,Clarke ID,Terasaki M,Bonn VE,Hawkins C,Squire J,Dirks PB.Identification of a cancer stem cell in human brain tumors.Cancer Res,2003,63:5821⁃5828.
[2]Kelly PN,Dakic A,Adams JM,Nutt SL,Strasser A.Tumor growth need not be driven by rare cancer stem cells.Science,2007,317:337.
[3]Qin XQ,Liang YG,Gao HZ,Qu HY,Dong RH,Wu XW,Li HY,Liu ZY.Reversing mechanism of schizandrin A on multi⁃drug resistance of K562/ADR,HL60/ADR,MCF⁃7/ADR cell lines.Zhongguo Yao Li Xue Tong Bao,2011,27:329⁃333[.秦小清,梁宇光,高洪志,曲恒燕,董瑞华,吴行伟,李海燕,刘泽源.五味子甲素对K562/ADR、HL60/ADR、MCF⁃7/ADR多药耐药逆转机制的研究.中国药理学通报,2011,27:329⁃333.]
[4]Jin XD,Xu QL,Zheng XZ,Zhang XD,Liu GL,Sun W.Reversaleffectofγ ⁃schisandrin compound on multidrug resistance of human carcinoma of colon cell THC⁃8307.Yi Xue Zong Shu,2011,17:1552⁃1554[.金秀东,徐秋玲,郑学芝,张绪东,刘桂莲,孙卫.复方五味子素B逆转多药耐药性人结肠癌细胞 THC⁃8307.医学综述,2011,17:1552⁃1554.]
[5]Li L,Wang T,Xu ZL,Yu Y,Chen W,Chen F.Effects of schisandrin B on reversing multidrug resistance in human breast cancer cells transfected with mdr1 gene.Zhonghua Yi Xue Za Zhi,2005,85:1633⁃1637[.李凌,王弢,许志良,俞颖,陈卫,陈菲.五味子乙素对转染多药耐药1基因的MCF⁃7细胞的多药耐药逆转作用.中华医学杂志,2005,85:1633⁃1637.]
[6]Wang JP,Huang Q,Zhang QB,Dong J,Zhu YD,Wang AD,Lan Q.Isolation and preliminary identification of brain tumor stem cells in human glioma cell line SHG⁃44.Zhongguo Zhong Liu Lin Chuang,2005,32:604⁃610[.王金鹏,黄强,张全斌,董军,朱玉德,王爱东,兰青.人脑胶质瘤干细胞SHG⁃44s的克隆及初步鉴定.中国肿瘤临床,2005,32:604⁃610.]
[7]Zhang HY,Dou J.Targeted therapeutic strategy aiming at multidrug resistance genes in tumor stem cells.Sheng Wu Ji Shu Tong Xun,2011,22:269⁃272[.张洪义,窦骏.瞄准肿瘤干细胞多药耐药性基因的靶向治疗策略.生物技术通讯,2011,22:269⁃272.]
[8]Zhao YD,Zhang QB,Lou MQ,Huang Q.Research ofPTENmutation in glioma stem/progenitor cells.Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2010,10:646⁃651[.赵耀东,张全斌,楼美清,黄强.PTEN在胶质瘤干/祖细胞中变异状态的研究.中国现代神经疾病杂志,2010,10:646⁃651.]
[9]Zhao YD,Wei ZL,Zhang QB,Lou MQ,Huang Q.Adenovirus⁃mediated wild⁃typePTENpromote glioma stem/progenitor cells autophagy activity.Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2013,13:425⁃430[.赵耀东,魏子龙,张全斌,楼美清,黄强.腺病毒介导野生型PTEN促进胶质瘤干/祖细胞自噬活性的实验研究.中国现代神经疾病杂志,2013,13:425⁃430.]
[10]Jeong CB,Kim HS,Kang HM,Lee YH,Zhou B,Choe J,Lee JS.Genome⁃wide identification of ATP⁃binding cassette(ABC)transportersand conservation of theirxenobiotictransporter function in the monogonont rotifer(Brachionus koreanus).Comp Biochem Physiol Part D Genomics Proteomics,2017,21:17⁃26.
[11]Donnenberg VS,Donnenberg AD.Multiple drug resistance in cancerrevisited:the cancerstem cellhypothesis.J Clin Pharmacol,2005,45:872⁃877.
[12]Takara K,Sakaeda T,Okumura K.An update on overcoming MDR1⁃mediated multidrug resistance in cancer chemotherapy.Curr Pharm Des,2006,12:273⁃286.
[13]Jin Y,Bin ZQ,Qiang H,Liang C,Hua C,Jun D,Dong WA,QingL.ABCG2 isrelated with thegradeofgliomaand resistance to mitoxantone,a chemotherapeutic drug for glioma.J Cancer Res Clin Oncol,2009,135:1369⁃1376.
[14]Lopes⁃Rodrigues V,Oliveira A,Correia⁃da⁃Silva M,Pinto M,Lima RT,Sousa E,VasconcelosMH.A novelcurcumin derivative which inhibits P⁃glycoprotein,arrests cell cycle and induces apoptosis in multidrug resistance cells.Bioorg Med Chem,2017,25:581⁃596.
[15]Loo TW,Bartlett MC,Clarke DM.Nucleotide binding,ATP hydrolysis,and mutation of the catalytic carboxylates of human P⁃glycoprotein cause distinct conformational changes in the transmembrane segments.Biochemistry,2007,46:9328⁃9336.
[16]Lou M,Zhao Y.Satisfactory therapy resultsofcombining nimustine with nicardipine against glioma at advanced stage.J Cancer Res Ther,2015,11:1030.
Study on schizandrin A reversing drug resistance of glioma stem/progenitor cells by ATP binding cassette subfamily B member 1
WEI Zi⁃long1,DI Chong2,LOU Mei⁃qing3,ZHAO Yao⁃dong3
1Department of Neurosurgery,Shanghai Pudong Hospital,Shanghai 201399,China
2Department of Intensive Care Unit,the Affiliated Hospital of Xuzhou Medical University,Xuzhou 221002,Jiangsu,China
3Department of Neurosurgery,Shanghai General Hospital,Shanghai 200080,China
Corresponding author:ZHAO Yao⁃dong(Email:zhaoyd@aliyun.com)
ObjectiveTo investigate the effect of schizandrin A on drug resistance of glioma stem/progenitor cells(GSPCs)and its mechanism.MethodsIsolate and culture SHG⁃44s cells from human glioma cell line SHG⁃44.The SHG⁃44s cells were treated with different concentrations of schizandrin A(0,12.50,25.00 and 50.00 μmol/L)and vincristine(400,800 and 1200 nmol/L).The cell proliferative activity was measured by cell counting kit⁃8(CCK⁃8)assay.Rhodamine 123 staining was used to detect the drug delivery ability of SHG⁃44s cells. The transcription and translation ability of ATP binding cassette subfamily B member 1(ABCB1)gene of SHG⁃44s cells was detected by real⁃time polymerase chain reaction(PCR)and Western blotting.ResultsThe proliferative activity of SHG⁃44s cells was inhibited when the concentration of schizandrin A was 50 μmol/L(P=0.001,0.001,0.039),so this concentration was removed in the follow⁃up study.No matter the concentration of vincristine was 400,800 or 1200 nmol/L,combining with schizandrin A could inhibit the proliferative activity of SHG⁃44s cells(vincristine 400 nmol/L:P=0.007,0.001;vincristine 800 nmol/L:P=0.001,0.000;vincristine 1200 nmol/L:P=0.000,0.000).Inverted fluorescence microscopy findings showed SHG ⁃44s cells in the group of schizandrin A 0 μ mol/L rarely revealed green fluorescence,while SHG ⁃44s cells in the groups of schizandrin A 12.50 and 25.00 μ mol/L presented obvious green fluorescence.Flow cytometry showed that with the increasing of schizandrin A concentration,the percentage of positive cells by Rhodamine 123 staining was 10.40%,39.20% and 45.20%,respectively.Real⁃time PCR showed thatABCB1gene expression levels of SHG⁃44s cells in schizandrin A 12.50 μ mol/L group and 25.00 μ mol/L group were significantly decreased comparing with schizandrin A 0 μ mol/L group(P=0.027,0.006),especially in schizandrin A 25.00 μ mol/L group(P=0.034).Western blotting showed that the expression level of P⁃glycoprotein(P⁃gp)in SHG⁃44s cells was gradually decreased with the increasing of schizandrin A concentration.ConclusionsSchizandrin A can inhibit the drug delivery ability of P⁃gp coded byABCB1gene existing in the surface of GSPCs.It can further reverse the drug resistance of GSPCs by reducing the transcription and translation ofABCB1gene.
Schizandrin; ATP ⁃binding cassette transporters; Glioma; Neoplastic stem cells;Drug tolerance; Microscopy, fluorescence; Flow cytometry; Polymerase chain reaction;Immunoblotting; Tumor cells,cultured
10.3969/j.issn.1672⁃6731.2017.06.009
上海市卫生和计划生育委员会科研课题(项目编号:201540412);上海市浦东医院基金资助项目(项目编号:201313);上海市浦东医院2012年度优秀人才“南菁奖”项目
201399上海市浦东医院神经外科(魏子龙);221002徐州医科大学附属医院重症医学科(狄冲);200080上海市第一人民医院神经外科(楼美清,赵耀东)
赵耀东(Email:zhaoyd@aliyun.com)
This study was supported by Scientific Research Project of Shanghai Municipal Commission of Health and Family Planning(No.201540412),Funded Project of Shanghai Pudong Hospital(No.201313)and Personnel Training Program"Nanjing Award 2012"of Shanghai Pudong Hospital.
2017⁃05⁃08)
