暗示策略对帕金森病患者平衡功能和步态的康复作用
2017-11-22崔立玲于洋朱志中李雅晴侯玮佳王利群陈荣杰
崔立玲 于洋 朱志中 李雅晴 侯玮佳 王利群 陈荣杰
暗示策略对帕金森病患者平衡功能和步态的康复作用
崔立玲 于洋 朱志中 李雅晴 侯玮佳 王利群 陈荣杰
目的探讨暗示策略对帕金森病患者平衡功能和步态的康复作用。方法共40例原发性帕金森病患者随机接受常规抗帕金森病药物治疗和常规康复训练以及在此基础上联合暗示策略,分别于训练前和训练4周时采用Berg平衡量表(BBS)、10米步行试验(10MWT)、起立⁃行走计时测验(TUGT)和冻结步态问卷(FOGQ)评价平衡功能和步态,10MWT计算步长和步速。结果与训练前相比,训练4周时两组患者BBS评分(P=0.000)、10MWT之步长(P=0.000)和步速(P=0.000)均增加,TUGT时间(P=0.000)和FOGQ评分(P=0.000)减少;与对照组相比,观察组患者仅10MWT之步长(P=0.048)和步速(P=0.025)均增加、TUGT时间(P=0.023)和FOGQ评分(P=0.034)减少。结论常规康复训练联合暗示策略可以明显改善帕金森病患者平衡功能和步态,尤其对步态的康复治疗效果优于常规康复训练。
帕金森病; 步态; 提示; 康复
帕金森病(PD)是常见于中老年人群的以黑质多巴胺能神经元变性和路易小体(LB)形成为病理学特征的神经变性病,患病率随年龄增长而逐渐增加,目前全球有(7~ 10)× 106例帕金森病患者[1]。临床以静止性震颤、肌强直、运动迟缓和姿势步态障碍为主要特征[2],姿势不稳和步态异常可以导致患者跌倒或少动,使日常生活活动能力(ADL)和参与能力明显下降,医疗费用明显增加[3]。疾病早期以拟多巴胺类药治疗为主,长期治疗药物疗效减退或出现严重症状波动和异动症时,考虑神经核团毁损术或脑深部电刺激术(DBS)[2]。药物治疗和手术治疗对静止性震颤和肌强直有明显改善作用,而对姿势不稳和步态异常无明显疗效[4],康复治疗作为帕金森病辅助治疗方法对改善姿势步态障碍有一定作用[5]。本研究旨在探讨暗示策略对帕金森病患者平衡功能和步态的康复作用。
资料与方法
一、临床资料
1.纳入标准 (1)帕金森病的诊断均符合国际运动障碍学会(MDS)帕金森病临床诊断标准[6],且具有帕金森病典型症状与体征。(2)Hoehn⁃Yahr分级3级,可独立行走。(3)简易智能状态检查量表(MMSE)评价无明显认知功能障碍,能够与医务人员进行有效沟通和交流。(4)本研究经天津市环湖医院道德伦理委员会审核批准,所有患者或其家属均知情同意并签署知情同意书。
2.排除标准 (1)继发性帕金森病或帕金森叠加综合征。(2)既往有明确中枢神经系统疾病或颅脑手术史。(3)伴双下肢肌肉、骨骼或周围神经病变。(4)伴认知功能障碍或精神症状。(5)伴视觉或听觉障碍。(6)既往有药物或酒精滥用史。(7)依从性差不能配合试验。
3.一般资料 选择2014年1月-2016年6月在天津市环湖医院神经内科和康复医学科门诊就诊的原发性帕金森病患者共计40例,男性20例,女性20例;年龄50~73岁,平均(60.38±6.80)岁;身高148.50~177.10 cm,平均(163.70±7.76)cm;体重40.13~74.18 kg,平均(59.15±11.51)kg;受教育程度2~18年,平均(10.18±3.80)年;病程3~11年,平均(6.13±2.48)年;统一帕金森病评价量表第三部分(UPDRSⅢ)评分18~35分,平均(27.53±3.70)分;MMSE评分24~29分,平均(26.25±1.77)分;左旋多巴等效剂量(LED)124~718 mg/d,中位剂量304.00(210.50,496.00)mg/d。
二、研究方法
1.常规治疗 所有患者均接受规范化、个体化抗帕金森病药物治疗、健康宣教、饮食指导和心理治疗等,病情和药物疗效稳定后即开始康复训练,由经过专业培训的康复治疗师进行一对一训练,主要包括肌肉牵伸训练、关节活动度训练、姿势矫正训练、耐力训练、呼吸功能训练、平衡功能训练和行走能力训练等,每天30 min、每周5 d,持续4周;同时对照料者进行指导,确保患者每天户外活动(如散步、打太极拳、骑脚踏车、社区健身器材等有氧运动)累计时间≥2 h。
2.暗示策略 采用随机数字表法将患者随机分为两组,对照组仅予上述常规治疗,观察组在此基础上联合暗示策略,包括节奏性重复暗示和一次性暗示。(1)节奏性重复暗示:主要用于行走能力训练,又分为听觉暗示和视觉暗示。听觉暗示嘱患者随节拍器的节拍迈步,其节奏取决于患者10米步行试验(10MWT)的基础步频(采用90%基础步频进行训练并根据具体情况适当调整)。视觉暗示以长16 m、宽4.80 cm的蓝色胶带在地板上粘贴一条直线,以多条长120 cm、宽4.80 cm、厚0.30 cm的绿色防滑橡胶条垂直置于蓝色胶带上,并使其中点与蓝色胶带重合,各条绿色橡胶条之间间隔为150%基础步长并根据具体情况适当调整,以不超过50 cm为限;嘱患者沿蓝色胶带行走,并根据绿色橡胶条迈步。(2)一次性暗示:主要用于平衡功能训练,尤其是运动起始或发生冻结步态时,又分为听觉暗示、视觉暗示和认知暗示。听觉暗示要求患者数第3个数时开始迈步。视觉暗示要求患者跨越地板上某个物体时开始迈步。认知暗示系指在患者行走过程中予以暗示,如将注意力集中于目的地或远方物体,而非要穿越的门。暗示策略每天30 min、每周5 d,持续4周。
3.平衡功能和步态评价 所有患者分别于训练前和训练4周时由同一位康复医师在疾病“开”期采用Berg平衡量表(BBS)评价平衡功能,10MWT试验、起立⁃行走计时测验(TUGT)和冻结步态问卷(FOGQ)评价步态[7],10MWT 试验计算步长和步速。(1)BBS量表:包括14个动作,每个动作分为0~4分共5级,总评分56分,评分越低、平衡功能越差。(2)10MWT试验:以长16 m、宽4.80 cm的蓝色胶带在地板上粘贴一条直线,并标记起点、3和13 m点、终点;嘱患者以最快、最稳的步态自起点行走至终点,记录自3 m行走至13 m所用时间和步数(起止各留3 m以消除加速和减速的影响),重复3次,每次测验之间休息2~5 min,取3次测验中时间最短的一次,并计算10MWT试验之步长[步长(m)=10/步数]和步速[步速(m/s)=10/时间]。(3)TUGT测验:于起点放置一把有扶手的靠背座椅(椅座高约45 cm、扶手高约20 cm),于终点粘贴蓝色胶带,起点至终点距离为3 m;嘱患者背靠椅背坐在椅子上,听到“开始”口令后,站起并按平时步态行走至终点,再转身返回起点并坐下,记录患者所用时间。(4)FOGQ问卷:评价近1个月步态异常情况,包括状态最差时行走,步态困难影响日常生活和独立性,行走、转弯或启动时感觉双脚粘在地板上,冻结事件最长时间,启动困难持续时间,转弯时冻结事件持续时间共6项内容,每项评分0~4分,总评分24分,评分越高、冻结步态越严重。
4.统计分析方法 采用SPSS 21.0统计软件进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验。呈正态分布的计量资料以均数±标准差(x±s)表示,行两独立样本的t检验;两组患者训练前后平衡功能和步态的比较采用前后测量设计的方差分析。呈非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,采用Mann⁃WhitneyU检验。以P≤0.05为差异具有统计学意义。
结 果
一、一般资料的比较
40例患者按照康复训练方法的不同分为对照组和观察组。(1)对照组:20例患者,男性12例,女性8例;年龄50~73岁,平均(60.45±6.59)岁;身高148.50~177.10 cm,平均(163.44±8.19)cm;体重40.44~71.90 kg,平均(59.34±11.70)kg;受教育程度2~18年,平均(10.10±3.93)年;病程3~11年,平均(6.05±2.68)年;入院时UPDRSⅢ评分22~33分,平均为(27.55±3.10)分;MMSE评分为24~29分,平均为(26.10±1.80)分;左旋多巴等效剂量为124~690 mg/d,中位剂量 245.50(210.50,523.50)mg/d。(2)观察组:共20例患者,男性11例,女性9例;年龄50~72岁,平均(60.30±7.18)岁;身高 150.00~176.90 cm,平均(163.96±7.50)cm;体重 40.13~74.18 kg,平均为(58.96±11.61)kg;受教育程度2~17年,平均(10.25±3.75)年;病程3~10年,平均(6.20±2.33)年;入院时UPDRSⅢ评分为18~35分,平均为(27.50±4.30)分;MMSE评分为24~29分,平均为(26.40±1.76)分;左旋多巴等效剂量为150~718 mg/d,中位剂量 350.00(211.75,476.00)mg/d。两组患者一般资料比较,差异无统计学意义(均P>0.05,表1),均衡可比。
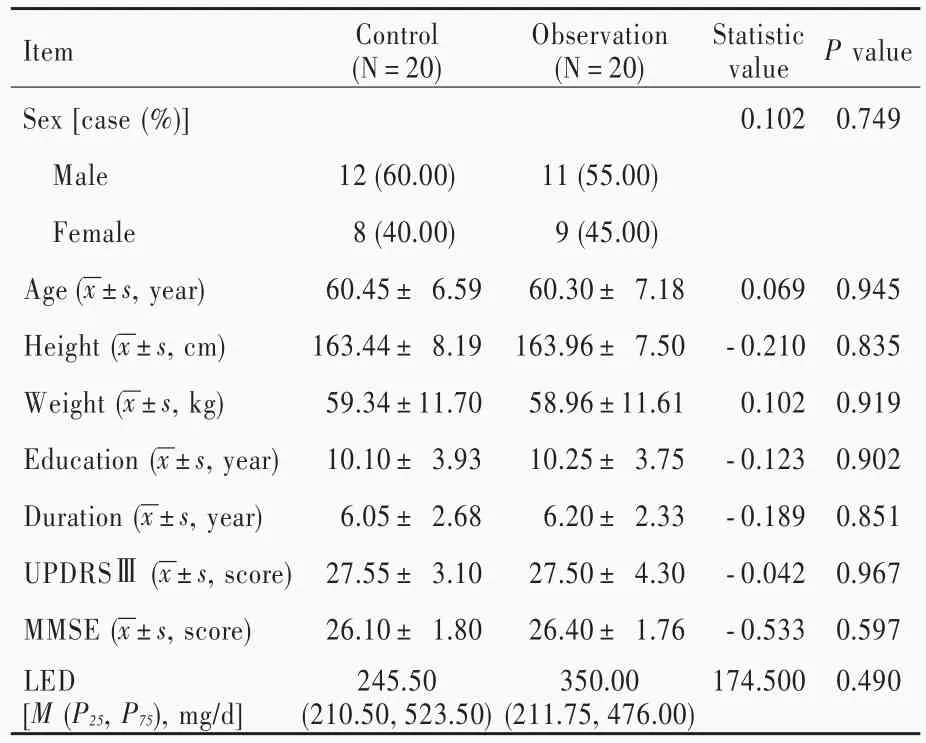
表1 两组患者一般资料的比较Table 1. Comparison of general data between 2 groups
二、平衡功能和步态的比较
与训练前相比,训练4周时患者BBS评分增加(P=0.000),表明常规康复训练及在此基础上联合暗示策略均可以改善帕金森病患者平衡功能;而两组患者BBS评分差异无统计学意义(P=0.775),表明暗示策略并未较常规康复训练显著改善帕金森病患者平衡功能(表2,3)。与训练前相比,训练4周时10MWT之步长(P=0.000)和步速(P=0.000)增加,TUGT时间(P=0.000)和FOGQ评分(P=0.000)减少,表明常规康复训练及在此基础上联合暗示策略均可以改善帕金森病患者步态;与对照组相比,观察组患者10MWT之步长(P=0.048)和步速(P=0.025)增加、TUGT时间(P=0.023)和 FOGQ 评分(P=0.034)减少,表明暗示策略较常规康复训练能够显著改善帕金森病患者步态(表4,5)。
讨 论
平衡功能是机体调整运动状态或维持某一姿势的能力,是维持正常体位、完成各种转移和行走的基础。完整对称的人体结构、正常的感觉输入、中枢神经系统的整合、正常的肌力和肌张力等,对平衡功能的维持具有重要作用。行走需要良好的平衡功能不断调整身体重心于双足支持范围内,以防止跌倒。帕金森病患者站立时重心不稳,向两侧偏移增大;行走时重心前倾缺乏足跟着地动作,促进慌张步态[8]。康复训练应注重调整重心,纠正双足外侧缘承重增高。本研究采用重复性视觉暗示,要求患者沿地面上蓝色胶带行走,使患者自发调整重心于中线上,减少两侧重心偏移,提高行走时平衡功能;要求患者根据地面上绿色橡胶条迈步,通过增加步长,使患者足跟先着地,克服重心前倾,从而改善慌张步态。训练4周时两组患者BBS评分较训练前增加,为行走能力训练打下基础;但两组患者BBS评分差异未达到统计学意义,考虑与样本量较小、治疗时间较短和影响平衡的因素较多有关。
步态是一种复杂、有节奏的周期性运动,需同时具备平衡功能和执行复杂运动的能力。慌张步态是帕金森病患者逐渐出现的不可避免症状,表现为头部前倾、躯干俯屈、摆臂减小、步幅减小、步频加快,有时难以停止[9]。随着病情进展,步长和步速逐渐变小、变慢[10]。帕金森病患者基底神经节功能紊乱可能导致节律性运动障碍[11],从而需要额外的认知功能参与控制运动[12]。在无外部暗示的情况下,内部暗示信号通过基底神经节⁃辅助运动区(SMA)⁃皮质运动前区环路传入运动程序,这种程序在中间运动区(包含辅助运动区和皮质运动区)执行;运动过程中感觉信息(如本体感觉)经脊髓小脑束、脊髓丘脑束、脊髓网状束和脊髓下丘脑束反馈给大脑,调节基底神经节⁃辅助运动区⁃皮质运动前区环路的生物钟,帮助计划和预测下一步任务[13]。帕金森病患者步态的运动程序似乎是完整的,但是由于生物钟紊乱,在缺乏外部暗示的情况下,运动程序不易执行[14]。外部的节奏性重复暗示包括视觉暗示和听觉暗示,替代紊乱的生物钟产生内部暗示[15],绕过受损的基底神经节,诱发运动感觉反馈信号,重新校准内部步调,从而改善步态。这种正确的短暂性步调一经确立,经基底神经节⁃辅助运动区⁃皮质运动前区环路加强,患者即使在缺乏外部暗示的情况下也可以长期维持改善的步态。有研究显示,听觉暗示频率低于或高于10%基础步频均可改善Hoehn⁃Yahr分级3级的帕金森病患者步长和步速[10]。本研究考虑到 Hoehn⁃Yahr分级 3 级患者易发生慌张步态,有时迈步后以极小的步伐越走越快,不能及时停止,故将听觉暗示频率设置为90%基础步频,并根据步态适当调整。亦有研究显示,帕金森病患者步长仅是同龄正常人群的一半[16],正常人群平均步长约为50 cm[17];基于上述两点,我们将绿色橡胶条间距设置为150%基础步长,并根据步态适当调整,上限为50 cm。经过4周康复训练,两组患者步长和步速均有改善,可能与外部暗示重新校准内部步调有关。此外,患者在进行TUGT测验时,需完成坐站转移、行走(加速、稳定和减速阶段)和转身等动作,可以充分反映帕金森病患者平衡功能和行走能力,表明暗示策略可以显著改善帕金森病患者平衡功能和行走能力。
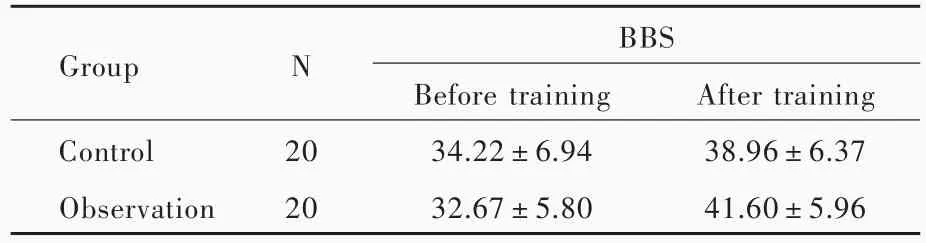
表2 两组患者训练前后平衡功能的比较(x±s,评分)Table 2. Comparison of balance function before and after training between 2 groups(x±s,score)
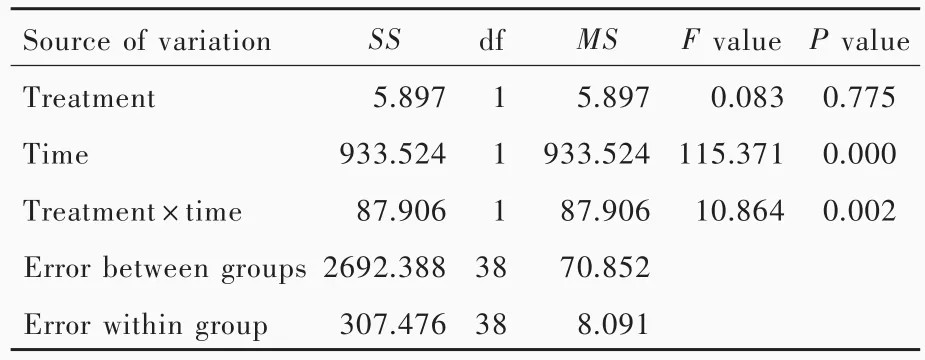
表3 两组患者训练前后平衡功能的前后测量设计的方差分析表Table 3. ANOVA of premeasure⁃postmeasure design for balance function before and after training in 2 groups

表4 两组患者训练前后步态的比较(x±s)Table 4. Comparison of gait before and after training between 2 groups(x±s)
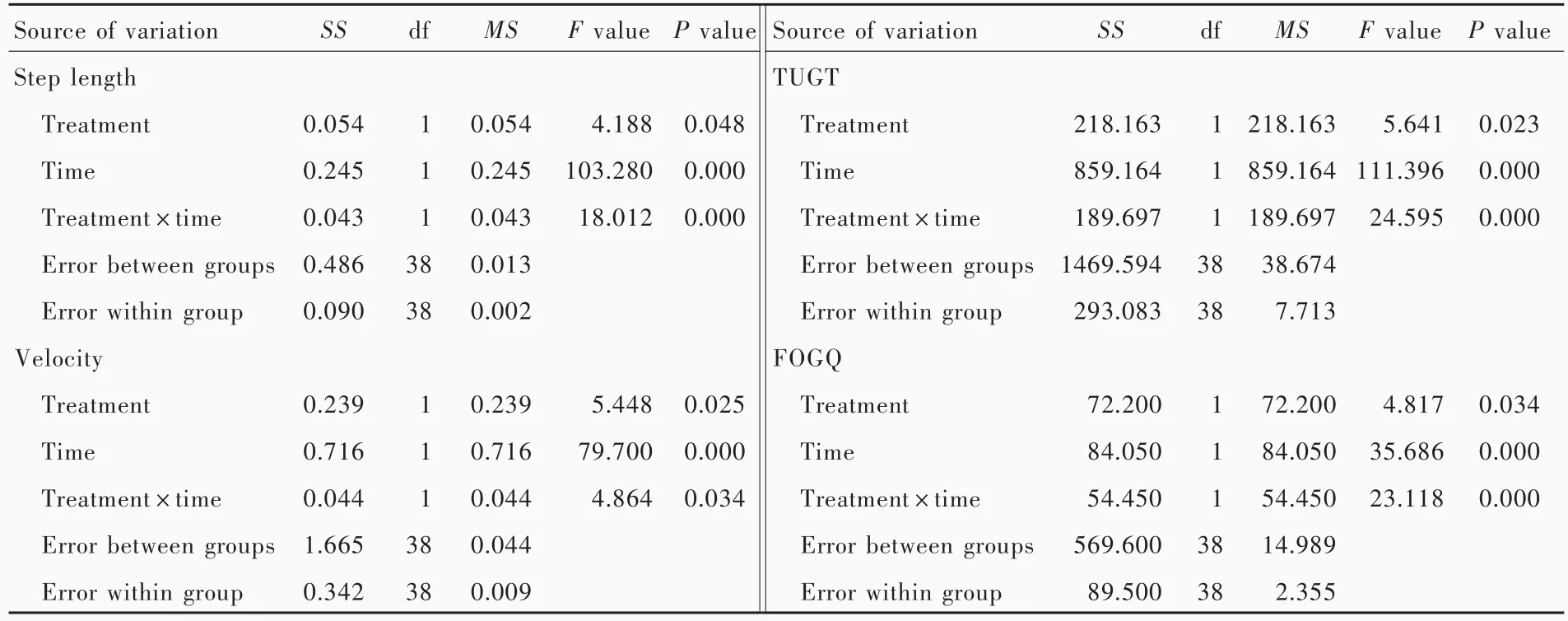
表5 两组患者训练前后步态的前后测量设计的方差分析表Table 5. ANOVA for premeasure⁃postmeasure design of gait before and after training in 2 groups
冻结步态作为一种短暂性、发作性步态紊乱,突然发生,不可预知。临床常表现为启动犹豫、迈步困难,在启动、转身、接近目的地和穿过狭窄过道时易触发,患者常主诉双脚粘在地面上,严重影响行走,甚至发生跌倒或骨折。Lewis和Barker[18]提出帕金森病冻结步态的病理生理学模型,纹状体多巴胺缺失抑制脚桥核(PPN)活性、提高基底神经节输出核团[苍白球内侧部(GPi)/黑质网状部(SNr)]活性,苍白球内侧部/黑质网状部过度活动反过来进一步抑制脚桥核活性[19],导致冻结步态;在感觉和(或)认知信息超负荷情况下,运动、认知和边缘系统在解剖上的会聚、功能上的整合可以引起脚桥核过多的阵发性抑制,触发冻结步态。行走过程中集中注意力可以抑制冻结步态,分散注意力可以触发冻结步态[20]。本研究通过视觉暗示、听觉暗示和认知暗示,使患者将注意力集中于运动起始和行走过程中,避免冻结步态的发生。经过4周康复训练,两组患者FOGQ评分减少,可能与上述调控机制有关。
综上所述,暗示策略可以改善帕金森病患者平衡功能和步态,显著增加步长、提高步速、减少冻结步态,进而提高行走能力。然而本研究样本量较小、治疗时间较短且影响平衡功能和步态的因素较多,常规康复训练及在此基础上联合暗示策略均可以改善帕金森病患者平衡功能,但暗示策略疗效并未优于常规康复训练。因此,在后续研究中我们进一步增加样本量、延长治疗时间、严格入组标准、细化治疗方案,进一步验证暗示策略对帕金森病患者平衡功能的疗效,将其更好地用于康复训练。
近年来,随着现代电子信息技术的发展和生物反馈疗法的应用,联合多种感觉刺激的暗示方法层出不穷,如 Google眼镜[21]、帕金森病鞋[22]、虚拟脚踏车[23]、智能手机软件[24]等,对帕金森病患者的康复训练具有较好疗效。今后我们也将逐渐引入这些新的暗示方法,用于帕金森病的康复治疗。
[1]Lauzé M,Daneault JF,Duval C.The effects of physical activity in Parkinson's disease:a review.J Parkinsons Dis,2016,6:685⁃698.
[2]Wu J,Jia JP.Neurology.3rd ed.Beijing:People's Medical Publishing House,2016:291⁃299[.吴江,贾建平.神经病学.3版.北京:人民卫生出版社,2016:291⁃299.]
[3]Chen JJ.Parkinson's disease:health⁃related quality of life,economic cost,and implications of early treatment.Am J Manag Care,2010,16 Suppl Implications:87⁃93.
[4]Pötter⁃Nerger M,Volkmann J.Deep brain stimulation for gait and postural symptoms in Parkinson's disease.Mov Disord,2013,28:1609⁃1615.
[5]Abbruzzese G, Marchese R, Avanzino L, Pelosin E.Rehabilitation forParkinson's disease:currentoutlook and future challenges.Parkinsonism Relat Disord,2016,22 Suppl 1:60⁃64.
[6]Postuma RB,Berg D,Stern M,Poewe W,Olanow CW,Oertel W,Obeso J,Marek K,Litvan I,Lang AE,Halliday G,Goetz CG,Gasser T,Dubois B,Chan P,Bloem BR,Adler CH,Deuschl G.MDS clinical diagnostic criteria for Parkinson's disease.Mov Disord,2015,30:1591⁃1601.
[7]Giladi N,Shabtai H,Simon ES,Biran S,Tal J,Korczyn AD.Construction of freezing of gait questionnaire for patients with Parkinsonism.Parkinsonism Relat Disord,2000,6:165⁃170.
[8]Chen SF,Mao YR,Li YX,Fan H,Chen X.Plantar pressure measurement in patients with Parkinson's disease and targeted rehabilitation protocols.Zhongguo Kang Fu Yi Xue Za Zhi,2015,30:985⁃989[.陈淑芳,毛玉瑢,李咏雪,范豪,陈曦.足底压力分析在帕金森病患者运动训练中的应用.中国康复医学杂志,2015,30:985⁃989.]
[9]Gui HW,Liu J.Gait disorders:classification,diagnosis and treatment.Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2011,11:18⁃21[.桂慧雯,刘军.步态障碍的分类与诊断治疗.中国现代神经疾病杂志,2011,11:18⁃21.]
[10]Arias P,Cudeiro J.Effects of rhythmic sensory stimulation(auditory,visual)on gait in Parkinson's disease patients.Exp Brain Res,2008,186:589⁃601.
[11]te Woerd ES,Oostenveld R,Bloem BR,de Lange FP,Praamstra P.Effects ofrhythmic stimulus presentation on oscillatory brain activity: the physiology of cueing in Parkinson's disease.Neuroimage Clin,2015,9:300⁃309.
[12]Maidan I,Nieuwhof F,Bernad⁃Elazari H,Reelick MF,Bloem BR,GiladiN,Deutsch JE,HausdorffJM,Claassen JA,Mirelman A.The role of the frontal lobe in complex walking among patientswith Parkinson'sdisease and healthy older adults:an fNIRS study.Neurorehabil Neural Repair,2016,30:963⁃971.
[13]AshooriA,Eagleman DM,Jankovic J.Effectsofauditory rhythm and music on gait disturbances in Parkinson's disease.Front Neurol,2015,6:234.
[14]Patel N,Jankovic J,Hallett M.Sensory aspects of movement disorders.Lancet Neurol,2014,13:100⁃112.
[15]Nombela C,Hughes LE,Owen AM,Grahn JA.Into the groove:can rhythm influence Parkinson's disease?Neurosci Biobehav Rev,2013,37:2564⁃2570.
[16]Knutsson E.An analysis of Parkinsonian gait.Brain,1972,95:475⁃486.
[17]Stuart S,Galna B,Lord S,Rochester L.A protocol to examine vision and gait in Parkinson's disease:impact of cognition and response to visual cues.F1000Res,2015,4:1379.
[18]Lewis SJ,Barker RA.A pathophysiological model of freezing of gait in Parkinson's disease.Parkinsonism Relat Disord,2009,15:333⁃338.
[19]Wang TH.Physiology.3rd ed.Beijing:People's Medical Publishing House,2015:491⁃493[.王庭槐.生理学.3版.北京: 人民卫生出版社,2015:491⁃493.]
[20]Giladi N,Hausdorff JM.The role of mental function in the pathogenesis of freezing of gait in Parkinson's disease.J Neurol Sci,2006,248:173⁃176.
[21]Zhao Y,Nonnekes J,Storcken EJ,Janssen S,van Wegen EE,Bloem BR,Dorresteijn LD,van Vugt JP,Heida T,van Wezel RJ.Feasibility of external rhythmic cueing with the Google Glass for improving gait in people with Parkinson's disease.J Neurol,2016,263:1156⁃1165.
[22]Winfree KN,Pretzer⁃Aboff I,Hilgart D,Aggarwal R,Behari M,Agrawal S.An untethered shoe with vibratory feedback for improving gait of Parkinson's patients:the PDShoe.Conf Proc IEEE Eng Med Biol Soc,2012:1202⁃1205.
[23]Gallagher R,Damodaran H,Werner WG,Powell W,Deutsch JE.Auditory and visual cueing modulate cycling speed of older adults and persons with Parkinson's disease in a Virtual Cycling(V⁃Cycle)system.J Neuroeng Rehabil,2016,13:77.
[24]Ellis RJ,Ng YS,Zhu S,Tan DM,Anderson B,Schlaug G,Wang Y.A validated smartphone⁃based assessment of gait and gait variability in Parkinson's disease.PLoS One,2015,10:E0141694.
2017⁃04⁃12)
中英文对照名词词汇(四)
糖基化终产物受体
receptor for advanced glycation end products(RAGE)
体感诱发电位somatosensory⁃evoked potential(SEP)
同型半胱氨酸 homocysteine(Hcy)
统一多系统萎缩评价量表
Unified Multiple System Atrophy Rating Scale(UMSARS)
统一帕金森病评价量表
Unified Parkinson's Disease Rating Scale(UPDRS)
α⁃突触核蛋白 α⁃synuclein(α⁃Syn)
18F⁃脱氧葡萄糖18F⁃fluoro⁃2⁃deoxy⁃D⁃glucose(18F⁃FDG)
稳态视觉诱发电位
steady state visual⁃evoked potential(SSVEP)
相对达峰时间 relative time to peak(rTTP)
相对脑血流量 relative cerebral blood flow(rCBF)
相对脑血容量 relative cerebral blood volume(rCBV)
相对平均通过时间 relative mean transmit time(rMTT)
心理神经肌肉理论 psychoneuromuscular theory(PM)
兴趣区region of interest(ROI)
虚拟现实 virtual reality(VR)
血管内皮生长因子
vascular endothelial growth factor(VEGF)
血管外细胞外间隙 extravascular extracellular space(EES)
血⁃脑屏障 blood⁃brain barrier(BBB)
烟雾病 moyamoya disease(MMD)
氧摄取分数 oxygen extraction fraction(OEF)
一氧化氮合酶 nitric oxide synthase(NOS)
胰岛素样生长因子⁃1 insulin⁃like growth factor⁃1(IGF⁃1)
以帕金森综合征为主要表现的多系统萎缩
multiple system atrophy with parkinsonism⁃predominant
(MSA⁃P)
异硫氰酸荧光素 fluorescein isothiocyanate(FITC)
肿瘤干/祖细胞 tumor stem/progenitor cells(TSPCs)
肿瘤坏死因子⁃α tumor necrosis factor⁃α(TNF⁃α)
转化生长因子⁃β transforming growth factor⁃β(TGF⁃β)
转铁蛋白 transferrin(TF)
转铁蛋白饱和度 transferrin saturation(TS)
最大密度投影 maximum intensity projection(MIP)
左旋多巴等效剂量 levodopa equivalent dose(LED)
Rehabilitation effect of cueing strategies on balance function and gait in patients with Parkinson's disease
CUI Li⁃ling1,YU Yang1,ZHU Zhi⁃zhong1,LI Ya⁃qing1,HOU Wei⁃jia1,WANG Li⁃qun1,CHEN Rong⁃jie21Department of Rehabilitation Medicine,2Department of Neurology,Tianjin Huanhu Hospital,
Tianjin 300350,China
Corresponding author:YU Yang(Email:tjhuanhu@163.com)
ObjectiveTo explore the effect of cueing strategies on balance function and gait in patients with Parkinson's disease(PD).MethodsA total of 40 PD patients were randomly divided into control group(N=20)and observation group(N=20).The patients in control group
routine drug treatment and rehabilitation therapy according to the disease.The patients in observation group received rhythmic recurring cues and one⁃off cues on the basis of routine treatment. All patients were given rehabilitation therapy for 4 weeks(30 minutes,5 times a week).Berg Balance Scale(BBS),10⁃Meter Walk Test(10MWT),Timed Up and Go Test(TUGT)and Freezing of Gait Questionnaire(FOGQ)were used to evaluate balance function and gait of patients before and after 4⁃week training.10MWT was used to calculate step length and velocity.ResultsAfter 4⁃week training,BBS score(P=0.000),step length(P=0.000)and velocity(P=0.000)of 10MWT were significantly increased,while TUGT time(P=0.000)and FOGQ score(P=0.000)were significantly reduced in both groups.Compared with control group,step length(P=0.048)and velocity(P=0.025)of 10MWT were significantly increased,while TUGT time(P=0.023)and FOGQ score(P=0.034)had a significant decrease in observation group.ConclusionsBoth routine rehabilitation therapy and cueing strategies can improve the balance function and gait of PD patients,but cueing strategies had better effect on gait than routine rehabilitation therapy.
Parkinson disease; Gait; Cues; Rehabilitation
10.3969/j.issn.1672⁃6731.2017.06.007
300350天津市环湖医院康复医学科(崔立玲、于洋、朱志中、李雅晴、侯玮佳、王利群),神经内科(陈荣杰)
于洋(Email:tjhuanhu@163.com)
