高速逆流色谱法分离制备金银木叶中芦丁
2017-11-21,
,
(山西大学生命科学学院,山西太原 030006)
高速逆流色谱法分离制备金银木叶中芦丁
李晨,宁丽娜
(山西大学生命科学学院,山西太原 030006)
应用高速逆流色谱法分离制备金银木叶中的芦丁,经过选择优化,确定以乙酸乙酯-正丁醇-水(5∶2∶5,v∶v)为两相溶剂系统,以上相为固定相,下相为流动相,在主机转速800 r/min,流速2 mL/min,检测波长256 nm条件下进行分离制备,得到4个分离组分。对所得分离产物进行高效液相检测,发现组分II为芦丁,其纯度达到96%以上,得率为10.7%。本实验从金银木叶中分离制备芦丁,方法简便,所得产物纯度高,为进一步扩大金银木的开发应用提供了理论依据。
金银木叶,芦丁,高速逆流色谱
金银木(LoniceramaackiiMaxim)是忍冬科忍冬属的落叶灌木,具有优良的观花、观果价值,在我国种植十分广泛。目前,人们已从忍冬属植物中发现多种化学成分,如黄酮类、有机酸及三萜类等[1]。忍冬属一些植物的花如金银花具有营养保健作用,果实含有必需微量元素及不饱和脂肪酸等营养成分[2]。因此,对忍冬属植物资源的开发具有广阔的市场。金银木全株可入药,具有清热解毒、杀菌消炎之功效[3]。研究发现金银木含有黄酮类化合物,在不同生长期金银木的花、叶、果中均含有芦丁,其中尤以金银木叶中含量为最高,其含量甚至高于传统药材金银花叶子中芦丁含量[4-5]。芦丁又名芸香甙,维生素P,属于黄酮类物质,其化学结构如图1。芦丁等黄酮类物质具有抗氧化、清除自由基、降糖降脂等多种作用,在保健食品或药品等领域应用前景广泛[6-8]。目前,对金银木叶总黄酮的提取工艺已有研究[9],但有关金银木叶黄酮类物质分离制备的研究尚未见报道。
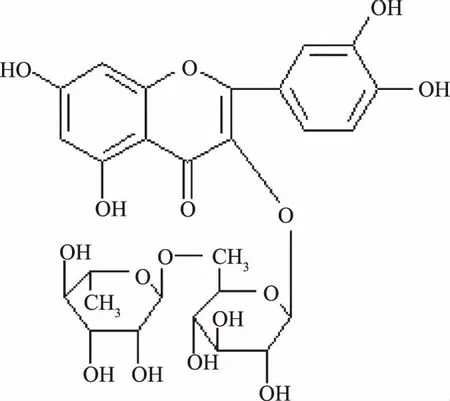
图1 芦丁的化学结构Fig.1 Chemical structure of rutin
高速逆流色谱(high speed counter-current chromatography HSCCC)为液液分配色谱,无需固体载体,不会发生样品的不可逆吸附等作用,具有样品回收完全、成本低、仪器操作简单等优点,近年来在天然产物、食品分离、生物制药等领域得到了广泛应用和关注[10-11]。宋学英等建立了从白芍粗提物中分离纯化五没食子酰基葡萄糖的HSCCC方法[12],石雪萍等应用HSCCC分离制备花椒中的黄酮化合物[13],朱琳等应用HSCCC法分离苦荞中的芦丁和槲皮素[14]。本研究采用高速逆流色谱分离金银木叶中的一种黄酮成分芦丁,有利于进一步研究金银木的药效及其机理,以期为更好地开发金银木的应用提供理论依据。
1 材料与方法
1.1材料与仪器
金银木叶(山西大学植物学孔冬梅老师鉴定,为金银木金银属,LoniceramaackiiMaxim) 采于山西大学校园内;芦丁标准品 纯度98%,上海生工生物工程股份有限公司;氯仿、正己烷、乙酸乙酯、甲醇、乙醇、磷酸 分析纯,高效液相色谱所用的甲醇为色谱纯,天津市化学试剂二厂;水 二次蒸馏水。
1.2实验方法
1.2.1 金银木叶粗提物的制备 采集新鲜金银木叶,清水冲洗干净后,自然阴干。用中药粉碎机粉碎,过40目筛。称取10.000 g粉末置于具塞锥形瓶中,按液料比25∶1加入70%(v∶v)乙醇溶液,于65 ℃水浴锅中提取1 h,12000 r/min离心20 min,取上清,重复提取三次。合并提取液后于旋转蒸发仪上浓缩,得到棕褐色粘稠浸膏。向浸膏中加入100 mL乙酸乙酯,于65 ℃水浴中超声波提取30 min,超声波功率为250 W,趁热过滤,取上清,旋转蒸发后,得到黄色粉末即为金银木叶粗提物,4 ℃避光保存备用[5]。
1.2.2 高效液相色谱分析条件 色谱柱:大连依利特HYPERSILC18柱(4.6 mm×250 mm,5 μm),流动相为甲醇-0.4%磷酸(体积比50∶50),流速为1.0 mL/min,柱温为25 ℃,检测波长256 nm。
精密配制20、40、60、80、100、120 μg/mL芦丁标准溶液,分别取10 μL进样,以浓度x (μg/mL)为横坐标,峰面积Y(A)为纵坐标绘制标准曲线,计算回归方程。
取一定量金银木叶提取物,用甲醇溶解,0.22 μm针头过滤器过滤后,进行HPLC分析。
1.2.3 高速逆流色谱溶剂系统的选择 参考高速逆流色谱分离黄酮类化合物的相关报道及芦丁的性质选择两相体系[15],如乙酸乙酯、正己烷、甲醇、正丁醇和水等,按照一定比例混合配制溶剂体系(见表1),通过高效液相色谱测定芦丁在不同体系中的分配系数K,筛选K值在0.5~2.0的溶剂系统用于高速逆流色谱[16]。
分配系数的测定[17]:分别取10.0 mL上相和下相溶液于分液漏斗中,加入10 mg金银木叶粗提物,充分剧烈振摇,静置至分配平衡后,分别各取4.0 mL上相和下相溶液减压旋干后用1 mL甲醇溶解,过0.22 μm滤膜,按照方法1.2.2用HPLC测定芦丁在两相中的峰面积,并按照公式K=Su/Sd计算分配系数K。其中,Su和Sd分别为芦丁在上相和下相溶剂中的HPLC峰面积。
1.2.4 高速逆流色谱法分离制备金银木叶中黄酮化合物芦丁 配制乙酸乙酯-正丁醇-水(5∶2∶5,v∶v)两相溶剂系统,于分液漏斗中充分振摇后在室温下静置12 h。分离上相和下相,分别进行超声脱气30 min,冷却。以10 mL/min的流速将上相泵入主机。待HSCCC分离管中充满上相后,再以2 mL/min的流速泵入下相,同时调整主机转速为800 r/min。待流动相流出后,两相在分离管中已达到动态平衡。开启AKTA prime检测系统,设置检测波长为254 nm,采集数据,待基线平稳后,上样。取样品100 mg,用等量上下相液体(各5 mL)溶解,由进样阀上样,记录色谱图,收集各分离组分。
2 结果与讨论
2.1芦丁标准品及金银木叶粗提物HPLC谱图
图2(A)为芦丁标准品的HPLC色谱图,图2(B)为金银木叶粗提物的HPLC色谱图。由图2(A)可知,芦丁的保留时间为5.44 min。按照1.2.2方法,计算得到芦丁的线性回归方程为Y=1474.2x-126.35,R2=0.9997。从图2(B)可见,金银木叶粗提物中的主要成分为芦丁,而且按照本实验的HPLC条件进行检测,芦丁与其它组分得到了较好的分离。

图2 芦丁标准品(A)和金银木叶粗提物(B)的HPLC图谱Fig.2 HPLC chromatogram of rutin(A) and the extract of Lonicera maackii Maxim leaves(B)
2.2HSCCC分配系数的测定
HSCCC能否达到好的分离效果,两相溶剂系统的选择至关重要。一个好的溶剂系统应该具备以下三个条件,即分配系数在0.5~2.0,两相溶剂系统能较快分层,分层时间小于30 s,同时固定相要有高的保留率。根据芦丁的结构特点和文献报道,本研究选择了7种不同的溶剂体系,采用高效液相色谱测定了芦丁在不同体系中的分配系数,各溶剂体系及相应分配系数K值见表1。

表1 样品在不同溶剂体系中的分配系数KTable 1 Partition coefficients(K)of the extract of Lonicera maackii Maxim leaves in different two phase solvent systems
根据表1的数据可以看出,1号溶剂正己烷-乙酸乙酯-甲醇-水(4∶5∶4∶5,v∶v)分层时间大于30 s,溶剂系统2、3、4的分配系数均小于0.5。因此,以上四种溶剂系统不适合用于高速逆流色谱。溶剂5、6、7的K值符合要求,但5号溶剂氯仿-甲醇-水(4∶3∶2,v∶v)上机后固定相流失较为严重,另外,氯仿毒性也较大,不宜用作实验溶剂。6、7号溶剂系统毒性较小,然而,6号溶剂的K值略微显小,7号溶剂系统的亲水性增强,K值增大,因此选用7号溶剂系统乙酸乙酯-正丁醇-水(5∶2∶5,v∶v)进行高速逆流色谱分离制备金银木叶的黄酮单体芦丁。
2.3HSCCC分离结果
采用溶剂系统乙酸乙酯-正丁醇-水(5∶2∶5,v∶v),按照1.2.4的方法进行高速逆流色谱分离金银木叶粗提物,得到4个分离组分,见图3。
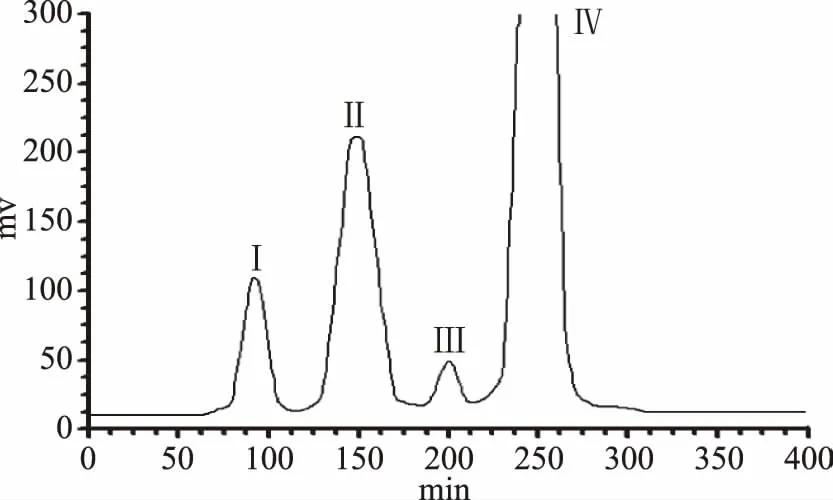
图3 金银木叶粗提物的高速逆流色谱图Fig.3 HSCCC chromatogram of the crude extract from Lonicera maackii Maxim leaves注:溶剂系统:乙酸乙酯-正丁醇-水(5∶2∶5,v∶v); 固定相:上相;流动相:下相;流速:2.0 mL/min; 转速:800 r/min;检测波长:254 nm。
收集图3中的各组分进行紫外-可见光谱扫描。其中,峰II样品(洗脱体积150 mL)与标准芦丁的特征吸收峰一致,结果见图4。将各组分将按照1.2.2的HPLC条件进行分析,发现峰Ⅱ为单一组分,结果如图5所示。将其HPLC谱图与对照品芦丁的HPLC谱图比较,二者保留时间一致,表明该组分为芦丁,经峰面积归一法测得其纯度为96.1%,经计算得知在本实验条件下芦丁得率为10.7%。
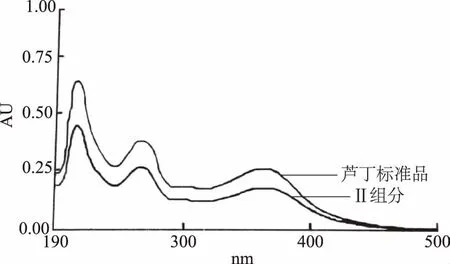
图4 峰Ⅱ组分的紫外可见吸收图谱Fig.4 Absorption spectra of effluent fraction Ⅱ
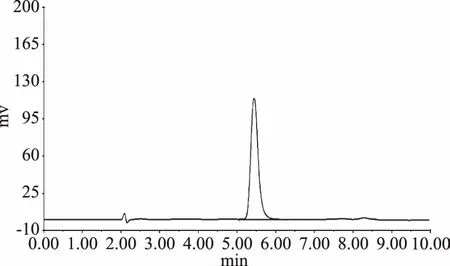
图5 峰Ⅱ组分的HPLC图谱Fig.5 HPLC chromatogram of effluent fraction Ⅱ
3 结论
本文应用高速逆流色谱法首次从金银木叶粗提物中一步分离制备了黄酮化合物芦丁。选用的两相溶剂体系为乙酸乙酯-正丁醇-水(5∶2∶5,v∶v),上相为固定相,下相为流动相,在转速800 r/min、流速2 mL/min的条件下,150 min时收集得到芦丁。经HPLC测定,芦丁纯度为96.1%。本实验所用的高速逆流色谱法为液液层析,无需色谱柱,也不会发生色谱柱污染等问题,所需耗材仅为溶剂体系,较制备型HPLC方法相比,HSCCC具有制备量大、成本低廉等优点[18]。本文建立了从金银木叶中分离纯化芦丁的HSCCC方法,为进一步研究金银木的功效、提高金银木的综合利用奠定了一定的理论基础。
[1]王翔,许延芳,陈月开,等.金银木粗脂肪、维生素C和类胡萝卜素的含量分析[J]. 山西大学学报:自然科学版,2011,34(1):143-146.
[2]杜佳朋,张友民,王豫. 忍冬属植物的研究进展[J].北方园艺,2005(4):11-13.
[3]李春华. 金银木叶中黄酮类化合物的提取[J]. 河北农业大学学报,2003,26(3):65-68.
[4]李春华,楮丽敏,李瑾. 金银木叶中黄酮类化合物的定性分析[J]. 河北职业技术师范学院学报,2003,17(1):23-26.
[5]陈月开,王美素,李红孩,等. 金银花和金银木芦丁成分分析[J]. 山西大学学报,2008,31(4):612-616.
[6]Jianhua Sun,Heng Wang,Bei Liu,et al. Rutin attenuates H2O2-induced oxidation damage and apoptosis in Leydig cells by activating PI3K/Akt signal pathways[J]. Biomed Pharmacother,2017,88:500-506.
[7]Agnieszka Gęgotek,Katarzyna Bielawska,MichaBiernacki,et al. Time-dependent effect of rutin on skin fibroblasts membrane disruption following UV radiation[J]. Redox Bio,2017,12:733-744.
[8]Qingsheng Liu,Ran Pan,Lei Ding,et al. Rutin exhibits hepatoprotective effects in a mouse model of non-alcoholic fatty liver disease by reducing hepatic lipid levels and mitigating lipid-induced oxidative injuries[J]. Int Immunopharmaco,2017,49:132-141.
[9]赵小珍,黄潇. 金银木叶总黄酮提取工艺的响应面设计优化[J]. 安徽农业科学,2015,43(23):264-266.
[10]Ito Y. High-speed countercurrent chromatography[J].Crit Rev Anal Chem,1986,17:65-143.
[11]曹学丽. 高速逆流色谱分离技术及应用[M]. 北京:化工出版社,2005:188.
[12]宋学英,殷志爽,赵逸,等. 高速逆流色谱法从白芍中分离纯化五没食子酰基葡萄糖[J].天然产物研究与开发,2012,24:303-306.
[13]石雪萍,吴亮亮,张卫明. 高速逆流色谱法分离花椒中的黄酮化合物[J]. 食品科学,2013,34(12):6-10.
[14]朱琳,任清,徐笑颖. 高速逆流色谱分离纯化苦荞中芦丁、槲皮素[J]. 食品科学,2014,35(2):47-50.
[15]吴素玲,张锋伦,张卫明,等. 高速逆流色谱法分离制备刺梨黄酮成分[J]. 食品科学,2009,30(14):37-40.
[16]Xl Cao,Qe Wang,Y Li,et al. Isolation and purification of series bioactive components from Hypericum perforatum L. by counter-current chromatography[J]. J Chromatogr B,2011,879:480-488.
[17]李忠琴,李秋云,江兴龙,等. 高速逆流色谱法分离制备中药诃子中的没食子酸[J]. 色谱,2014,32(12):1404-1408.
[18]刘浩,沈洁,刘铭,等. 高速逆流色谱分离纯化钩吻中钩吻素甲[J]. 天然产物研究与开发,2013,25:479-483.
IsolationandpreparationofrutinfromLoniceramaackiiMaximleavesbyhighspeedcountercurrentchromatography
LIChen,NINGLi-na
(School of Life Science,Shanxi University,Taiyuan 030006,China)
High-speed counter-current chromatography(HSCCC)was developed for separation and purification of rutin from crude extract ofLoniceramaackiiMaxim leaves. 10.7 mg of rutin was separated from 100 mg of the crude extract. The separation was performed using a two-phase solvent system composed of ethyl acetate-n-butanol-water(5∶2∶5,v∶v),in which the upper phase as stationary phase and the lower phase was used as the mobile phase,at a flow rate of 2.0 mL/min. The rotation speed and detection wavelength were set at 800 r/min and 256 nm,respectively. Four peaks were displayed on HSCCC chromatogram. The collected fractions were analyzed by HPLC and peak II contained the target compound of rutin,with a purity over 96% and a yield of 10.7%. This paper provided an easier method to purify rutin from crude extract ofLoniceramaackiiMaxim leaves. It can provide reference basis for full use ofLoniceramaackiiMaxim.
LoniceramaackiiMaxim leaves;rutin;high-speed counter-current chromatography(HSCCC)
2017-04-14
李晨(1981-),女,博士,副教授,研究方向:蛋白质与酶工程,E-mail:lichen@sxu.edu.cn。
山西省青年科学基金(2015021047);山西省高校科技创新项目(2016116)。
TS207.3
A
1002-0306(2017)21-0237-04
10.13386/j.issn1002-0306.2017.21.047
