橡子粉酶法制备低聚异麦芽糖的工艺研究
2017-11-21,,,,,,*
, ,,, ,,*
(1.东北林业大学,黑龙江哈尔滨 150040; 2.哈尔滨医科大学附属第二医院,黑龙江哈尔滨 150086; 3.东北农业大学,黑龙江哈尔滨 150030)
橡子粉酶法制备低聚异麦芽糖的工艺研究
张智1,李晴1,化洪苓1,尹文哲2,李杰3,马建章1,*
(1.东北林业大学,黑龙江哈尔滨 150040; 2.哈尔滨医科大学附属第二医院,黑龙江哈尔滨 150086; 3.东北农业大学,黑龙江哈尔滨 150030)
对橡子粉酶法制备低聚异麦芽糖的工艺过程进行优化,以期提高低聚异麦芽糖中异麦芽糖、潘糖和异麦芽三糖的含量。采用Box-Benhnken响应面法,优化以耐高温α-淀粉酶液化橡子粉的工艺条件。最佳的液化工艺条件为:以DE值13%为最佳液化指标,液化时间31 min、液化温度95 ℃、液化pH6.6、酶添加量13 U/g,结合生产实际最佳条件下的DE值为12.91%;继而采用正交实验,优化以普鲁兰酶、β-淀粉酶糖化橡子粉液化液的工艺条件,得到最佳的糖化工艺条件为:普鲁兰酶添加量25 U/g、β-淀粉酶添加量130 U/g、温度60 ℃、时间10 h,在此最佳工艺条件下糖化转苷后的(IG2+P+IG3)含量为36.11%±0.17%;转苷工艺过程的α-葡萄糖转苷酶最佳添加量为1.5 U/g,最佳条件下异麦芽糖、潘糖、异麦芽三糖含量之和为36.27%±0.18%。
低聚异麦芽糖,橡子粉,液化,糖化,转苷,工艺
橡子(acorn),壳斗科,为麻栎属橡树和常绿槠栲类橡树所结果实,全球此树种有8属900多种,而在我国就有7属300多种,充分说明了我国橡子资源丰富[1]。橡子仁营养丰富,含有淀粉约50.6%~58.7%、蛋白质11.7%~15.8%、脂肪2.1%~2.8%、单宁10.2%~14.1%[2]。其淀粉含量不亚于大豆等谷物,与玉米淀粉含量相似[3]。橡子粉可以开发成各种产品,例如橡子凉粉[4]、橡子饼干[5]等,同时橡子粉还可以进一步加工成变性淀粉、糖浆、环状糊精、淀粉胶和生物多糖等深层次的产品,从而可有效提高橡实产品的经济效益以及科学价值,在橡子粉的凝沉稳定性、颗粒晶体等淀粉特性方面的研究[6-8]也有了进展。
低聚异麦芽糖(isomalto-oligosaccharide)又称分枝低聚糖,是指由葡萄糖以α-(1-6)糖苷键结合而成的单糖数为2~5不等的低聚糖[9],主要成分为异麦芽糖(IG2)、潘糖(P)、异麦芽三糖(IG3)。自然界中纯天然游离的低聚异麦芽糖较少,一般存在于蜂蜜、黄酒、酱油等。含有丰富的食物纤维,具有防龋齿的功效,可降低胆固醇及血脂水平,同时作为益生菌可促进双歧杆菌的增殖,既是保健品又是营养物质,可谓是21世纪的新型保健品[10-11]。目前低聚异麦芽糖的制备多以玉米淀粉及大米淀粉居多[12-13],然而以橡子粉为原料制备低聚异麦芽糖工艺过程的研究尚未发现。
本研究以橡子粉为原料,使橡子资源更加合理地被利用,为以橡子粉为原料的优质低聚异麦芽糖的制备提供了新的理论依据,提高了生产效率。
1 材料与仪器
1.1材料与仪器
橡子粉 抚顺金宇食品有限公司;耐高温α-淀粉酶、β-淀粉酶、普鲁兰酶、α-葡萄糖转苷酶(酶活性分别为20000 U/mL、700000 U/mL、1000 ASP U/mL、100000 U/mL) 上海源叶生物科技有限公司;异麦芽糖(IG2)、潘糖(P)、异麦芽三糖(IG3)标准品 美国Miragen公司;硫酸铜、氢氧化钠、酒石酸钾钠、葡萄糖、次甲基蓝、盐酸等均为分析纯 天津市天力化学试剂有限公司。
FA-B/JA-N电子分析天平 上海佑科仪器仪表有限公司;DL-6M落地离心机 湖南星科科学仪器有限公司;PHS-3精密pH计 上海仪电科学仪器股份有限公司;2WAJ型阿贝折射仪 上海光学仪器五厂;SHZ-C型水浴恒温振荡器 上海博迅实业有限公司医疗设备厂;101型电热鼓风干燥箱 北京市永光明医疗仪器有限公司;LC-10A高效液相色谱仪 日本岛津公司。
1.2测定指标及方法
1.2.1 工艺流程

1.2.2 橡子粉去单宁实验 常规水浸提法[14]。
1.2.3 液化适宜DE值范围的确定 将橡子粉用水配制浓度为25%,调节pH到6.0~7.0,加入耐高温α-淀粉酶16 U/g,于95 ℃水浴条件下液化不同时间后调酸升温灭酶,分别测得DE值,将液化液冷却至60 ℃左右,加入普鲁兰酶20 U/g,β-淀粉酶130 U/g糖化10 h左右后加入α-葡萄糖转苷酶1.5 U/g,水浴加热35 h后灭酶,用HPLC法测(IG2+P+IG3)含量。以此确定液化的适宜DE值范围。
1.2.4 液化单因素实验 橡子粉用水分别配制浓度为10%、15%、20%、25%、30%,调节pH为5.5、6.0、6.5、7.0、7.5,分别加入耐高温α-淀粉酶8、16、24、32、40 U/g,在80、85、90、95、100 ℃水浴条件下分别加热10、20、30、40、50 min后调酸升温灭酶,测液化液DE值。
1.2.5 液化条件优化实验 在单因素实验设计基础上,根据中心组合实验设计原理,以DE值为指标,设计4因素3水平Box-Benhnken响应面分析实验[15],数据用Design-Expert软件统计,确定最优液化工艺参数。因素水平表如表1所示。

表1 Box-Benhnken实验因素水平表Table 1 Factors and levels table of Box-Benhnken experimental design
1.2.6 糖化转苷工艺的优化 最佳条件下的液化液,分别加入普鲁兰酶5、10、15、20、25、30 U/g,β-淀粉酶40、70、100、130、160、190 U/g,在45、50、55、60、65 ℃水浴条件下糖化4、6、8、10、12、14 h后于80 ℃下加热5 min灭酶后加入α-葡萄糖转苷酶1.5 U/g在55 ℃条件下水浴加热35 h,测(IG2+P+IG3)含量,根据单因素实验结果,进行L9(34)的正交实验,获取最佳糖化工艺条件;最后以(IG2+P+IG3)含量为指标,加入0.5、1.0、1.5、2.0、2.5 U/g的α-葡萄糖转苷酶,在55 ℃条件下水浴加热35 h,考察不同的α-葡萄糖转苷酶添加量对(IG2+P+IG3)含量的影响。
1.2.7 酶活力的测定 耐高温α-淀粉酶酶活力的测定:参考GB/T 24401-2009;β-淀粉酶酶活力的测定:分光光度计法[16];普鲁兰酶酶活力的测定:分光光度计法[17]。
1.2.8 DE值的测定 参考GB/T 5009.7-2008《食品中还原糖含量的测定》直接滴定法;固形物含量的测定:采用阿贝折射仪,DE值按照公式(1)计算。
式(1)
1.2.9 低聚异麦芽糖中(IG2+P+IG3)含量的测定 LC-10A高效液相色谱仪检测制备的低聚异麦芽糖中各糖组分含量。色谱条件为:色谱柱:Waters ultrahydrogel(7.8 mm×300 mm);柱温:40 ℃;流动相:超纯水;进样量:10 μL;流速:0.8 mL/min。以标准样品保留时间定性,以峰面积归一化定量。
1.3数据处理
利用Design Expert 8.0软件中的Box-Benhnken Design模型,对酶添加量、液化温度、液化pH、底物浓度4个因素进行响应面分析,并对所获得的响应面回归模型进行显著性检验;并采用Microsoft Excel 2003和Origin 8.6进行数据分析。
2 结果与分析
2.1液化实验
2.1.1 液化适宜DE值范围的确定 当DE值过低时,液化不完全导致液化液粘度大,反应效率降低,从而不利于接下来糖化的进行;而当DE值过大时,液化液中的糊精较多,不利于之后糖化过程中大量麦芽糖的产生,所以控制液化液的DE值范围为10%~16%的反应进度[18]。由图1可以看出,当DE值在7%~13%时,(IG2+P+IG3)含量是逐渐增加的,这是因为DE值较低时,呈近凝胶状,且淀粉颗粒没有水解为糊精等小分子物质,不利于下一步工艺的进行;当DE值在13%~17%时,(IG2+P+IG3)含量减少,这是因为DE值越大在糖化过程中会产生过多的葡萄糖致使(IG2+P+IG3)含量减少[19]。因此,以DE值13%为液化指标。

图1 液化DE值与(IG2+P+IG3)含量的关系Fig.1 The relationship between DE of liquefying liquor and the content of(IG2+P+IG3)
2.1.2 单因素实验

图2 液化时间对液化液DE值的影响Fig.2 Effect of liquefying time on DE of liquefying liquor
2.1.2.1 液化时间对液化液DE值的影响 由图2可以看出,随着液化时间的增加,DE值也逐渐增大,当液化时间>40 min时,DE值增长变缓,其原因是耐高温α-淀粉酶随机水解淀粉内部的α-1,4葡萄糖苷键,对长链淀粉水解速度比短链淀粉更快速且更有活性[20],当液化到一定时间时,液化液中的短链淀粉增多,因此水解速度变慢。与此同时,耐高温α-淀粉酶先作用于直链淀粉而后作用于支链淀粉,生成葡萄糖、麦芽糖和糊精[21]。选定液化DE值在13%为宜,因此最佳液化时间在20~30 min。
2.1.2.2 液化温度对液化液DE值的影响 由图3可以看出,随着液化温度的高,DE值也逐渐增大,当温度达95 ℃左右时酶活力达到最佳状态,且DE值达到最佳范围。其原因为温度对酶活性以及对淀粉的糊化作用破坏了其晶体结构的影响。此时满足DE值的要求,因此其最适液化温度为95 ℃左右。

图3 液化温度对液化液DE值的影响Fig.3 Effect of liquefying temperature on DE of liquefying liquor
2.1.2.3 液化pH对液化液DE值的影响 由图4可以看出,随着pH的升高,DE值也逐渐增大,当pH升至6.5时,DE值达到最佳范围,这是因为pH的变化影响着耐高温α-淀粉酶的酶活力以及淀粉的糊化作用。故选取最适液化pH为6.5左右。
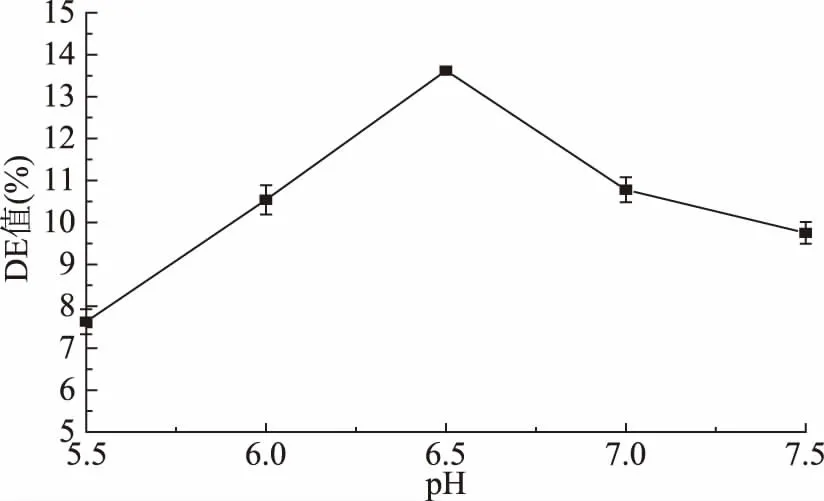
图4 液化pH对液化液DE值的影响Fig.4 Effect of liquefying pH on DE of liquefying liquor
2.1.2.4 底物浓度对液化液DE值的影响 由图5可以看出,随着底物浓度的逐渐增大,DE值也逐渐增大,当底物浓度达25%时,DE值达到最大值,且只有在最大底物浓度时才能达到最佳DE值范围。底物浓度继续增大,DE值开始下降,其原因为底物浓度过大时,由于橡子粉的独特结构性质,易形成胶凝体及结块,不利于耐高温α-淀粉酶对其进行酶解[22],故选择最佳底物浓度为25%。
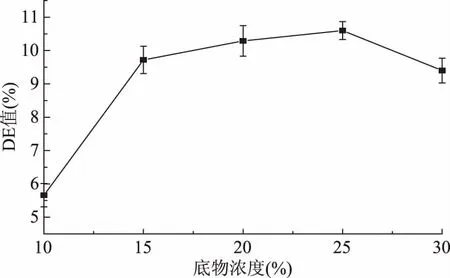
图5 底物浓度对液化液DE值的影响Fig.5 Effect of the substrate content on DE of liquefying liquor
2.1.2.5 酶添加量对液化液DE值的影响 由图6可以看出,随着酶添加量的逐渐增加,DE值也逐渐增大,当酶添加量达到32 U/g时,DE值得到最大,之后稍微下降。这是由于随着酶添加量的增加,水解作用就逐渐增强。选取DE值在13%,因此选择耐高温α-淀粉酶的添加量范围为16 U/g左右最佳。
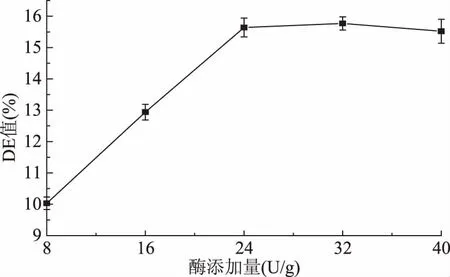
图6 酶添加量对液化液DE值的影响Fig.6 Effect of the quantity of enzyme on DE of liquefying liquor
2.1.3 响应面优化及结果分析 设计表2中29个实验,中心实验进行5次用来估计实验误差,其余为析因点。控制底物浓度为25%。具体设计组合及实验结果如表2所示。
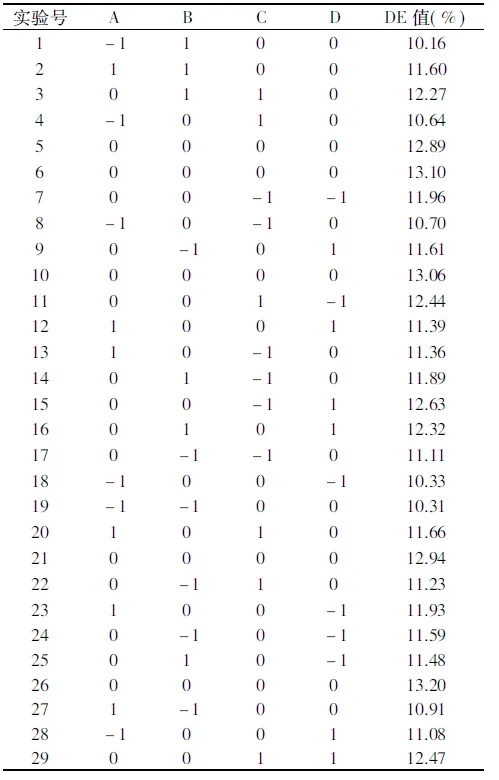
表2 Box-Benhnken响应面实验设计及结果Table 2 Box-Benhnken experimental design arrangement and results
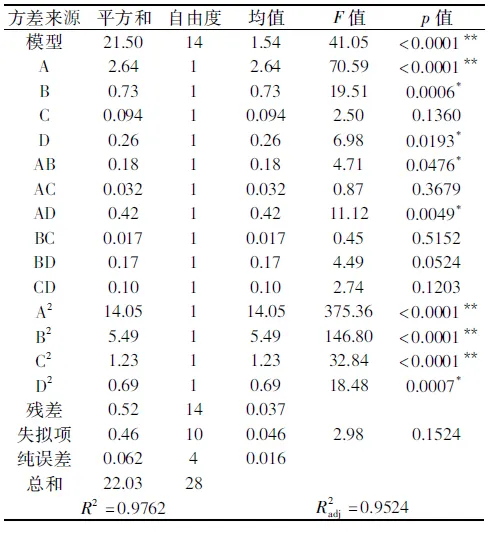
表3 响应面实验回归模型方差分析Table 3 Analysis of variance with regression model
利用设计软件Design-Expert对数据进行多元回归拟合,获得液化时间(A)、液化温度(B)、液化pH(C)和酶添加量(D)的二次多项回归方程为:
DE(%)=13.04+0.47A+0.25B+0.088C+0.15D-1.47A2-0.92B2-0.44C2-0.33D2+0.21AB+0.09AC-0.32AD+0.065BC+0.21BD-0.16CD
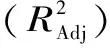
以DE值13%为优化目标值,得到最优的液化条件为:液化时间31.1 min、液化温度94.75 ℃、液化pH6.575、酶添加量13.44 U/g。
为检验实验方案的准确性,结合生产实际,将各因素调整为:液化时间31 min、液化温度95 ℃、液化pH6.6、酶添加量13 U/g。在此条件下通过5次平行实验进行验证,液化液的平均DE值为12.91%,与目标值较为吻合。
图7中AB的曲面图表明液化时间和液化温度的交互作用较强,在液化pH为6.5、酶添加量为16 U/g时,若液化温度一定,则随着液化时间的增加,液化液DE值先增大后逐渐减小。若液化时间一定,则随着液化温度的升高,液化液DE值先增大后减小;AD的曲面图表明液化时间和酶添加量的交互作用较强,在液化温度为95 ℃、液化pH为6.5时,若酶添加量一定,则随着液化时间的增加,液化液DE值先增大后趋于平稳。若液化时间一定,则随着酶添加量的增大,液化液DE值逐渐减小。

图7 AB、AD交互作用对液化液DE值的影响Fig.7 Effects of AB and AD interaction on DE of liquefying liquor
2.2糖化转苷实验
2.2.1 糖化单因素实验

图8 普鲁兰酶添加量对(IG2+P+IG3)含量的影响Fig.8 Effect of the quantity of pullulanase on the content of(IG2+P+IG3)
2.2.1.1 普鲁兰酶及β-淀粉酶添加量对(IG2+P+IG3)含量的影响 由图8和图9可以看出,普鲁兰酶添加量的逐渐增加,会使(IG2+P+IG3)含量极速增大,在添加量为20 U/g时,(IG2+P+IG3)含量达到最大,此后稍有下降,这可能是因为普鲁兰酶在糖化体系中已达到饱和。普鲁兰酶作为一种脱支酶,添加量要适中,用量太少时不能够切断糊精中所有的α-1,6糖苷键,残余的支链片段可能干扰β-淀粉酶和α-葡萄糖转苷酶的作用从而产生较多的葡萄糖,因此最佳普鲁兰酶添加量为20 U/g;β-淀粉酶是一种外切酶,从淀粉侧链的非还原端开始水解相隔的α-1,4糖苷键,依次切下一个麦芽糖单位,但它不能水解α-1,6糖苷键[23],当β-淀粉酶添加量逐渐增加时,(IG2+P+IG3)含量也逐渐增大,当添加量达到130 U/g时,(IG2+P+IG3)含量达到最大,之后稍有下降。
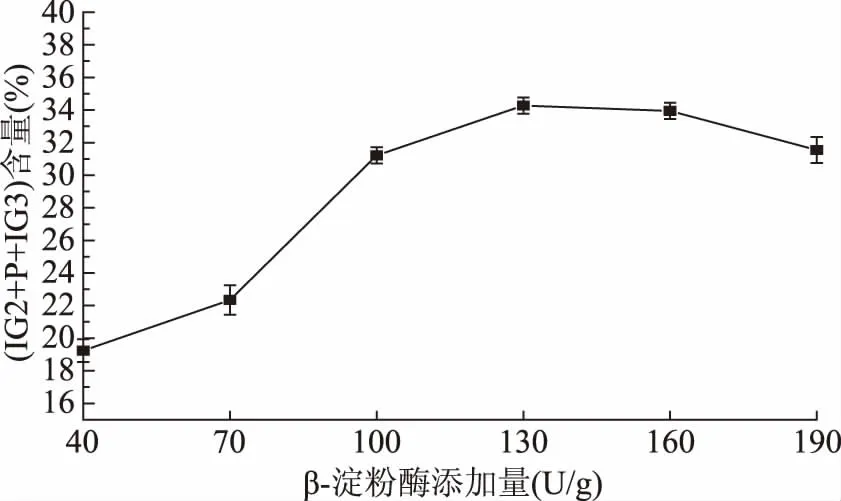
图9 β-淀粉酶添加量对(IG2+P+IG3)含量的影响Fig.9 Effect of the quantity of glucoamylase on the content of(IG2+P+IG3)
2.2.1.2 温度对(IG2+P+IG3)含量的影响 由图10可以看出,温度为60 ℃时(IG2+P+IG3)含量达到最大,超过60 ℃后(IG2+P+IG3)含量下降可能是因为酶在温度较高时被钝化影响了酶的活性,因此最佳温度为60 ℃。

图10 温度对(IG2+P+IG3)含量的影响Fig.10 Effect of temperature on the content of(IG2+P+IG3)
2.2.1.3 时间对(IG2+P+IG3)含量的影响 由图11可以看出,当糖化时间超过10 h后,(IG2+P+IG3)含量开始趋于稳定,这是因为反应至一定时间后,底物浓度会相对降低,所以酶反应也会减速,因此考虑生产效率问题,选择10 h为最适糖化时间。
2.2.2 正交实验及结果分析 由表4极差分析可知,因素对橡子粉糖化工艺的影响程度顺序依次为:A>D>B>C,橡子粉糖化工艺过程最佳工艺条件为:A3B2C2D2,即普鲁兰酶添加量25 U/g、β-淀粉酶添加量130 U/g、温度60 ℃、时间10 h,在此工艺条件下进行三次平行实验后得到最佳条件下的(IG2+P+IG3)含量为36.11%±0.17%,此时橡子粉糖化效果最好。

表5 反应产物中低聚异麦芽糖成分Table 5 Elements of isomaltooligosaccharides products
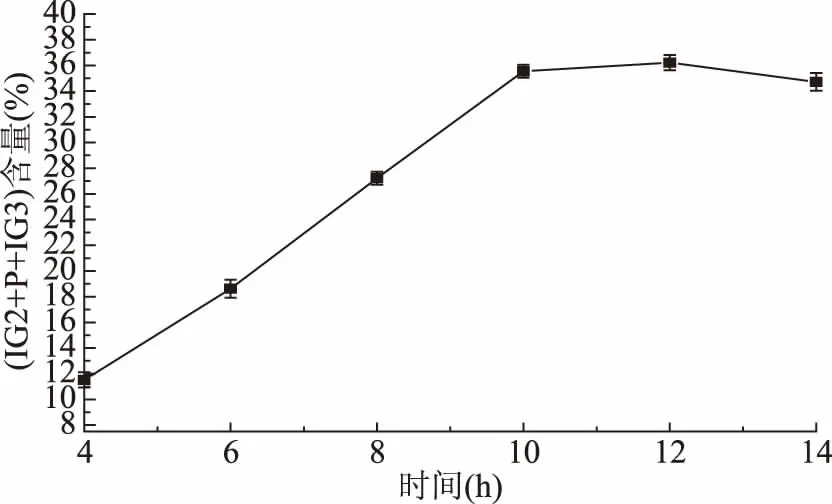
图11 时间对(IG2+P+IG3)含量的影响Fig.11 Effect of time on the content of(IG2+P+IG3)
注:G. Glucose(葡萄糖);M. Maltose(麦芽糖);IG2. Isomaltose(异麦芽糖);P. Panose(潘糖);IG3. Isomaltotriose(异麦芽三糖)。

表4 正交实验设计及结果Table 4 Design and results of orthogonal experiment
2.3转苷实验
α-葡萄糖转苷酶能催化双糖、低聚糖和其他类似物的非还原端α-1,4糖苷键断裂,释放出D-葡萄糖;也能专一地进行糖苷键转移反应,将葡萄糖苷转移到糖类受体底物上形成α-1,6糖苷键。如图12所示,随着酶添加量的逐渐增加,通过HPLC检测出IG2、P、IG3含量,观察不同α-葡萄糖转苷酶添加量下的变化。酶添加量为1.5 U/g时,IG2、P、IG3含量达到最大,且异麦芽糖含量占的比例最大,之后随着酶添加量增加逐渐减小,且异麦芽三糖所占比例越来越小,这是因为随着转苷酶添加量的增加,就有更多的转苷酶将麦芽糖和麦芽三糖转苷为异麦芽糖、潘糖和异麦芽三糖,但是α-葡萄糖转苷酶的作用底物可以为麦芽二糖~八糖,其中异麦芽糖、潘糖和异麦芽三糖都是其的底物,当酶过量时,就会开始降解异麦芽糖、潘糖和异麦芽三糖,其中的三糖开始降解为双糖[24-25]。
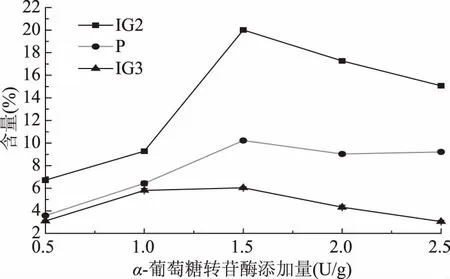
图12 α-葡萄糖转苷酶添加量对IG2、P、IG3含量的影响Fig.12 Effect of α-transglucosidase dosage on the content of IG2,P and IG3
当酶添加量为1.5 U/g,制得的样品经HPLC法检测,由表5可以看出,样品中以麦芽糖(M)居多,含有少量的葡萄糖(G)。麦芽糖含量为52.6%±0.14%,葡萄糖含量为11.13%±0.22%,(IG2+P+IG3)含量约为36.27%±0.18%。
3 结论
利用橡子粉制备低聚异麦芽糖,确定了液化最佳工艺条件为液化时间31 min、液化温度95 ℃、pH6.6、耐高温α-淀粉酶添加量13 U/g,此条件下所得液化液DE值为12.91%;糖化最佳工艺条件为糖化温度60 ℃、糖化时10 h、加酶量(β-淀粉酶130 U/g,普鲁兰酶25 U/g),此条件下所得(IG2+P+IG3)含量为36.11%±0.17%;转苷工艺过程最佳α-葡萄糖转苷酶添加量为1.5 U/g,制备的低聚异麦芽糖中异麦芽糖、潘糖和异麦芽三糖之和(IG2+P+IG3)为36.27%±0.18%,符合由中国发酵工业协会拟定的低聚异麦芽糖产品的相关标准,即异麦芽糖(IG2)、潘糖(P)、异麦芽三糖(IG3)占总糖的百分比之和≥35%[26]。
[1]张志健,王勇. 我国橡子资源开发利用现状与对策[J]. 氨基酸和生物資源,2009,31(3):10-14.
[2]张志健,李新生,陈锐. 橡子单宁脱除技术的比较研究[J].食品科技,2008(9):24-27.
[3]张玥,谢文霁,杨可心,等. 我国橡子资源的开发利用[J].中国林副特产,2014(4):85-88.
[4]钟昔阳,张景强. 橡子凉粉的研制[J]. 食品科技,2002(12):26-27.
[5]王继伟. 橡子饼干的研制[J]. 食品工业科技,2002(1):81-82.
[6]Kim W W,Yoo B. Rheological behaviour of acorn starch dispersions:effects of concentration and temperature[J]. International Journal of Food Science & Technology,2009,44(3):503-509.
[7]高立琼,陈丽冰,杨倩,等. 橡子淀粉制备及其理化性质研究[J]. 食品科技,2015(4):215-218.
[8]李樊. 橡实淀粉凝沉特性与晶体特性研究[D]. 长沙:中南林业科技大学,2013.
[9]赵凯,张守文,方桂珍. 低聚异麦芽糖的特性及其在低糖冰淇淋中的应用研究[J]. 食品科学,2003,24(1):73-75.
[10]Patel S,Goyal A. Functional oligosaccharides:production,properties and applications[J]. World Journal of Microbiology and Biotechnology,2011,27(5):1119-1128.
[11]赵晋,王娇,阚健全. 低聚异麦芽糖生理功能及应用的研究进展[J]. 食品研究与开发,2007,28(2):166-170.
[12]田康明,乔舰,李普均,等. 快速酶法制备低聚异麦芽糖工艺建立与优化[J]. 食品工业科技,2016(16):41.
[13]黎跃红,万全玉,钟卫兵. 利用碎米生产低聚异麦芽糖新工艺研究[J]. 粮食加工,2010(6):42-43.
[14]万洋灵,郭顺堂. 橡子全粉与淀粉糊化性质和消化性的研究[J]. 食品科技,2013,38(12):204-208.
[15]Huang Z L,Liang Z Y,Li G J,et al. Response surface methodology to extraction of dioscoreae polysaccharides and the effects on rat’s bone quality[J]. Carbohydrate Polymers,2011,83(1):32-37.
[16]李雯,邵远志,陈维信. 淀粉酶活性测定方法的改进[J]. 植物生理学通讯,2005,41(5):655-656.
[17]朱梦,孙海彦,彭明. 普鲁兰酶产生菌的筛选鉴定与发酵条件的研究[J]. 食品研究与开发,2011,32(7):136-140.
[18]叶红玲,杜先锋. 全酶法制备超高麦芽糖浆工艺[J]. 食品科学,2010(20):15-19.
[20]Ramesh M V,Lonsane B K. Critical importance of moisture content of the medium in alpha-amylase production by Bacillus licheniformis M27 in a solid-state fermentation system[J]. Applied Microbiology and Biotechnology,1990,33(5):501-505.
[21]Marchal L M,Jonkers J,Franke G T,et al. The Effect of Process Conditions on the a-Amylolytic Hydrolys is of Amylopectin Potato Starch An Experimental Design Approach[J].Biotechnology and Bioengineering,1999,62(3):348-357.
[22]Stevenson D G,Jane J,Inglett G E. Physicochemical properties of pin oak(Quercus palustris Muenchh.)acorn starch[J]. Starch Stärke,2006,58(11):553-560.
[23]周春海. 小麦β-淀粉酶生产啤酒用糖浆糖化工艺条件的优化[J]. 现代食品科技,2012(3):15.
[24]Zhang L,Jiang Y,Jiang Z,et al. Immobilized transglucosidase in biomimetic polymer-inorganic hybrid capsules for efficient conversion of maltose to isomaltooligosaccharides[J]. Biochemical Engineering Journal,2009,46(2):186-192.
[25]符琼. 大米淀粉酶法制备低聚异麦芽糖的研究[D]. 长沙:中南林业科技大学,2011.
[26]鲍元兴,杨维亚,孙蔚榕. 低聚异麦芽糖的质量与工艺设备[J]. 食品工业,1999(3):8-9.
Studyonthepreparationofisomalto-oligosaccharidebyenzymaticmethodsofacornstarch
ZHANGZhi1,LIQing1,HUAHong-ling1,YINWen-zhe2,LIJie3,MAJian-zhang1,*
(1.Northeast Forestry University,Harbin 150040,China; 2.Second Affiliated Hospital of Harbin Medical University,Harbin 150086,China; 3.Northeast Agricultural University,Harbin 150030,China)
With the acorn starch as raw material,the process of preparation of isomalto-oligosaccharide by enzymatic methods were optimized in order to increase the content of isomaltose,panose and isomaltotriose of isomalto-oligosaccharide. Box-Benhnken response surface analysis method was used to optimize the process conditions of liquefying acorn starch with thermostableα-amylase.The results showed that the DE value of 13% as the best liquefaction index,the optimal liquefaction conditions were 31 min of liquefaction time,95 ℃ of liquefaction temperature,6.6 of liquefying pH value,13 U/g of thermostableα-amylase,at this point,in combination with the production practice,the value of the liquefied liquid DE was 12.91%,then through single factor experiments,the process conditions of saccharifying acorn starch liquefying liquor with pullulanase and glucoamylase were investigated,the saccharification conditions were optimized to be 25 U/g of pullulanase,130 U/g of glucoamylase,60 ℃ of saccharification temperature and 10 h of saccharification time,at this optimal condition,the content of(IG2+P+IG3)was predicted to 36.11%±0.17%,the optimum concentration ofα-glucosidase in transglycosylation process was 1.5 U/g,under the optimal condition,the total content of isomaltose,panose,and isomaltotriose were 36.27%±0.18%.
isomalto-oligosaccharide;acorn starch;liquefaction;saccharification;transglycosylation;technology
2017-03-10
张智 (1964-),女,博士,教授,研究方向:微生物于发酵工程,E-mail:ldzhangzhi@163.com。
*
马建章 (1937-),男,博士,院士,研究方向:野生动物生态与管理,E-mail:lq_233@163.com。
大熊猫益生菌制剂的研究(SG1409);黑龙江省应用技术研究与开发计划项目(GA15B203)。
TS210.9
B
1002-0306(2017)21-0151-07
10.13386/j.issn1002-0306.2017.21.031
