大白猪群中HDAC1基因多态性与重要经济性状的相关性研究
2017-11-21李明杨叶泽坤聂光伟毛元良毛慧敏王国水
李明杨,叶泽坤,杨 华,聂光伟,毛元良,毛慧敏,王国水,左 波*
(1.华中农业大学动科动医学院农业部猪遗传育种重点实验室,武汉 430070;2.湖北省畜禽育种中心,武汉 430072;3.浙江天蓬集团有限公司,浙江 江山 324111)
大白猪群中HDAC1基因多态性与重要经济性状的相关性研究
李明杨1,叶泽坤1,杨 华2,聂光伟1,毛元良3,毛慧敏3,王国水3,左 波1*
(1.华中农业大学动科动医学院农业部猪遗传育种重点实验室,武汉 430070;2.湖北省畜禽育种中心,武汉 430072;3.浙江天蓬集团有限公司,浙江 江山 324111)
该研究利用PCR-RFLP技术检测343头法系大白猪HDAC1基因酶切位点多态性,并对乳头数、达100 kg体重日龄、校正背膘厚、初生重和体长等性状进行关联分析。结果显示:在法系大白群体中检测到HDAC1基因3种基因型(分别为AA、AG和GG基因型)的存在。HDAC1基因HinfⅠ位点与大白猪达100 kg体重日龄显著相关,G等位基因具有显著降低达100 kg体重日龄的遗传效应,而GG基因型个体的初生重要高于AA基因型个体,GG基因型个体的生长性能有着明显优势。
猪;HDAC1基因;关联分析
1 前言
HDACs家族与染色体移位、转录调控、基因沉默、细胞周期以及细胞分化增殖、凋亡有关。组蛋白的各种修饰功能对基因转录有调节作用,而且各种修饰之间相互联系,能够调控染色质调节因子的募集[1-2]。
组蛋白去乙酰化酶1(Histone Deacetylase 1,HDAC1) 是HDACs家族中的一员,存在于人的各种器官中,而在胚胎干细胞,一些转化细胞系和高度增生组织中高效表达[3]。有研究表示,在HDAC家族中多个基因参与成脂分化[4],而HDAC1基因在信号传导、细胞繁殖和分化过程中有着重要的作用[5],并且可以调控与细胞周期调控、增殖、分化及凋亡相关基因的转录[6]。2002年,Ye等[7]首次在猪群体中研究HDAC1基因与猪部分性状之间的关联性。2005年刘峰[8]发现猪HDAC1基因的HinfI酶切位点的多态性与猪的背膘厚、达100 kg体重日龄、瘦肉率等性状显著相关。因此,揭示该基因的多态性及基因型效应,寻找与猪生长和胴体性状相关的遗传标记,为优质瘦肉型猪的标记辅助选择提供科学依据。
2 材料与方法
2.1 实验材料
法系大白猪343头(源自浙江开盛生态农业发展有限公司),体重在85~135 kg,使用一次性采血器在前腔静脉处采集血液。基因组DNA采用血液基因组DNA中量提取试剂盒(离心柱型)提取,于-80 ℃超低温冰箱中保存。
2.2 PCR扩增
本实验主要利用PCR-RFLP技术进行基因分型,所用引物由上海生工生物工程有限公司合成,引物序列见表1。PCR反应体系为10 μl:2×Es Taq Master Mix( 含 染 料 )5.0 μl;ddH2O 4.0 μl;Sense primer(10 μM) 0.25 μl;Antisense primer(10 μM)0.25 μl;DNA 0.5 μl。HDAC1基因反应程序:94 ℃,5 min;35个循环(30 s-95 ℃,30 s-55 ℃,30 s-72 ℃);72 ℃,5 min;25 ℃,1 min。
2.3 PCR-RFLP分析
HDAC1基因用限制性内切酶HinfI进行酶切。酶切反应体系为:PCR 产 物 10.0 μl,10×FastDigest Green buffer 2.0 μl, 内 切 酶 0.5 μl,ddH2O 7.5 μl。37 ℃消化 1 h。酶切产物分别用2%的琼脂糖凝胶电泳检测分型,并拍照保存图片。
2.4 统计分析
本实验所采用模型为:Tijkl=μ+Gi+Fj+Sk+Pl+eijklm,Tijkl为性状表型值,μ为平均值,Gi为基因型效应(包括基因加性效应和显性效应);Fj、Sk、Pl为固定效应,分别为家系、性别、批次,eijklm为残差效应。采用SAS软件GLM模型自编程序完成,同时采用reg程序计算基因加性效应和显性效应,并进行显著性检验。
3 结果与分析
3.1 HDAC1基因的PCR-HinfIRFLP多态性检测
本研究用于检测HDAC1基因多态性的扩增片段产物长度为333 bp,见图1。利用HinfI内切酶酶切后产生 219 bp,190 bp,114 bp 和 29 bp片段,根据条带类型的不同共检测到3种基因型,分别命名为AA基因 型(219 bp+114 bp)、AG基 因 型(219 bp+190 bp+114 bp+29 bp)和GG基因型(190 bp+114 bp+29 bp)。基因分型结果见图2。

表1 扩增目的基因所用的引物
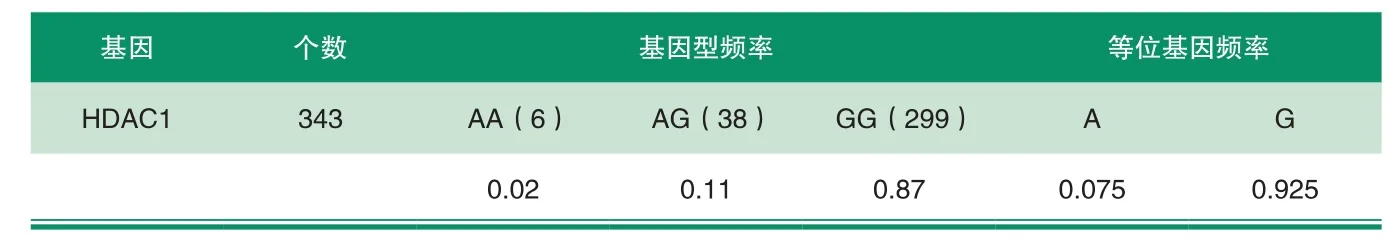
表2 大白猪群中HDAC1基因型频率和等位基因频率

表3 HDAC1基因HinfI多态性与大白猪性状间的关联分析

图1 HDAC1基因PCR凝胶电泳结果

图2 HDAC1基因PCR-HinfⅠ-RFLP酶切分型结果
3.2 HDAC1基因在大白猪中的基因频率分布及与生长和胴体性状的关联分析
3.2.1 HDAC1基因在大白猪群体中的基因频率分布
利用PCR-RFLP技术对HDAC1基因多态性进行检测,在法系大白猪中检测到3种基因型,对各基因型频率进行统计,结果如表2所示。
由表2得出,HDAC1基因的A等位基因和G等位基因的频率相差很大,G等位基因在法系大白猪群体中的分布频率显著高于A等位基因,G等位基因是优势等位基因。Hardy-Weinberg平衡检验结果显示,HDAC1基因在法系大白猪群体中偏离哈迪一温伯格平衡状态 (P<0.05)。
3.2.2 HDAC1基因多态性与法系大白猪生长及胴体性状的关联分析
对HDAC1基因多态性位点的不同基因型与大白猪生长及胴体性状进行关联性分析,结果分别如表3所示。由表3可以得出,HDAC1基因HinfI位点多态性与法系大白猪的达100 kg体重日龄性状显著相关,其中GG基因型个体要显著(P<0.05)低于AA基因型个体。而GG基因型个体的初生重性状要高于AA基因型个体,但没有达到显著水平,说明GG基因型对于猪生长性能具有明显的优势。另外,AA基因型个体的活体背膘厚要低于AG和GG基因型个体,但没有达到显著水平。
4 讨论
4.1 大白猪HDAC1基因的多态性
本研究中,HDAC1基因HinfI酶切位点在大白猪群体中都有AA、AG、GG三种基因型的分布。其中,HDAC1基因HinfI酶切位点在大白猪中GG(0.87)基因型频率要高于AA(0.02)基因型频率,G等位基因为优势等位基因,而在刘峰[8]和柳小春[9]的研究中,在大白猪群体中并没有检测到AA基因型,但是在杜洛克群体中AA基因型频率要高于GG基因型频率。
4.2 HDAC1基因对大白猪各性状的遗传效应
在刘峰[8]和柳小春等[9]的研究中得出,HDAC1基因GG基因型个体具有较高的生长速度和较低的活体背膘厚。而在本研究中,GG基因型个体达100 kg体重日龄要少于AA基因型个体,且达到显著水平,这与以前的研究结果一致,说明G等位基因具有增加生长性能的正效应,但是GG基因型的活体背膘厚要高于AA基因型个体,这与前者研究结果不符,其原因可能是由于品种、选育工作和环境等一些因素的不同,进而对群体的遗传机制造成一定的影响。
本实验还需进一步扩大样本量,并且在不同群体品种,尤其是地方品种和杜洛克品种进行分析验证。另外,HDAC1基因与猪的一些其他胴体、肉质性状显著相关,Ye等[7]的研究中指出HDAC1基因与猪的后腿重、肩部脂肪重等性状显著相关;刘峰[8]发现HDAC1基因与猪的瘦肉率、脂肪率等性状显著相关。所以,还需检测与肉质性状之间的相关性,为HDAC1基因在猪遗传育种上的研究提供更多的理论依据。
[1] KIM K C,GENG L,HUANG S.Inactivation of a histone methyltransferase by mutations in human cancers[J].Cancer research,2003,63(22):7619-7623.
[2] AHMAD M,HAMID A,HUSSAIN A,et al.Understanding histone deacetylases in the cancer development and treatment: an epigenetic perspective of cancer chemotherapy[J].DNA and cell biology,2012,31(S1):S-62-S-71.
[3] MA P,SCHULTZ R M.Histone deacetylase 1 (HDAC1) regulates histone acetylation, development,and gene expression in preimplantation mouse embryos[J].Developmental biology,2008,319(1):110-120.
[4] YOO E J,CHUNG J J,CHOE S S,et al.Down-regulation of histone deacetylases stimulates adipocyte differentiation[J].Journal of Biological Chemistry,2006,281(10):6608-6615.
[5] LU Z,WANG Y.Relationship between histone acetylation/deacetylation and gene transcription[J].Chinese science bulletin,1998,43(13):1057-1063.
[6] WANG A G,KIM S U,LEE S H,et al.Histone deacetylase 1 contributes to cell cycle and apoptosis[J].Biological and Pharmaceutical Bulletin,2005,28(10):1966-1970.
[7] YE X,ROBINSON J A B,JIANG Z,et al.Polymorphisms of histone deacetylase 1 and 3 genes and fatty acid binding protein 3 and 4 genes and their associations with economic traits in swine[C]//7th World Congress on Genetics Applied to Livestock Production.2002,8:19-23.
[8] 刘峰.HDAC1基因、PIT-1基因与猪部分经济性状相关性研究[D].长沙:湖南农业大学,2005.
[9] 柳小春,肖调义,何伟光,等.猪生长及胴体性状3个相关基因座遗传效应[J].中国农业科学 ,2009,42(2):742-747.
本项目受国家科技支撑计划(项目编号:2014BAD20B01)和“863”计划(2013AA102502)、湖北省农业科技创新中心创新团队资助。
李明杨(1992-),男,河北衡水人,动物遗传育种硕士,主要从事动物遗传育种与繁殖方面的研究,E-mail:907166871@qq.com
左波,华中农业大学动科动医学院教授,博士生导师,研究方向:猪遗传育种,E-mail:zuobo@mail.hzau.edu.cn
2017-08-24)
