苄嘧磺隆降解菌的分离及生长降解特性研究
2017-11-20韩丽珍
陈 森,王 欢,陆 敏,韩丽珍
(贵州大学 生命科学学院,贵州 贵阳 550025)
苄嘧磺隆降解菌的分离及生长降解特性研究
陈 森,王 欢,陆 敏,韩丽珍*
(贵州大学 生命科学学院,贵州 贵阳 550025)
苄嘧磺隆是一种磺酰脲类除草剂,被广泛应用于稻田土壤中防除一年生和多年生阔叶杂草。在土壤中的持效期较长,大量施用后易对后茬敏感作物产生药害,微生物降解是土壤中苄嘧磺隆转化的主要方式。本研究从长期施用该除草剂的稻田土壤中分离筛选到1株苄嘧磺隆降解菌株75B,经形态学及生理生化特征、16S rRNA基因扩增测序构建系统发育树分析,鉴定为Klebsiellapneumoniae(肺炎克雷伯氏菌)。75B菌株对环境的适应能力较强,在pH 5.09.0、0.55.0% NaCl浓度下、培养温度为2638℃的范围内生长良好。将该菌株按5%接种量置于pH 7.0、以苄嘧磺隆为唯一碳源的无机盐培养基(2.0% NaCl浓度)中、34℃条件下培养,对50 mg/L苄嘧磺隆的5 d降解率为74.11%,培养至10 d时的降解率为97.65%。结果表明75B菌株可以有效地降解苄嘧磺隆,具有应用于该除草剂污染环境修复的潜力。
苄嘧磺隆降解菌;肺炎克雷伯氏菌;生长降解特性
苄嘧磺隆(Bensulfuron-methyl, BSM)是一种磺酰脲类除草剂,可以抑制乙酰乳酸合成酶(acetolactate synthase, ALS)的活性,导致植物支链氨基酸的合成受阻而起杀草作用[1]。由于其选择性高,对禾本科植物无害,因而被广泛应用于稻田土壤中防除一年生和多年生阔叶杂草和莎草。苄嘧磺隆具有挥发性低、难以光降解,在碱性土壤中的持效期长达100 d以上的特征[2]。大量应用后不仅对后茬轮作作物有毒、损伤烟草和番茄等敏感作物,而且其残留可通过渗滤增加邻近水生环境污染的可能性[3]。研究已经证明BSM对水生蕨类和淡水蓝藻有高度毒性[4]。较高浓度(3.553 mg/kg)BSM的处理可造成土壤微生物多样性降低,严重抑制需氧性细菌、固氮菌、纤维素分解菌及氨化细菌的生长,减少了土壤固氮过程和硝化作用的进行[5];还可导致Pseudomonasputida(恶臭假单胞菌)的急性毒性效应[6]。然而,利用14C标记技术对施加苄嘧磺隆的稻田土壤进行降解研究,发现重复施用BSM的稻田土壤中矿化产生14CO2的速率更快,表明土壤细菌可以利用BSM为碳源和能源[7];显然,通过微生物酶系统发挥的微生物降解仍然是苄嘧磺隆在土壤中转化的决定性机制[8]。但是,自2005年首次分离到可以降解苄嘧磺隆的Brevibacteriumsp. BH菌株后,近年来苄嘧磺隆的降解微生物报道仍较少。为了丰富苄嘧磺隆的降解菌株,本研究从长期施用苄嘧磺隆除草剂的农田土壤中,分离筛选到1株Klebsiellapneumoniae,并对其生长降解特性进行了研究,以期为苄嘧磺隆污染土壤的生物修复提供理论依据和菌种资源。
1 材料与方法
1.1土样采集
采集土样来自贵州省贵阳市花溪区常年施用野老除草剂(含苄嘧磺隆 6%,乙草胺 16.7%)的稻田淹水土壤(北纬N26°26′18.23″,东经E106°39′45.32″,海拔1 125.35 m),土壤为黄壤、pH值6.0。
1.2培养基
基础盐培养基(minimal sodium medium, MSM):NH4NO31.0 g,NaCl 1.0 g,MgSO40.1 g,KH2PO40.5 g,K2HPO41.5 g,蒸馏水1 000 mL,pH 7.0,121℃灭菌 30 min。
LB培养基:酵母膏 5.0 g,蛋白胨 10.0 g,NaCl 10.0 g,蒸馏水1 000 mL,pH 7.0,121℃灭菌 30 min。
固体培养基均加入2.0%琼脂。
1.3主要试剂及仪器
主要试剂:苄嘧磺隆标品(Sigma-Aldrich, USA),10%苄嘧磺隆原药(安徽华星化工股份有限公司),除乙腈和甲醇为色谱纯外,其余试剂均为国产分析纯;分子生物学试剂Premix rTaq购自TakaRa,Bacterial DNA Kit购自Omega;主要仪器为T100 PCR仪(Bio-Rad, USA),Chemi Doc XRS+凝胶成像仪(Bio-Rad, USA),Waters 600高效液相色谱系统(Waters, USA)。
引物合成及产物测序均由上海英骏生物工程有限公司完成。
1.4苄嘧磺隆降解菌的分离
称取土壤10.0 g加入100 mL含10 mg/L苄嘧磺隆的无机盐培养基中,于30℃恒温振荡培养器中150 rpm振荡培养,每隔10 d转接一次,逐步提高培养基中的苄嘧磺隆浓度,连续驯化、富集培养6次,直至苄嘧磺隆浓度为250 mg/L。取最后一次富集培养液适量,稀释后涂布培养于含50 mg/L苄嘧磺隆的MSM固体培养基上,30℃培养4 d左右,挑选生长良好的菌落进行分离纯化并保种。
1.5苄嘧磺隆降解菌株的鉴定
1.5.1降解菌株的形态及生理生化鉴定 纯化的单菌落接种到LB固体培养基中活化两次后观察菌落形态,挑取少量单菌落涂片进行Gram染色后光学显微镜观察。生理生化的鉴定依照《Bergey’s Manual of Systematic Bacteriology》[9]进行。
1.5.2降解菌株的分子鉴定 利用Bacterial DNA Kit提取细菌DNA,以降解菌DNA为模板,利用细菌16S rRNA基因扩增的通用引物27f(5′-AGAGTTTGATCMTGGCTCAG-3′)、1492r (5′-TACGGYTACCTTGTTACGACTT-3′)进行PCR扩增。扩增产物经琼脂糖凝胶电泳,有目的大小条带者送出测序。测序获得的16S r RNA基因序列使用BLAST进行同源性比较,同时联合EzTaxon-e服务器的模式种细菌菌株比对进行分子鉴定。利用MEGA6.0中的邻近法(Neighbor-Joining)构建系统发育树,进行1 000次自展检验。
1.6不同环境因素对苄嘧磺隆降解菌株生长的影响
1.6.1降解菌株的生长曲线 将活化菌液分别接种于LB培养基和含50 mg/L苄嘧磺隆的LB培养基中,使得培养液起始OD600值为0.2左右,于30℃ 150 rpm振荡培养,定时取样测定菌体生长量。
1.6.2培养基不同pH值对降解菌株生长的影响 将活化菌液接种于60 mL含50 mg/L苄嘧磺隆的LB培养基中,调节培养基pH值分别为 5.0、6.0、7.0、8.0和9.0,于30℃ 150 rpm振荡培养,定时取样测定OD600值。
1.6.3培养基中不同NaCl浓度对降解菌株生长的影响 在含50 mg/L苄嘧磺隆的60 mL LB培养基中(原有NaCl浓度为0.5%),分别添加NaCl使其盐浓度分别为1.0、2.0和5.0%,接种菌液于30℃振荡培养并测定OD600值。
1.6.4不同接种量对降解菌株生长的影响 将活化的菌液调节OD600值为1.0,按1.0、5.0、7.0和10.0%的接种量分别转接入含50 mg/L苄嘧磺隆的60 mL LB培养基中,于30℃振荡培养并测定OD600值。
1.6.5不同装液量对降解菌生长的影响 分别取20、40和60 LB培养基(含50 mg/L苄嘧磺隆)装入100 mL三角瓶中,接入菌液于30℃振荡培养并测定OD600值。
1.6.6不同培养温度对降解菌生长的影响 将活化菌液转接入60 mL LB培养基(含50 mg/L苄嘧磺隆)中,分别在26、30、34和38℃条件下振荡培养并测定OD600值。以上每个处理均设三个重复。
1.7降解菌株在以苄嘧磺隆为唯一碳源培养基中的生长及降解
将活化菌液6000 rpm离心5 min后弃上清,菌体沉淀用MSM培养液洗涤2次后重悬。重悬菌液分别接种于含50、100和150 mg/L苄嘧磺隆的MSM培养基中,在最适生长条件下置于恒温摇床中150 rpm振荡培养,定时取样测定OD600值。每个处理设三个重复。选择菌体生长较好的培养液处理后,HPLC测定其中的苄嘧磺隆浓度并计算降解率。
培养液中苄嘧磺隆的提取及浓度测定参考李阳阳方法[10],简而言之,取适量培养液加入3倍体积的二氯甲烷萃取、无水硫酸钠吸去水分,经旋转蒸发仪蒸干后加入色谱级甲醇溶解、过滤后利用HPLC测定培养液中的苄嘧磺隆含量。HPLC测定的色谱柱为AsilentTC-C18柱,以甲醇为流动相,流速1.0 mL/min,检测波长为210 nm。
1.8数据处理
试验数据处理采用Excel 2010和SPSS19.0软件,多重比较采用LSD法。
2 结果与分析
2.1苄嘧磺隆降解菌株的分离与鉴定
利用长期使用野老除草剂的稻田土壤为材料,通过逐步提高培养基中苄嘧磺隆浓度的方法,经近两个月的驯化及富集培养,最终分离纯化获得1个细菌菌株,该菌株在含50 mg/L苄嘧磺隆的MSM固体培养基平板上生良好,命名为75B。
降解菌株75B在LB固体平板上培养24 h后,呈现出半透明、光滑、隆起的乳白色光泽感菌落;镜检为G-的杆状细菌(图1)。生理生化测试表明,该菌株M.R试验、V.P试验、氧化酶及过氧化氢酶阴性;苯丙氨酸水解、淀粉水解、酪素水解阴性;硝酸盐还原、纤维素分解、丙酸盐利用阳性;有荚膜;可发酵葡萄糖、乳糖、核糖醇,不能利用山梨糖和5-酮基-D-葡萄糖酸。
利用16S rRNA基因扩增的通用引物,以75B菌株的总DNA为模板进行PCR扩增,扩增产物经电泳显示扩增到1.5 kb大小目的条带。测序产物经BLAST及EzTaxon-e服务器鉴定,构建系统发育树(图2),表明75B菌株的16S rRNA基因与Klebsiellavariicola及Klebsiellapneumoniae同源性极高,分子鉴定为Klebsiellasp.。
结合生理生化测定及分子生物学方法,最终将苄嘧磺隆降解菌75B鉴定为Klebsiellapneumoniae(肺炎克雷伯氏菌)。

图1 苄嘧磺隆降解菌75B的菌落和镜下Gram染色图谱Fig.1 Colony and Cell Gram staining of Bensulfuron-methyl degrading strain 75B
2.2苄嘧磺隆降解菌株75B在不同环境条件下的生长
2.2.1降解菌株75B在不同培养基中的生长曲线 当把降解菌株75B接种入LB、含50 mg/L苄嘧磺隆的LB培养基中,结果显示出相似的生长趋势;另外,在LB培养基中加入50 mg/L苄嘧磺隆后,降解菌株75B的生长稍稍有所滞后,表明苄嘧磺隆的加入对于苄嘧磺隆降解菌株仍然存在略微的影响,这主要表现在对数生长期的生长速率有所降低。但是,当培养至稳定期后期(24 h),在两种培养基中的菌体生长量(OD600值)并未有显著差别(p0.05)(图3),降解菌株可以快速适应苄嘧磺隆的存在。

图2 苄嘧磺隆降解菌75B的16S rRNA基因系统发育树Fig.2 Phylogenetic tress on 16S rRNA gene of Bensulfuron-methyl degrading strain 75B

图3 苄嘧磺隆降解菌株75B的生长曲线Fig.3 Growth curves of Bensulfuron-methyl degrading strain 75B
2.2.2培养基不同pH值及NaCl浓度对降解菌株生长的影响 在不同pH值的LB培养基(含50 mg/L苄嘧磺隆)中,降解菌株75B的菌体生长量在对数生长期存在差异,pH 7.0的培养基中生长速率最快(p0.05),最适pH值为7.0。进入稳定期后期,pH值对菌体生长量的影响下降,该菌株在pH 5.09.0范围内生长良好,表明75B对环境pH值有较强的适应能力(图4)。
2.2.3不同接种量及装液量对降解菌株生长的影响 设置4个不同接种量接种菌液,结果表明,在接种量为1%时,75B菌株的菌体生长量低于其余3个处理,而当接种量为5.0~10.0%范围内时,菌体OD600值并无显著差异(p<0.05)。 因而,适当加大接种量可使菌体缩短适应期而进入快速生长阶段,但接种量与菌体生长量之间并不呈完全对应增长趋势,降解菌株75B的最适接种量为5.0%。而在3个不同的装液体积下,菌体生长量并无明显差异(图5)。
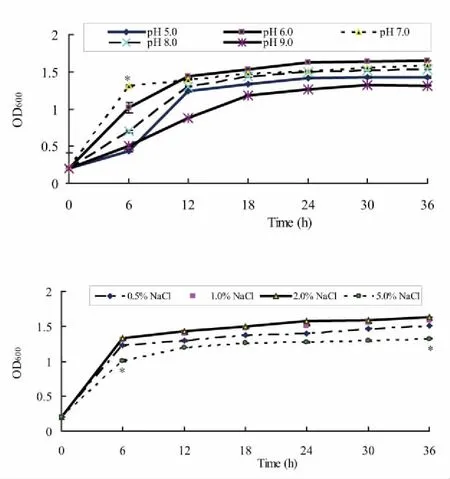
注:上图为不同pH值,下图为不同NaCl浓度,*代表差异显著(p0.05)
图4 培养基不同pH值及NaCl浓度对苄嘧磺隆降解菌株75B生长的影响
Fig.4 Growth Effects on different pH and NaCl concentration of Bensulfuron-methyl degrading strain 75B
2.2.4不同培养温度对降解菌株生长的影响 温度通常对微生物的生长影响较大。在4个不同的温度条件下培养75B菌株,34℃条件下的菌体生长量略高;除在培养初期(12 h),测试的最低温度(26℃)及最高温度(38℃)下菌体OD600值略低于其余处理外;总体上,在26~38℃温度范围内,苄嘧磺隆降解菌株75B的生长良好,菌株可以耐受较广的温度范围。

注:上图为不同接种量,下图为不同装液量,*代表差异显著(p0.05)
图5 接种量及装液量对苄嘧磺隆降解菌株75B生长的影响
Fig.5 Growth Effects on different inoculum size and medium volume of Bensulfuron-methyl degrading strain 75B
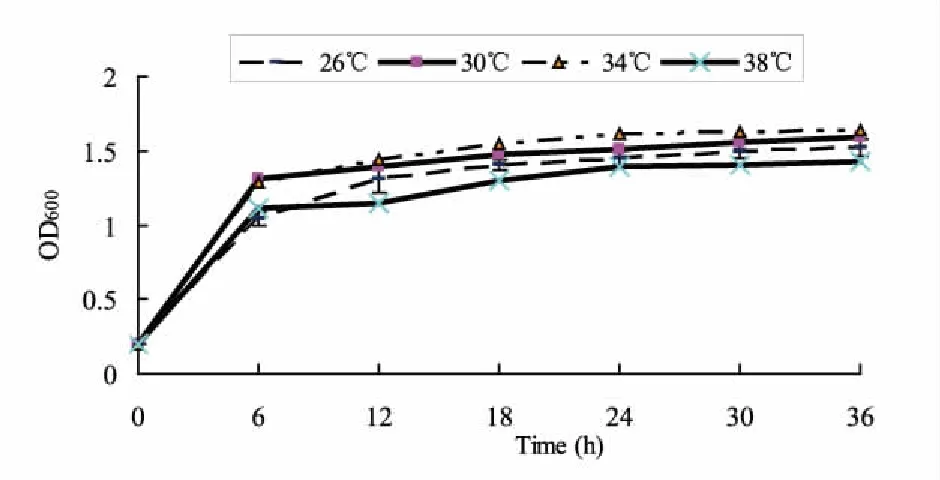
图6 不同培养温度对苄嘧磺隆降解菌75B生长的影响Fig.6 Growth Effects on different temperature of Bensulfuron-methyl degrading strain75B
2.3苄嘧磺隆降解菌株75B的生长及降解
将活化的75B菌株培养液以5%接种量、转接入以苄嘧磺隆为唯一碳源的无机盐培养基(pH 7.0,含2.0% NaCl)中,34℃摇床振荡培养监测菌体生长量。结果表明,菌体在150 mg/L苄嘧磺隆的培养基中基本无生长;而50 mg/L和100 mg/L浓度下菌体的延滞期达3 d左右,之后OD600值开始逐渐呈上升趋势。在含50 mg/L苄嘧磺隆的MSM培养基中,75B菌株的生长明显优于另两组处理(p0.05)(图7)。收集该浓度下的菌体培养液,经萃取、蒸干后进行HPLC测定,显示75B菌株对50 mg/L苄嘧磺隆的5 d降解率为74.11%,培养至10 d时的降解率高达97.65%(图8)。

注:*代表差异显著(p0.05)
图7 降解菌株75B在以不同浓度苄嘧磺隆为唯一碳源MSM培养基中的生长
Fig.7 Growth on MSM containing different concentration Bensulfuron-methyl of strain 75B
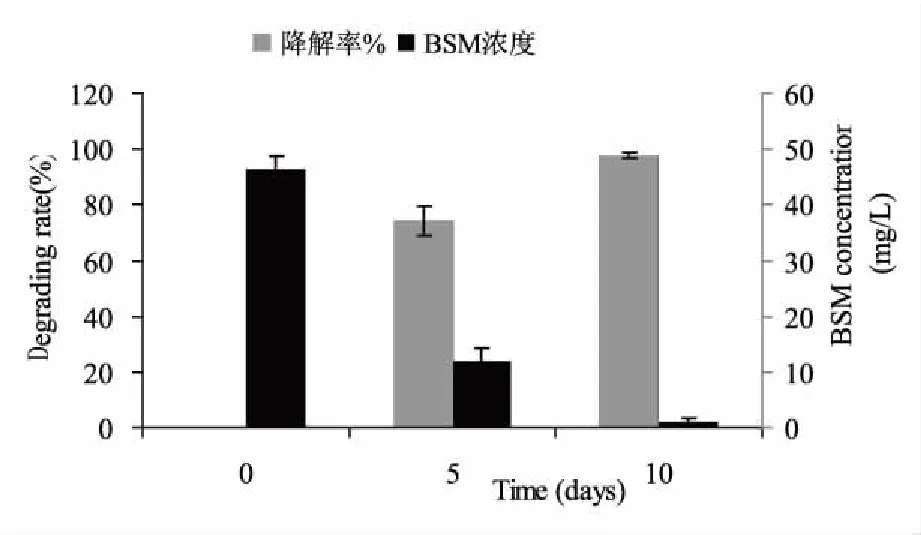
图8 苄嘧磺隆降解菌株75B对50 mg/L苄嘧磺隆的降解能力Fig.8 Degrading capability on 50 mg/L Bensulfuron-methyl of strain 75B
3 结 论
苄嘧磺隆是20世纪80年代中期开发的一种新型磺酰脲类除草剂,是我国水稻田中使用面积广、时间长、用量大的除草剂之一。由于其在土壤中的持效期较长,大量施用后会对环境造成一定危害。本研究采集长期施用野老除草剂(含苄嘧磺隆6%)的稻田土壤,经富集、驯化后分离到1株苄嘧磺隆降解菌株75B,形态学、生理生化研究及分子生物学研究结果显示该菌株为Klebsiellapneumoniae(肺炎克雷伯氏菌),该菌株对环境的适应能力较强,生长在pH 7.0、含50 mg/L苄嘧磺隆的无机盐培养基(2.0%NaCl)中,34℃条件下培养10 d,对苄嘧磺隆的降解率可达97.65%。
Zhu等在2005年首次报道可降解苄嘧磺隆的短杆菌属(Brevibacteriumsp.)BH菌株,在2535℃条件下、pH7.07.5时,培养7 d对100 mg/L BSM的降解率为29.4%[11]。张松柏等从农药厂工业废水和污泥中富集分离到光合细菌PSB07-6,鉴定为Rhodopseudomonaspalustris(沼泽红假单胞菌),在pH6.5的光合细菌培养基中30℃条件下培养5 d后,对350 mg/L苄嘧磺隆的降解率为25.03%[12]。Lin等分离到BacillusmegateriumL1菌株,培养84 h对50 mg/L BSM的降解率为12.8%[13]。Xiong等筛选到的Rhodococcussp. BX2菌株对20 mg/L BSM的7d降解率为92%[14]。除此外,彭星星等分离筛选到的苄嘧磺隆降解真菌Aspergillussp. BP-H-01菌株,最适pH 7.5、28℃条件下对25 mg/L BSM的2 d降解率为84.5%[15]。Peng等分离到Penicilliumpinophilum(嗜松青霉) BP-H-02菌株,在30℃条件下置于pH 6.5的培养基中,对50 mg/L BSM的60 h降解率为87%[16]。以上报道的苄嘧磺隆降解菌株最适pH值均为中性或酸性条件。Sabadie等的研究表明BSM在土壤中主要经化学水解和生物学降解进行,其化学水解是pH依赖性的、在酸性或中性条件下(pH8.0)可通过脲桥断裂水解形成稳定的嘧啶胺和苯甲磺酰氨[17]。本研究获得的Klebsiellapneumoniae75B菌株在碱性条件下(pH 7.09.0)生长良好,更有利于碱性土壤中生物降解的进行。另外,该菌株的温度适应范围(2638℃)更广、对50 mg/L苄嘧磺隆的5 d降解率可达74.11%,培养至10 d时几乎可完全降解,是一株降解效果优良的菌株,对于该菌株的进一步研究可为其用于污染土壤的生物修复奠定基础。
Klebsiella属于肠杆菌科(Enterobacteriaceae),在环境中广泛存在,其分离株或具有内生性固氮作用、或者是条件性致病菌[18]。Klebsiellapneumoniae是可定殖和感染多种动植物的克雷伯氏菌属成员[19]。早期的研究表明该菌为条件性致病菌,可致人肺炎及奶牛乳腺炎[20]。近年来发现Klebsiellapneumoniae分离株具有代谢多样性,占据了不同类型的环境生态位;菌种的不同分离株也表现出遗传和表型的多样性[21]。多位研究者发现在玉米或水稻中有该种微生物内生定殖并具有固氮活性[22],而且玉米分离株较临床分离株的毒力更低[23]。Klebsiellapneumoniae不同地区分离株还被报道具有降解石油、降解苯并芘和芘,可利用单宁酸[24]等多种能力。本研究中分离到的Klebsiellapneumoniae菌株被首次发现还具有降解苄嘧磺隆的能力,也充分表明了该种微生物具有一定的环境生物修复潜能。
[1] Saeki M, Toyota K. Effect of bensulfuron-methyl (a sulfonylurea herbicide) on the soil bacterial community of a paddy soil microcosm[J].Biology&FertilityofSoils. 2004, 40(2): 110-118.
[2] Sarmah AK, Sabadie J. Hydrolysis of sulfonylurea herbicides in soils and aqueous solutions: a review[J].JournalofAgricultural&FoodChemistry. 2002, 50(22): 6253-6255.
[3] Luo W, Zhao Y, Ding H. Co-metabolic degradation of bensulfuron-methyl in laboratory conditions[J].JournalofHazardousMaterials. 2008, 158(1): 208-214.
[4] Aida M, Ikeda H, Itoh K,etal. Effects of five rice herbicides on the growth of two threatened aquatic ferns[J].Ecotoxicology&EnvironmentalSafety. 2006, 63(3): 463-468.
[5] Lin X, Zhao Y, Fu Q,etal. Analysis of culturable and unculturable microbial community in bensulfuron-methyl contaminated paddy soils[J]. 环境科学学报(英文版). 2008, 20(12): 1494-1500.
[6] Chen HL, Yao J, Wang F,etal. Acute toxic effects of three pesticides onPseudomonasputidamonitored by microcalorimetre[J].JournalofEnvironmentalScience&Health,PartB. 2009, 44(2): 157-163.
[7] Xie XM, Liu WP, Subhani A. Rapid degradation of bensulphuronmethyl upon repeated application in paddy soils[J]. 环境科学学报(英文版). 2004, 16(1): 49-52.
[8] Cabrera A, Trigo C, Cox L,etal. A comparative study of the use of organoclay-based formulations and organic amendment to reduce the leaching of the herbicide MCPA in Soil[J].CleanSoilAirWater. 2010, 36(12): 990-995.
[9] Garrity GM, Bell JA, Lilburn TG. Bergey’s Manual of Systematic Bacteriology, second edition[M]. New York:BerlinHeideberg. 2004.5: 118-130.
[10] 李阳阳. 苄嘧磺隆降解菌株的分离、降解特性及降解途径研究[D]. 南京: 南京农业大学, 2013:5- 20.
[11] Zhu YW, Zhao YH, Lin XY,etal. Isolation, characterizaiton and phylogenetic analysis of an aerobic bacterium capable of degrading bensulfuronmethyl[J].WorldJournalofMicrobiology&Biotechnology. 2005, 21(6): 1195-1200.
[12] 张松柏, 张德咏, 罗香文, 等. 一株降解苄嘧磺隆光合细菌的分离鉴定及其降解特性[J]. 生态环境. 2008, 17(5): 1774-1777.
[13] Lin XY, Wang Y, Wang HL,etal. Isolation and characterization of a Bensulfuron-methyl-degrading strain L1 ofBacillus[J].Pedosphere. 2010, 20(1):111-119.
[14] Xiong M, Li C, Pan J,etal. Isolation and characterization ofRhodococcussp. BX2 capable of degrading bensulfuron-methyl[J].AfricanJournalofMicrobiologyResearch. 2011, 5(25): 4296-4302.
[15] 彭星星, 罗建军, 刘承兰, 等. 苄嘧磺隆降解菌BP-H-01的分离及降解特性[J]. 西北农林科技大学学报. 2009, 37(5): 155-160.
[16] Peng X, Huang J, Liu C,etal. Biodegradation of bensulphuron-methyl by a novelPenicilliumpinophilumstrain, BP-H-02.JournalofHazardousMaterials. 2012, s213-214(3): 216-221.
[17] Sabadie J. Alcohoysis and chemical hydrolysis of bensulfuron-methyl[J].WeedResearch. 2010, 36(5): 441-448.
[18] Maatallah M, Vading M, Kabir MH,etal.Klebsiellavariicolais a frequent cause of bloodstream infection in the stockholm area, and associated with higher mortality compared toK.pneumoniae[J].PLOSONE. 2014, doi: 10.1371/journal.pone.0113539.
[19] Holt KE, Wertheim H, Zadoks RN,etal. Genomic analysis of diversity, population structure, virulence, and antimicrobial resistance inKlebsiellapneumoniae, an urgent threat to public health[J].PNAS. 2015, doi: 10.1073/pnas.1501049112.
[20] Schukken Y, Chuff M, Moroni P,etal. The “other” gram-negative bacteria in mastitis:Klebsiella, serratia, and more.VeterinaryClinicsofNorthAmericaFoodAnimalPractice. 2012, 28(2):239-256.
[21] Brisse S, Fevre C, Passet V,etal. Virulent clones ofKlebsiellapneumoniae: identification and evolutionary scenario based on genomic and phenotypic characterization[J].PLOSONE. 2009, 4(3):e4982.
[22] Pinto-Tomás AA, Anderson MA, Suen G,etal. Symbiotic nitrogen fixation in the fungus gardens of leaf-cutter ants[J].Science. 2009, 326(5956): 1120-1123.
[23] Dong YM, Chelius MK, Brisse S,etal. Comparisons between twoKlebsiella: the plant endophyteK.pneumoniae342 and a clinical isolateK.pneumoniaeMGH78578.Symbiosis. 2003, 35(1): 247-259.
[24] Tahmourespour A, Tabatabaee N, Khalkhali H,etal. Tannic acid degradation byKlebsiellastrains isolated from goat feces[J].IranianJournalofMicrobiology. 2016, 8(1): 14-20.
Isolation,GrowthandDegradationCharacteristicsofBensulfuron-methylDegradingStrain
CHENSen,WANGHuan,LUMin,HANLi-zhen*
(CollegeofLifeSciences,GuizhouUniversity,Guiyang,Guizhou550025,China)
Bensulfuron-methyl(BSM) is a kind of sulfonylurea herbicide and widely used to control broad-leaf weeds in paddy fields. Over-utilization can have negative impact on damaging sensitive succeeding crops because of BSM’s long persistence. Microbial degradation was considered to be the main mechanisms of reducing bensulfuron-methyl herbicide in soil. In this study, A BSM-degrading bacterium, strain 75B, was isolated from paddy soil used this herbicide several years. It was identified asKlebsiellapneumoniaebased on its morphological, physiological, biochemical properties, and phylogenetic analysis of 16S rDNA sequences. Strain 75B grew well at pH 5.0 to 9.0, 0.5% to 5.0% NaCl concentration and temperature range from 26℃ to 38℃. Under optimal conditions (5% inoculum size, pH 7.0 minimal salt medium containing 2.0% NaCl concentration, culture temperature 34℃), 74.11% of the initially added BSM (50 mg/L) was degraded after 5 days and almost complete degradation (97.65%) could be achieved after 10 days. These results revealed that 75B can biodegrade bensulfuron-methyl efficiently and could potentially be used to bioremediate sulphonylurea herbicides contamination.
Bensulfuron-methyl degrading bacteria;Klebsiellapneumoniae; growth and degrading characteristics
2017-06-28;
2017-09-19
贵州省自然科学基金项目(黔科合J字[2014]2065号)。
*
韩丽珍(1972-),女,博士,教授,硕士生导师,主要研究方向:环境微生物及微生物生态学;E-mail: hanlizhen11@163.com。
Q939.9
A
1008-0457(2017)05-0046-07国际DOI编码10.15958/j.cnki.sdnyswxb.2017.05.008
