骨髓基质干细胞在脑缺血疾病治疗的新进展
2017-11-20项永生徐如祥
项永生 徐如祥
骨髓基质干细胞在脑缺血疾病治疗的新进展
项永生 徐如祥
成人骨髓基质干细胞是源于骨髓的一种多潜能成体干细胞。它们的移植改善脑缺血模型和脊髓损伤模型的机制可能包括替换受损细胞,神经功能保护作用,诱导轴突生长和促进新生血管形成。其应用于细胞治疗的主要优势在于其可以自体移植,因而不存在胚胎干细胞移植所存在的免疫排斥、伦理学及致瘤性等方面的限制;不像神经干细胞主要位于脑室下带、海马等结构中,因而细胞来源有限,获得困难。因此,这种干细胞移植疗法可能在未来的临床治疗具有重大意义。
骨髓基质干细胞; 脑缺血性疾病; 干细胞治疗
成人骨髓基质干细胞 (human bone marrow stromal stem cells,hBMSCs)是源于骨髓的一种多潜能成体干细胞,其移植改善脑缺血模型和脊髓损伤模型的机制可能包括替换受损细胞、神经功能保护作用、诱导轴突生长和促进新生血管形成。在成人脑卒中受试者中静脉给予注射hBMSCs的初步临床研究已经开展,目前还在评估中。在这里,笔者回顾在中风模型中hBMSCs移植用于细胞修复和神经保护的特性,描述静脉注射hBMSCs对脑卒中患者的影响,同时展望hBMSCs细胞移植的发展前景。
一、脑卒中治疗新进展
尽管缺血灶面积保持不变或扩大,脑卒中患者或动物模型在康复期间都会出现不同程度自发神经功能恢复[1,2]。这些结果表明,随着康复时间的延长,神经可塑性代偿或是大脑的重塑可能有助于神经功能恢复。干细胞移植疗法将有助于促进功能恢复或是提高内源性自我修复过程[3]。而对神经系统疾病的干细胞治疗方法,早期的假设是干细胞将取代受伤的细胞。然而,目前的研究提出了几种可能的作用机制,包括干细胞可以释放或刺激释放趋化因子、神经保护、促进新生血管形成和轴突生成。这些不同的影响并不是相互排斥的,细胞疗法可能是多种治疗作用机制在不同的地点和时间点共同作用的结果。本文将阐述hBMSCs在治疗脑卒中患者中的经验。
二、骨髓来源的间充质干细胞
在胚胎发育过程中,中胚层含有多潜能祖细胞,能够分化形成软骨、骨、肌肉和其他的间充质组织。研究表明,hBMSCs可以通过不同的信号通路分化为多个不同类型细胞系[4,5]。其他研究也证实hBMSCs具有自我更新和多分化潜能,分化成成骨细胞、脂肪细胞和软骨细胞[6-10]。hBMSCs也被认为可以分化成神经元和神经胶质细胞[7,11-14]。然而,有学者对hBMSCs是否能进入脑内并分化成神经元或是神经胶质细胞提出异议[15]。在体内,hBMSCs没有明确的标记,并且局部微环境不同细胞特征混淆,因此对其鉴定比较困难[16]。
在本综述中不讨论hBMSCs的复杂性和特异性。只专注于通过流式细胞技术挑选CD34-、CD45-、CD73+和CD105+的hBMSCs移植对脑卒中患者潜在的修复能力[10,17]。
三、hBMSCs移植在脑卒中模型中的作用
鼠脑缺血后hBMSCs移植几小时到几天即可减少梗死面积,改善神经功能在鼠脑缺血模型[18-20]。静脉注射hBMSCs后磁共振成像或组织切片均显示梗塞灶体积的减小,并有功能性恢复(图1)[17,21,22]。hBMSCs这些积极的作用机制包括神经保护作用、血管生成、神经再生和轴突发芽/再生[18,23,24]。

图1 成人骨髓基质干细胞注射后梗塞灶体积的减小并获得功能性恢复
四、hBMSCs神经保护作用
在脑缺血局灶区,hBMSCs释放生长因子和趋化因子或是刺激残存的细胞释放生长因子和趋化因子,加快缺血局灶区的修复或是重建,这对脑缺血区是有积极的意义[25]。事实上,在脑卒中模型中,给予静脉注射hBMSCs能够减少缺血局灶区细胞的凋亡,同时促进内源性细胞的增殖[26]。在体外培养中,hBMSCs能够分泌少量的多种神经趋化因子;在体内缺血局灶区,移植的hBMSCs周围也检测出神经趋化因子和血管生成因子。脑源性神经趋化因子(brain derived neurotrophic factor,BDNF)在hBMSCs培养中发现少许表达,然而在鼠大脑中动脉栓塞模型中,静脉给予注射hBMSCs能发现在缺血局灶区BDNF表达明显增加[22,27]。BDNF基因改造的hBMSCs移植能显著提高缺血局灶区BDNF表达水平及增强治疗效果;在脊髓损伤模型中也观察到同样的效果,同时还发现脊髓神经束轴突的再生[28]。这种以细胞为基础的治疗方法对损伤部位提供趋化因子相对于系统性全身给药的不利影响具有潜在的优势。
五、血管生成刺激
传统认为hBMSCs能够分泌血管生成因子,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)和促血管生成素-1(angiopoietin-1,Ang-1)[29,30]。 VEGF 在脑组织中具有强大的血管生成能力及生成不成熟的新生血管[31,32]。然而,在脑缺血局灶区VEGF增强血管的通透性,血浆蛋白从血管内漏出导致脑水肿[33]。直接注射VEGF到神经系统中,能导致血脑屏障的开放[34]。在脑内,Ang-1参与血管的成熟、稳定和血管的重塑,并促进血管的生成[30,35-37]。Ang-1保护血管的通透性,减少血浆蛋白的漏出,在缺血局灶区减少脑水肿,其作用机制是通过酪氨酸激酶受体Tie2受体家族信号通路促进新生血管的成熟及稳定,减少渗漏(图2)[38-41]。
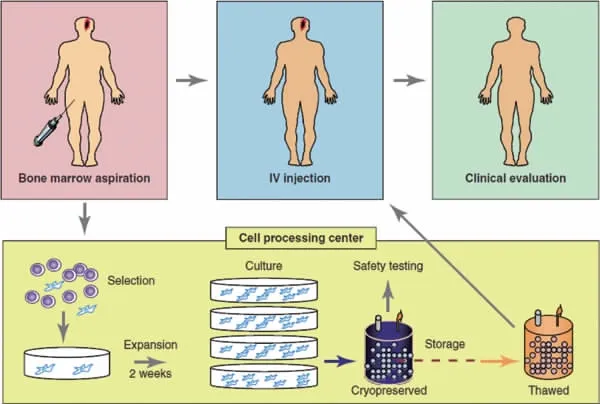
图2 自体骨髓间充质干细胞原理流程图
创伤性脑损伤后由于血脑屏障的破坏,血管通透性增加,细胞从血管壁游出,导致脑水肿[42]。同样,脑卒中后,由于血脑屏障的破坏,血管通透性增强,细胞渗漏增加,水肿明显,给予移植hBMSCs将可能通过Ang-1信号通路招募内皮细胞稳定微血管作用,减轻脑水肿。研究也证实,在脑缺血模型中,静脉内给予经基因改造的Ang-1-hBMSCs比单独给予hBMSCs更能产生更多新生血管和更好的神经功能康复。相反,静脉给予经基因改造的VEGF-hBMSCs反而增加神经功能的缺失,这和VEGF导致的血管通透性增加有关。然而,Miki等[43]研究却认为给予经基因改造的VEGF-hBMSCs比单独给予hBMSCs有更大的治疗作用。因此,VEGF表达水平具有潜在的治疗意义。静脉内给予经基因改造的Ang-1-VEGF-hBMSCs将会导致更多的新生血管形成和更好的神经功能恢复。
周细胞是hBMSCs的主要来源之一[5,44]。假设脑缺血性损伤后,周细胞被破坏,hBMSCs的移植具有微血管修复作用,那么周细胞将是hBMSCs靶向治疗微血管修复的重要靶点。
六、刺激神经生成和轴突发芽
在侧脑室室管膜下区(subventricular zone,SVZ)和齿状回,成年哺乳动物的大脑能产生新的神经元前体细胞[45]。这些细胞的一个亚群表达祖细胞的标记巢蛋白。在SVZ神经前体细胞通过嘴侧迁移流迁移到嗅球,然后分化成神经元[46]。脑缺血后,在SVZ祖细胞的数量增加;研究表明hBMSCs移植增加祖细胞数量[3,26]。Shen等[24]研究表明,在hBMSCs移植治疗缺血性脑损伤突触素表达增加,提示轴突发芽的增加。
七、经静脉给予hBMSCs的临床研究
在一项可行性、疗效、安全使用扩增培养的hBMSCs治疗脑卒中患者的研究中,Bang等[47]按随机化原则随机分配30例大脑中动脉(middle cerebral artery,MCA)脑梗死患者,均表现出严重的神经功能障碍。其中5例患者接受静脉注射1×108hBMSCs。对照组和hBMSCs输入组的预处理特征(临床和放射学)是一致的。入院后1周开始抽吸骨髓,分离出单个核细胞,等细胞贴壁后,选取贴壁细胞用含有胎牛血清的培养基进行扩增培养。表面标记物为CD34-、CD45-、SH2+和SH4+的细胞被定义为hBMSCs,在症状出现后4~5周和7~9周给予两个静脉输注,每个输注为5×107个细胞,并对2组患者进行1年的研究学习。
在Bang等[47]研究中,患者有大面积的MCA脑梗死缺血灶,随访影像资料为弥散加权成像的MRI进行记录。采用巴塞尔指数测量方法进行评估,hBMSCs输注组患者显示更好的神经功能恢复,重要的是,hBMSCs输注组患者无一例死亡、再次脑卒中或是更加严重的时间发生。本研究结果显示hBMSCs运用的安全性和适度的神经功能改善,但是由于患者数量较少,研究具有局限性。但是其5年随访也证实hBMSCs移植在脑卒中患者中没有发生不良反应事件[48]。
有报道描述一个Ⅰ期研究,12例脑卒中患者接受了静脉注射自体hBMSCs[49]。安全性评估第1次在非人灵长类动物模型的建立[50]。本研究的总体结构如图3概述。在这项研究中患者入院后数周内,抽吸骨髓物,细胞贴壁后,取贴壁细胞与来自患者的血清进行培养,这种培养方式具有很高的同质性[10,51]。 这些患者的细胞表面抗原(CD34-,CD45-,CD73+和CD105+)具有很高的同质性。这些细胞在体外进行扩增,安全性评估和抗原表型分析后,冷冻保存。同一天静脉给予这些细胞。
12例患者行hBMSCs移植后对其进行1年多的MRI影像学观察未发现肿瘤或异常细胞生成。细胞输注后的第1周国家卫生署脑卒中评分有改善,病灶体积有所缩小;有些患者细胞输注后最初的2周神经功能显著改善(图3)。此外,还有患者细胞输注后最初的2周病灶体积变小(图3B),与病灶体积减少的是神经功能改善(图3C)[49]。相关评估显示没有严重的不良反应。
作为一个临床Ⅰ期研究,这个研究没有进行双盲也没有安慰剂作对照,其结果不可靠。在这些患者中细胞输注后,发生自发性的功能恢复不能排除。然而,在脑卒中患者接受细胞输注的36~136 d里,缺血灶明显缩小,神经功能恢复明显好转,这些均鼓励进一步研究。
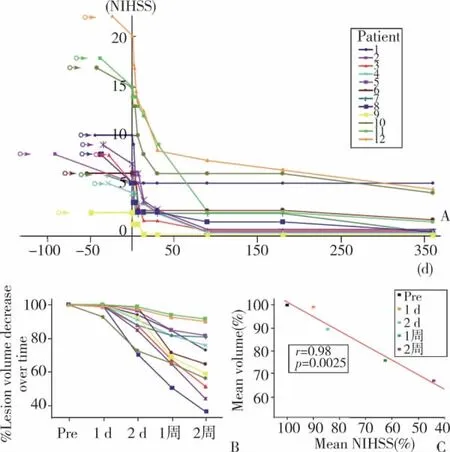
图3 12例脑卒中患者静脉注射自体骨髓基质干细胞的数据统计
七、结束语和展望
在一些神经系统疾病中系统性给予hBMSCs细胞治疗的研究已检查并证实是相对安全的[47,49]。最佳的治疗方案、移植细胞的数量、制备方式和移植的时间点都需要进一步研究。早期进行细胞输注后,可通过调节hBMSCs释放兴奋因子(如BDNF)获得有益的影响。hBMSCs还可以提供招募神经元的营养支持,尤其是在半影中;抗炎反应减少神经脑水肿,从而导致增强脑组织的保护。随着时间的增加,hBMSCs可促进新生血管形成、血管稳定和血脑屏障的重塑,从而保护中枢神经系统的组织和限制性脑水肿。hBMSCs也可以刺激缺血局灶区轴突出芽和新的突触连接。而且,hBMSCs能够招募缺血局灶区祖细胞有助于神经髓鞘和轴突的发生。这些潜在的作用机制值得进一步研究。希望今后的临床研究,可以最终确定治疗干预,通过细胞或无细胞的方法,在亚急性和慢性早期阶段能够积极影响细胞的存活和提高脑卒中的临床观察。
[1] Cramer SC,Finklestein SP,Schaechter JD,et al.Activation of distinct motor cortex regionsduring ipsilateral and contralateral finger movements[J].J Neurophysiol,1999,81(1):383-387.
[2] Jiang Q,Ewing JR,Zhang ZG,et al.Magnetization transfer MRI:application totreatment of middle cerebral artery occlusion in rat[J].J Magn Reson Imaging,2001,13(2):178-184.
[3] Chopp M,Zhang ZG,Jiang Q.Neurogenesis,angiogenesis,and MRI indices offunctional recovery from stroke[J].Stroke,2007,38(2 Suppl):827-831.
[4] Caplan AI.Mesenchymal stem cells[J].J Orthop Res,1991,9(5):641-650.
[5] Caplan AI,Correa D.The MSC:an injury drugstore[J].Cell Stem Cell,2011,9(1):11-15.
[6] Caplan AI. Review: mesenchymal stem cells: cellbasedreconstructive therapy in orthopedics[J].Tissue Eng,2005,11(7-8):1198-1211.
[7] Prockop, DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues[J].Science,1997,276(5309):71-74.
[8] Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1997,284(5411):143-147.
[9] Sanchez-Ramos J,Song S,Cardozo-Pelaez F,et al.Adult bone marrow stromal cellsdifferentiate into neural cells in vitro[J].Exp,Neurol,2000,164(2):247-256.
[10] KobuneM,KawanoY,ItoY,etal.Telomerized human multipotent mesenchymalcells can differentiate into hematopoietic and cobblestone areasupportingcells[J].Exp Hematol,2003,31(8):715-722.
[11] Azizi SA,Stokes D,Augelli BJ,et al.Engraftment and migration of human bonemarrow stromal cells implanted in the brains of albino rats–similarities to astrocyte grafts[J].Proc Natl Acad Sci U S A,1998,95(7):3908-3913.
[12] Brazelton TR,Rossi FM,Keshet GI,et al.From marrow to brain:expression ofneuronal phenotypes in adult mice[J].Science,2000,290(5497):1775-1779.
[13] Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromalcells differentiate into neurons[J].J Neurosci Res,2000,61(4):364-370.
[14] Kim S,Honmou O,Kato K,et al.Neural differentiation potential of peripheralblood-and bone-marrow-derived precursor cells[J].Brain Res,2006,1123(1):27-33.
[15] Massengale M,Wagers AJ,Vogel H,et al.Hematopoietic cells maintainhematopoietic fates upon entering the brain[J].J Exp Med,2005,201(10):1579-1589.
[16] Bianco P,Robey PG,Simmons PJ,et al.Mesenchymal stem cells:revisiting history,concepts,and assays[J].Cell Stem Cell,2008,2(4):313-319.
[17] Honma T,Honmou O,Iihoshi S,et al.Intravenous infusion of immortalized humanmesenchymal stem cells protects against injury in a cerebral ischemiamodel in adult rat[J].Exp Neurol,2006,199(1):56-66.
[18] Chen J,Li Y,Wang L,et al.Therapeutic benefit of intravenous administrationofbone marrow stromalcells after cerebral ischemia in rats[J].Stroke,2001,32(4):1005-1011.
[19] Li Y,Chen J,Chen XG,et al.Human marrow stromal cell therapy for stroke in rat:neurotrophins and functional recovery[J].Neurology,2002,59(4):514-523.
[20] Horita Y,Honmou O,Harada K,et al.Intravenous administration of glial cell linederivedneurotrophic factor gene-modified human mesenchymal stemcells protects against injury in a cerebral ischemia model in the adultrat[J].J Neurosci Res,2006,84(7):1495-1504.
[21] Iihoshi S,Honmou O,Houkin K,et al.A therapeutic window for intravenousadministration ofautologous bone marrow after cerebral ischemia inadult rats[J].Brain Res,2004,1007(1-2):1-9.
[22] Nomura T,Honmou O,Harada K,et al.I.V.infusion of brainderived neurotrophicfactor gene-modified human mesenchymal stem cells protects againstinjury in a cerebral ischemia model in adult rat[J].Neuroscience,2005,136(1):161-169.
[23] Liu H,Honmou O,Harada K,et al.Neuroprotection by PlGF gene-modified humanmesenchymalstem cellsaftercerebral ischaemia[J].Brain,2006,129(Pt 10):2734-2745.
[24] Shen LH,Li Y,Chen J,et al.One-year follow-up after bone marrow stromalcell treatment in middle-aged female rats with stroke[J].Stroke,2007,38(7):2150-2156.
[25] Chen X,Li Y,Wang L,et al.Ischemic rat brain extracts induce human marrowstromal cell growth factor production[J].Neuropathology,2002,22(4):275-279.
[26] Chen J,Li Y,Katakowski M,et al.Intravenous bone marrow stromal cell therapyreduces apoptosis and promotes endogenous cell proliferation afterstroke in female rat[J].J Neurosci Res,2003,73(6):778-786.
[27] Kurozumi K,Nakamura K,Tamiya T,et al.BDNF gene-modified mesenchymal stemcells promote functional recovery and reduce infarct size in the ratmiddle cerebral artery occlusion model[J].Mol Ther,2004,9(6):189-197.
[28] Sasaki M,Radtke C,Tan AM,et al.BDNF-hypersecreting human mesenchymalstem cellspromote functionalrecovery,axonal sprouting,and protection of corticospinal neurons after spinal cord injury[J].J Neurosci,2009,29(47):14932-14941.
[29] Toyama K,Honmou O,Harada K,et al.Therapeutic benefits of angiogenetic genemodifiedhuman mesenchymal stem cells after cerebral ischemia[J].Exp Neurol,2009,216(1):47-55.
[30] Onda T,Honmou O,Harada K,et al.Therapeutic benefits by human mesenchymalstem cells(hMSCs)and Ang-1 gene-modified hMSCs after cerebralischemia[J].J Cereb Blood Flow Metab,2008,28(2):329-340.
[31] Zhang Z,Chopp M.Vascular endothelial growth factor andangiopoietins in focal cerebral ischemia[J].Trends Cardiovasc Med,2002,12(2):62-66.
[32] Carmeliet P, Collen D. Molecular analysis of blood vesselformation and disease[J].Am J Physiol,1997,273(Pt 2):H2091-H2104.
[33] Bates DO,Hillman NJ,WilliamsB,etal.Regulation of microvascular permeability byvascular endothelial growth factors[J].J Anat,2002,200(6):581-597.
[34] Sasaki M,Lankford KL,Brown RJ,et al.Focal experimental autoimmune encephalomyelitis in the Lewis rat induced by immunization withmyelin oligodendrocyte glycoprotein and intraspinal injection ofvascular endothelial growth factor[J].Glia,2010,58(13):1523-1531.
[35] Suri C,McClain J,Thurston G,et al.Increased vascularization in miceoverexpressing angiopoietin-1[J].Science,1998,282(5388):468-471.
[36] Yancopoulos GD,Davis S,Gale NW,et al.Vascular-specific growth factors andblood vessel formation[J].Nature,2000,407(6801):242-248.
[37] Ward NL,Lamanna JC.The neurovascular unit and itsgrowth factors:coordinated response in the vascular and nervoussystems[J].Neurol Res,2004,26(8):870-883.
[38] Thurston G,Suri C,Smith K,et al.Leakage-resistant bloods in micetransgenically overexpressing angiopoietin-1[J].Science,1999,286(5449):2511-2514.
[39] Sundberg C,Kowanetz M,Brown LF,et al.Stable expression of angiopoietin-1 and othermarkers by cultured pericytes:phenotypic similarities to asubpopulation of cells in maturing vessels during later stages ofangiogenesis in vivo[J].Lab Invest,2002,82(4):387-401.
[40] Baffert F,Le T,Thurston G,et al.Angiopoietin-1 decreases plasma leakage byreducing number and size of endothelial gaps in venules[J].Am J Physiol Heart Circ Physiol,2006,290(1):H107-H118.
[41] Carmeliet P.Blood vessels and nerves:common signals,pathways and diseases[J].Nat Rev Genet,2003,4(9):710-720.
[42] Dore-Duffy P,Owen C,Balabanov R,et al.Pericyte migration from the vascular wall inresponse to traumatic brain injury[J].Microvasc Res,2000,60(1):55-69.
[43] Miki Y,Nonoguchi N,Ikeda N,et al.Vascular endothelial growth factor gene-transferred bone marrow stromal cells engineered with a herpes simplex virus type 1 vector can improve neurological deficits and reduced infarction volume in rat brain ischemia[J].Neurosurgery,2007,61(3):586-594.
[44] Crisan M,Yap S,Casteilla L,et al.A perivascular origin for mesenchymal stemcells in multiple human organs[J].Cell Stem Cell,2008,3(3):301-313.
[45] Alvarez-Buylla A,Lim DA.For the long run:maintaininggerminal niches in the adult brain[J].Neuron,2004,41(5):683-686.
[46] Luskin MB,Zigova T,Soteres BJ,et al.Neuronal progenitor cells derived from theanterior subventricular zone of the neonatal rat forebrain continue toproliferate in vitro and express a neuronal phenotype[J].Mol Cell Neurosci,1997,8(5):351-366.
[47] Bang OY,Lee JS,Lee PH,et al.Autologous mesenchymal stem celltransplantation in stroke patients[J].Ann Neurol,2005,57(6):874-882.
[48] Lee JS,Hong JM,Moon GJ,et al.A long-term follow-up study of intravenousautologous mesenchymal stem cell transplantation in patients withischemic stroke[J].Stem Cells,2010,28(6):1099-1106.
[49] Honmou O,Houkin K,Matsunaga T,etal.Intravenous administration of auto serumexpandedautologous mesenchymal stem cells in stroke[J].Brain,2011,134(Pt16):1790-1807.
[50] Sasaki M,Honmou O,Radtke C,et al.Development of a middle cerebral arteryocclusion model in the nonhuman primate and a safety study of I.V.infusion of human mesenchymal stem cells[J].PLoS ONE,2011,6(10):e26577.
[51] Majumdar MK,Thiede MA,Mosca JD,et al.Phenotypic and functional comparison ofcultures of marrow-derived mesenchymal stem cells(MSCs)andstromal cells[J].J Cell Physiol,1998,176(1):57-66.
2016-06-13)
(本文编辑:张丽)
项永生,徐如祥.骨髓基质干细胞在脑缺血疾病治疗的新进展[J/CD].中华神经创伤外科电子杂志,2017,3(5):300-304.
New progress of bone marrow mesenchymal stem cells in the treatment of cerebral ischemic diseases
Xiang Yongsheng,Xu Ruxiang.Affiliated Bayi Brain Hospital,PLA General Hospital,Beijing 100700,China
Corresponding author:Xu Ruxiang,Email:xuruxiang1123@163.com
Adult bone marrow stromal stem cells(hBMSCs)is a kind of multi potential adult stem cells derived from bone marrow.The model mechanisms of transplantation to improve cerebral ischemia model and spinal cord injury model may include replacing damaged cells,protective effect of nerve function,the induction of axon growth,and the formation of new blood vessels.Its main advantage is that it can be used in cell therapy,so there is no limit to the immune rejection,ethical problems and tumorigenicity caused by embryonic stem cell transplantation;its material is easy to be obtained,unlike neural stem cells,which are mainly located in the lower zone of the brain and hippocampus,the cell source is limited,so it is difficult to obtained.Therefore,this stem cell transplantation therapy may be of great significance in the future clinical treatment.
Bone marrow stromal stem cells;Cerebral ischemic disease;Stem cell treatment
10.3877/cma.j.issn.2095-9141.2017.05.011
国家自然科学基金(81671189);全军医学科研十二五重点课题(BWS11J002)
100700北京,陆军总医院附属八一脑科医院
徐如祥,Email:zjxuruxiang@163.com
