胶质母细胞瘤鼠双微粒体2单核苷酸多态性易感性:Meta分析
2017-11-20秦家骏钟荣德陈先震
秦家骏 钟荣德 陈先震
胶质母细胞瘤鼠双微粒体2单核苷酸多态性易感性:Meta分析
秦家骏 钟荣德 陈先震
目的 对鼠双微粒体(MDM2)单核苷酸多态性与胶质母细胞瘤易感性的关联进行分析。 方法 本研究在PubMed、Google Scholar、中国知网、百度学术等数据库对相关检索词组合进行不限定检索,通过文献筛选,最终确定6篇病例对照研究中的样本为试验对象,对MDM2 SNP309与肿瘤的关联性进行Meta分析。 结果 Meta分析的结果表明,MDM2 SNP309杂合和纯合突变型与胶质母细胞瘤的易感性有关联,比值比(OR)=1.23[95%置信区间(CI):1.05~1.44],I2检验 P=0.288;杂合突变型尤为突出,OR=1.35(95%CI:1.05~1.73);按人种的亚组分析可知,高加索人的关联性较强,OR=1.30 (95%CI:1.08~1.57),I2检验 P=0.410。 结论 本研究中的 Meta分析提示了 MDM2 SNP309突变与胶质母细胞瘤发生的密切联系,强调了不同人种中关联程度的不同,突出了高加索人种中杂合型突变在易感性中发挥的作用。
鼠双微粒体基因SNP309; 胶质母细胞瘤; 遗传易感性; Meta分析
鼠双微粒体2(murine double minute 2 protein,MDM2)是一种p53蛋白的负反馈调节分子,在正常的体细胞内,p53促进MDM2的表达,MDM2可通过p53泛素化的介导将p53移出细胞核,并进行降解,从而限制p53的生物学功能,而p53是一种抑癌基因[1]。当MDM2过表达时,p53蛋白被过度抑制,从而间接促进肿瘤的形成[2]。应当引起注意的是,在胶质母细胞瘤的增殖过程中,MDM2过表达不仅可以对p53相关通路造成干扰,对非p53相关的基因组稳定性也可造成较大的影响[3]。
前期的研究发现,MDM2基因的启动子区存在一个单核苷酸多态性的位点rs2279774,简称MDM2 SNP309。当该位点的TT或TG变成GG时,MDM2启动子将更易于转录因子Sp1结合,从而增强MDM2的表达,进而会减弱p53通路的生物学功能[4,5]。进一步的研究中发现,在p53单个等位基因突变的各类肿瘤中,GG型MDM2可加速肿瘤的形成过程[6-10]。因此,在胶质母细胞瘤中,MDM2 SNP309可能是一个潜在的易感性生物标志物。
通过前期文献检索发现,目前已有多篇关于MDM2与肿瘤的关联性研究,并对其研究结果进行了一定的Meta分析,但尚缺乏针对胶质母细胞瘤的相关Meta分析[11-25]。通过进一步的检索,笔者发现,针对胶质母细胞瘤MDM2 SNP309的易感性分析各报道尚有不一致的结果,因而,本研究拟对这一基因位点与肿瘤的关联性进行Meta分析。
一、检索策略
通过对 “胶质母细胞瘤”、“多态性”、“变异性”、“MDM2”、“glioblastoma”、“polymorphism”、“variation”、“heterogeneity”等关键词进行拓展,在 PubMed、Google Scholar、中国知网、百度学术等网络搜索平台上进行检索,所有的检索不限定语言、发表时间,并对所有综述性文章中所引用相关结果进行进一步的检索。
二、纳入与排除标准
所有的文献符合下列标准:(1)文献为病例对照研究;(2)文献的研究对象为人类,动物、细胞模型等非人类活体研究则予以排除;(3)文献中应包括胶质母细胞瘤和健康人群的MDM2 SNP309基因的多态性、等位基因的详细数据;(4)文献不限取材方式,不限种族、性别、年龄,研究不限样本量,研究对象是否符合Hardy-Weinberg平衡,对基因型的分析方法应予以声明;(5)胶质母细胞瘤的诊断方式应为病理证实,健康人群的确认应为体检或全身影像学检查证实;不可患有除胶质母细胞瘤以外的其他肿瘤;(6)文献方法应基本符合Newcastle-Ottawa质量评价量表[26]。针对上述标准,有一条不符合者,则予以排除。
三、数据提取
由2位研究者独立进行数据提取,提取数据中的第一作者、发表年份、研究对象人种、年龄段、胶质母细胞瘤组和健康人群组基因型(野生纯合型、突变纯合型、突变杂合型)的数目、Hardy-Weinberg平衡的检验情况等信息。并将纳入研究的6篇文献Newcastle-Ottawa病例进行对照研究,对其质量评估表的评价情况进行详细记录。
四、遗传模型的选择
群体遗传学有多种遗传模型,AA表示野生纯合基因型,GA表示突变杂合基因型,GG表示突变醇和基因型。依次对下列模型的比值比(odds ratio,OR)进行合并:等位基因的比较GvsA;显性模型GG vsGA+AA;隐性模型GG+GAvsAA;超显性模型GG+AAvsGA;加性模型(GGvsAA,GAvsAA,GGvsGA)。
五、统计学分析
采用Stata14.1进行统计学计算,并将得到结果进行记录、汇总、归纳。
1.合并统计量的计算:胶质母细胞瘤与MDM2 SNP309的关联强度采用OR及其95%置信区间(confidence interval,CI)进行度量,按高加索人种、亚洲人种进行亚组的分析,根据I2检验结果来选择固定效应模型(Mantel-Haenszel模型)或随机效应模型(Dersimonian-Laird模型)进行Meta分析。
2.敏感性分析:采用单项排除的方法进行敏感性分析,并将不符合Hardy-Weinberg平衡或基因检测方法等混杂因素的研究剔除后再次进行敏感性分析,对结果进行前后对比,并作出讨论。根据文献的发表年份对数据进行累积Meta分析及趋势性检验,评估OR值的稳定性,根据稳定性对MDM2与胶质母细胞瘤的关联性进行评价。
3.发表偏畸的判断:利用伪95%CI的Begg漏斗图和Egger检验对文献发表偏畸进行评价。采用harbord法和peters法对漏斗图的对称性进行判断,当P>0.05时,提示漏斗图对称,未见明显发表偏畸。
结 果
一、纳入文献汇总
经过计算机检索,得到71篇文献。经过阅读题目和摘要,2篇非人类研究被排除,42篇因为不含有DM2 SNP309多态性被排除,剩余的27篇进行全文搜索,其中20篇因非病例对照研究予以排除,1篇因不含有野生型和突变型等位基因频率的相关信息而予以排除(图1)。通过上述标准,笔者获得6篇文献,6组数据,病例组996例,对照组635例。6篇文献在Meta分析前首先运用Newcastle-Ottawa量表进行方法学质量评价 (表1),6篇文献均采用了盲法,全部人群来自社区,对实验方法采取了严格的质量控制,保证了试验具有较好的可比性。6篇文献中2篇发表于2007年,3篇发表于2008年,1篇发表于2011年,分别来自中国、日本、美国、法国、瑞士、英国,2篇为亚洲人种的报道,4篇为高加索人种的报道[27-32]。1篇采用限制性片段长度多态性聚合酶链反应法进行检测外,其余5篇采用聚合酶链式反应测序进行检测[27]。除一篇不符合Hardy-Weinberg平衡外,其余5篇均符合该平衡[30]。详细信息见表2。
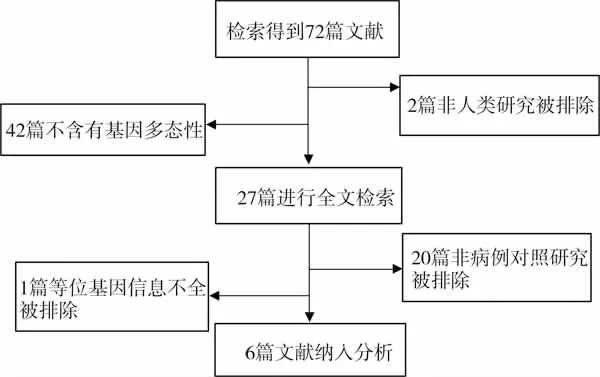
图1 文献筛选流程图
二、Meta分析结果汇总
1.等位基因频率的比较:病例组和对照组的等位基因进行比较,发现2组间突变型和野生型的比例具有显著差异(OR=1.23,95%CI:1.05~1.44,I2检验P=0.288);按人种进行进一步分析发现,亚洲人种未见明显差异(OR=1.05,95%CI:0.67~1.63,I2检验 P=0.151),高加索人种具有较大差异(OR=1.30,95%CI:1.08~1.57,I2检验 P=0.410),详细信息见图 2。
2.各遗传模型的比较:如图3~8所示,笔者分别对各遗传模型进行了OR的分析,并按人种亚组进行了亚族分析,结果表明,在总合并风险比中,隐性模型具有统计学意义,即具有GG和GA基因人群患有胶质母细胞瘤的风险是具有AA基因人群的1.36 倍(95%CI:1.08~1.72,I2检验 P=0.107),GA 基因人群的风险是AA人群的1.35倍 (95%CI:1.05~1.73,I2检验 P=0.109)。
按人种进行亚组分析则表明,携带GA基因的高加索人种的比AA基因的人群更具有患胶质母细胞瘤的危险性,OR=1.46(95%CI:1.10~1.95,I2检验P=0.075)。而在隐性模型中,I2检验P=0.049,接近0.050。为了更加充分地估计统计学异质性对合并结果的影响,采用随机效应模型进行计算,其结果表明,基因模式与患者胶质母细胞瘤的风险性之间不存在相关性,OR=1.57,95%CI:0.95~2.61。

表1 Newcastle-Ottawa病例对照研究研究质量评估表
3.敏感性分析:分别将不符合Hardy-Weinberg平衡的研究(Khatri等[30],2008)和采用 PCR-RFLP(杨军等[27],2011)检测法的研究剔除,进行敏感性分析,如图9~14所示,各研究结果中剔除某一研究后的合并OR值均位于总合并OR值的95%CI内,并与总合并效应并无明显差异,表明Hardy-Weinberg平衡是否满足和不同的基因检测方法对Meta分析的结果影响不大。
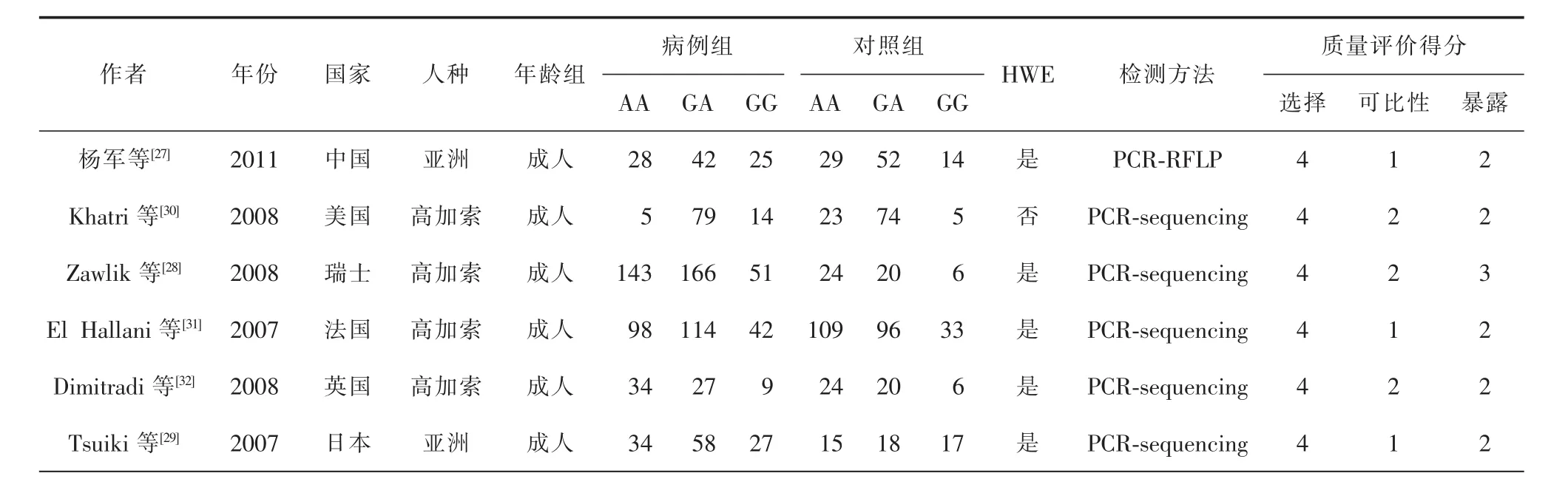
表2 纳入文献一般情况分析
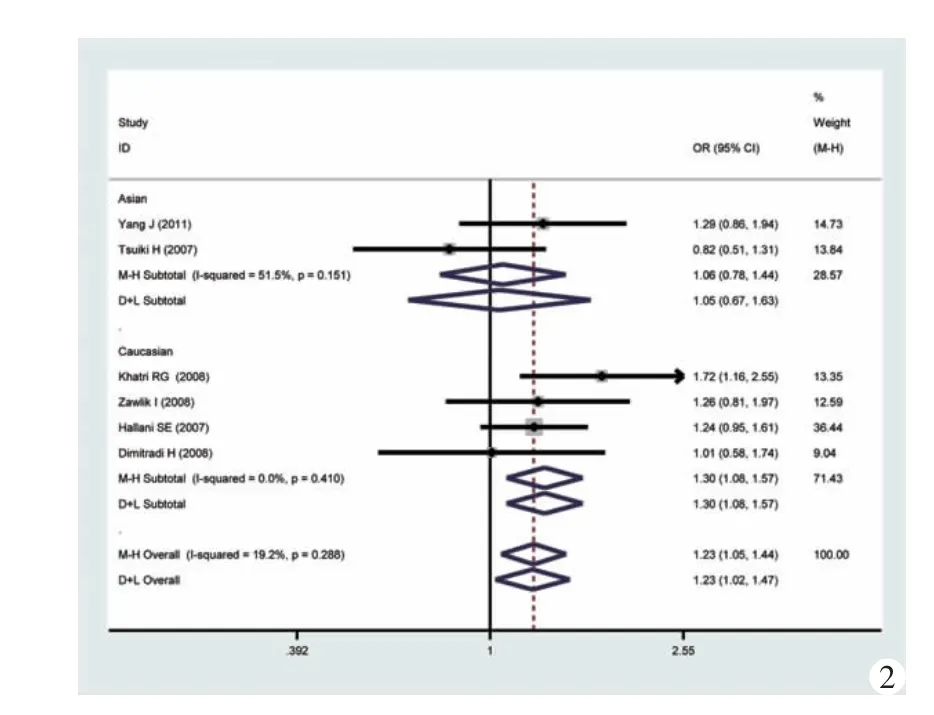
图2 等位基因频率比较
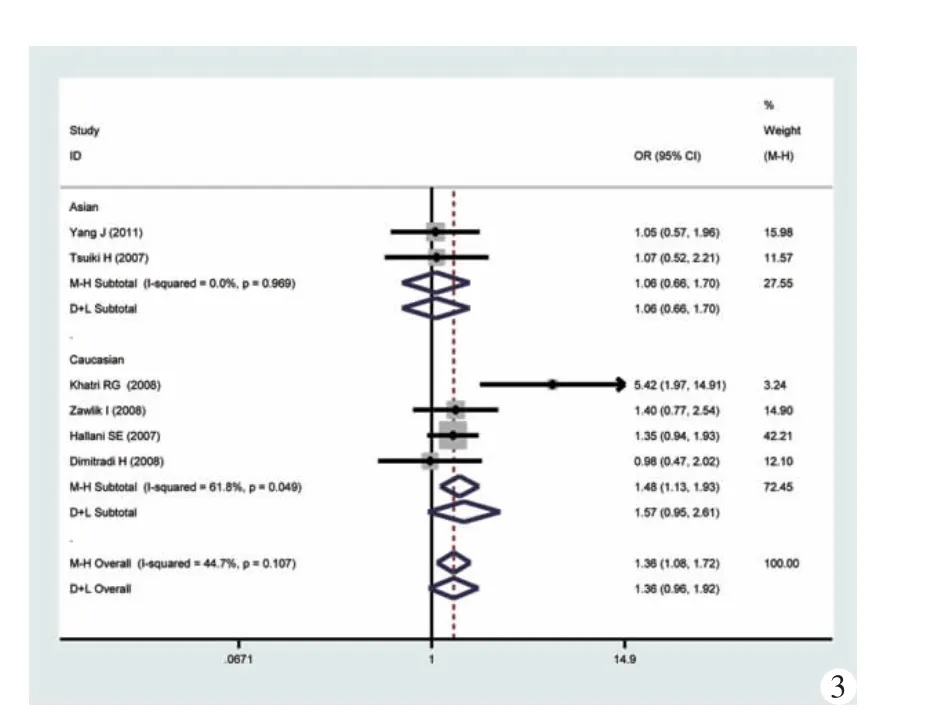
图3 隐性模型(GG+GA vs AA)的森林图及亚组分析
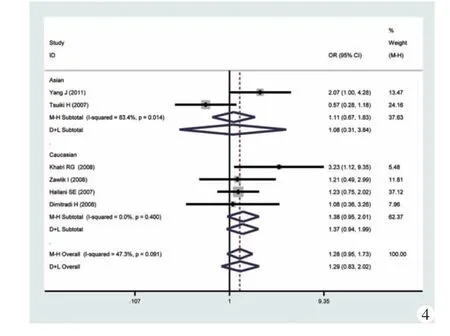
图4 显性模型(GG vs GA+AA)的森林图及亚组分析
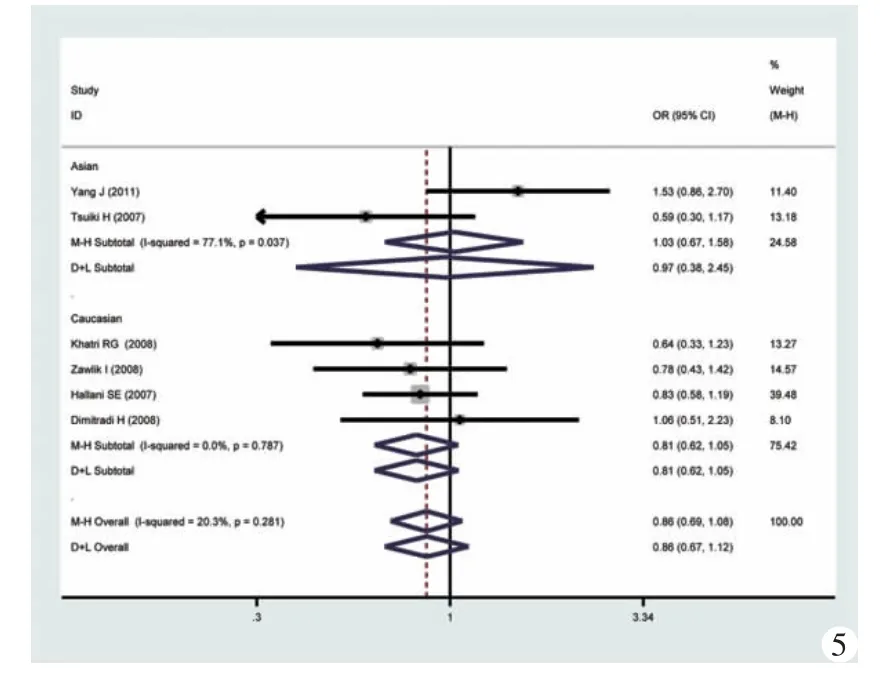
图5 超显性模型(GG+AA vs GA)的森林图及亚组分析
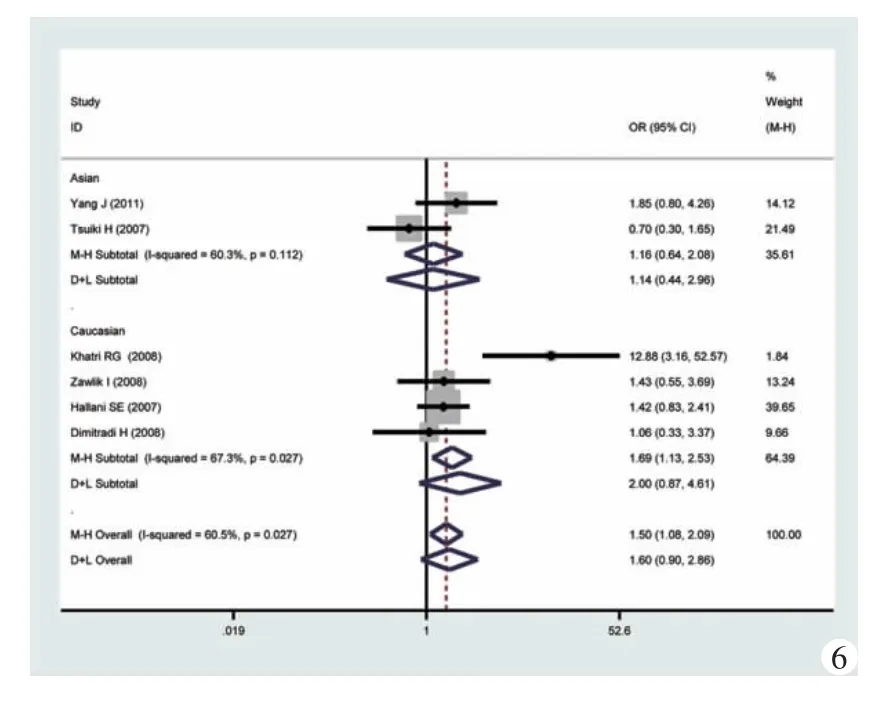
图6 加性模型(GG vs AA)的森林图及亚组分析
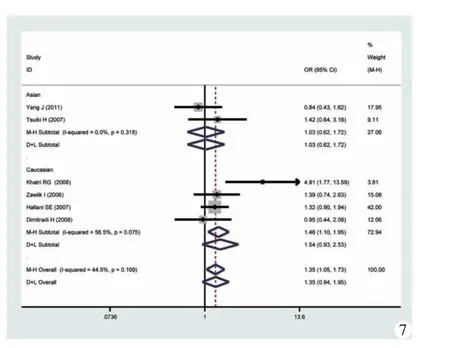
图7 加性模型(GA vs AA)的森林图及亚组分析
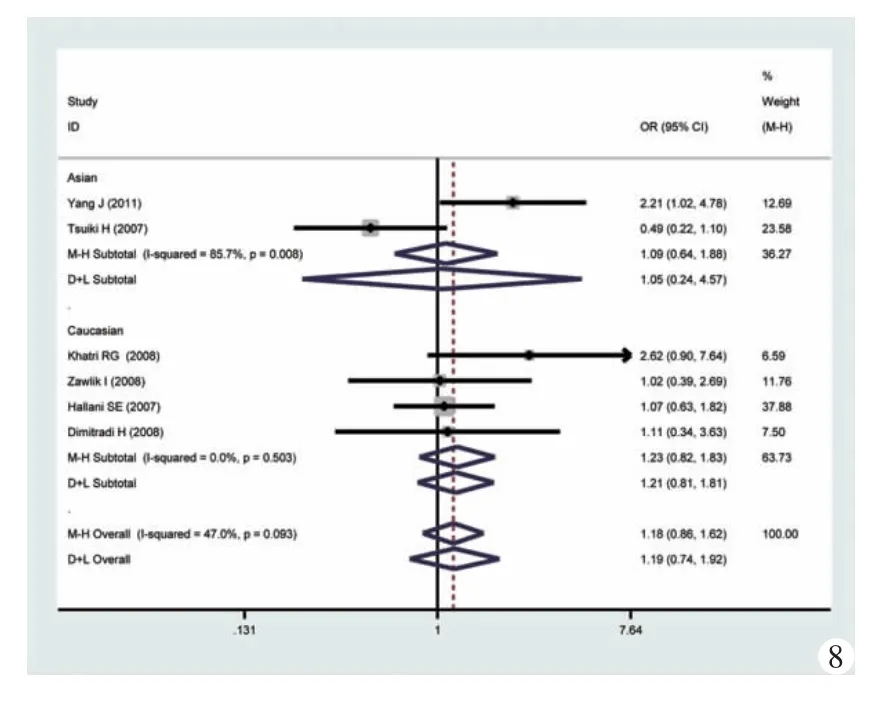
图8 加性模型(GG vs GA)的森林图及亚组分析
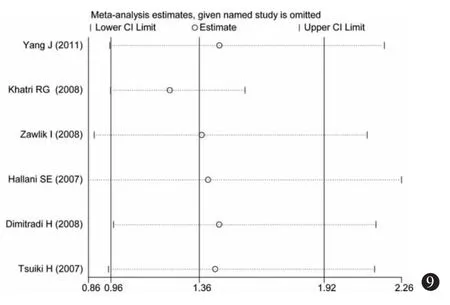
图9 隐性模型(GG+GA vs AA)的单项排除法敏感性分析
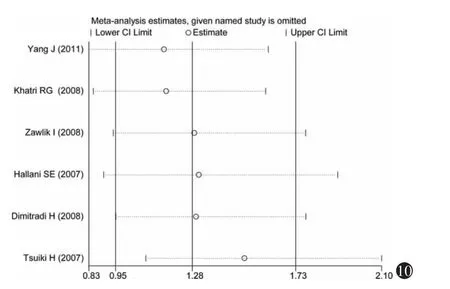
图10 显性模型(GG vs GA+AA)的单项排除法敏感性分析
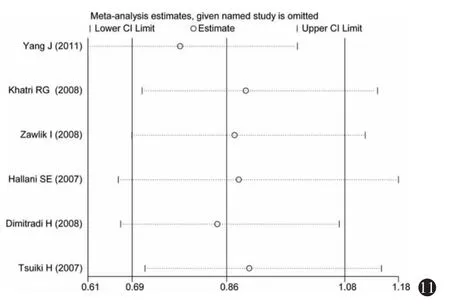
图11 超显性模型(GG+AA vs GA)的单项排除法敏感性分析
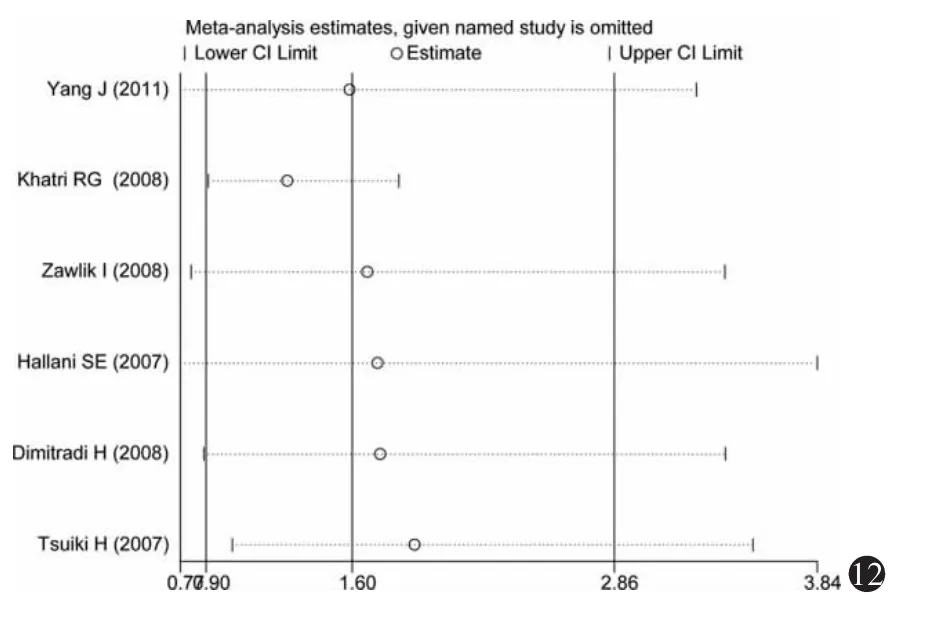
图12 加性模型(GG vs AA)的单项排除法敏感性分析
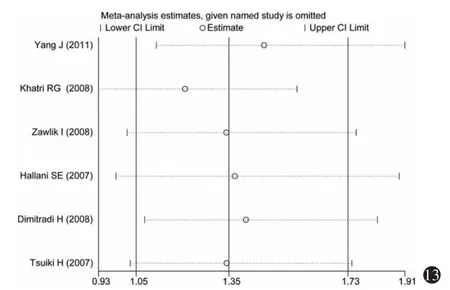
图13 加性模型(GA vs AA)的单项排除法敏感性分析
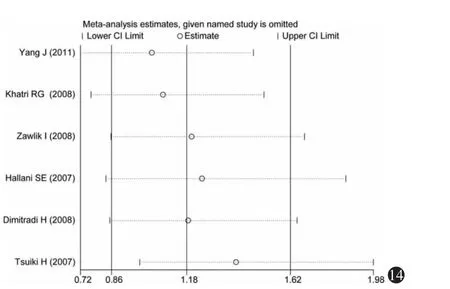
图14 加性模型(GG vs GA)的单项排除法敏感性分析
对隐性模型和GA与AA加性模型进行累计Meta分析,累计按发表年份的早晚进行,合并模型采用固定效应模型。如图15~16所示,2种模型OR的点估计值和可信区间并没有因为发表文章数量的累计而趋于稳定,各项研究结果的差异比较大,在α=0.05的标准下,2种模型的结果均在1998年的2篇文献发表后变得有统计学意义(P<0.05),该项分析表明本Meta分析所纳入的文献中缺乏大样本研究,同时体现了研究纳入的文献数量不足的问题,而尚不能确定本研究存在易变现象。
为了进一步探索易变现象存在的原因,对隐性模型和加性模型(GA vs AA)进行了累积Meta分析的趋势检验,如图17~18所示。趋势检验的计算表明,隐性模型中“最初”vs“后续”策略 P=0.495,GLS回归策略中排除第一项文献前后,回归系数为0.02880和0.02785,P=0.000和0.016;而加性模型(GA vs AA)中“最初”vs“后续”法,P=0.868,GLS 回归前后,回归系数为0.01277和0.02499,P=0.018和0.151,以上结果表明,两种模型中不存在易变现象,即纳入的各项文献的研究结果相对独立,后期文献受早期结果的影响相对较小。
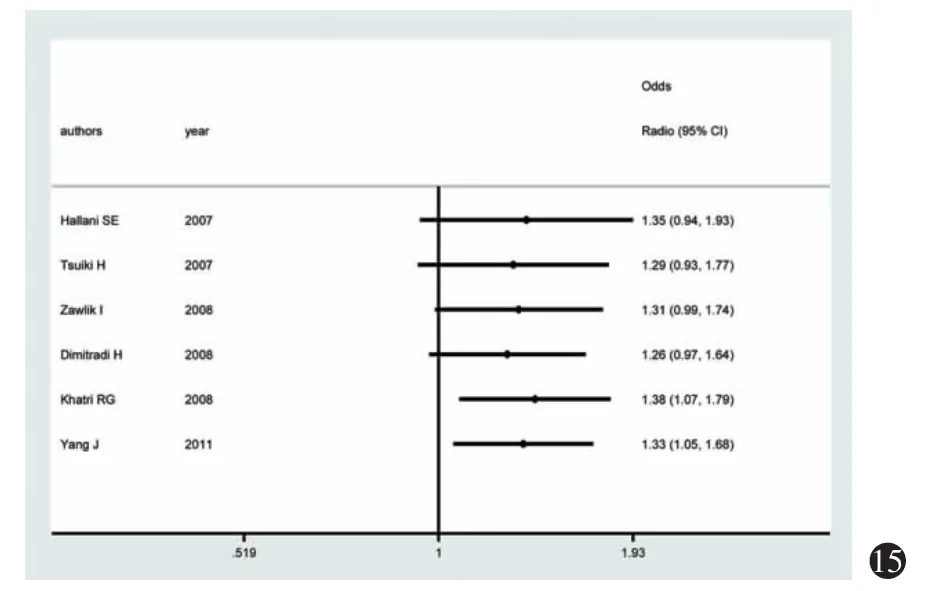
图15 隐性模型(GG+GA vs AA)的按发表年份累积Meta分析
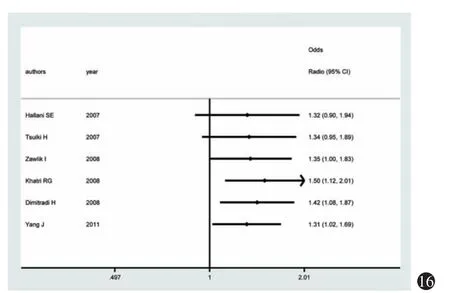
图16 加性模型(GA vs AA)的按年份发表累计Meta分析

图17 隐性模型(GG+GA vs AA)的累积Meta分析趋势检验
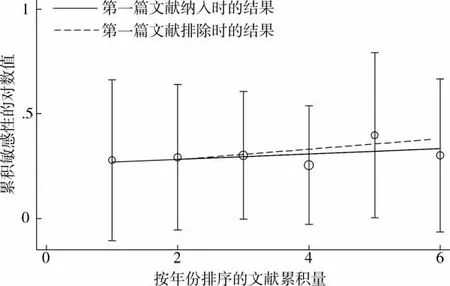
图18 加性模型(GA vs AA)的累积Meta分析趋势检验
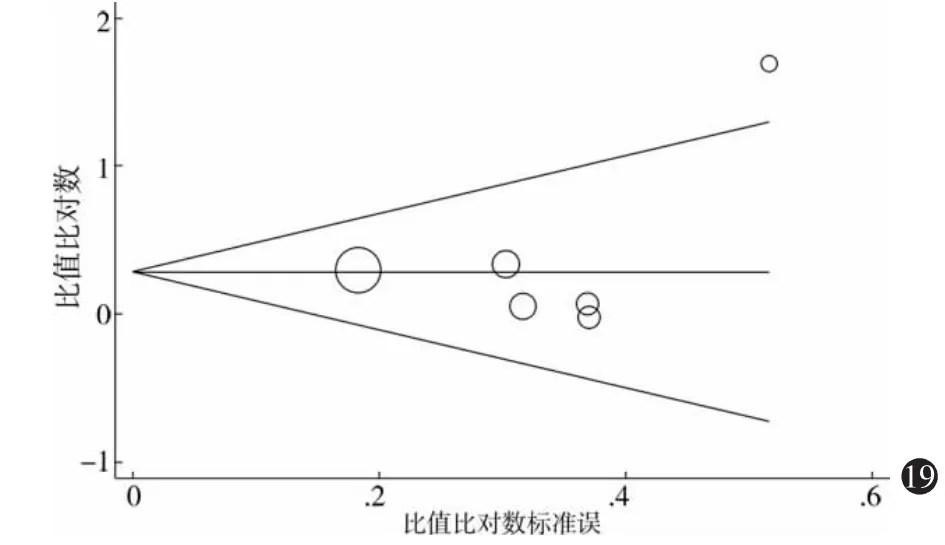
图19 伪95%置信区间的Begg漏斗图
4.发表偏畸分析:采用Begg漏斗图和Egger检验对发表偏畸进行分析,如图19所示,Pr>|z|=1.000,Egger检验P=0.517;隐性模型的Harbord和Peters漏斗图不对称检验,P=0.704和0.795;加性模型(GA vs AA),P=0.783,均提示漏斗图无明显不对称。
讨 论
本研究对MDM2 SNP309基因多态性与胶质母细胞瘤的关联性做了分析,结果表明MDM2 rs2279774位点TT突变为TG或GG时,患有胶质母细胞瘤的危险性增加,这一点在高加索人种中也得到了验证。在亚洲人种中,由于中国人与日本人的关联性不同,且文献中报道的样本量较少,因而尚不能明确基因多态性与肿瘤易感性的关系。
MDM2蛋白是p53通路的核心蛋白之一,对p53通路的调控具有重大作用,多篇原始研究报道反映了MDM2 SNP309突变型可引起表达的增加,并对抑制p53通路产生的显著效果[7,8,20,33]。与之前其他文献报道不同的是,患有胶质母细胞瘤的高加索人种等位基因G的频率较亚洲人种更高,说明了胶质母细胞瘤的人中特殊性。较近年的多篇Meta分析表明,MDM2的纯野生型(GG)单核苷酸突变可能对p53通路也具有调控作用,这在多种类型的肿瘤中获得了证实[16,18]。然而对于胶质母细胞瘤中的作用由于文献报道的结果不尽相同,因而尚缺乏明确结论,通过对本Meta分析结果的研究,发现在胶质母细胞瘤中存在与其他肿瘤不一致的遗传模型,杂合型突变即可引起肿瘤发生危险性的显著提高。为了进一步分析不同基因表型的关联,笔者进行了多种遗传模型的分析,并按种族进行了亚组分析,结果凸显了杂合型突变在胶质母细胞瘤的发生中发挥的重要作用,而纯和野生突变型与肿瘤关联不大。这一特性在其他肿瘤中并不显著。产生这些现象的原因除了与Meta分析结果的不稳定及肿瘤自身的遗传背景有关外,还可能与人种所处的环境有关联,群体的性别、年龄、生活习惯、发病年限等混杂因素也应该进行充分的考虑。随着相关文献报道的累积,应对这些因素进行更深入的讨论。
本文所做的 Meta分析有几点局限性:(1)MDM2与胶质母细胞瘤的关联性不够显著,发表文献较少,即使文献发表偏畸的检验并未提示出版偏畸,但是由于未出版的文献并未纳入本研究中,仍有发表偏畸存在的可能;(2)本文并未考虑年龄、性别、种族、环境等混杂因素对研究结果的影响。虽然考虑了种群基因平衡和人种对结果的影响,但由于总体样本量较小,研究结果不够稳定,这2种混杂因素对试验的影响可能会被忽略;(3)亚洲人群中两个种族的基因关联性结果差异过大,同时2组人群只有一篇文献报道,导致亚洲人群的统计学效能受到了很大的影响,这一亚组的研究结果不能代表真是的人群情况。
本篇Meta分析有以下几点有势:(1)纳入文献量较小,但单篇研究的病例-对照组数较高,因而整体的检验效能较高,研究的可靠性得到了保证;(2)首次针对胶质母细胞瘤的MDM2 SNP309与肿瘤易感性做了分析,这在文献报道中尚属首次;(3)针对遗传易感性分析采用了多种不同的模型,并对研究结果的敏感性、异质性、发表偏畸做了充分的讨论,不仅发现了杂合突变型与易感性之间的关联,还发现了导致这一结果可能的根源,为进一步基因关联性的研究提供了思路。
综上所述,本研究提示了MDM2 SNP309突变与胶质母细胞瘤发生的密切联系。强调了不同人种中关联程度的不同,突出了高加索人种中杂合型突变在易感性中发挥的作用。为下一步基因-基因、基因-环境相互作用研究提供了一定的思路。
[1] Momand J,Zambetti GP,Olson DC,et al.The oncogene product forms a complex with the p53 protein and inhibits p53-mediated transactivation[J].Cell,1992,69(7):1237-1245.
[2] Michael D,Oren M.The p53-Mdm2 module and the ubiquitin system[J].Semin Cancer Biol,2003,13(1):49-58.
[3] Zhang Z,Zhang R.p53-independent activities of MDM2 and their relevance to cancer therapy[J].Curr Cancer Drug Targets,2005,5(1):9-20.
[4] BondGL,Hu W,LevineA,etal.A singlenucleotide polymorphism in the MDM2 gene:from a molecular and cellular explanation to clinical effect[J].Cancer Res,2005,65(13):5481-5484.
[5] BondGL,Hu W,BondEE,etal.A singlenucleotide polymorphism in the MDM2 promoter attenuates the p53 tumor suppressor pathway and accelerates tumor formation in humans[J].Cell,2004,119(5):591-602.
[6] 王倩,谭诗云,吴鹏波,等.MDM2-309 T/G基因多态性与食管癌易感性关系的Meta分析[J].疑难病杂志,2017,16(1):75-79.
[7] Marcel V,Palmero EI,Falagan-Lotsch P,et al.TP53 PIN3 and MDM2 SNP309 polymorphisms as genetic modifiers in the Li-Fraumeni syndrome:impact on age at first diagnosis[J].J Med Genet,2009,46(11):766-772.
[8] Grochola LF,Zeron-Medina J,Meriaux S,et al.Single-nucleotide polymorphisms in the p53 signaling pathway[J].Cold Spring Harb Perspect Biol,2010,2(5):a001032.
[9] Boersma BJ,Howe TM,Goodman JE,et al.Association of breast cancer outcome with status of p53 and MDM2 SNP309[J].J Natl Cancer Inst,2006,98(13):911-919.
[10] Asomaning K,Reid AE,Zhou W,et al.MDM2 promoter polymorphism and pancreatic cancer risk and prognosis[J].Clin Cancer Res,2008,14(12):4010-4015.
[11] Zhuo X,Ye H,Li Q,et al.Is MDM2 SNP309 variation a risk factor for head and neck carcinoma?:an updated meta-analysis based on 11,552 individuals[J].Medicine(Baltimore),2016,95(9):e2948.
[12] Yu H,Li H,Zhang J,et al.Influence of MDM2 polymorphisms on squamous cell carcinoma susceptibility:a meta-analysis[J].Onco Targets Ther,2016,9:6211-6224.
[13] Yang XI,Zhu Y,Ye D,et al.Association of MDM2 promoter T309G polymorphism with oral cancer risk:a meta-analysis of 3,536 subjects[J].Mol Clin Oncol,2016,5(1):175.
[14] Xue Z,Zhu X,Teng Y.Relationship between murine double minute 2 (MDM2)T309G polymorphism and endometrial cancer risk:a meta-analysis[J].Med Sci Monit,2016,22:3186-3190.
[15] Xie L,Chen T,Hu H,et al.Association between MDM2 SNP309T>G polymorphism and the risk of bladder cancer:new data in Chinese population and an update meta-analysis[J].Transl Androl Urol,2016,5(S1):AB265.
[16] Wo X,Han D,Sun H,et al.MDM2 SNP309 contributes to tumor susceptibility:a meta-analysis[J].J Genet Genomics,2011,38(8):341-350.
[17]WangLH,WangX,XuWT,etal.MDM2rs2279744 polymorphism and endometrial cancer:a meta-analysis[J].Tumour Biol,2014,35(4):3167-3170.
[18]Wan Y,Wu W,Yin Z,et al.MDM2 SNP309,gene-gene interaction,and tumor susceptibility:an updated meta-analysis[J].BMC cancer,2011,11:208.
[19]Tian X,Wang B,Guo J,et al.The MDM2 T309G polymorphism and risk of lung cancer:an updated meta-analysis of 10,186 cases and 14,155 controls[J].Panminerva Med,2016,58(4):341-348.
[20] Levav-Cohen Y,Goldberg Z,Tan KH,et al.The p53-Mdm2 loop:a critical juncture of stress response[J].Subcell Biochem,2014,85:161-186.
[21] He X,Chen P,Yang K,etal.Association ofMDM2 polymorphism with risk and prognosis of leukemia:a metaanalysis[J].Acta Haematol,2015,133(4):365-371.
[22] Gao J,Kang AJ,Lin S,et al.Association between MDM2 rs 2279744 polymorphism and breast cancer susceptibility:a metaanalysis based on 9,788 cases and 11,195 controls[J].Ther Clin Risk Manag,2014,10(1):269-277.
[23] Chen W,Wu Q,Ren H.Meta-analysis of associations between MDM2 SNP309 polymorphism and gastric cancer risk[J].Biomed Rep,2014,2(1):105-111.
[24] Lei C,Zhang W,Fan J,et al.MDM2 T309G polymorphism and esophageal cancer risk:a meta-analysis[J].Int J Clin Exp Med,2015,8(8):13413-13416.
[25] Bilbao-Aldaiturriaga N,Askaiturrieta Z,Granado-Tajada I,et al.A systematic review and meta-analysis of MDM2 polymorphisms in osteosarcoma susceptibility[J].Pediatr Res,2016,80(4):472-479.
[26] Stang A.Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in metaanalyses[J].Eur J Epidemiol,2010,25(9):603-605.
[27] 杨军,刘运海.MDM2启动子309位点多态性与胶质母细胞瘤易感性的关系[J].山东医药,2011,51(29):87-88.
[28] Zawlik I,Kita D,Vaccarella S,et al.Common polymorphisms in the MDM2 and TP53 genes and the relationship between TP53 mutations and patient outcomes in glioblastomas[J].Brain Pathol,2009,19(2):188-194.
[29] Tsuiki H,Nishi T,Takeshima H,et al.Single nucleotide polymorphism 309 affects murin-double-minute 2 protein expression but not glioma tumorigenesis[J].Neurol Med Chir(Tokyo),2007,47(5):203-208.
[30] Khatri RG,Navaratne K,Weil RJ.The role of a single nucleotide polymorphism of MDM2 in glioblastoma multiforme[J].J Neurosurg,2008,109(5):842-848.
[31] El Hallani S,Marie Y,Idbaih A,et al.No association of MDM2 SNP309 with risk of glioblastoma and prognosis[J].J Neurooncol,2007,85(3):241-244.
[32] Dimitriadi M,Poulogiannis G,Liu L,et al.p53-independent mechanisms regulate the P2-MDM2 promoter in adult astrocytic tumours[J].Br J Cancer,2008,99(7):1144-1152.
[33] Hunziker A,Jensen MH,Krishna S.Stress-specific response of the p53-Mdm2 feedback loop[J].BMC Syst Biol,2010,4:94.
2017-09-03)
(本文编辑:马帅)
秦家骏,钟荣德,陈先震.胶质母细胞瘤鼠双微粒体2单核苷酸多态性易感性:Meta分析[J/CD].中华神经创伤外科电子杂志,2017,3(5):284-291.
Hereditary susceptibility with MDM2 gene single nucleotide polymorphism for glioblastoma:Meta-analysis
Qin Jiajun,Zhong Rongde,Chen Xianzhen.Department of Neurosurgery,Tenth Perples’Hospital of Tongji University,Shanghai 200072,China
Corresponding author:Chen Xianzhen,Email:chenxianzheny@126.com
ObjectiveTo explore the association of MDM2 single nucleotide polymorphism with the risk of glioblastoma.MethodsThis study has searched a great number of papers using key terms based on PubMed,Google Scholar,CNKI,Baidu Scholar before screening samples.To investigate the interaction between MDM2 SNP309 and glioblastoma risk,was performed a Meta-analysis of the risk estimate on case-control studies from six qualified articles.ResultsThe data we reviewed indicated that variant homozygote and heterozygote for MDM2 SNP309 were associated with an increased risk of glioblastoma by 1.23 on odds radio (OR)(95%CI:1.05-1.44),P=0.288 by I2test;was performed variant heterozygote of SNP309 significantly increased the risk of cancer by 1.35 on OR(95%CI:1.05-1.73).In a stratified analysis by ethnicity,this study certified that a significant increased risk in Caucasian by 1.30 on OR(95%CI:1.08-1.57),P=0.410 by I2test.ConclusionThe analysis indicate MDM2 SNP309 serves as a susceptibility marker on glioblastoma,which was clarified the different risks in ethnicity,especially in Caucasian with variant heterozygote.
MDM2 SNP309;Glioblastoma;Hereditary susceptibility;Meta-analysis
10.3877/cma.j.issn.2095-9141.2017.05.007
上海市科学技术委员会科研计划项目(12ZR1423400)
200072上海,同济大学附属第十人民医院神经外科
陈先震,Email:chenxianzheny@126.com
