脊髓中血红素加氧酶-1缓解神经病理性疼痛*
2017-11-20支亦博郭伟兵程祝强陈春龙陈浩飞朱红梅刘晓明刘清珍李伟彦
章 洁 支亦博 郭伟兵 程祝强 陈春龙 陈浩飞 朱红梅 刘晓明 刘清珍 金 毅 △ 李伟彦△
(1徐州医科大学 江苏省麻醉学重点实验室,江苏省麻醉与镇痛应用技术重点实验室,徐州221002;2南京总医院麻醉科,南京210002;3南京总医院疼痛医学中心,南京210002)
脊髓中血红素加氧酶-1缓解神经病理性疼痛*
章 洁1,2,3支亦博2郭伟兵2程祝强3陈春龙2陈浩飞3朱红梅3刘晓明3刘清珍2金 毅3△李伟彦2△
(1徐州医科大学 江苏省麻醉学重点实验室,江苏省麻醉与镇痛应用技术重点实验室,徐州221002;2南京总医院麻醉科,南京210002;3南京总医院疼痛医学中心,南京210002)
目的:观察血红素加氧酶-1 (Heme oxygenase-1, HO-1)在神经病理性疼痛(Neuropathic pain,NP)大鼠脊髓中的表达水平变化,研究HO-1激动剂原卟啉钴(cobalt protoporphyrin Ⅸ, COPP)对神经病理性疼痛的调节作用及其可能机制。方法:本实验采用保留性坐骨神经损伤(spared nerve injury,SNI)模型。雄性SD大鼠随机分为3组: Sham + Vehicle组、SNI + Vehicle和SNI + COPP组。术后第一天开始, Sham + Vehicle组和SNI + Vehicle组腹腔注射1%DMSO 10 ml/kg,SNI + COPP组腹腔注射0.1% COPP 10 mg/kg,均连续给药7天。各组分别于术前、术后第3(D3)、7(D7)和14(D14)天测定大鼠50%的机械刺激缩足阈值(Paw withdrawl threshold, PWT)。于术后D7、D14处死,取大鼠L4-6节段术侧脊髓, 采用western blot检测脊髓中HO-1、µ受体(µ-opioid receptor, MOR)和δ受体(δ-opioid receptor, DOR)的表达量变化。结果:(1)各组术前术侧PWT无明显统计学差异(P>0.05);术后SNI + Vehicle组和SNI + COPP组较Sham + Vehicle组相比,在相同时间点术侧PWT值显著下降(P< 0.05);与SNI + Vehicle组相比,SNI + COPP组在术后D7和D14术侧PWT显著升高(P<0.05)。(2)与Sham + Vehicle组相比,SNI+Vehicle组HO-1的表达在术后D7、D14明显增加(P< 0.05),MOR、 DOR无明显改变(P> 0.05);与SNI+ Vehicle组相比,SNI+COPP组的HO-1与MOR的表达在术后D7、D14有显著提高(P< 0.05),DOR仍无明显改变(P> 0.05)。结论:腹腔注射HO-1激动剂COPP可缓解大鼠神经病理性疼痛,调节阿片受体表达是其可能作用机制之一。
血红素加氧酶-1;神经病理性疼痛;阿片受体
神经病理性疼痛(neuropathic pain, NP)是一种临床常见的慢性疼痛,给病人带来持续的巨大的痛苦,严重降低病人的生活质量。NP的主要表现为痛觉过敏(hyperalgesia)及痛觉超敏(allodynia),主要的病生机制包括神经源性炎症反应,外周及中枢敏化,神经元可塑性改变等等,目前应用传统药物难以有效控制[1]。寻找治疗NP的有效靶点成为目前研究的主要目标。HO-1是一种线粒体酶,分解血红素生成一氧化碳(carbon monoxide, CO)、胆绿素(biliverdin,BV)和游离铁,BV经还原酶转变为胆红素(bilirubin,BR)。炎症反应中, HO-1可由内毒素等多种介质诱导在多种细胞中表达来发挥抗炎镇痛的作用,如内皮细胞,中性粒细胞,神经胶质细胞等[2]。既往较多研究显示HO-1对炎性疼痛有显著的镇痛作用[3],但对NP的作用研究较少,有研究显示HO-1对糖尿病神经病理性疼痛有治疗作用,可能与其能够减轻糖尿病外周神经病变及抑制脊髓背角神经元凋亡有关[4]。目前,阿片受体激动剂是运用较多的治疗NP的药物,最常见的有吗啡等。但系统用药会产生较多的副作用,有研究显示给予二氧化碳释放分子(two carbon monoxide-releasing molecules, CO-RMs)和HO-1激动剂原卟啉钴(cobalt protoporphyrin Ⅸ, COPP)可显著增强吗啡的局部镇痛作用[5]。COPP是HO-1的特异性激动剂。对于HO-1缓解NP及增强吗啡的局部镇痛作用的具体机制尚未得知。本实验采用大鼠保留性坐骨神经损伤模型(spared nerve injury, SNI),通过免疫印迹方法观察HO-1 、MOR和DOR在脊髓中的表达变化,并观察腹腔注射HO-1激动剂对神经病理性疼痛的影响从而探讨其可能的镇痛机制。
方 法
1.实验动物及分组
清洁级成年雄性Sprague-Dawley大鼠,体重150~180 g,由南京军区南京总医院比较医学科提供。实验所实行操作均符合国际疼痛研究会的准则,并且经动物伦理委员会许可。采用数字表法将大鼠随机分为Sham + Vehicle组、SNI + Vehicle组、SNI+ COPP组,行为学部分每组大鼠8只,分子检测部分每组每时间点9只,共78只。
2.动物模型制备
模型参照既往文献[6]的方法。2%戊巴比妥钠40 mg/kg腹腔注射麻醉,将大鼠俯卧,四肢及头部固定于手术台板上,于大鼠左后肢上缘切开皮肤并钝性分离肌肉,暴露坐骨神经主干及分支:胫神经、腓总神经和腓肠神经,5-0丝线结扎并剪断腓总神经和胫神经,保留细小的腓肠神经,逐层缝合。整个过程中尽量避免过分牵拉腓肠神经。假手术组(Sham+Vehicle组)仅暴露坐骨神经及其三个分支。
3.给药方案
本实验采用腹腔给药的方式。COPP溶解于1%DMSO (DMSO溶于生理盐水),SNI + COPP组注 射 COPP 10 mg/kg/d,Sham + Vehicle组 和 SNI+Vehicle组注射1%DMSO,自造模后第1天连续给药至第7天,每天1次。
4.行为学测试
根据Chaplan[7]等人报道Up-Down方法,于造模前、造模后D3、D7、D14、晨8:00测定大鼠50%的机械刺激缩足阈值(paw withdrawal threshold,PWT)。将大鼠放置于测试的有机玻璃箱(22 cm×12 cm×15 cm)内约15分钟,待大鼠安静后,选择不同折力(0.6、1.0、1.4、2.0、4.0、6.0、8.0、15 g) von Frey纤维丝(Stoleing公司,美国)分别对大鼠左后肢足底部外侧皮肤进行机械性刺激,每次刺激持续时间为6~8 s。首先用力度为2.0 g的纤维丝开始测试,测试时纤维丝微弯,在大鼠足底部保持6~8 s,出现快速撤足或舔足行为视为阳性反应。若撤足反应为阴性则选用刺激强度递增的相邻纤维丝继续刺激;反之,则选择相邻递减的刺激强度给予刺激,如此反复。每次间隔30 s左右,以Up-Down法推测阈值,并计算50%PWT。
5. Western blot
腹腔注射2%戊巴比妥钠40mg/kg深麻醉后,放血处死大鼠,迅速取出L4-6脊髓,液氮速冻后-80℃保存。称取标本质量按比例加入细胞裂解液和蛋白酶抑制剂,组织匀浆后,4℃12000 r/min离心15 min,取上清,BCA法(Thermo,美国)测定样品的蛋白含量。将40 µg/well总蛋白加入SDS上样缓冲液(Beyotime),95℃变性5 min,用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodeeyl sulfate poly-aerylamide gel electrophoresis,SDSPAGE)电泳,转至PVDF膜,转膜时恒流0.3 mA,时间90 min。5%的脱脂奶粉溶液封闭1.5 h,加一抗:兔抗大鼠HO-1 (1:1000, Millipore, 美国)或兔抗大鼠MOR(1:500, Millipore, 美国)或兔抗大鼠DOR(1:1000, Millipore, 美国),4℃摇床孵育过夜,内参为β-actin(兔源, l:1000, Cell Signaling, 美国)。TBST缓冲液冲洗10 min×3次,辣根过氧化物酶标二抗室温孵育1 h,TBST缓冲液冲洗10 min×3次,ECL显色曝光(Bio-Rad ChemiDoc MP全能型凝胶成像分析系统)。目标蛋白与内参的灰度比值表示目的蛋白的相对表达量。
6统计学分析
采用SPSS 16.0统计软件进行统计学分析,计量资料数据以均数±标准差(±SD)表示。各组机械痛阈值比较采用重复测量的方差分析;HO-1蛋白表达水平及阿片受体的表达水平同一时间点三组组间比较采用单因素方差分析,两两比较采用LSD法。P< 0.05为差异有统计学意义。
结 果
所有动物术后恢复良好,未见左后肢运动障碍迹象,造模后大鼠均出现术侧后爪内收、后爪轻度外翻,假手术组大鼠术后未出现上述迹象。
1.行为学结果
术前各组间的机械刺激缩足阈值(paw withdrawl threshold, PWT)基础值比较差异无统计学意义;Sham + Vehicle组术侧后肢PWT和时间点未见明显改变(P> 0.05)。与Sham+ Vehicle组相比,SNI + Vehicle组和SNI+COPP组自术后第3、7、14天PWT明显下降,差异有统计学意义(P< 0.05);与SNI + Vehicle组相比,SNI + COPP组在第7、14天PWT显著上升,且差异有统计学意义(P< 0.05,见图1)。
2. HO-1在脊髓中的表达变化
Western blot结果表明,各时间点Sham+Vehicle组HO-1表达无明显变化。与Sham+ Vehicle组相比,SNI+ Vehicle组和SNI + COPP组HO-1在术后第7、14天表达显著增高(P< 0.05);与SNI +Vehicle组相比,SNI + COPP组HO-1在术后第7、14天表达明显上调(P< 0.05,见图2)。
3.阿片受体在脊髓中的表达变化
(1)MOR表达变化
各时间点Sham + Vehicle组MOR表达量无明显变化。与Sham + Vehicle组相比,SNI + Vehicle组MOR在术后第7、14天表达无明显改变(P>0.05);与SNI + Vehicle组相比,SNI + COPP组MOR在术后第7、14天表达显著上调(P< 0.05,见图3)。
(2)DOR表达变化
各时间点Sham + Vehicle组DOR表达量无明显变化。与Sham + Vehicle组相比,SNI + Vehicle组和SNI + COPP组DOR在术后第7、14天表达无明显变化(P> 0.05);与SNI + Vehicle组相比,SNI + COPP组DOR在术后第7、14天表达也无明显变化(P> 0.05,见图4)。
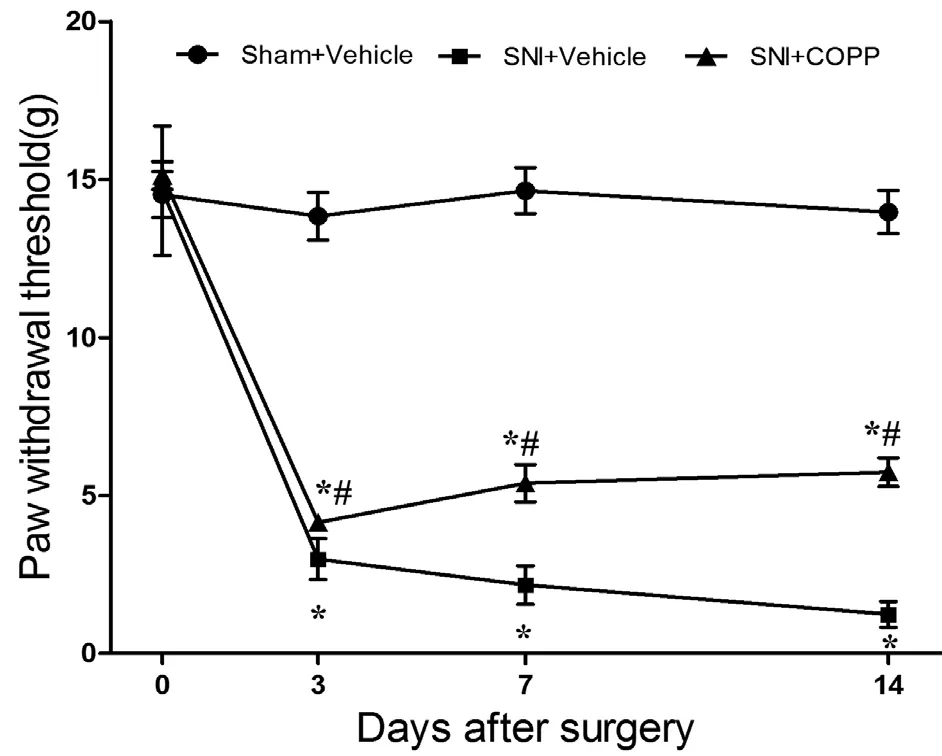
图1 COPP对SNI大鼠PWT的影响*P < 0.05,与 Sham + Vehicle 组比较;#P < 0.05, 与 SNI + Vehicle组比较Fig.1 The effects of COPP on PWT in SNI rats*P < 0.05, compared with Sham + Vehicle group; #P < 0.05,compared with SNI+Vehicle group
讨 论
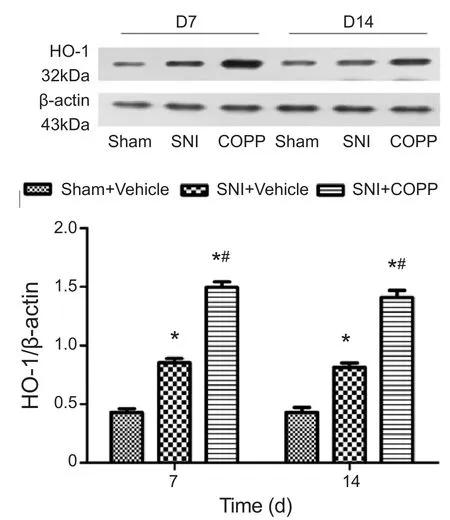
图2 各组大鼠脊髓HO-1表达量变化*P < 0.05, 与 Sham+Vehicle 组比较;#P < 0.05, 与 SNI+Vehicle组比较Fig.2 The changes of HO-1 expression in each group*P < 0.05, compared with Sham + Vehicle group; #P < 0.05,compared with SNI + Vehicle group
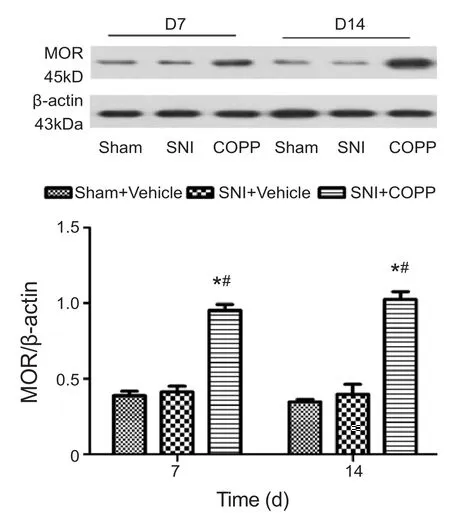
图3 各组大鼠脊髓MOR表达量变化*P < 0.05,与 Sham + Vehicle 组比较;#P < 0.05, 与 SNI+Vehicle组比较Fig.3 The changes of MOR expression in each group*P < 0.05, compared with Sham + Vehicle group; #P < 0.05,compared with SNI + Vehicle group
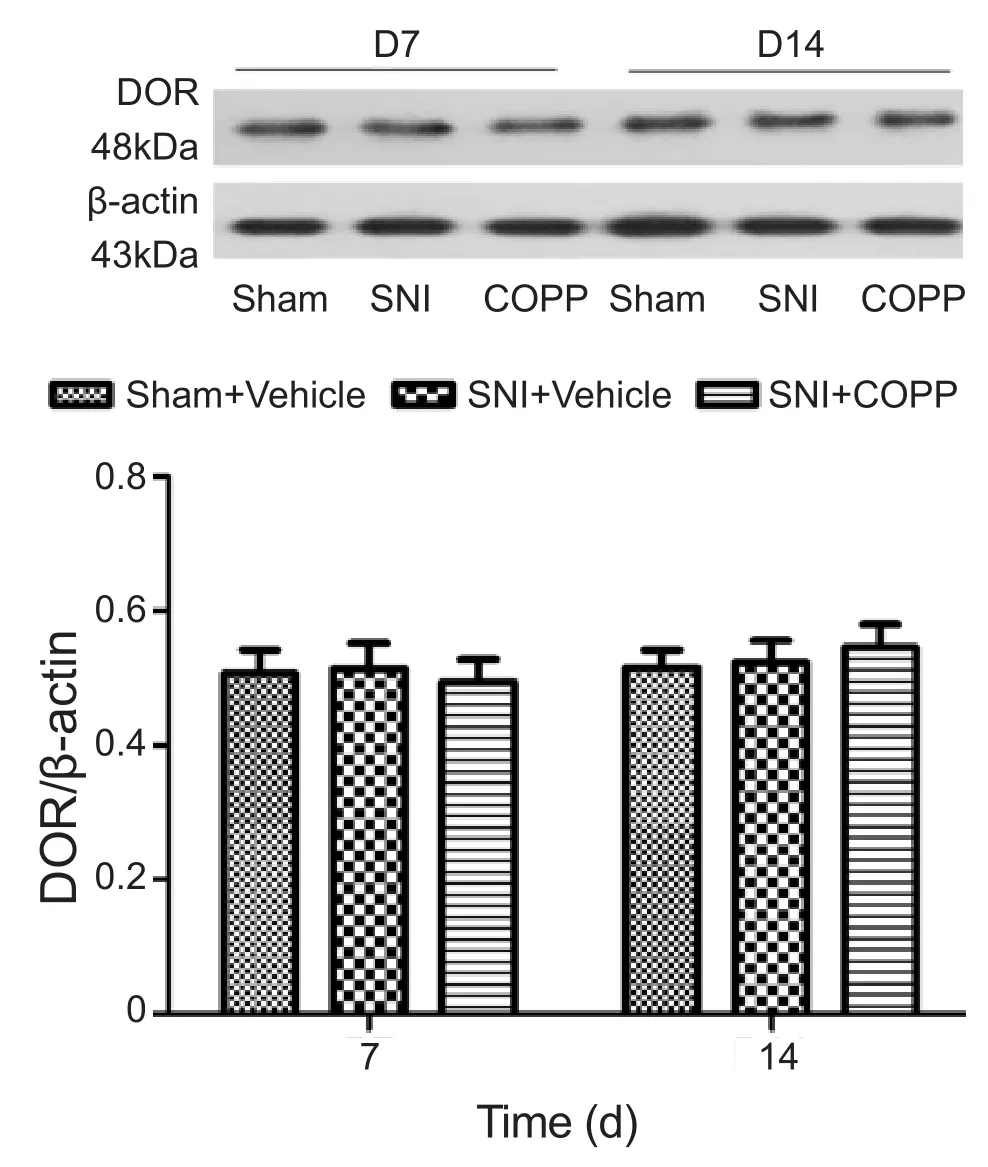
图4 各组大鼠脊髓DOR表达量变化*P < 0.05,与 Sham + Vehicle组比较;#P < 0.05,与 SNI + Vehicle组比较Fig.4 The changes of DOR expression in each group*P < 0.05, compared with Sham + Vehicle group; #P < 0.05,compared with SNI + Vehicle group
本实验利用HO-1激动剂COPP研究了HO-1对神经病理性疼痛的影响并探讨其作用机制。由于SNI制作简单,产生疼痛迅速且稳定性好,可靠性高,对机械刺激敏感,故本实验选择SNI为神经病理性疼痛模型。行为学结果显示SNI术后即产生了明显的机械痛阈下降,而连续腹腔注射COPP后大鼠的机械痛敏症状较Vehicle + SNI组有显著改善。说明COPP对SNI所致的NP有调节作用,HO-1产生镇痛作用的机制目前仍不十分清楚,以往的研究表明可能通过如下机制。首先,HO-1分解血红素生成CO、游离铁和BV,BV进一步转变为BR。其中CO对感受伤害性通路有调节作用。CO可激活可溶性鸟苷酸环化酶(soluble guanylyl cyclase, sGC)上调胞内第二信使环鸟苷酸(cGMP),进而激活下游靶点,包括cGMP依赖性蛋白激酶(cGKs),离子通道和受体[8]。因此,腹腔注射HO-1激动剂COPP可上调内源性CO,从而显著降低机械痛觉超敏及痛觉过敏。其次,HO-1与环氧化酶(cyclooxygenase,COX) -2通路间存在相互作用[3]。因此,炎症反应时HO-1过表达对血红素蛋白可产生抑制作用,包括细胞色素P450同工酶和环氧化酶[9]。COX-2可产生多种与炎症及疼痛发展相关的前列腺素。所以,HO-1过表达可削弱COX的活性同时可缓解神经病理性疼痛。第三,HO-1作为白介素(interleukin,IL)-10和IL-13的下游效应器,可产生细胞保护、免疫调节及促进抗凋亡作用[10,11]。因此,HO-1能促进抗氧化防御系统功能。
阿片类药物是治疗疼痛的常用药物,可有效缓解急性痛及炎性痛,而常规剂量的阿片药物难以缓解神经病理性疼痛,大剂量用药会产生巨大的中枢副作用。在外周损伤组织应用小剂量阿片药物不但能产生有效的镇痛作用,并将中枢副作用最小化[12]。在小鼠坐骨神经损伤模型研究中,给予CORMs和COPP可提高吗啡的局部镇痛效果。这一作用机制是上调MOR表达及抑制脊髓小胶质细胞活化和一氧化氮合酶(nitric oxide synthases, NOS)1/NOS2过表达[5]。与此一致,本实验通过观察SNI及给予COPP后HO-1、MOR和DOR表达的变化探讨在SNI所致的NP模型中HO-1过表达对MOR、DOR的调节作用。Western blot结果显示,与Vehicle +Sham组相比,Vehicle + SNI组HO-1有明显升高,MOR和DOR无明显升高,表明诱导型的HO-1在应激状态下会被激活并表达增多;而与Vehicle +SNI组比较,COPP + SNI组HO-1和MOR都明显升高,说明COPP是HO-1的有效激动剂,同时上调的HO-1可通过某种方式升高MOR的表达。但具体的作用机制还不明确。MOR激动剂吗啡外周镇痛作用可能通过NO-cGMP-PKG-ATP敏感性钾通道(ATP-sensitive potassium, KATP)信号通路产生[5]。如上所述,HO-1分解血红素的产物CO也可激活此通路。NO由NOS合成,通过激活cGMP-PKG通路调节NP。NOS分为神经元型(NOS1)和诱导型(NOS2)。CO和NO作为体内两种重要的气体神经递质,两者之间存在密切的相互作用[8],不同浓度的CO对NO介导激动sGC分别有促进和抑制作用,有离体实验证实NOS/NO是CO的下游靶点[8]。NOS2来源的NO能通过cGMP-PKG激活HO-1产生CO。在体实验证实NOS通路的完整性是CO产生镇痛作用的必要条件,而NO的抗伤害作用则不依赖于CO[3]。NP中CO和NO之间的相互关系十分复杂,仍需要进一步研究。
相较MOR激动剂而言,DOR激活后呼吸抑制和躯体依赖及耐受明显减少[13]。既往研究显示,糖尿病神经病理性疼痛小鼠模型,皮下给予小剂量(0.5 mg/kg) DOR激动剂DPDPE ([D-Pen(2), D-Pen(5)]-Enkephalin)同时腹腔注射大剂量(10 mg/kg) CORM-2或COPP可显著增强DPDPE的镇痛作用,而高剂量的DPDPE(5 mg/kg)与HO-1拮抗剂SnPP(tin protoporphyrin Ⅸ)合用,DPDPE的镇痛作用完全被阻断,充分说明HO-1参与调解DOR激动剂的镇痛作用[13]。本实验结果显示较Vehicle + sham组,DOR在Vehicle + SNI和COPP + SNI组的表达量均无明显改变,NP中抑制NO-PKG通路会抑制吗啡的外周镇痛作用,但能增强DOR和CB2R激动剂的镇痛作用。DOR激活后缓解NP的主要机制是通过激活蛋白激酶C (protein kinase C, PKC)下调电压门控型钠通道[5],可见MOR和DOR缓解NP的机制不同,但两者间的具体联系尚不清楚。
众所周知,小胶质细胞在慢性疼痛的发生发展中起到了重要作用。神经损伤后小胶质细胞显著激活,并参与了NP的发生发展[14]。给予其活化抑制剂后可显著减轻NP的症状[15]。有文献显示,小鼠神经损伤模型中小胶质细胞标志物CD11b/c表达增加,给予CORM-2或COPP后明显减少[3]。神经损伤后小胶质细胞激活也可改变阿片药物信号通路抑制吗啡的镇痛作用,但具体作用机制还不明确[5]。故可以推测HO-1对小胶质细胞的调节作用可能也是其发挥NP镇痛作用机制之一。
综上所述,SNI模型促进大鼠产生神经病理性疼痛后诱导脊髓HO-1表达上调。腹腔注射HO-1激动剂COPP后促进HO-1表达进一步升高以缓解SNI模型大鼠的神经病理性疼痛症状,HO-1/CO通路对阿片受体的调节作用是其重要机制之一。本研究在更深入阐明神经病理性疼痛的发病机制的同时,为治疗神经病理性疼痛提供新思路。
[1]Maruo T, Nakae A, Maeda L,et al. Validity, reliability,and assessment sensitivity of the Japanese version of the short-form McGill pain questionnaire 2 in Japanese patients with neuropathic and nonneuropathic pain. Pain Med, 2014, 15:1930 ~ 7.
[2]Motterlini R, Otterbein LE. The therapeutic potential of carbon monoxide. Nat Rev Drug Discov, 2010, 9:728 ~ 43.
[3]Hervera A, Le anez S, Negrete R,et al. Carbon monoxide reduces neuropathic pain and spinal microglial activation by inhibiting nitric oxide synthesisin mice. PLoS One,2012, 7:e43693.
[4]孔倩,刘康.血红素加氧酶 -1 对糖尿病大鼠神经病理性疼痛的影响及可能的机制.中国疼痛医学杂志,2013, 19(3):145 ~ 151.
[5]Hervera A, Le anez S, Motterlini R,et al. Treatment with carbon monoxide-releasing molecules and an HO-1 inducer enhances the effects and expression of m-opioid receptors during neuropathic pain. Anesthesiology, 2013,118:1180 ~ 97.
[6]Decosterd I, Woolf CJ. Spared nerve injury: an animal model of persistent peripheral neuropathic pain. Pain,2000, 87:149 ~ 158.
[7]Chaplan SR, Bach FW, Pogrel JW,et al. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods, 1994, 53:55 ~ 63.
[8]Fan W, Huang F, Wu Z,et al. Carbon monoxide: A gas that modulates nociception. J Neurosci Res, 2011,89:802 ~ 807.
[9]Haider A, Olszanecki R, Gryglewski R,et al. Regulation of cyclooxygenase by the heme-heme oxygenase system in microvessel endothelial cells.J Pharmacol Exp Ther,2002, 300:188 ~ 194.
[10]Lee TS, Chau LY. Heme oxygenase-1 mediates the antiin fl ammatory effect of interleukin-10 in mice. Nat Med,2002, 8:240 ~ 246.
[11]Ke B, Shen XD, Zhai Y,et al. Heme oxygenase 1 mediates the immunomodulatory and antiapoptotic effects of interleukin 13 gene therapy in vivo and in vitro. Hum Gene Ther, 2002, 13:1845 ~ 57.
[12]Obara I,Parkitna JR, Korostynski M,et al. Local peripheral opioid effects and expression of opioid genes in the spinal cord and dorsal root ganglia in neuropathic and in fl ammatory pain. Pain, 2009, 141(3):283 ~ 291.
[13]Castany S, Carcolé M, Leánez S,et al. The antinociceptive effects of a δ-opioid receptor agonist in mice with painful diabetic neuropathy: Involvement of heme oxygenase 1.Neurosci Lett, 2016, 614:49 ~ 54.
[14]Watkins LR, Milligan ED, Maier SF. (2001) Glial activation: a driving force for pathological pain. Trends Neurosci, 2001, 24: 450 ~ 455.
[15]Mika J, Osikowicz M, Rojewska E,et al. Differential activation of spinal microglial and astroglial cells in a mouse model of peripheral neuropathic pain. Eur J Pharmacol, 2009, 623:65 ~ 72.
HO-1 IN SPINAL CORD MEDIATES NEUROPATHIC PAIN IN RATS*
ZHANG Jie1,2,3, ZHI Yi-Bo2, GUO Wei-Bing2, CHENG Zhu-Qiang3, CHEN Chun-Long2, CHEN Hao-Fei3,ZHU Hong-Mei3, LIU Xiao-Ming3, LIU Qing-Zhen2, JIN Yi3△, LI Wei-Yan2△
(1Xuzhou Medical University, Jiangsu Key Laboratory of Anesthesiology&Jiangsu Key Laboratory of Anesthesia and Analgesia Application Technology, Xuzhou 221002, China;2Anesthesiology of Jinling Hospital, Nanjing 210002, China;3Pain Medicine Center of Jinling Hospital, Nanjing 210002, China)
Objectives: To investigate the effects and possible mechanism of cobalt protoporphyrinⅨ(COPP), an inducible heme oxygenase agonist, on neuropathic pain (NP) by observing the alteration of expression and distribution of heme oxygenase-1 (HO-1) in the spinal cord of rats with sciatic nerve injury.Methods: Neuropathic pain was induced by the spared nerve injury (SNI). All male Sprague-Dawley rats were randomly assigned into 3 groups: Vehicle + Sham group, Vehicle + SNI group and COPP + SNI group.On the fi rst day after operation, Vehicle (1%DMSO, 10 ml/kg) was intraperitoneally injected in Vehicle + Sham group and Vehicle + SNI group, and COPP (0.1%, 10 mg/kg) was intraperitoneally injected in COPP + SNI group. The paw withdrawal threshold (PWT) was measured before surgery and on day 3,7,14 after surgery.The expression of HO-1, µ-opioid receptor (MOR) and δ-opioid receptor (DOR) in the ipsilateral L4-6lumbar segments of the spinal cord was analyzed by Western blotting on day 7 and 14 after surgery. Results: (1)At baseline, there was no signi fi cant difference of PWT among the three groups (P> 0.05). Compared with the Vehicle + Sham group, rats in the Vehicle + SNI group and SNI + COPP group showed signi fi cantly lower PWT from day 3 to 14 (P< 0.05). Compared with the Vehicle + SNI group, rats in the COPP+SNI group showed a signi fi cant improvement of PWT on day 7 and 14 after surgery (P< 0.05). (2) Compared with Vehicle+ Sham group, the expression of HO-1 in Vehicle+ SNI group was markedly increased (P< 0.05) on day 7 and 14;The expression of MOR and DOR were unaltered (P> 0.05); Compared with the Vehicle + SNI group, the expression of HO-1 and MOR increased signi fi cantly (P< 0.05) and DOR expression had no change (P> 0.05).Conclusion: Intraperitoneal injection of HO-1 agonist COPP reduced the mechanical allodynia of NP. The possible mechanism of these effects of COPP might be associated with the expression of opioid receptor.
Heme oxygenase-1; Neuropathic pain; Opioid receptor
10.3969/j.issn.1006-9852.2017.02.003
江苏省自然科学基金面上研究项目(BK20141374);南京总医院院管课题(2015007)
△通讯作者 金毅 kimye@vip.163.com; 李伟彦 weiyanlee@sina.cn
