内源性大麻素诱发脊髓伤害性回路的去抑制效应*
2017-11-20杜诗斌何晓兰袁宏杰
杜诗斌 王 群 何晓兰 张 晓 顾 楠 袁宏杰 吕 岩
(第四军医大学西京医院疼痛科,西安710032)
·论 著·
内源性大麻素诱发脊髓伤害性回路的去抑制效应*
杜诗斌 王 群 何晓兰 张 晓 顾 楠 袁宏杰 吕 岩Δ
(第四军医大学西京医院疼痛科,西安710032)
目的:观察内源性大麻素2-AG对脊髓背角浅层伤害性突触传递的影响。方法:选用5~6周雄性SD大鼠,麻醉后用人工脑脊液快速灌注心脏,取出脊髓腰膨大段,制备保留后根的脊髓旁矢状位切片。采用全细胞膜片钳技术,记录脊髓背角II层胶状质神经元,脊髓后根电刺激诱发初级传入和记录神经元之间的突触后电位。在脊髓切片上灌流2-AG,观察其对Aδ和C纤维介导的兴奋性突触后电位 (eEPSPs) 或抑制性突触后电位(eIPSPs)的影响。结果:2-AG显著抑制Aδ和C纤维介导的eIPSPs的幅度(P< 0.01),而对eEPSPs无明显影响。结论:内源性大麻素2-AG可抑制脊髓背角浅层Aδ和C纤维介导的抑制性突触传递,发挥去抑制效应,但对兴奋性突触传递影响不大,提示内源性大麻素可能参与抑制性脊髓回路功能降低导致的中枢敏化过程。
内源性大麻素;脊髓背角;去抑制;抑制性突触后电位
神经病理性疼痛是医学界亟待攻克的难题,与生理性疼痛相比,病理性疼痛不仅表现在刺激-感觉强度的量变上,更表现在刺激-感觉模式的质变上,病理性疼痛的发生和持续慢性化过程可能累及整个神经系统结构和功能可塑性变化[1]。因此阐明病理性疼痛的神经环路机制,寻找潜在的药物靶点具有重要意义。脊髓背角由初级传入神经纤维、中间神经元、投射神经元,以及上位中枢下行投射等成分共同形成了复杂的神经环路,是伤害性信息传递及整合的初级中枢。在外周组织损伤后,产生的持续性伤害性冲动传递至脊髓背角。脊髓背角是疼痛持续慢性化病理过程的重要参与者,表现为脊髓背角伤害性神经元的激活和敏化[2],抑制性中间神经元功能降低[3],以及胶质细胞活性增强[4]。其中抑制性中间神经元的功能在调控伤害性信息传递以及中枢敏化过程中发挥重要作用[5]。
近年来内源性大麻素(endocannabinoids, eCBs)系统在神经病理性疼痛发病机制中的作用越来越引起关注。eCBs系统由配体2-arachidonoylglycerol (2-AG)和 Anandamide (AEA)、受体 cannabinoid receptor 1 (CB1) 和 cannabinoid receptor 2 (CB2)、转运体、合成酶及水解酶等组成[6]。尽管大多数关于eCBs系统的研究主要集中在镇痛机制中的作用[7],但值得注意的是有报道大麻素在有些情况下并不产生镇痛作用,有时甚至起到致痛作用,2009年Christie MJ提出了一个新的假说:eCBs可开启疼痛闸门[8],但一直未得到证实。CB1受体在脊髓背角广泛表达[9],激活CB1受体对脊髓背角伤害性突触传递有何影响并不十分清楚。本实验采用膜片钳全细胞记录技术,在保留后根的脊髓切片中外源性灌流大麻素配体2-AG,模拟病理性状态下内源性大麻素含量升高,观察其对Aδ和C纤维介导的兴奋性或抑制性突触后电位的影响,从而进一步揭示其镇痛或致痛机理,为更规范的临床应用提供理论参考。
方 法
1.实验动物
采用5~6周,体重120~180 g的雄性Sprague-Dawley(SD)大鼠。由第四军医大学实验动物中心提供。
2.主要实验试剂与仪器
水合氯醛(国药集团上海化学试剂有限公司),2-AG (Sigma,美国),Axopatch200B膜片钳放大器(Axon,美国),Grass刺激器、隔离器(Grass,美国)。微电极拉制仪MODEL P-97 (Sutter,美国),有芯玻璃电极TW150F-4 (WPI,美国),震动切片机VT1200S (Leica,美国)。
3.主要实验溶液的配制
脊 髓 切 片 液(mM):74 Sucrose, 82 NaCl,2.4 KCl, 1.15 NaH2PO4·H2O, 0.5 CaCl2, 1.1 MgCl2,25 NaHCO3, 1.5 Ascorbate, 2.8 Pyruvate。细胞外液(mM): 123 NaCl, 1.15 NaH2PO4, 2.0 CaCl2, 1.0MgCl2,3.0 Pyruvate, 26 NaHCO3, 25 D-glucose, 2.5 KCl, 1.3 Ascorbate。记录电极内液 (mM): 130 Kgluconate, 10 KCl, 4 Mg-ATP, 10 phosphocreatine, 0.3 Li-GTP, 10 Hepes。
4.电生理实验
电生理实验按照吕岩[10]等的全细胞记录实验方法,给予10%水合氯醛腹腔内注射麻醉大鼠(1.5 g/kg)。待大鼠麻醉后仰卧位固定,打开胸腔从心尖部插入灌流针至升主动脉,给予脊髓切片液快速灌流。快速取出脊柱置于4℃充分氧饱和的切片液中。在体视显微镜下打开椎板游离脊髓,除去蛛网膜后,切取腰膨大处约0.6~1 cm脊髓组织,保留一根完整的后根(0.8~1.2 cm),固定于琼脂台上。采用振动切片机,行保留后根的脊髓旁矢状位切片,切片厚度400~600 µm。将脊髓切片移置于细胞孵育槽内,孵育液为细胞灌流液并持续充有95% O2和5% CO2,孵育温度25℃,孵育时间为1~1.5 h。将孵育好的脊髓切片移置于脊髓片记录槽,氧饱和灌流液持续灌流,用U型盖网固定切片,采用suck电极将后根吸入电极内以便刺激。
根据吕岩等[11]报道,在此实验条件下Aδ的传导速度为1.85±0.20 m/s,C纤维的传导速度为0.26±0.01 m/s。Aδ纤维刺激强度为0.6~1.3 V,C纤维刺激强度为2-6V。本实验中,通过刺激伪迹到eEPSC起始部的潜伏期除以保留的后根长度(0.8~1 cm),计算出神经纤维传导速度,再根据诱发突触后电位所需刺激强度综合判断实验中所诱发的突触后电位为Aδ纤维或C纤维介导。刺激频率0.1 Hz,每个刺激时长0.1ms。用红外相差显微镜定位脊髓背角浅层,选取立体感较强,边缘清晰的胶状质(Substantia Gelatinosa, SG)神经元。用加有电极内液的玻璃微电极(电极阻抗为5~7 MΩ)高阻封接细胞后破膜,行全细胞记录。
在电流钳模式下,钳制膜电位在-45mV左右,记录15条后根刺激诱发的Aδ或C纤维介导的抑制性突触后电位(Aδ-eIPSPs或C-eIPSPs);或钳制膜电位在-70 mV, 记录15条后根刺激诱发的Aδ或C纤维介导的兴奋性突触后电位(Aδ-eEPSPs或C-eEPSPs), 取平均值作为基础值。灌流2-AG (40 µM)8 min达到有效平衡浓度后,记录15条同样刺激诱发的抑制性或兴奋性突触后电位,取平均值作为实验组。充分洗脱后可恢复接近对照,证明细胞状态良好,数据可靠。信号收集采用Axopatch200B膜片钳放大器和pCLAMP10记录软件。
5.统计分析
所有数据采用SPSS 20.0软件进行分析,计量数据以均数±标准差(±SD)表示,两组间的计量资料比较采用单因素方差分析(one-way ANOVA)和LSD-t检验,P< 0.05为差异有统计学意义。
结 果
1. 2-AG显著抑制Aδ纤维介导的抑制性突触后电位
形成稳定记录后,钳制膜电位在-45 mV左右,判定后根刺激诱发出的突触反应为Aδ纤维介导的Aδ-eIPSPs后,取基础值作为对照。灌流2-AG(40 µM)8 min可明显抑制Aδ-eIPSPs的幅度,洗脱20 min后Aδ-eIPSPs波幅恢复接近对照(见图1AB)。其幅度绝对值由灌流前的12.0±4.8 mV降低至5.3±2.8 mV,差异有统计学意义(P< 0.01,n= 4, 见图1C)。
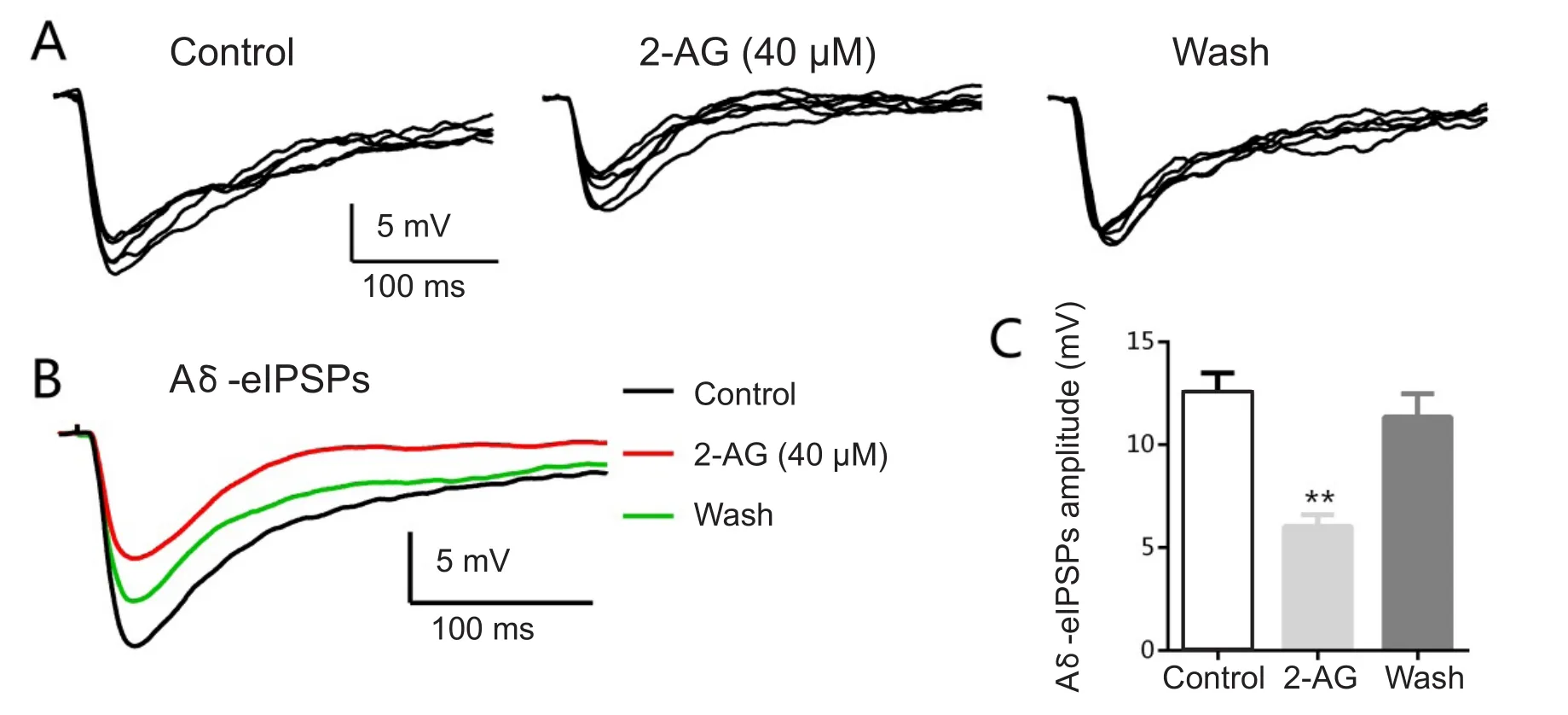
图1 2-AG对Aδ纤维介导的抑制性突触后电位幅度的影响A分别为灌流前、灌流中、洗脱后诱发的抑制性突触后电位;B为三个不同阶段平均综合曲线;C为抑制性突触后电位幅度的绝对值大小。Fig.1 Effects of 2-AG on the amplitude of Aδ fi ber mediated eIPSPs A: Superfusion of 2-AG (40μM) signi fi cantly suppressed the amplitude of Aδ fi ber mediated eIPSPs. B: Every trace was an average of 15 consecutive eIPSPs. C: The histogram showed the absolute value of eIPSPs amplitude. **P < 0.01compared with control.
2. 2-AG显著抑制C纤维介导的抑制性突触后电位
形成稳定记录后,钳制膜电位在-45 mV左右,判断后根刺激诱发出的突触后反应为C纤维介导的C-eIPSPs后,取基础值作为对照,灌流2-AG(40 µM)8 min可明显抑制其幅度,洗脱20 min后恢复接近对照(见图2AB)。其幅度绝对值由灌流前的13.5±3.6 mV降低至5.7±2.1 mV,差异有统计学意义(P< 0.01,n= 4,见图 2C)。
3. 2-AG对Aδ纤维介导的兴奋性突触后电位无明显影响
形成稳定记录后,钳制膜电位在-70 mV,确定记录到的兴奋性突触后电位为Aδ纤维介导后,取基础值作为对照。灌流2-AG(40 µM)8 min对Aδ介导的兴奋性突触后电位无明显影响,继续增加浓度(100 µM)对Aδ纤维介导的eEPSPs影响不明显(见图3AB)。在2-AG浓度为100 µM时,Aδ纤维介导的eEPSPs的幅度值由灌流前的15.0±2.2 mV至灌流后的14.8±2.9 mV,差异无统计学意义(P> 0.05,n= 4,见图3C)。
4. 2-AG对C纤维介导的兴奋性突触后电位无明显影响
形成稳定记录后,钳制膜电位在-70 mV,记录到C纤维介导的兴奋性突触后电位,取基础值作为对照,灌流2-AG(40 µM)8 min对C纤维介导的兴奋性突触后电位无明显影响,继续增加浓度(100 µM)对C纤维介导的eEPSPs影响不明显(见图4A, B)。在浓度为100 µM时,C纤维介导的eEPSPs幅度值由灌流前的14.2±2.5 mV至灌流后的13.1±2.0 mV,差异无统计学意义(P> 0.05,n=4, 见图 4C)。
讨 论
外周伤害性信息主要由Aδ和C纤维传导,经脊髓背角中间神经元信息整合后再上传至高位中枢[12]。脊髓背角中间神经元既有兴奋性也有抑制性神经元,抑制性中间神经元功能降低是神经病理性疼痛的中枢敏化机制之一[13]。而抑制性神经元功能降低的原因尚不清楚。近年来,eCBs系统是中枢神经系统突触可塑性研究的热点之一,研究发现大麻素对神经系统具有广泛的调控作用,包括痛觉、学习和记忆、帕金森疾病、药物成瘾等的调节作用[14]。内源性大麻素CB1受体在中枢神经系统主要位于谷氨酸能和 GABA 能神经元突触末梢,突触后膜合成和释放的eCBs通过激活突触前膜上的 CB1受体,从而影响谷氨酸能和 GABA 能神经元的突触释放功能[15]。
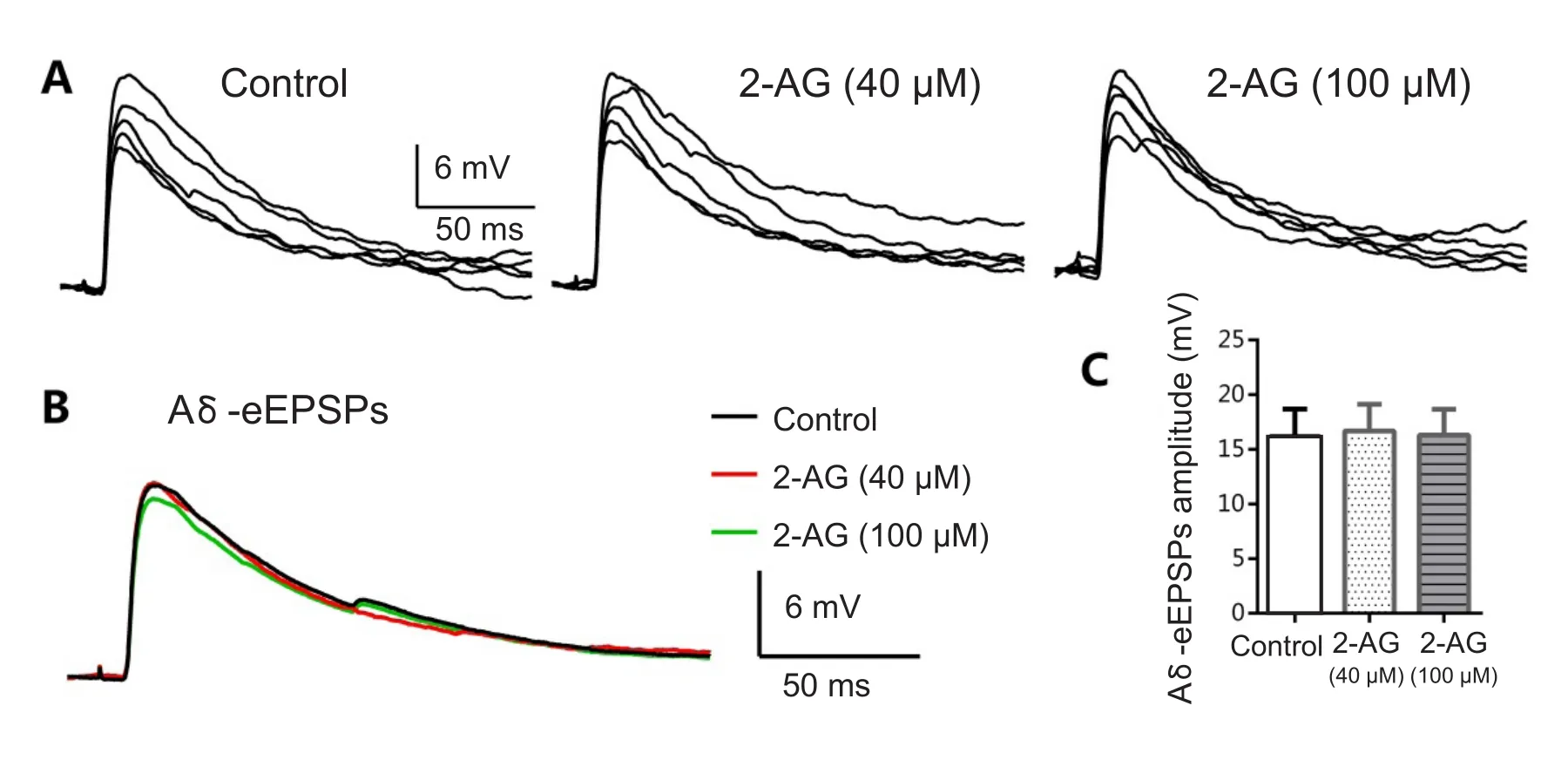
图3 2-AG对Aδ纤维介导的兴奋性突触后电位幅度的影响A分别为灌流前、灌流40 µM 2-AG、灌流100 µM2-AG后诱发的兴奋性突触后电位; B为三个不同阶段平均综合曲线; C为兴奋性突触后电位幅度值。Fig.3 Effects of2-AG on the amplitude of Aδ fi ber mediated eEPSPs A: Superfusion of 2-AG (40~100 µM) had little effect on the amplitude of Aδ fi ber mediated eEPSPs. B: Every trace was an average of 15 consecutive eEPSPs. C: The histogram showed the value of eEPSPs amplitude. P > 0.05 compared with control.
本研究发现,在脊髓切片中直接灌流2-AG,发现其可抑制伤害性纤维介导的抑制性神经递质的释放,而对兴奋性传递无明显影响,整体效应表现为抑制性回路的功能降低,表明脊髓水平的内源性大麻素含量升高可能参与脊髓伤害性回路的去抑制过程,提示eCBs可能介导了脊髓背角的敏化状态。研究表明,外周神经损伤以后,在形成神经病理性疼痛的过程中,脊髓内的eCBs水平明显升高[16],提示eCBs参与了这一病理过程,这为我们的观点提供了有力支持。虽然本实验发现的去抑制现象为短时程的突触可塑性变化,但我们推测在病理状态下,脊髓背角内源性大麻素的含量是始终维持在高水平状态,即去抑制效应持续存在,从而介导了痛觉敏化。有报道称,在脊髓背角抑制性中间神经元上敲除CB1受体以后,给与辣椒素所诱发的痛觉过敏明显缓解[17],提示eCBs的受体CB1介导了热痛觉过敏;最近有报道在烧灼痛模型鼠上给与CB1受体拮抗剂可以减轻灼伤后的痛觉过敏[18],这些研究都是建立在不同的痛模型鼠上,发现干扰CB1受体减轻了痛觉过敏,均暗示CB1受体介导了痛觉过敏的发生,和我们的发现激活CB1受体减少了抑制性递质的释放从而介导了脊髓背角的敏化状态高度吻合。本研究是在正常大鼠脊髓切片上外源性应用大麻素配体2-AG,模拟内源性大麻素升高状态,发现其可介导去抑制效应,而去抑制效应本身就是神经病理性疼痛的重要基础[19]。若对于已经形成的病理性状态,再应用大麻素,其效果和机制尚不清楚。本实验2-AG应用浓度是建立在探索性实验基础上,发现10~100 µM的浓度均可诱发去抑制效应,故为了减少细胞毒性提高实验有效性,采用中等水平浓度,但应用浓度并不一定和病理状态下脊髓背角的实际浓度相吻合,这也是本实验的局限所在。
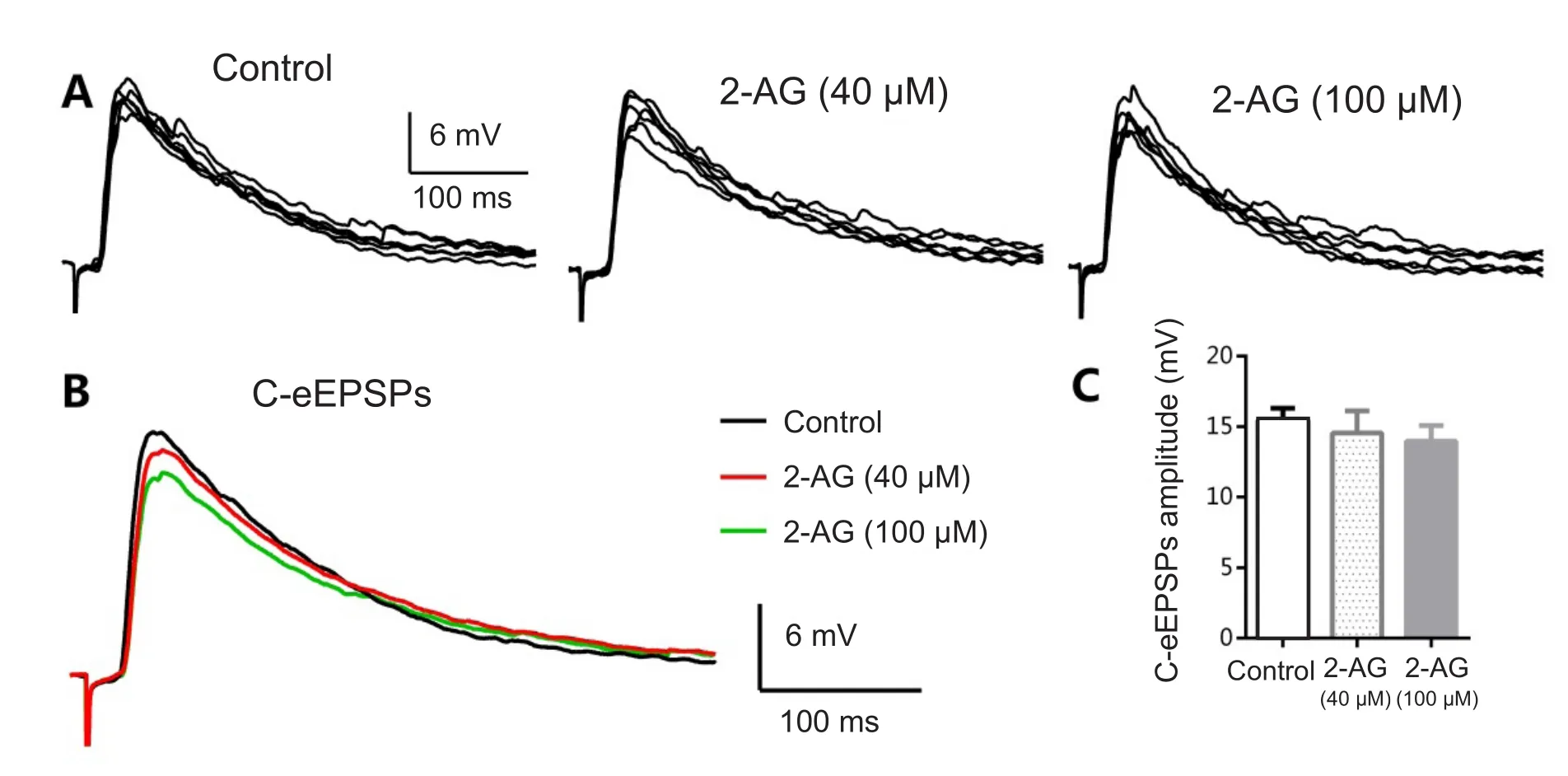
图4 2-AG对C纤维介导的兴奋性突触后电位幅度的影响A分别为灌流前、灌流40 µM 2-AG、灌流100 µM2-AG诱发的兴奋性突触后电位;B为三个不同阶段平均综合曲线;C为兴奋性突触后电位幅度值。Fig.4 Effects of2-AG on the amplitude of C fi ber mediated eEPSPs A: Superfusion of 2-AG (40~100 µM) had little effect on the amplitude of C fiber mediated eEPSPs. B: Every trace was an average of 15 consecutive eEPSPs. C: The histogram showed the value of eEPSPs amplitude. P > 0.05 compared with control.
我们推测,外周神经损伤以后,由于炎症反应或其他机制,激活了内源性大麻素系统,突触后神经元大麻素合成增加,作用于突触前抑制性神经元CB1受体,使抑制性神经递质释放减少,促进了脊髓背角痛觉敏化的形成。鉴于神经病理性疼痛机制复杂,本研究仅仅研究了内源性大麻素配体2-AG可减少脊髓背角抑制性神经递质的释放,但这种作用是不是神经病理性疼痛中枢敏化的基础仍需要深入研究。
[1]Woolf CJ, Salter MW. Neuronal plasticity: increasing the gain in pain. Science, 2000, 288(5472): 1765 ~ 1769.
[2]Ohaswa M, Yamamoto S, Ono H. [Contribution of the sensitization of supraspinal nociceptive transmission in chronic pain]. Yakugaku Zasshi, 2014, 134(3): 387 ~395.
[3]Todd AJ. Plasticity of inhibition in the spinal cord.Handb Exp Pharmacol, 2015, 227:171 ~ 190.
[4]Bradesi S. Role of spinal cord glia in the central processing of peripheral pain perception. Neurogastroenterol Motil, 2010, 22(5): 499 ~ 511.
[5]Lu Y, Perl ER. A speci fi c inhibitory pathway between substantia gelatinosa neurons receiving direct C-fiber input. J Neurosci, 2003, 23(25): 8752 ~ 8758.
[6]Woodhams SG, Sagar DR, Burston JJ,et al. The role of the endocannabinoid system in pain. Handb Exp Pharmacol, 2015, 227:119 ~ 143.
[7]郭薇薇, 姚磊, 熊伟. 大麻镇痛机制.中国疼痛医学杂志 , 2015, 21:561 ~ 566.
[8]Christie MJ, Mallet C. Endocannabinoids can open the pain gate. Sci Signal, 2009, 2(88): pe57.
[9]Veeraraghavan P, Nistri A. Modulatory effects by CB1 receptors on rat spinal locomotor networks after sustained application of agonists or antagonists. Neuroscience, 2015,303:16 ~ 33.
[10]Lu Y, Dong H, Gao Y,et al. A feed-forward spinal cord glycinergic neural circuit gates mechanical allodynia. J Clin Invest, 2013, 123(9): 4050 ~ 4062.
[11]Lu Y, Perl ER. Modular organization of excitatory circuits between neurons of the spinal superficial dorsal horn(laminae I and II). J Neurosci, 2005, 25(15): 3900 ~ 3907.[12]Cordero-Erausquin M, Inquimbert P, Schlichter R,et al.Neuronal networks and nociceptive processing in the dorsal horn of the spinal cord. Neuroscience, 2016,338:230 ~ 247.
[13]Woolf CJ, Mannion RJ. Neuropathic pain: aetiology,symptoms, mechanisms, and management. Lancet,1999, 353(9168): 1959 ~ 1964.
[14]Heifets BD, Castitlo PE. Endocannabinoid signaling and long-term synaptic plasticity. Annu Rev Physiol,2009, 71:283 ~ 306.
[15]Szabo B, Schlicker E. Effects of cannabinoids on neurotransmission. Handb Exp Pharmacol, 2005, 168):327 ~ 365.
[16]Petrosino S, Palazzo E, DE Novellis V,et al. Changes in spinal and supraspinal endocannabinoid levels in neuropathic rats. Neuropharmacology, 2007, 52(2):415 ~ 422.
[17]Nadal X, LA Porta C, Andreea Bura S,et al. Involvement of the opioid and cannabinoid systems in pain control:new insights from knockout studies. Eur J Pharmacol,2013, 716(1-3): 142 ~ 157.
[18]Ueda M, Iwasaki H, Wang S,et al. Cannabinoid receptor type 1 antagonist, AM251, attenuates mechanical allodynia and thermal hyperalgesia after burn injury.Anesthesiology, 2014, 121(6): 1311 ~ 1319.
[19]Prescott SA. Synaptic inhibition and disinhibition in the spinal dorsal horn. Prog Mol Biol Transl Sci, 2015,131:359 ~ 383.
ENDOCANNABINOID INDUCES SYNAPTIC DISINHIBITION IN SPINAL NOCICEPTIVE CIRCUITS OF RATS*
DU Shi-Bin, WANG Qun, HE Xiao-Lan, ZHANG Xiao, GU Nan, YUAN Hong-Jie, LU YanΔ
(Department of Pain Medicine, Xijing Hospital, Fourth Military Medical University, Xian 710032, China)
Objective: To determine the effects of endocannabinoid 2-AG on synaptic transmission of nociceptive circuits in spinal super fi cial dorsal horn of rats. Methods: 5~6 weeks old male Sprague-Dawley rats were anaesthetized and killed by heart perfusion of artificial cerebrospinal fluid. The lumbosacral enlargement of the spinal cord was quickly removed and cut into sagittal spinal slices with a single dorsal root attached. Whole-cell patch-clamp recordings were made in super fi cial spinal dorsal horn neurons (lamina I and II). Dorsal root electric stimulation was used to evoke the excitatory postsynaptic potentials (eEPSPs)or inhibitory postsynaptic potentials (eIPSPs) in neurons recorded. 2-AG was bath perfused onto spinal cord slices to observe the changes of amplitude of eIPSPs or eEPSPs. Results: Application of 2-AG in spinal cord slices markedly suppressed the amplitude of Aδ and C fi ber mediated eIPSPs (P< 0.05), but had little effect on Aδ and C fiber mediated eEPSPs. Conclusion: Endocannabinoid 2-AG may induce disinhibition of spinal nociceptive circuits through attenuating the inhibitory synaptic transmission in super fi cial spinal dorsal horn, suggesting that Endocannabinoid 2-AG is involved in the impairment of spinal inhibitory circuits and contributed to the development of central sensitization.
Endocannabinoids; Spinal dorsal horn; Disinhibition; IPSPs
10.3969/j.issn.1006-9852.2017.02.004
国家自然科学基金(31530090, 81471139)
△通讯作者 yanlu001@fmmu.edu.cn
