罗平小黄姜多糖提取工艺的优化及抗氧化活性测定
2017-11-17赵丛丛彭春艳
赵丛丛,彭春艳
(曲靖师范学院,云南 曲靖 655011)
罗平小黄姜多糖提取工艺的优化及抗氧化活性测定
赵丛丛,彭春艳
(曲靖师范学院,云南 曲靖 655011)
采用水提醇沉法提取罗平小黄姜中的多糖,正交试验显示最佳提取工艺为料液比1∶20、提取温度90 ℃、提取时间160 min,在此条件下罗平小黄姜多糖的得率达到6.16%。此外,当多糖浓度达到1.0 mg/mL时,对DPPH·和·OH的清除率分别可达57.1%和44.5%,清除DPPH·的IC50为0.96 mg/mL。
罗平小黄姜;多糖;抗氧化
罗平小黄姜是云南省罗平县传统的出口产品之一,曾获国家对外经济贸易部优质产品称号。研究表明生姜含多种氨基酸,水提取物和醇提取物中含有可溶性多糖、姜酚和黄酮等有效成分,具有降血脂、抗氧化、降胆固醇、治疗心血管疾病等功效[1-4]。生姜具有重要的药用价值及广阔的发展前景[5-7],但对罗平小黄姜的研究甚少,本文利用水提醇沉法提取罗平小黄姜中的多糖,并对其抗氧化性进行了研究,为罗平小黄姜资源的开发利用提供了一定的理论基础。
1 材料与方法
1.1 材料与试剂
罗平小黄姜:罗平农贸市场;抗坏血酸:食品级;葡萄糖、水杨酸、DPPH·、乙醇、苯酚、浓硫酸等:均为分析纯。
1.2 主要仪器和设备
CP114型分析天平 美国奥豪斯天平有限公司;TU-1810型紫外可见分光光度计 北京普析通用仪器有限公司;FW135型中药粉碎机 天津市泰斯特仪器有限公司;3200LHC型超声仪 上海科导超声仪器有限公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 小黄姜预处理
将新鲜罗平小黄姜切片,80 ℃烘干,用粉碎机粉碎后过60目筛得生姜粉。将罗平小黄姜粉先按1∶5加入无水甲醇于70 ℃条件下回流2 h,再加石油醚于50 ℃回流2 h脱去脂质和色素,重复操作2次,过滤后风干备用[8]。
1.3.2 葡萄糖标准曲线的制备[9]
称取10 mg葡萄糖,105 ℃干燥至恒重置于100 mL容量瓶中,定容,得到0.1 mg/mL的葡萄糖标准溶液。吸取葡萄糖标准液0.0,0.2,0.4,0.6,0.8,1.0 mL,分别放置于10 mL容量瓶中,分别加入1.0 mL 5%的苯酚溶液,混匀后加入4 mL的浓硫酸,定容,室温条件下放置30 min, 490 nm处测定吸光度(A)。以葡萄糖浓度(C,mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线,得到标准曲线方程y=1.259x+0.001,R2=0.999,见图1。

图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
1.3.3 罗平小黄姜多糖的提取
称取预处理后的罗平小黄姜粉5.000 g,加入适量蒸馏水,混匀,在恒温水浴锅中提取一段时间后进行抽滤,滤渣用相同体积的蒸馏水进行第2次提取,合并2次滤液,将其浓缩定容至一定的体积。移取2.0 mL罗平小黄姜多糖提取液置于10 mL容量瓶中, 490 nm处测定吸光度,计算出罗平小黄姜多糖的得率。
多糖得率(%)=(C×V)/(W×1000)×100%。
式中:C为罗平小黄姜提取液中多糖的浓度(mg/mL);V为罗平小黄姜提取液的总体积(mL);W为罗平小黄姜的质量(g)。
1.3.4 单因素试验
本文选取提取温度、料液比、提取时间3个因素,研究其对罗平小黄姜多糖提取率的影响,单因素水平表见表1。

表1 单因素水平表Table 1 Single factor-level table
1.3.5 罗平小黄姜多糖的抗氧化性研究
1.3.5.1 罗平小黄姜多糖对DPPH·的清除作用
参照刘海英、马利华、李顺峰等的研究[10-12],配制不同浓度的多糖样品液5,4,3,2,1,0.1 mg/mL,研究罗平小黄姜多糖对DPPH·的清除作用。
1.3.5.2 罗平小黄姜多糖对·OH自由基的清除作用
参照严军等[13]的研究,配制一系列不同浓度的罗平小黄姜多糖溶液,研究罗平小黄姜多糖对·OH自由基的清除作用。
2 结果与分析
2.1 单因素试验
2.1.1 提取温度对罗平小黄姜多糖得率的影响
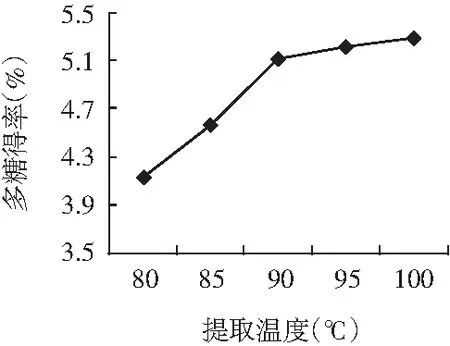
图2 提取温度的影响Fig.2 The effect of extraction temperature
由图2可知,罗平小黄姜多糖的得率随提取温度的升高而增大,当温度超过90 ℃后,提取率增高得不明显,因为此时水对多糖的溶解度已达到饱和。考虑到多糖在高温下会发生水解及升高温度对设备的要求等因素,因此提取温度确定在90 ℃为宜。
2.1.2 料液比对罗平小黄姜多糖得率的影响

图3 料液比的影响Fig.3 The effect of solid-liquid ratio
由图3可知,当料液比小于1∶18时,多糖得率随料液比的升高而显著增加,当料液比超过1∶20时,罗平小黄姜多糖的得率变化不明显。显著增加的原因可能是相似相溶的原理,使罗平小黄姜多糖的提取率上升;料液比达到1∶18时,多糖的溶解达到平衡,多糖得率最大,因此选择料液比1∶18为宜。
2.1.3 提取时间对罗平小黄姜多糖得率的影响

图4 提取时间的影响Fig.4 The effect of extraction time
由图4可知,提取时间在150 min之前,多糖的提取率速度变快,曲线斜率变大;在150 min之前10 min内,斜率变化尤为明显,之后速度减慢;在150 min之后,多糖的得率变化不明显。表明提取时间过短,多糖提取不充分;提取时间过长,多糖在水中溶解达到平衡,多糖提取率变化逐渐不明显,同时溶液中其他物质的溶解量增加,也会阻碍多糖类物质的溶出。综上得出150 min作为提取时间最为合适。
2.2 正交试验
采用 L9(33)正交试验确定罗平小黄姜多糖的最佳提取条件,正交试验设计见表2。

表2 正交试验因素水平Table 2 The factors and levels of orthogonal experiment

表3 正交试验结果Table 3 The results of orthogonal experiment
续 表
由表3可知,在3个因素中,提取温度(A)极差最大,料液比(B)其次,提取时间(C)最小。表明影响多糖得率的主次因素顺序为:提取温度>料液比>提取时间。由K值可知A2B3C3为最优组合,即多糖提取最优条件为:提取温度90 ℃,料液比1∶20,提取时间160 min。在此条件下,做验证试验,多糖得率为6.16%。
2.3 罗平小黄姜多糖抗氧化性研究
2.3.1 罗平小黄姜多糖对DPPH·的清除能力
评价自由基清除剂效果常用IC50值,其值越小,自由基清除效果越好。
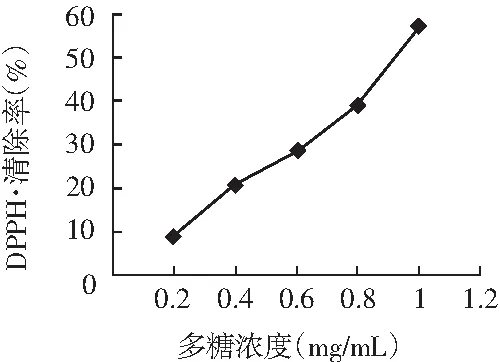
图5 多糖对DPPH·自由基的清除作用Fig.5 The scavenging effect of polysaccharideson DPPH free radical
由图5可知,当提取液浓度达到1.0 mg/mL时,对DPPH·的清除率达到57.1%,清除DPPH·的IC50为0.96 mg/mL,比抗坏血酸的IC50值(0.85 mg/mL)小一些,结果显示在一定浓度范围内罗平小黄姜多糖具有较强的清除DPPH·能力。
2.3.2 罗平小黄姜多糖对·OH的清除能力

图6 多糖对·OH自由基的清除作用Fig.6 The scavenging effect of polysaccharides on·OH free radical
由图6可知,罗平小黄姜多糖对·OH有一定的清除作用,随着小黄姜多糖浓度的增加,清除能力逐渐增强,呈现递增关系。当提取液浓度达到1.0 mg/mL时,提取液对·OH自由基的清除作用达到44.5%。
3 结论
最佳提取工艺参数为料液比1∶20、提取温度90 ℃、提取时间160 min,在此条件下罗平小黄姜多糖的得率达到6.16%。此外,罗平小黄姜多糖对DPPH·和·OH 2种自由基都存在清除效果,当罗平小黄姜多糖提取液浓度达到1.0 mg/mL时,对DPPH·和·OH的清除率分别可达57.1%和44.5%,清除DPPH·的IC50为0.96 mg/mL。
[1]卢传坚.姜的化学成分分析研究概述[J].中药新药与临床药理,2003(3):215-217.
[2]Ahmed R S,Seth V,Pasha S T,et al.Influence of dietary ginger on oxidative stress induced by malation in rats[J].Food Chem Toxieol,2000,38(5):443-445.
[3]刘雪梅.生姜的药理作用研究进展[J].中成药,2002,24(7):539-541.
[4]邓胜国,尹爱武,陈铁壁.罗平小黄姜多糖的提取工艺及抗氧化活性的研究[J].湖南科技学院学报,2013,34(4):66-73.
[5]营大礼.干姜化学成分及药理作用的研究[J].中国药房,2008,19(18):1435-1436.
[6]郑灿龙,张月明,王良.姜茶保健饮料开发研究[J].食品工业科技,2006,27(2):112-114.
[7]王晓梅,张忠山,郑卫红,等.罗平小黄姜多糖的提取工艺纯化及鉴定[J].中国调味品,2011,36(5):44-51.
[8]侯英梅,吴少福,沈勇根.罗平小黄姜多糖的提取工艺研究[J].江西农业大学学报,2007(3):466-469.
[9]马猛华,崔波,于海峰,等.苯酚-硫酸法测定玫瑰花渣中多糖含量的研究[J].山东轻工业学院学报,2008,22(4):23-25.
[10]刘海英,张运峰,范永山,等.平菇、杏鲍菇和白灵菇菌丝多糖对·OH、DPPH·和NO2-的体外清除作用[J].中国农学通报,2010(17):26-30.
[11]马利华,秦卫东.罗平.小黄姜多糖抗氧化性及其组分的研究[J].食品工业科技,2010(7):120-124.
[12]李顺峰,张丽华,付娟妮.真姬菇子实体多糖体外抗氧化特性研究[J].西北农业学报,2008(4):302-305.
[13]颜军,苟小军,邹全付.分光光度法测定Fenton反应产生的羟基自由基[J].成都大学学报(自然科学版),2009(2):93-103.
OptimizationofExtractionProcessandDeterminationofAntioxidantActivityofPolysaccharidesfromLuopingYellowGinger
ZHAO Cong-cong,PENG Chun-yan
(Qujing Normal University, Qujing 655011, China)
The polysaccharides of Luoping yellow ginger are extracted by water-extraction and alcohol-precipitation method. The optimal extraction conditions are determined by orthogonal test as follows: solid-liquid ratio is 1∶20, extraction temperature is 90 ℃, extraction time is 160 min. Under the optimum conditions, the yield of Luoping yellow ginger reaches 6.16%. In addition, when the polysaccharides concentration reaches 1.0 mg/mL, the scavenging rates of DPPH·and·OH are 57.1% and 44.5% respectively, and the IC50of scavenging DPPH·is 0.96 mg/mL.
Luoping yellow ginger;polysaccharide;antioxidation
TS207.3
A
10.3969/j.issn.1000-9973.2017.11.030
1000-9973(2017)11-0133-04
2017-05-01
云南省教育厅科学研究一般项目(2015C088Y)
赵丛丛(1986-),女,讲师,研究方向:保健功能食品。
