真空包装低温熟牛肉中腐败菌的分离与鉴定
2017-11-16徐雅梦姜晓冰于涛姜晓杰张艺鸽
徐雅梦+姜晓冰+于涛+姜晓杰+张艺鸽

摘 要:为研究真空包装低温熟牛肉中腐败菌的种类和特性,利用细菌常规培养方法,根据菌株的菌落形态、颜色等特征,挑选差别较明显的12 株菌。通过扩增核糖体DNA限制性分析(amplified ribosomal DNA restriction analysis,ARDRA)以及16S rDNA序列比对分析确定菌株的分类地位,并结合菌株形态和生理生化鉴定确定12 株菌所属的种。结果表明:所选取的12 株菌中,3 株为绿色魏斯氏菌,2 株为枯草芽孢杆菌,2 株为巴黎链球菌,2 株为粪肠球菌,1 株为解淀粉芽孢杆菌,1 株为特基拉芽孢杆菌,1 株为嗜冷杆菌属的Psychrobacter urativorans。其中绿色魏斯氏菌是导致样品变绿的主要原因。
关键词:低温肉制品;腐败菌;绿色魏斯氏菌;乳酸菌
Isolation and Identification of Spoilage Bacteria in Vacuum-Packed Low-Temperature Cooked Beef
XU Yameng1, JIANG Xiaobing1, YU Tao2,*, JIANG Xiaojie3, ZHANG Yige1
(1.College of Life Sciences, Henan Normal University, Xinxiang 453007, China;
2.College of Life Sciences and Technology, Xinxiang University, Xinxiang 453000, China;
3.Department of Food Hygiene and Environmental Health, University of Helsinki, Helsinki FI00014, Finland)
Abstract: In order to investigate the species and characteristics of spoilage bacteria in vacuum-packed low-temperature cooked beef, the conventional bacterial culture method was employed to select 12 morphologically distinct isolates from spoiled cooked beef samples according to colonial characteristics. The isolates were taxonomically classified by amplified ribosomal DNA restriction analysis (ARDRA) as well as 16S rDNA sequence alignment and then they were identified at species level by morphological analysis and biochemical tests. Our results showed 3 isolates of Weissella viridescens, 2 isolates of Bacillus subtilis, 2 isolates of Streptococcus lutetiensis , 2 isolates of Enterococcus cecorum ,1 isolate of Bacillus amyloliquefaciens, 1 isolate of Bacillus tequilensis and 1 isolate of Psychrobacter urativorans among the 12 isolates. Weissella viridescens was responsible for the green color of spoiled meat samples.
Key words: low-temperature meat product; spoilage bacteria; Weissella viridescens; lactic acid bacteria
DOI:10.7506/rlyj1001-8123-201708005
中图分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2017)08-0023-05
低温肉制品是指在常压下通过蒸、煮、熏、烤等热加工过程使肉制品的中心温度控制在68~72 ℃,并且需要在0~4 ℃的低温环境下贮藏、运输及销售的一类肉制品[1]。与高温肉制品(通常采用121 ℃、0.1 MPa的高温高压加热方式)相比,低温肉制品能够最大限度地保留肉类原有的营养成分及风味物质,是世界肉类产品的发展趋势[2]。低温肉制品在蒸煮阶段一般采用68~72 ℃的杀菌工艺,冷却后在无菌车间进行切分,真空包装为此类肉制品的主要包装形式,保质期一般为2~4 周,保质期的长短主要取决于初始菌量及贮藏温度[3]。
肉制品富含蛋白質、脂肪等营养物质,极易被微生物利用,产生腐败变质现象[4]。低温肉制品腐败后会产生发黏、变色、变味、胀袋等现象,导致感官品质及营养价值的降低,这不仅会造成严重的经济损失,还可能引发食品安全事件[5]。因此,研究低温肉制品中腐败微生物的种类及特性对此类产品的质量安全控制具有重要意义。本研究对真空包装低温熟牛肉中的腐败菌进行分离和鉴定,并对菌株的生理生化特性进行研究,为进一步采取有效的防腐保鲜措施、延长产品的货架期提供参考。
1 材料与方法endprint
1.1 材料与试剂
已变质的真空包装低温熟牛肉。打开包装后,可观察到样品表面有黏液,伴随有异味产生;无菌操作切开样品后,可观察到切面上多处已呈现绿色。
蛋白胨、脑心浸液(brain heart infusion,BHI)培养基 北京陆桥生物技术有限公司;细菌基因组DNA提取试剂盒 北京天根生化科技有限公司;用于聚合酶链式反应(polymerase chain reaction,PCR)擴增的试剂、限制性内切酶(15 U/μL) 宝生物工程(大连)有限公司;PCR产物纯化试剂盒 德国Qiagen公司;扩增引物 上海英骏生物技术有限公司;过氧化氢酶、甲基红、葡萄糖、木糖、麦芽糖、鼠李糖、甘露醇、七叶苷、
D-核糖、阿拉伯糖、蔗糖、乳糖、半乳糖(质量浓度均为0.5 g/mL) 广东环凯微生物科技有限公司。
1.2 仪器与设备
XO-6D拍击式均质器 江苏南京先欧仪器制造有限公司;DH360电热恒温培养箱 北京科伟永兴仪器有限公司;THZ-82气浴恒温振荡器 金坛市天竟实验仪器厂;ETC811基因扩增仪 北京东胜创新生物科技有限公司;DYY-8C电泳仪 北京市六一仪器厂;TGL-16B离心机 上海安亭科学仪器厂;UNIVERSAL HOOD Ⅱ凝胶成像分析系统 美国Bio-Rad公司。
1.3 方法
1.3.1 菌株的培养、分离与纯化
以无菌操作从样品中心和表面取样(各12.5 g),混合后放入装有225 mL 0.1 g/mL蛋白胨水的均质袋中,在拍击式均质器上连续均质1~2 min;吸取均质液0.5 mL,用0.1 g/mL的蛋白胨水按10 倍递增进行梯度稀释,选取3 个适宜浓度(保证平板上的菌落数为30~300 个),分别采用涂布法[6]和倾注法[7]进行菌株培养。涂布法:取100 ?L稀释液均匀涂布在BHI培养基上,30 ℃有氧培养2 d;倾注法:取1 mL稀释液于无菌平皿内,将15 mL冷却至46 ℃的BHI培养基倾注至平皿,转动平皿使稀释液与培养基混合均匀,待琼脂凝固后,将平板翻转,30 ℃厌氧培养3 d。待平板上长出菌落后,挑取外观形态不同的单菌落,划线于BHI培养基上进行纯化。将纯化后的菌株转移至BHI培养基,4 ℃保存。
1.3.2 菌株的PCR扩增
DNA模板的制备:用细菌基因组DNA提取试剂盒提取分离所得菌株的DNA,-20 ℃保存备用。
以提取出的菌株基因组DNA(16S rDNA)为模板,选用细菌通用引物(正向引物27F:5-AGAGTTTGATCCTGG-3;反向引物1492R:5-GGTTACCTTGTTACGACTT-3)进行PCR扩增。PCR反应条件:95 ℃预变性5 min,95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,30 个循环;72 ℃延伸10 min。使用1%琼脂糖凝胶电泳对PCR产物进行检测,使用PCR产物纯化试剂盒对PCR产物进行纯化,将纯化后的产物送北京博迈德生物技术有限公司测序。
1.3.3 扩增核糖体DNA限制性分析(amplified ribosomal DNA restriction analysis,ARDRA)
本研究选取的限制性内切酶为EcoRⅠ、SpeⅠ和TaqⅠ,选择20 ?L酶切反应体系。
EcoRⅠ和SpeⅠ双酶切反应体系:1 ?L EcoRⅠ、1 ?L SpeⅠ、2 ?L 10×H Buffer、7 ?L DNA模板和9 ?L无菌水。反应条件:37 ℃恒温酶切4 h,65 ℃恒温5 min终止反应[8]。TaqⅠ单酶切反应体系:1 ?L TaqⅠ、2 ?L 10×TaqⅠ Buffer、2 ?L 0.1 g/mL的牛血清白蛋白(bovine serum albumin,BSA)、7 ?L DNA模板和8 ?L无菌水。反应条件:65 ℃反应4 h,加入2 ?L 10×Loading buffer终止反应。使用1%琼脂糖凝胶电泳检测酶切产物。
1.3.4 系统进化树的构建
测序得到菌株的16S rDNA序列,使用NCBI网站的BLAST程序将测序结果与GenBank数据库中的核酸序列进行比对,从中选取相似性较高的序列,使用DNAstar和MEGA 4软件进行多重序列比对分析,并构建系统进化树。
1.3.5 菌株的生理生化鉴定
参照《伯杰氏细菌鉴定手册》[9]和《常见细菌系统鉴定手册》[10]对纯化后的菌株进行生理生化鉴定。
2 结果与分析
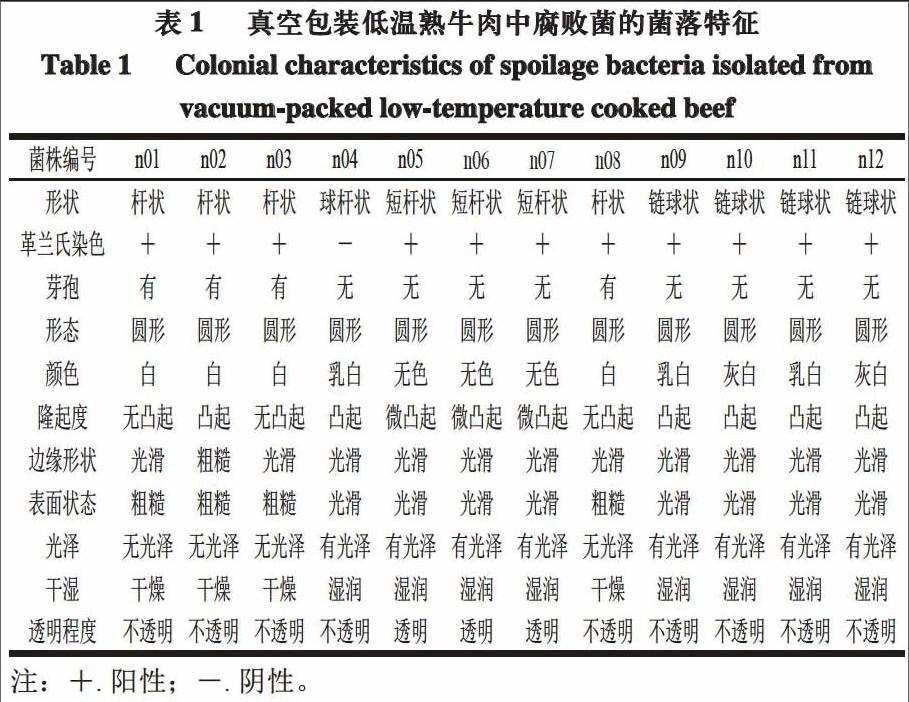
2.1 菌株的菌落特征
本研究分别采用涂布法和倾注法对菌株进行培养,涂布法中的平板在有氧条件下放置,主要用于好氧菌和兼性厌氧菌的分离;倾注法中的平板在厌氧条件下放置,主要用于厌氧菌和兼性厌氧菌的分离。根据样品稀释液在BHI培养基上所生长细菌菌落的表型差异,共筛选出12 株腐败菌,编号为n01~n12,12 株菌的基本形态特征如表1所示。菌株的分离和筛选主要依据其形态、颜色等特征,不排除筛选出同一种属、甚至同一菌株的可能性。
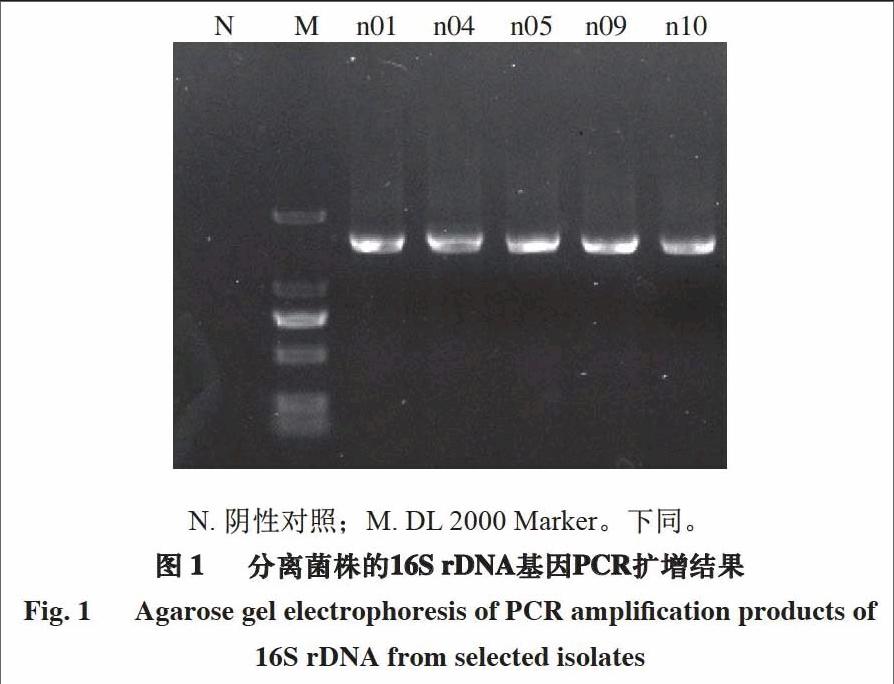
2.2 菌株的PCR扩增结果
所有菌株经过PCR扩增(16S rDNA)后均出现了清晰可辩的特异性条带,条带大小为1 500 bp左右。其中菌株n01、n04、n05、n09、n10的PCR扩增结果如
图1所示。
N. 阴性对照;M. DL 2000 Marker。下同。
2.3 ARDRA结果
ARDRA是限制性片段长度多态性(restriction fragment length polymorphism,RFLP)在核糖体DNA序列上的应用[11]。最初的RFLP技术的依据是不同生物个体之间DNA片段的酶切位点有所差异,经限制性内切酶消化后能够产生长短、种类、数目不同的限制性片段,基于对限制性片段的分析,从DNA水平比较不同个体之间的差异[12]。ARDRA则是根据16S rDNA基因序列的限制性片段区分菌株种的差异[13]。由图2~3可知,12 株菌的16S rDNA分别经EcoRⅠ和SpeⅠ双酶切、TaqⅠ单酶切后,均可获得便于区分的酶切图谱。根据条带的相似性可以将12 株菌分为5 组,第1组包括n01、n02、n03和n08,第2组包括n05、n06和n07,第3组包括n09和n11,第4组包括n10和n12,第5组仅包括n04。同一组内菌株的酶切图谱具有较高的相似性,表明这些菌株之间存在一定的亲缘关系。endprint
2.4 菌株系统进化树的构建
将12 株菌的16S rDNA序列通过BLAST与GenBank中已发表的16S rDNA序列进行比对,选取相似性在99%以上的菌株构建系统进化树。由图4可知,n01和n08与枯草芽孢杆菌(Bacillus subtilis)、n02与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、n03与特基拉杆菌(Bacillus tequilensis)亲缘关系最近,它们均属于芽孢杆菌属(Bacillus sp.);n04与嗜冷杆菌属(Psychrobacter sp.)
亲缘关系最近;n05、n06和n07与魏斯氏菌属(Weissella sp.)
亲缘关系最近;n09和n11与链球菌属(Streptococcus sp.)
亲缘关系最近;n10和n12与肠球菌属(Enterococcus sp.)亲缘关系最近。
2.5 菌株的生理生化鉴定结果
参照GenBank比对结果,根据《伯杰氏细菌鉴定手册》[9]和《常见细菌系统鉴定手册》[10]对菌株进行相应的生理生化鉴定。由表2可知,n01和n08为枯草芽孢杆菌,n02为解淀粉芽孢杆菌,n03为特基拉芽孢杆菌,n04为嗜冷杆菌属的Psychrobacter urativorans(暂无中文命名),n05、n06和n07为魏斯氏菌属中的绿色魏斯氏菌,n09和n11为巴黎链球菌,n10和n12为粪肠球菌。
芽孢杆菌属为革兰氏阳性、好氧或兼性厌氧杆菌,能形成芽孢,抵抗不良生存环境。芽孢杆菌属在自然界中分布广泛,是污染肉类、乳类和谷类食品的重要细菌,芽孢杆菌属中与食品密切相关的菌株是其模式菌——枯草芽孢杆菌,该菌常污染肉制品,并使肉制品表面出现黏丝状或黏液状现象[14]。芽孢杆菌能够耐高温,即使经过高温杀菌,肉制品中的芽孢杆菌也有可能存活下来,进而导致肉制品变质。陈晓等[15]从腐败的火腿肠样品中分离出枯草芽孢杆菌和解淀粉芽孢杆菌。嗜冷杆菌属是一类不运动、不产色素、氧化酶反应呈阳性、耐低温的革兰氏阴性杆菌,其通常能在低至5 ℃的环境中生长,20 ℃时生长情况最好[16]。嗜冷杆菌属的耐冷特性主要是由于其细胞膜内含有大量的不饱和脂肪酸,并且随着温度的降低不饱和脂肪酸的含量会增加,以保证细胞膜在低温条件下的流动性,使细胞能够在低温条件下不断从外界环境中吸收营养物质,维持细胞的正常生命活动[17]。嗜冷杆菌属是导致低温保藏食品腐败的主要腐败菌。到目前为止,已经从冷冻肉和乳制品中分离得到嗜冷杆菌属[18-19]。本研究从真空包装低温熟牛肉中分离得到一株Psychrobacter urativorans,据报道这种菌曾在低温保藏的猪肉香肠中检出过[20]。
国内外的研究表明,乳酸菌(lactic acid bacteria,LAB)是真空包装低温熟肉制品中的主要腐败菌[21]。从广义上来讲,本研究中分离得到的链球菌、肠球菌和魏斯氏菌均属于乳酸菌,这些细菌的存活能力较强,能够适应低pH值、高温等不良环境。在真空包装低温熟肉制品的贮藏初期,此类细菌数量较少,所占比例较低;但在贮藏过程中,此类细菌的生长明显优于其他细菌,并且具有较强的腐败活性[22]。链球菌为革兰氏阳性菌,兼性厌氧,能够利用碳水化合物产生乳酸,属于单一发酵型菌株[23]。该属中的嗜热链球菌和乳酸链球菌与食品工业密切相关,嗜热链球菌常用于发酵乳的生产,乳酸链球菌中的某些菌株能够产生乳酸链球菌素,该物质作为一种天然防腐剂能够有效抑制食品中细菌的生长[24]。在早期的报道中,巴黎链球菌被认为是婴儿链球菌的一个亚种(结肠亚种)[25];2002年以后,该菌被划分为链球菌属的一个新种,命名为巴黎链球菌。巴黎链球菌能够在BHI和MRS培养基中生长。在血平板上,该菌能够形成表面光滑、无色素的圆形菌落。巴黎链球菌能够从发酵乳制品和发酵谷物制品中分离得到[26]。刘晓红等[27]的研究表明巴黎链球菌是卤鸭脖中的优势腐败菌,肠球菌是人类和动物肠道中的主要常驻菌,动物屠宰时,肠道中的肠球菌可能会对原料肉造成污染,例如粪肠球菌是牛肉、猪肉切口上的优势菌。和大多数乳酸菌一样,肠球菌对高温具有耐受性,经加热处理后,肉中的肠球菌仍能存活,最终导致肉制品的腐败。
绿色魏斯氏菌属于异型发酵乳酸菌,能夠导致食品(特别是肉制品)的腐败变质。贺旺林等[14]认为魏斯氏菌是真空包装低温熟肉制品中的特定腐败菌(specific spoilage organism,SSO)。Du?ková等[28]的研究表明,绿色魏斯氏菌是导致肉制品产生黏液并且发绿的主要原因,起初黏液仅在单个菌落周围出现,之后逐渐形成一整片绿色的黏液,并从肉制品的表面向内部渗透。绿色魏斯氏菌在生长过程中会产生过氧化氢和硫化氢,过氧化氢能直接氧化肉中肌红蛋白的卟啉环,生成绿色的羟基卟啉胆绿蛋白;另一方面,当硫化氢、过氧化氢和氧气同时存在时,硫原子会加在血红素卟啉环的α-亚甲基上,使血红素转变为巯基卟啉血素、肌红蛋白转变为巯卟啉肌绿蛋白及巯卟啉血绿蛋白,最终导致肉制品变绿[29]。本研究所检测的肉制品内部已出现整片的绿色黏液,从该样品中分离得到绿色魏斯氏菌,推测该菌是导致样品变绿的主要原因。真空包装低温熟牛肉样品受到绿色魏斯氏菌的污染可能由2 种原因造成[28-30]:1)在加工环节,包括冷却、切片和真空包装等工序中受到污染;2)绿色魏斯氏菌能够耐受高温,肉制品加工过程中对原料肉的蒸煮并不能有效杀灭该菌,且在包装好的成品中该菌会迅速成为优势菌,从而导致肉制品的腐败变质。
3 结 论
本研究对真空包装低温熟牛肉中的腐败菌进行分离,并结合表型分析、ARDRA、系统进化树的构建对菌株进行鉴定。结果表明,分离得到的12 株菌中,4 株为芽孢杆菌属,3 株为绿色魏斯氏菌,2 株为巴黎链球菌,2 株为粪肠球菌,1 株为嗜冷杆菌。其中,绿色魏斯氏菌是导致样品变绿的主要原因,总体来说,乳酸菌是真空包装低温熟肉制品中的主要腐败菌。本研究为进一步采取有效的防腐保鲜措施、延长低温肉制品的货架期提供了理论依据。endprint
参考文献:
[1]BECKER A, BOULAABA A, PINGEN S, et al. Low temperature cooking of pork meat: physicochemical and sensory aspects[J]. Meat Science, 2016, 118: 82-88. DOI:10.1016/j.meatsci.2016.03.026.
[2]肖九梅. 正在悄然崛起的保健肉制品成为食品市场新贵[J]. 肉类工业, 2015(12): 49-54.
[3]DABAD? D S, DEN BESTEN H M W, AZOKPOTA P, et al. Spoilage evaluation, shelf-life prediction, and potential spoilage organisms of tropical brackish water shrimp (Penaeus notialis) at different storage temperatures[J]. Food Microbiology, 2015, 48: 8-16. DOI:10.1016/j.fm.2014.11.005.
[4]DRAGOEV S G, STAYKOV A S, VASSILEV K P, et al. Improvement of the quality and the shelf life of the high oxygen modified atmosphere packaged veal by superficial spraying with dihydroquercetin solution[J]. International Journal of Food Science, 2014: 1-10. DOI:10.1155/2014/629062.
[5]COMI G, IACUMIN L. Identification and process origin of bacteria responsible for cavities and volatile off-flavour compounds in artisan cooked ham[J]. International Journal of Food Science and Technology, 2012, 47(1): 114-121. DOI:10.1111/j.1365-2621.2011.02816.x.
[6]LIU Jie, ZHANG Xinxin, WANG Hongying, et al. The antibacterial properties and biocompatibility of a Ti-Cu sintered alloy for biomedical application[J]. Biomedical Materials, 2014, 9(2): 025013. DOI:10.1088/1748-6041/9/2/025013.
[7]李光泽. 食品微生物检验菌落总数测定方法的效果分析[J]. 中国卫生产业, 2016, 13(1): 134-135.
[8]鲍大鹏, 王南, 陈明杰, 等. 采用ARDRA和RAPD对柳松菇(Agrocybeaegerita)菌株遗传多样性的分析[J]. 上海农业学报, 2001, 17(1): 18-22.
[9]希坎南R E. 伯杰氏细菌鉴定手册[M]. 北京: 科学出版社, 1989.
[10]东秀珠, 蔡妙英. 常见细菌鉴定手册[M]. 北京: 科学出版社, 2001.
[11]BLASCO L, KAHALA M, JATILA H, et al. Application of 16S-ARDRA and RFLP-PFGE for improved genotypic characterisation of dairy propionibacteria and combination with characteristic phenotypes[J]. International Dairy Journal, 2015, 50: 66-71.
DOI:10.1016/j.idairyj.2015.06.005.
[12]SJ?BERG F, NOWROUZIAN F, RANGEL I, et al. Comparison between terminal-restriction fragment length polymorphism (T-RFLP) and quantitative culture for analysis of infants gut microbiota[J]. Journal of Microbiological Methods, 2013, 94(1): 37-46. DOI:10.1016/j.mimet.2013.04.002.
[13]周建波, 姜亞, 宁俊平, 等. 应用扩增性rDNA限制性酶切片段多态性分析技术研究竹鼠盲肠细菌菌群的多样性[J]. 动物营养学报, 2013, 25(10): 2504-2508.
[14]贺旺林, 俞龙浩. 基于腐败微生物的低温肉制品货架期预测研究进展[J]. 黑龙江八一农垦大学学报, 2015(2): 51-56.
[15]陈晓, 高晓平, 李苗云, 等. 肉制品致腐微生物溯源技术构建[J]. 食品科学, 2013, 34(14): 178-181. DOI:10.7506/spkx1002-6630-201314036.endprint
[16]MOGHADAM M S, ALBERSMEIER A, WINKLER A, et al. Isolation and genome sequencing of four Arctic marine Psychrobacter strains exhibiting multicopper oxidase activity[J]. BMC Genomics, 2016, 17: 117-131. DOI:10.1186/s12864-016-2445-4.
[17]池振明, 王致鹏, 徐红梅. 嗜冷酵母菌在低温下生长和适应及可能的机理[J]. 中国海洋大学学报(自然科学版), 2015, 45(5): 54-58.
[18]朱雅玲. 浅谈如何控制生鲜乳中的嗜冷菌[J]. 中国乳业, 2013(5): 49-50.
[19]蓝蔚青, 谢晶. PCR结合生理生化鉴定对冷藏带鱼主要细菌菌相组成分析[J]. 食品与发酵工业, 2012, 38(2): 11-17. DOI:10.13995/j.cnki.11-1802/ts.2012.02.003.
[20]GONZ?LEZ C J, SANTOS J A, GARC?A-L?PEZ M L, et al. Psychrobacters and related bacteria in freshwater fish[J]. Journal of Food Protection, 2000, 63(3): 315-321.
[21]J??SKEL?INEN E, HULTMAN J, PARSHINTSEV J, et al. Development of spoilage bacterial community and volatile compounds in chilled beef under vacuum or high oxygen atmospheres[J]. International Journal of Food Microbiology, 2016, 223: 25-32. DOI:10.1016/j.ijfoodmicro.2016.01.022.
[22]PATRICIA E, ALBA P C, ALBA Y, et al. Pyrosequencing vs.
culture-dependent approaches to analyze lactic acid bacteria associated to chicha, a traditional maize-based fermented beverage from Northwestern Argentina[J]. International Journal of Food Microbiology, 2015, 198: 9-18. DOI:10.1016/j.ijfoodmicro.2014.12.027.
[23]TRAPPETTI C, MCALLISTER L J, CHEN A, et al. Autoinducer 2 signaling via the phosphotransferase frua drives galactose utilization by Streptococcus pneumoniae, resulting in hypervirulence[J]. mBio, 2017, 8(1): e02269-16. DOI:10.1128/mBio.02269-16.
[24]VIJAYAKUMAR P P, MURIANA P M. A microplate growth inhibition assay for screening bacteriocins against Listeria monocytogenes to differentiate their mode-of-action[J]. Biomolecules, 2015, 5(2):
1178-1194. DOI:10.3390/biom5021178.
[25]POYART C, QUESNE G, TRIEU-CUOT P. Taxonomic dissection of the Streptococcus bovis group by analysis of manganese-dependent superoxide dismutase gene (sod A) sequences: reclassification of ‘Streptococcus infantarius subsp. coli as Streptococcus lutetiensis sp. nov. and of Streptococcus bovis biotype II.2 as Streptococcus pasteurianus sp. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52: 1247-1255. DOI:10.1099/ijs.0.02044-0.
[26]OGUNTOYINBO F A, TOURLOMOUSIS P, GASSON M J, et al. Analysis of bacterial communities of traditional fermented west African cereal foods using culture independent methods[J]. International Journal of Food Microbiology, 2011, 145(1): 205-210. DOI:10.1016/j.ijfoodmicro.2010.12.025.
[27]劉晓红, 李嘉文, 翟平平, 等. 卤鸭脖中优势腐败菌和致病菌的分离与鉴定[J]. 肉类工业, 2012(6): 32-34.
[28]DU?KOV? M, KAMEN?K J, KARP??KOV? R. Weissella viridescens in meat products: a review[J]. Acta Veterinaria Brno, 2013, 82(3): 237-241. DOI:10.2754/avb201382030237.
[29]KAMENIK J, DUSKOVA M, SEDO O, et al. Lactic acid bacteria in hot smoked dry sausage (non-fermented salami): thermal resistance of Weissella viridescens strains isolated from hot smoked dry sausages[J]. LWT-Food Science and Technology, 2015, 61(2): 492-495.
DOI:10.1016/j.lwt.2014.12.012.
[30]韩衍青, 徐宝才, 徐幸莲, 等. 真空包装熟肉制品中的特定腐败微生物及其控制[J]. 中国食品学报, 2011, 11(7): 148-156. DOI:10.3969/j.issn.1009-7848.2011.07.023.endprint
