诺邓火腿粗肽抗氧化活性及亚硝酸钠清除活性
2017-11-16吴宝森谷大海王桂瑛程志斌徐志强普岳红汪善荣廖国周
吴宝森+谷大海+王桂瑛+程志斌+徐志强+普岳红+汪善荣+廖国周


摘 要:以諾邓火腿为研究对象,提取诺邓火腿粗肽,测定不同质量浓度粗肽液对羟自由基(·OH)、1,1-二苯基-2-三硝基苯肼(DPPH)自由基的清除效果、Fe2+螯合能力、脂质氧化抑制能力及普通条件和模拟胃液条件下对亚硝酸钠的清除能力。结果表明:质量浓度为5.0 mg/mL的诺邓火腿粗肽液对·OH和DPPH自由基的清除率分别为47.81%和67.10%,与相同质量浓度的谷胱甘肽(glutathione,GSH)相比差异极显著(P<0.01);质量浓度为
5.0 mg/mL的粗肽液对Fe2+的螯合率为31.38%,与GSH相比差异不显著(P>0.05);质量浓度为25.0 mg/mL的粗肽液反应结束后144 h时的脂质氧化抑制率达77.86%,与GSH相比差异极显著(P<0.01);普通条件和模拟胃液条件下,质量浓度为10.0 mg/mL的粗肽液对亚硝酸钠的清除率分别为(84.31±0.77)%和(80.97±2.00)%,与GSH相比差异极显著(P<0.01)。综上所述,诺邓火腿粗肽液具有一定的抗氧化活性和脂质氧化抑制能力,同时具有较强的亚硝酸钠清除活性。
关键词:诺邓火腿;粗肽;抗氧化活性;亚硝酸钠清除活性
Antioxidant and Sodium Nitrite Scavenging Activity of Crude Peptide Extracted from Nuodeng Ham
WU Baosen1,2, GU Dahai1,2, WANG Guiying1,2, CHENG Zhibin2, XU Zhiqiang1,2, PU Yuehong1,2, WANG Shanrong3,*, LIAO Guozhou1,2,*
(1.College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China;
2.Livestock Product Processing Engineering and Technology Research Center of Yunnan Provine, Kunming 650201, China;
3.College of Yunnan Rural Leader, Yunnan Agricultural University, Kunming 650201, China)
Abstract: In this experiment, the scavenging capacities against hydroxyl and 2,2-diphenyl-1-picrylhydr-azyl (DPPH) free radicals, ferrous ion chelating activity, lipid oxidation inhibitory activity, and sodium nitrite scavenging capability under normal and simulated gastric conditions of the crude peptide extracted from Nuodeng ham were investigated. Results showed that the percentage scavenging of hydroxyl and DPPH free radicals by the crude peptide at 5.0 mg/mL was 47.81% and 67.10%, respectively, highly significantly different from that by glutathione (GSH) at the same concentration
(P < 0.01). The percentage chelating of ferrous ion by the crude peptide at 5.0 mg/mL was 31.38%, not significantly different from that by GSH at the same concentration (P > 0.05). The percentage inhibition of lipid oxidation by the crude peptide at
25.0 mg/mL at 144 h of reaction was as high as 77.86%, highly significantly different from that by glutathione (GSH) at the same concentration (P < 0.01). Under normal and simulated gastric conditions, the percentage scavenging of sodium nitrite by the crude peptide at 10.0 mg/mL was (84.31 ± 0.77)% and (80.97 ± 2.00)%, respectively, highly significantly different from that by glutathione (GSH) at the same concentration (P < 0.01). Collectively, we concluded that the crude peptide extracted from Nuodeng ham had antioxidant and lipid oxidation inhibitory activities, and also exhibited strong sodium nitrite scavenging capacity.endprint
Key words: Nuodeng ham; crude peptide; antioxidant activity; sodium nitrite scavenging capacity
DOI:10.7506/rlyj1001-8123-201708002
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2017)08-0006-06
天然抗氧化肽可以从动、植物中获取,其具有清除重金属、降低细胞自氧化速率、防止脂肪过氧化和减少自由基生成等作用[1]。目前对天然抗氧化肽的研究主要集中在从植物中提取的抗氧化肽,如大豆多肽、玉米多肽等[2-3],而动物中富含蛋白质,也是获取抗氧化肽的重要来源,如肌肽、鱼肽等[4-5]。发酵肉制品富含蛋白质,在发酵过程中蛋白质受组织内源性酶和微生物酶的作用会降解生成许多小分子肽段[6-7]。作为发酵肉制品的一种,火腿是获取天然抗氧化肽的潜在资源,Escudero等[8]从西班牙火腿中提取出具有抗高血压和抗氧化活性的短肽。祝智超等[9]提取了金华火腿中的粗肽,并用多种体外抗氧化实验证明金华火腿粗肽具有抗氧化活性。从火腿中提取的抗氧化肽具有安全性高、抗氧化性强和易吸收等特点[10]。
诺邓火腿是云南三大著名火腿之一,其因配料独特、制作精细、质优味美的特点与宣威火腿及鹤庆圆腿齐名。2012年,诺邓火腿经中央电视台纪录片《舌尖上的中国》的宣传而声名鹊起[11-12]。目前有关诺邓火腿中多肽抗氧化特性及亚硝酸钠清除活性等方面的研究尚未见报道。本研究通过提取诺邓火腿粗肽,并简单分析其特征,同时以相同质量浓度的谷胱甘肽(glutathione,GSH)溶液为对照,探讨不同质量浓度粗肽液对羟自由基(·OH)、1,1-二苯基-2-三硝基苯肼(DPPH)自由基的清除能力、螯合Fe2+能力及在普通条件和模拟胃液条件下抑制脂肪氧化和清除亚硝酸钠的能力,旨在评价诺邓火腿粗肽的抗氧化活性及亚硝酸钠清除活性,为诺邓火腿的深度开发及利用提供科学的理论依据。
1 材料与方法
1.1 材料与试剂
选取8 头诺邓当地日龄相近的黑毛土猪,取其腿重相近的后腿作为原料,按传统加工工艺制作诺邓火腿,由云南省大理白族自治州云龙县诺邓火腿食品厂进行加工,腌制加工时间:2013年12月—2015年12月(发酵成熟2 年)。
磷酸二氢钠、磷酸氢二钠、硫氰酸铵、甲醛、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 天津市化学试剂厂;领苯二甲醛、DPPH(2,2-diphenyl-1-picrylhydrazyl)、吐温-20、邻二氮菲 上海源叶生物科技有限公司;β-巯基乙醇、GSH 美国Sigma公司。所有试剂均为分析纯。
1.2 仪器与设备
H2-16KR冷冻离心机 湖南可成仪器设备有限公司;
T25匀浆机 德国IKA公司;18N冷冻干燥机 宁波新芝生物科技有限公司;TU-1950紫外分光光度计 北京谱析通用仪器有限责任公司。
1.3 方法
随机选取5 条诺邓火腿,取股二头肌肉样,真空包装后置于-80 ℃冰箱保存。
1.3.1 诺邓火腿粗肽的提取
参考Zhu Chaozhi等[13]的方法,并稍作修改。取诺邓火腿股二头肌肉样,去除瘦肉中的肌腱和肌膜;称取30 g,加入100 mL磷酸盐缓冲液(0.2 mol/L,pH 7.2),24 000 r/min条件下冰浴匀浆3 次,每次10 s,间歇10 s;将匀浆液4 ℃静置2 h后,于4 ℃、10 000 r/min条件下离心10 min;取上清液,过滤,加入3 倍体积的40%乙醇溶液,4 ℃静置12 h后,于4 ℃、10 000 r/min条件下离心10 min;上清液冷冻干燥后即为粗肽粉,于-80 ℃冰箱中保存,备用。
1.3.2 诺邓火腿粗肽中多肽含量的测定
参考Church等[14]的方法,并稍作修改。邻苯二甲醛混合试剂的配制:将40 mg邻苯二甲醛溶解于1 mL甲醇中,依次加入25 mL 0.1 mol/L的四硼酸钠溶液、2.5 mL质量分数为20%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和100 μL β-巯基乙醇,去离子水定容至50 mL。取100 μL诺邓火腿粗肽溶液(1 mg/mL),加入2.0 mL邻苯二甲醛混合试剂,室温孵育2 min,测定混合溶液在340 nm波长处的吸光度。用胰酪蛋白胨作为标准蛋白配制梯度溶液,以质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,由样品溶液的吸光度和标准曲线换算得到诺邓火腿粗肽粉中的多肽含量。
1.3.3 诺邓火腿粗肽平均链长的测定
参考严群芳[15]的方法,并稍作修改。茚三酮显色液的配制:将170 mg茚三酮和30 mg还原茚三酮溶于20 mL乙二醇甲醚中。取1 mL诺邓火腿粗肽液(1 mg/mL),加入1 mL醋酸缓冲溶液和1 mL茚三酮显色液,沸水浴15 min,冷却后加入3 mL 60%乙醇溶液,在570 nm波长处测定吸光度。配制不同质量浓度梯度的甘氨酸标准溶液,以质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,由样品的吸光度和标准曲线换算得到样品中多肽的含量,根据氨基酸平均分子质量为126.7 D,计算得多肽个数。
平均肽链长度(average peptide chain length,APCL)的测定:肽链长是指组成肽的氨基酸殘基数,一个多肽或氨基酸只有一个N-端,采用茚三酮显色法测定诺邓火腿粗肽的多肽个数,将多肽彻底酸解,根据上述操作测定氨基酸个数,APCL按式(1)计算。
1.3.4 ·OH清除率的测定endprint
参考Li Yanhong等[16]的方法,将诺邓火腿粗肽配制成质量浓度分别为1.0、2.0、3.0、4.0、5.0 mg/mL的粗肽液,以相应质量浓度的GSH溶液为对照组。样品管:取0.6 mL邻二氮菲溶液(5 mmol/L),加入0.4 mL磷酸盐缓冲液(0.2 mol/L、pH 7.4)混匀后,加入0.6 mL样品溶液(粗肽液或GSH溶液)和0.6 mL 15 mmol/L的EDTA溶液,再次混匀,之后加入0.6 mL 5 mmol/L的FeSO4溶液,充分混匀后加入0.8 mL体积分数为0.1%的H2O2,摇匀后于37 ℃保温1 h,测定溶液在536 nm波长处的吸光度;损伤管:以去离子水代替样品溶液,其余步驟同样品管,测定吸光度,表示未添加抗氧化剂时的·OH含量;未损伤管:以去离子水代替样品溶液和H2O2,其余步骤同样品管,测定吸光度。·OH清除率按式(2)计算。
式中:A1为样品管的吸光度;A2为损伤管的吸光度;A3为未损伤管的吸光度。
1.3.5 DPPH自由基清除率的测定
参考Sheih等[17]的方法,将诺邓火腿粗肽配制成质量浓度分别为1.0、2.0、3.0、4.0、5.0 mg/mL的粗肽液,以相应质量浓度的GSH溶液为对照组。样品管:将2 mL DPPH自由基溶液(0.2 mmol/L,溶于95%乙醇)置于试管中,加入2 mL粗肽液(或GSH溶液),混匀,室温避光放置30 min后,在517 nm波长处测定溶液的吸光度;空白管:在2 mL 95%乙醇中加入2 mL样品溶液;对照管:在2 mL DPPH自由基溶液中加入2 mL 95%乙醇。DPPH自由基清除率按式(3)计算。
式中:A1为样品管的吸光度;A2为对照管的吸光度;A0为空白管的吸光度。
1.3.6 Fe2+螯合能力的测定
参考Lee等[18]的方法,将诺邓火腿粗肽配制成质量浓度分别为1.0、2.0、3.0、4.0、5.0 mg/mL的粗肽液,以相应质量浓度的GSH溶液为对照组。样品管:取1 mL样品溶液于试管中,加入0.05 mL 2 mmol/L的FeCl2溶液,混匀后加入0.2 mL 5 mmol/L的菲啰嗪试剂启动反应,将混合物剧烈摇晃混匀后,室温静置10 min,在562 nm波长处测定溶液的吸光度。对照管:以去离子水代替样品溶液。Fe2+螯合率按式(4)计算。
式中:A1为样品管的吸光度;A2为对照管的吸光度。
1.3.7 脂质氧化抑制能力的测定
参考米兰等[19]的方法,并稍作修改。亚油酸乳化液的配制:将0.56 g亚油酸及0.056 g吐温-20用磷酸盐缓冲液(0.2 mol/L,pH 7.2)定容至100 mL。用去离子水配制质量浓度为25.0 mg/mL的粗肽液,并以相应质量浓度的GSH溶液为对照组。取8 mL样品溶液,加入4 mL无水乙醇、10 mL亚油酸乳化液(0.02 mol/L,pH 7.0)和8.0 mL磷酸盐缓冲液,密闭后放在黑暗处静置10 min。以去离子水代替样品溶液作为空白对照。
采用硫氰酸铁法测定过氧化值:取0.1 mL上述混合溶液,依次加入4.7 mL 75%乙醇溶液、0.1 mL
0.3 g/mL的硫氰酸铵溶液和0.1 mL 0.02 mol/L的FeCl2溶液(3.5% HCl作为溶剂),快速混匀,准确反应3 min后,在500 nm波长处测定吸光度。反应结束后0 h的吸光度记为A0,之后每隔24 h测定一次吸光度,记为At。脂质氧化抑制率按式(5)计算。
式中:A0t为空白对照组每隔24 h测得的吸光度;A00为空白对照组反应结束后0 h测得的吸光度;A1t为样品组每隔24 h测得的吸光度;A10为样品组反应结束后0 h测得的吸光度。
1.3.8 亚硝酸钠清除能力的测定[20-21]
模拟胃液的配制:称取NaCl 1.0 g,去离子水溶解,加入3.5 mL浓盐酸,去离子水定容至500 mL(pH 1.80)。取10 mL模拟胃液置于25 mL具塞比色管中,37 ℃水浴10 min;加入2.0 mL 10 μg/mL的NaNO2溶液和10 mL 10 mg/mL的粗肽液(或相同质量浓度的GSH溶液),摇匀,37 ℃水浴10 min;加入2.0 mL
0.4 g/mL的对氨基苯磺酸溶液,摇匀,水浴4 min,再加入1.0 mL 2 g/L的盐酸萘乙二胺溶液,摇匀,去离子水定容,在542 nm波长处测定吸光度,记为A1。用蒸馏水代替NaNO2溶液,其余操作相同,测得的吸光度记为A2;用蒸馏水代替样品溶液测得的吸光度记为A3。用蒸馏水代替模拟胃液作为普通组。亚硝酸钠清除率按式(6)计算。
1.4 数据处理
实验均平行测定5 次,结果以平均值±标准差表示,采用SPSS 19.0软件进行数据统计与分析,对各组数据进行单因素方差分析和Duncans多重比较。
2 结果与分析
2.1 诺邓火腿粗肽的多肽含量
胰酪蛋白胨的标准曲线方程为y=0.049 7x+2.078 8(R2=0.994 4),根据标准曲线换算得加工2 年的诺邓火腿粗肽的多肽含量为(72.00±0.99)%。
2.2 诺邓火腿粗肽的APCL
粗肽是由不同肽链长度的多肽组成的混合物,根据氨基酸标准曲线(y=1.772 9x-0.009 4,R2=0.998 2)及氨基酸平均分子质量(126.7 D)计算得加工2 年的诺邓火腿粗肽的APCL为15,平均分子质量为1 900 D。
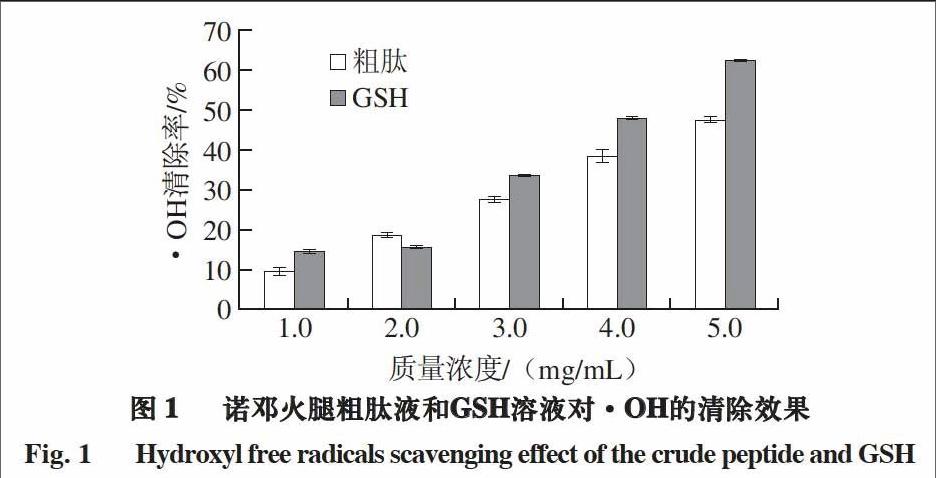
2.3 诺邓火腿粗肽对·OH的清除效果
由图1可知,诺邓火腿粗肽液和GSH溶液对·OH的清除效果随着溶液质量浓度的增大而增强,二者均具有·OH清除能力。当质量浓度为5.0 mg/mL时,诺邓火腿粗肽液对·OH的清除率达47.81%,与对照组的GSH溶液相比降低了14.24%,差异极显著(P<0.01)。endprint
2.4 诺邓火腿粗肽对DPPH自由基的清除效果
由图2可知,诺邓火腿粗肽液和GSH溶液对DPPH自由基的清除效果随着溶液质量浓度的增大而增强,二者均具有一定的DPPH自由基清除活性。当质量浓度为5.0 mg/mL时,诺邓火腿粗肽液对DPPH自由基的清除率达67.10%,与对照组的GSH溶液相比降低了18.21%,差异极显著(P<0.01)。
2.5 诺邓火腿粗肽的Fe2+螯合能力
由图3可知,诺邓火腿粗肽液和GSH溶液都具有螯合Fe2+的能力,且Fe2+螯合率均随溶液质量浓度的增大而增加。当质量浓度为5.0 mg/mL时,诺邓火腿粗肽液对Fe2+的螯合率达31.38%,与对照组的GSH溶液相比增加了1.15%,差異不显著(P>0.05)。
2.6 诺邓火腿粗肽的脂质氧化抑制能力
由图4可知,当质量浓度为25.0 mg/mL时,诺邓火腿粗肽液和GSH溶液均具有抑制脂质氧化的能力。反应结束后0~72 h的抑制率增长较快,表明抑制效果较好,反应结束72 h后的抑制率变化趋于平缓,反应结束后144 h时,诺邓火腿粗肽液的脂质氧化抑制率达77.86%,与GSH溶液的抑制效果(65.32%)存在极显著差异(P<0.01)。
2.7 诺邓火腿粗肽的亚硝酸钠清除能力
由表2可知,在模拟胃液和普通条件下诺邓火腿粗肽液均有亚硝酸钠清除活性,清除率均大于80%,且2 种条件下的差异不显著(P>0.05);GSH溶液对亚硝酸钠的清除率均大于90%,且2 种条件下的清除率差异不显著
(P>0.05)。2 种条件下,诺邓火腿粗肽液与GSH溶液的亚硝酸钠清除率均有极显著差异(P<0.01)。
3 讨 论
3.1 诺邓火腿粗肽的提取
一般使用盐酸或磷酸缓冲液对火腿中的抗氧化肽进行提取,Escudero等[8]用0.01 mol/L的盐酸溶液从西班牙火腿中提取并分离、纯化出具有抗高血压和抗氧化活性的短肽。祝智超等[9]用0.01 mol/L的盐酸溶液提取金华火腿中的粗肽,并用多种体外抗氧化实验证明金华火腿粗肽具有抗氧化活性。邢路娟等[22]用0.2 mol/L的磷酸盐缓冲液(pH 7.2)提取宣威火腿中的粗肽,并测得粗肽粉中的多肽含量为60%。本研究用磷酸盐缓冲液提取诺邓火腿中的多肽,所得多肽为不同分子质量的多肽组成的混合物,与茚三酮显色剂反应显色,说明多肽N-端未封闭,结构呈链状[23]。测得诺邓火腿粗肽中的多肽含量为72.00%,粗肽粉中可能还含有大分子蛋白质、小分子氨基酸和无机盐等,因此还可以进一步分离、纯化,以获得高纯度多肽。
3.2 诺邓火腿粗肽对自由基的影响
·OH是一种活跃的活性分子,也是进攻性最强的化学物质之一,几乎可以与所有的生物分子、有机物或无机物发生各种不同类型的化学反应[24]。在水解过程中,蛋白质中具有抗氧化活性的基团逐渐暴露出来,从而起到抗氧化作用,小分子肽显示出·OH清除能力[25]。陈美珍等[26]的研究表明,5×103 D以下的短肽对DPPH自由基具有清除效果,短肽具有疏水作用,肽链越长,对DPPH自由基的清除率越低。本研究中不同质量浓度的粗肽液和GSH溶液对·OH和DPPH自由基均有清除效果,GSH对·OH和DPPH自由基的清除作用主要依靠巯基及酸性基团[9,27],火腿粗肽清除DPPH自由基的机制可能与GSH类似。GSH是一种重要的抗氧化剂和自由基清除剂,其纯度和自由基清除活性优于初步提取的诺邓火腿粗肽,因此诺邓火腿粗肽仍需要进行进一步的分离、纯化,以获得高活性的抗氧化肽。Fe2+是活性氧自由基形成的前体物质,其在人体内的积累会加剧活性氧对DNA和脂质的氧化损伤,抗氧化剂能抑制Fe2+的催化氧化过程[28]。
短肽中暴露的中性和酸性氨基酸(如天冬氨酸)因带有游离羧基而具有抑制金属离子产生自由基的作用。酸性氨基酸和中性氨基酸侧链中包含的氨基和羧基能够与Fe2+紧密结合,从而降低Fe2+的含量,抑制自由基的
产生[29-31]。从西班牙火腿、金华火腿及宣威火腿中提取的多肽均具有一定的自由基清除效果,但不同种类火腿粗肽的抗氧化活性存在一定的差异[8,9,32],且提取出的火腿粗肽是由不同长度肽段组成的混合物,结构不明确,因此诺邓火腿粗肽的组成、肽段的相对分子质量及抗氧化机理还有待进一步研究。
3.3 诺邓火腿粗肽对脂肪氧化的影响
Chen等[32]研究发现含有5 个以上氨基酸的肽链具有更强的抑制脂质氧化的效果。多肽中含有的疏水性氨基酸可以捕获脂类自由基、加强抗氧化肽与疏水性多不饱和脂肪酸的相互作用,从而减缓脂质氧化反应。诺邓火腿粗肽具有较强的脂肪氧化抑制能力,金华火腿和宣威火腿具有类似的活性[9,22]。
3.4 诺邓火腿粗肽对亚硝酸钠的影响
亚硝酸盐可以作为亚硝胺合成的前体物质存在于食物中,其进入人体后可以在胃液中与胺类物质反应生成致癌物亚硝胺[33-34]。多肽具有供氢活性,能够直接将亚硝酸盐还原为氨根离子,加强对亚硝酸盐的清除作用[35]。
目前关于火腿多肽清除亚硝酸钠的研究鲜有报道,本研究表明诺邓火腿多肽具有亚硝酸钠清除活性,且在胃液条件下仍能保持活性,因此火腿多肽在清除亚硝酸钠方面有潜在的利用及开发价值。
4 结 论
通过提取诺邓火腿粗肽并测定其多肽含量、APCL、对·OH和DPPH自由基的清除效果、对Fe2+的螯合能力、抑制脂质氧化的能力及亚硝酸钠清除能力,表明从诺邓火腿中初步提取的肽类物质具有抗氧化活性,并且其抗氧化活性随粗肽质量浓度的增大而增强,同时粗肽在普通条件及模拟胃液条件下还具有较强的亚硝酸钠清除活性。在火腿的生产加工过程中会产生大量边角料,造成资源浪费和环境污染,从火腿中提取抗氧化肽有利于减少生产加工过程中的浪费,提高经济效益,具有广阔的应用前景,在食品、食品添加剂、保健品、医药用品和化妆品行业均有广泛应用的潜力。但是目前对火腿抗氧化肽的研究还较少且不全面,主要集中在粗肽的体外抗氧化活性实验,粗肽的抗氧化效果并不十分显著,因此诺邓火腿粗肽仍有待进行进一步的分离、纯化,以获得具有高抗氧化活性的高纯度多肽。endprint
参考文献:
[1]KORHONEN H, PIHLANTO A. Bioactive peptides: production and functionality[J]. Journal of International Dairy, 2006, 16(9): 945-960. DOI:10.1016/j.idairyj.2005.10.012.
[2]周媛媛, 周瑞宝. 大豆多肽的分离纯化与抗氧化活性研究[J]. 中国油脂, 2008, 33(5): 34-36. DOI:10.3321/j.issn:1003-7969.2008.05.011.
[3]朱艳华, 谭军. 玉米多肽抗氧化作用的研究[J]. 中国粮油学报, 2008, 23(1): 36-38; 43.
[4]何雄, 薛长湖, 杨文鸽. 肌肽的提取分离与生物活性的研究进展[J]. 海洋科学, 2007, 31(5): 85-89. DOI:10.3969/j.issn.1000-3096.2007.05.016.
[5]刘晶, 陈连文, 于磊. 抗氧化鱼肽对熟猪肉饼中脂质氧化的影响及其纯化鉴定[J]. 中国食品学报, 2013, 13(9): 157-161.
[6]JIM?NEZ C F, VENTANAS J, TOLDR? F. Nutritional composition of dry-cured ham and its role in a healthy diet[J]. Meat Science, 2010, 84(4): 585-593. DOI:10.1016/j.meatsci.2009.10.029.
[7]赵改名, 周光宏, 柳艳霞, 等. 肌肉非蛋白氮和游离氨基酸在金华火腿加工过程中的变化[J]. 食品科学, 2006, 27(2): 33-37. DOI:10.3321/j.issn:1002-6630.2006.02.001.
[8]ESCUDERO E, ARISTOY M C, NISHIMURA H, et al. Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J]. Meat Science, 2012, 91(3): 306-311. DOI:10.1016/j.meatsci.2012.02.008.
[9]祝超智, 张万刚, 徐幸莲, 等. 金华火腿粗肽液的体外抗氧化活性[J]. 肉类研究, 2013, 27(6): 5-9.
[10]LIU Q, KONG B, XIONG Y L, et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as in?uenced by the degree of hydrolysis[J]. Food Chemistry, 2010, 118(2): 403-410. DOI:10.1016/j.foodchem.2009.05.013.
[11]夏天, 夏四维, 王峻. “火腿小镇”诺邓盐马古道中心的古老村庄[J]. 环球人文地理, 2013(4): 64-73.
[12]吴晓玲. 活着的诺邓: 有“盐味”的火腿历久弥香[EB/OL]. (2014-10-17)[2017-05-12]. http://news.sina.com.cn/c/2014-10-17/054431001898.shtml.
[13]ZHU Chaozhi, ZHANG Wangang, KANG Zhuangli, et al. Stability of an antioxidant peptide extracted from Jinhua ham[J]. Meat Science, 2014, 96(2): 783-789. DOI:10.1016/j.meatsci.2013.09.004.
[14]CHURCH F C, SWAISGOOD H E, PORTER D H, et al. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J]. Journal of Dairy Science, 1983, 66(6): 1219-1227. DOI:10.3168/jds.S0022-0302(83)81926-2.
[15]嚴群芳. 大豆抗氧化肽的分离及其生物活性研究[D]. 南京: 南京农业大学, 2006: 25.
[16]LI Yanhong, JIANG Bo, ZHANG Tao, et al. Antixidant and free radical scavenging activities of chickpea protein hydrolysate (CPH)[J]. Food Chemistry, 2008, 106(2): 444-450. DOI:10.1016/j.foodchem.2007.04.067.
[17]SHEIH I C, WU T K, FANG T J. Antioxidant properties of a new antioxidative peptides from algae protein waste hydrolysate in different oxidation systems[J]. Bioresource Technology, 2009, 100(13): 3419-3425.endprint
DOI:10.1016/j.biortech.2009.02.014.
[18]LEE S J, KIM E K, HWANG J W, et al. Purification and characterisation of an antioxidative peptide from enzymatic hydrolysates of duck processing by-products[J]. Food Chemistry, 2010, 123(2): 216-220. DOI:10.1016/j.foodchem.2010.04.001.
[19]米兰, 赵小元, 张炎, 等. 藏灵菇酸乳的抗氧化性研究[J]. 食品科技, 2014, 39(1): 78-83.
[20]詹秀环, 付星锋, 王子云. 大蒜对蔬菜亚硝酸盐消除作用的实验研究[J]. 中国调味品, 2015, 40(1): 36-39. DOI:10.3969/j.issn.1000-9973.2015.01.009.
[21]冯磊. 茶叶籽蛋白提取及其酶解物抗氧化作用研究[D]. 吉首: 吉首大学, 2013: 59-61.
[22]邢路娟, 胡亚亚, 周光宏, 等. 宣威火腿中粗肽的提取与抗氧化活性鉴定[J]. 南京农业大学学报, 2015, 38(4): 661-666. DOI:10.7685/j.issn.1000-2030.2015.04.021.
[23]韦绪芹, 张建华, 占文婷, 等. 海洋生物源抗氧化活性肽的制备和构效关系[J]. 安徽农业科学, 2015, 43(25): 15-20. DOI:10.3969/j.issn.0517-6611.2015.25.006.
[24]黄莉, 孔保华, 李菁, 等. 氧化引起肉及肉制品品质劣变的机理及影响因素[J]. 食品科学, 2011, 32(9): 319-323.
[25]CACCIUTTOLO M A, TRINH L, LUMPKIN J A, et al. Hyperoxia induces DNA damage in mammalian cells[J]. Free Radical Biological Medicine, 1993, 14(3): 267-276. DOI:10.1016/0891-5849(93)90023-N.
[26]陈美珍, 余杰, 郭慧敏. 大豆分离蛋白酶解物清除羟自由基作用的研究[J]. 食品科学, 2002, 23(1): 43-47.
[27]SHI Y N, KOVACS-NOLAN J, JIANG B, et al. Antioxidant activity of enzymatic hydrolysate from eggshell membrane proteins and its protective capacity in human intestinal epithelial Caco-2 cells[J]. Journal of Functional Foods, 2014, 10: 35-45. DOI:10.1016/j.jff.2014.05.004.
[28]WANG Xiaoxing, GU Yan, FANG Yanfen, et al. Mechanism of oxidative damage to DNA by Fe-loaded MCM-41 irradited with visible light[J]. Chinese Science Bulletin, 2012, 57(13): 1504-1509. DOI:10.1007/s11434-012-5042-1.
[29]CHEN H M, MURAMOTO K, YAMAUCHI F, et al. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2619-2623. DOI:10.1021/jf950833m.
[30]RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005, 38(2): 175-182. DOI:10.1016/j.foodres.2004.10.002.
[31]徐力, 李相鲁, 吴晓霞, 等. 一种新的玉米抗氧化肽的制备与结构表征[J]. 高等学校化学学报, 2004(3): 466-469; 390. DOI:10.3321/j.issn:0251-0790.2004.03.014.
[32]CHEN J R, KUNIO S, FUMIO Y. Isolation and characterization of immunostimulative peptides from soybean[J]. The Journal of Nutritional Biochemistry, 1996, 6(6): 310-313.
[33]GANGOLLI S D, BRANDT P A, FERON V J. Nitrates, nitrites and N-nitroso compounds[J]. Environmental Toxicology and Pharmacology, 1994, 292(1): l-38.
[34]傅亮, 鮑玲玲, 吴炳鸿, 等. 多肽对酱菜发酵中亚硝酸盐的影响[J]. 食品与机械, 2011(6): 168-170. DOI:10.3969/j.issn.1003-5788.2011.06.044.
[35]王海凤, 王常青, 刘佳璐, 等. 不同方法制备的葵花籽多肽酶解物对亚硝化反应的抑制作用[J]. 食品科学, 2011, 32(9): 51-54.endprint
