松果菊苷对db/db小鼠肝脏脂质代谢的影响
2017-11-16唐凤娟郝亚荣张雪秦建
唐凤娟+郝亚荣++张雪++秦建
[摘要] 目的 探討松果菊苷(ECH)对db/db小鼠肝脏脂质代谢的影响及其作用机制。 方法 采用随机数字表法将21只8周龄体重40~48 g的健康雄性db/db小鼠分为db/db+ECH组[n = 11,ECH灌胃300 mg/(kg·d)]和db/db组(n = 10,给予相应体积的生理盐水灌胃)。以同窝出生的db/m小鼠为正常对照组,即db/m组(n = 9,给予相应体积的生理盐水灌胃)。每周检测小鼠的体重。连续干预10周后处死小鼠,留取肝脏组织标本,检测小鼠肝湿重、睾丸周围脂肪重量,提取肝脏总RNA用实时定量PCR检测三组小鼠肝脏中过氧化物酶体增殖物激活受体α(PPAR-α)和脂肪酸氧化的限速酶肉毒碱棕榈酰转移酶-1(CPT-1)的mRNA表达水平,肝组织苏木精-伊红(HE)、油红O染色评价病理学变化。处死三组小鼠前1 d禁食12 h后经眼眶后取血,利用全自动生化检测仪检测谷丙转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)的水平。 结果 与db/m组比较,db/db组小鼠体重、肝湿重、睾丸周围脂肪重量增加,血清中ALT、AST、TG、TC、LDL-C升高,HDL-C降低(P < 0.05或P < 0.01),肝脏组织中肝细胞肿胀,空泡变性,大量的脂质沉积;ECH干预后可降低db/db小鼠体重,肝湿重及睾丸周围脂肪重量,也可以降低db/db小鼠血清中ALT、AST、TG、TC、LDL-C水平,升高HDL-C水平(P < 0.05或P < 0.01),改善肝组织病理改变和脂质沉积情况,上调肝脏组织PPAR-α和CPT-1表达(P < 0.05)。 结论 ECH对db/db小鼠肝脏具有保护作用,其机制可能与上调肝脏组织中PPAR-α和CPT-1表达从而改善脂质代谢有关。
[关键词] 非酒精性脂肪肝;db/db小鼠;松果菊苷;过氧化物酶体增殖物激活受体α
[中图分类号] RR285.5;R589.2 [文献标识码] A [文章编号] 1673-7210(2017)10(b)-0019-05
Effects of echinacoside on liver lipid metabolism in db/db mice
TANG Fengjuan1 HAO Yarong1 ZHANG Xue1 QIN Jian2
1.Department of Geriatrics, Renmin Hospital of Wuhan University, Hubei Province, Wuhan 430060, China; 2.Central Laboratory, Renmin Hospital of Wuhan University, Hubei Province, Wuhan 430060, China
[Abstract] Objective To investigate the effect of echinacoside (ECH) on liver lipid metabolism in db/db mice and its mechanism. Methods Twenty-one healthy male db/db mice aged 8 weeks and weighing from 40 to 48 g were divided into db/db+ECH group [n = 11, ECH, 300 mg/(kg·d)] and db/db group (n = 10, given the corresponding volume of saline) by random number table, db/m mice born with same littermates were served as normal control group, that was db/m group (n = 9, given corresponding volume of normal saline). The weight of the mice was measured weekly. The mice were sacrificed 10 weeks after the intervention. The liver tissues were sacrificed and the wet weight of the liver and the weight of the fat around the testes were measured. The total RNA of the liver was extracted and the mRNA of peroxisome proliferator-activated receptor α (PPAR-α) and carnitine palmitoyl transterase-1 (CPT-1) were detected by real-time quantitative PCR. Liver tissue hematoxylin-eosin (HE), oil red O staining were used to evaluate pathologic changes. The levels of alanine aminotransferase (ALT), aspartate transaminase (AST), triglyceride (TG), serum total cholesterol (TC), high density lipoprotein cholesterol (HDL-C) and low density lipoprotein cholesterol (LDL-C) were measured by automatic biochemical analyzer after fasting for 12 hours and 1 d before the rats were sacrificed. Results Compared with db/m group, the body weight, wet weight of liver and testicular fat around the weight in the db/db group were increased, and the levels of ALT, AST, TG, TC, LDL-C in serum were increased and HDL-C in serum was decreased (P < 0.05 or P < 0.01), liver tissue showed liver cell swelling, vacuolar degeneration, a lot of lipid deposition; ECH intervention could reduce body weight, liver wet weight and testicular fat around the weight of db/db mice, decrease the levels of ALT, AST, TG, TC, LDL-C and increase the level of HDL-C (P < 0.05 or P < 0.01), improve the pathological changes of liver tissue and lipid deposition, and up-regulate the expression of PPAR-α and CPT-1 in liver tissue (P < 0.05). Conclusion Echinacoside has protective effect on liver of db/db mice, and its mechanism may be related to up-regulating the expression of PPAR-α and CPT-1 in liver tissue and improving lipid metabolism.endprint
[Key words] Nonalcoholic fatty liver disease; db/db mice; Echinacoside; Peroxisome proliferator-activated receptor α
非酒精性脂肪性肝病是除酒精和其他明確损肝因素所致的以肝实质细胞脂肪堆积为主要特征的一系列疾病,包括肝细胞的脂肪沉积、脂肪性肝炎、肝纤维化和肝硬化[1]。近年来随着人们生活水平的提高,非酒精性脂肪性肝病已成为最常见的慢性肝病,非酒精性脂肪性肝病也是肝硬化与肝癌发生的一个重要原因[2-3]。非酒精性脂肪性肝病的有效防治可阻止和改善疾病的进程及预后。但对于该病至今尚缺乏有效的治疗方法,因此,非酒精性脂肪性肝病早期的发现、诊断和预防工作显得尤为重要。
目前为止,非酒精性脂肪肝尚无理想的治疗药物,临床上主要使用调血脂药如他汀类对其进行治疗,但其一方面毒副作用明显,另一方面会加重脂质在肝脏中的沉积,容易引起和加重肝损伤。因此,近年来从植物资源中寻找高效、安全的天然产物来改善和治疗非酒精性脂肪性肝病及代谢综合征已成为研究的一大热点。松果菊苷(echinacoside,ECH)是从管花肉苁蓉根部提取分离得到,为管花肉苁蓉的活性部位苁蓉总苷中含量最高的苯乙醇苷类化合物[4]。近年,ECH在对保护肝脏、抗炎的药理作用已得到证实[5-6]。但鲜有关于ECH抗非酒精性脂肪性肝病的药理作用及其机制研究。本研究通过给予db/db小鼠ECH治疗,观察ECH对db/db小鼠脂质代谢的影响及作用机制。
1 材料与方法
1.1 实验动物
遗传背景为C57BLKS/J的雄性db/db小鼠和db/m小鼠由南京大学-南京生物医药研究院提供[SCXK(苏)2015-0001],分笼饲养于武汉大学人民医院动物中心(SPF级),每笼4~5只,室温18~24℃,相对湿度60%,每日光照12 h,实验期间自由摄食、饮水,喂养普通饲料,不运用任何降糖药物。
1.2 仪器与试剂
电子天平(METTER TOLEDO公司);全自动显微镜BX63(日本Olympus公司);基因扩增仪(美国ABI公司);实时荧光定量PCR检测仪(7500序列检测系统)(美国ABI公司);全自动生化检测仪AU2700、Image Pro Plus图像分析系统。
ECH(上海融禾医药科技发展有限公司,批号150623)、4%多聚甲醛(谷歌生物科技有限公司,批号WB1101)、TRIZOL试剂(美国Invitrogen公司,批号15596-026);油红O染液(上海晶都生物技术有限公司,批号JD-0699);苏木精染液(深圳市康初源有限公司,批号H1328);伊红染液(北京索莱宝科技有限公司,批号G11002);RT-PCR逆转录试剂盒(日本Takara公司,批号047A);荧光定量PCR试剂盒(日本Takara公司,批号820A)。
1.3 实验动物分组
同窝出生6周龄小鼠经检疫1周及适应饲养1周。随机编号将db/db小鼠分为两组:令1~10号为糖尿病对照组(db/db组,n = 10),11~21号为ECH治疗组(db/db+ECH组,n = 11)。选取db/m小鼠9只作为正常对照组(db/m组,n = 9),于8周龄时分别作如下干预:db/m组和db/db组每日按照0.05 mL/10 g体重进行生理盐水灌胃10周。db/db+ECH组按松果菊300 mg/(kg·d)灌胃,共10周。每周检测三组小鼠体重,观察小鼠的摄食、饮水以及活动等情况。干预10周后用2%戊巴比妥钠0.1 mL/10 g体重腹腔注射麻醉小鼠,眼眶后采血,迅速分离血清,于-80℃冰箱保存待测。心脏灌流后,分离小鼠肝脏,称取肝脏湿重、腹部及睾丸周围脂肪重量。留取肝脏组织,一部分用4%多聚甲醛固定,用于做石蜡切片病理检查,一部分新鲜组织做冰冻切边后用于油红O染色,剩余的肝脏组织置于液氮1 h后保存在-80℃,用于实时荧光定量PCR。
1.4 小鼠的一般情况
观察并记录实验期间小鼠的摄食、饮水、体重、行为和皮毛等一般情况。
1.5 肝功能与血脂水平
用全自动生化检测仪检测血清中谷丙转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.6 肝脏HE染色和油红O染色
HE染色:处死小鼠后立即分离肝脏,4%多聚甲醛中固定24 h后,脱水,石蜡包埋,切片厚度4 μm,进行HE染色,在200×光镜下观察肝组织脂肪变及炎症情况,并行NASH评分。评分标准参照《非酒精性脂肪性肝病诊疗指南》[7]制订的标准。油红O染色:肝脏组织有OCT包埋后,行冰冻切片,切片厚度为5 μm。用60%异丙醇洗后再水洗,然后采用油红O工作液染色1 min,60%异丙醇分化30 s,水洗后以苏木精染色30 s,水洗至显微镜下观察清晰颜色,风干后用中性树脂封片。
1.7 RT-PCR检测
取各组小鼠肝脏组织100 mg,Trizol法提取总RNA。逆转录成cDNA后用SYBR Green扩增cDNA,每个样本加入3个复孔。扩增条件:①预变性95℃ 30 s;②PCR反应95℃ 5 s、60℃ 40 s,总共40个循环;③溶解95℃ 15 s、60℃ 60 s、95℃ 15 s。选取管家基因β-actin作为内参照,使用ABI7500软件2-△△CT法处理数据[8],引物序列见表1。
1.8 统计学方法
研究数据采用SPSS 20.0软件进行统计分析。计量资料数据以均数±标准差(x±s)表示,多组资料间比较采用单因素方差分析,两两比较,方差齐采用LSD法,方差不齐采用Dunnett-t检验。以P < 0.05为差异有统计学意义。endprint
2 结果
2.1 小鼠的一般情况及ECH对小鼠体重、肝湿重以及睾丸周围脂肪重量的影响
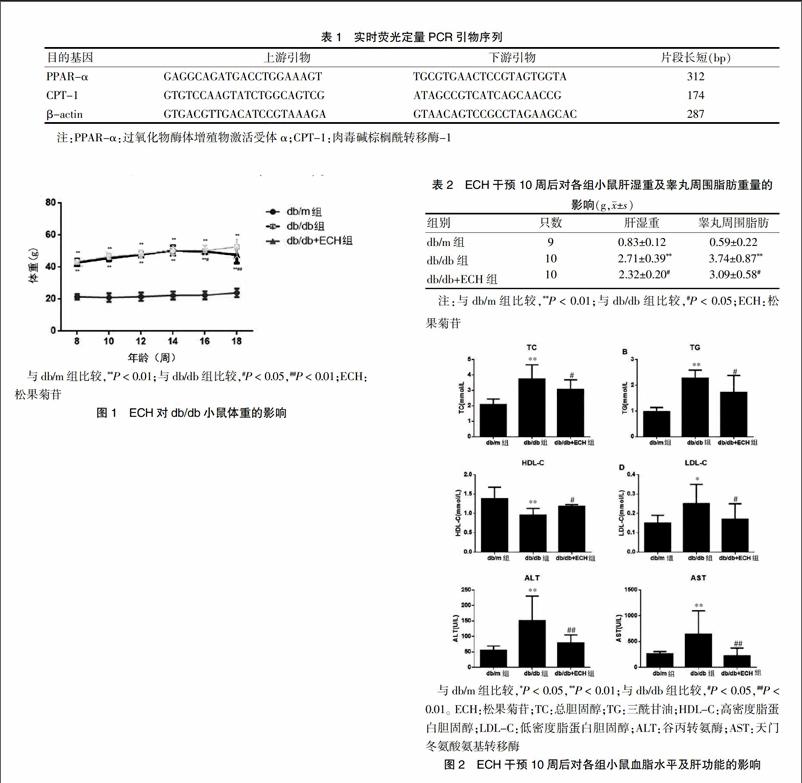
实验过程中db/m组小鼠摄食与饮水正常,皮毛光滑。与db/m组比较,db/db组和db/db+ECH组小鼠水与食物摄入量增加,活动度降低,皮毛颜色变黑。db/db组小鼠在第8周时体重是db/m组小鼠的近2倍[(43.34±1.70)g比(21.51±1.71)g,P < 0.01]。干预10周后,db/db组小鼠体重明显高于db/m组(P < 0.01),而db/db+ECH组小鼠体重较db/db组明显下降(P < 0.01)(图1)。三组小鼠干预10周后肝脏湿重、睾丸周围脂肪重量差异有高度统计学意义(P < 0.01),与db/m组比较,db/db组小鼠肝脏湿重、睾丸周围脂肪重量明显升高(P < 0.01),与db/db组比较,db/db+ECH组小鼠肝脏湿重、睾丸周围脂肪明显下降(P < 0.05)(表2)。实验过程中ECH治疗组小鼠死亡1只(被咬死)。
与db/m组比较,**P < 0.01;与db/db组比较,#P < 0.05,##P < 0.01;ECH:松果菊苷
图1 ECH对db/db小鼠体重的影响
2.2 ECH对db/db小鼠血脂水平以及肝功能的影响
与db/m组比较,db/db组小鼠TC、TG、LDL、ALT、AST和明显升高(P < 0.05),而HDL-C明显降低(P < 0.01)。与db/db组比较,db/db+ECH组小鼠TC、TG、ALT、AST明显降低(P < 0.01),HDL-C显著升高(P < 0.01)(图2)。
2.3 ECH对db/db小鼠肝脏形态学的影响
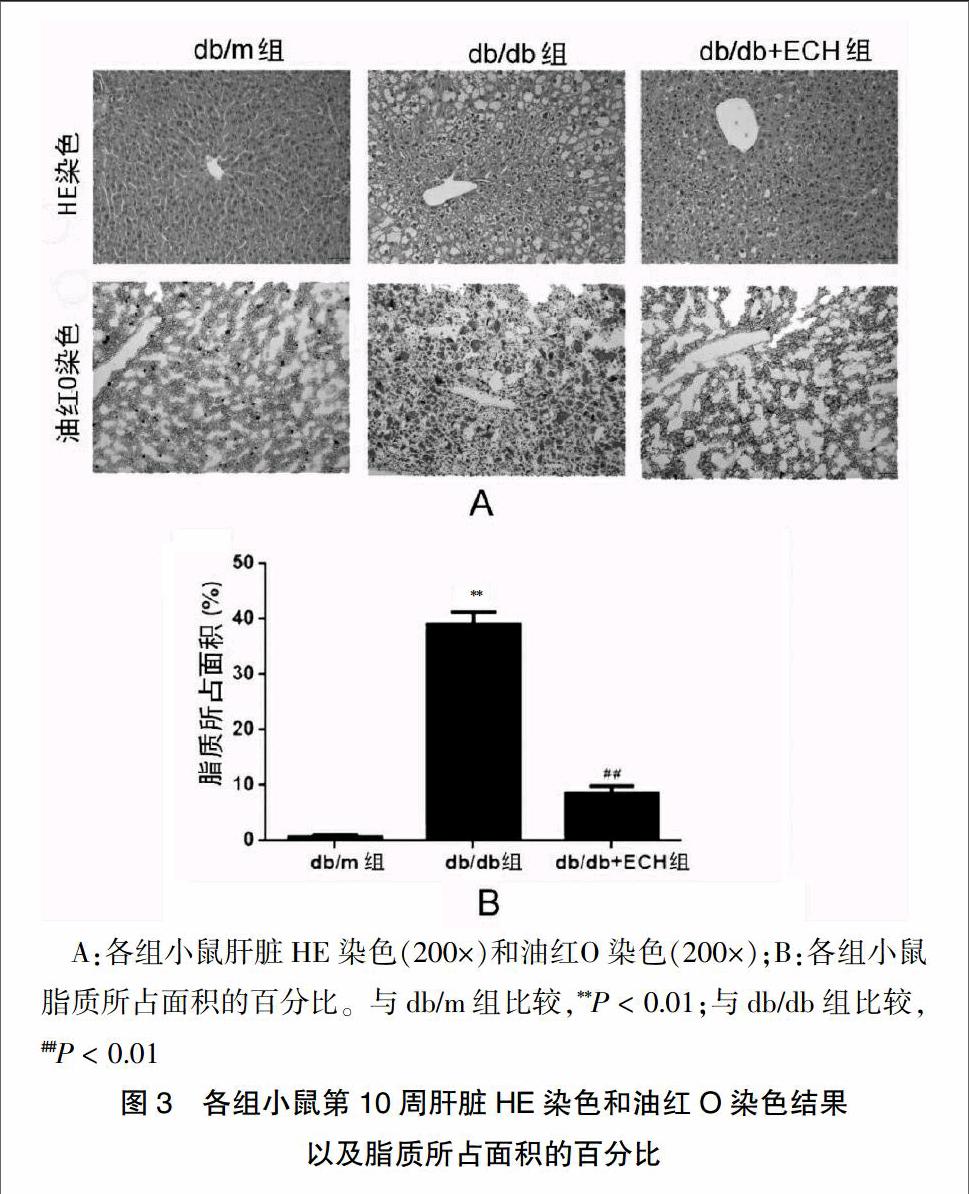
HE染色显示,db/m组小鼠肝组织染色正常,肝细胞排列整齐,胞浆分布均匀。db/db组肝细胞体积增大,表现为肿胀和大小不等的脂滴。中肝叶是可见炎性细胞浸润的,在肝门区有病灶性坏死,非酒精性脂肪性肝病活动度评分3~7分,60%达到非酒精性脂肪性肝炎的诊断标准(图3A)。与db/db组比较,db/db+ECH组小鼠肝细胞体积减小,细胞内脂滴减少,炎性浸润减轻(图3A)。油红染色显示,db/m组小鼠肝细胞脂滴少,无脂质变性。db/db组小鼠肝细胞发生严重脂质变性,观察到不同大小的脂质空泡,在门静脉竇区有显著意义。经ECH治疗后小鼠肝细胞内脂质沉积明显减轻(P < 0.01,图3B)。
2.4 ECH对db/db小鼠肝脏组织中PPAR-α和CPT-1的mRNA表达水平的影响
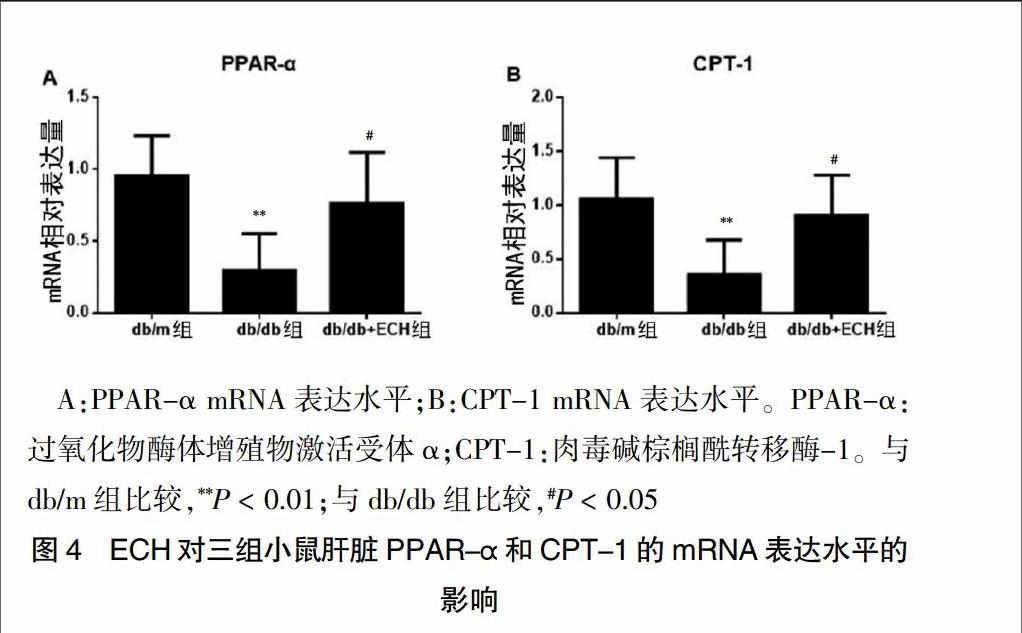
应用Takara RT-PCR反应体系进行mRNA定量检测发现:db/db组小鼠肝脏组织PPAR-α和CPT-1水平显著低于db/m组小鼠(P < 0.01);经ECH治疗10周后,小鼠肝脏组织PPAR-α和CPT-1表达水平较db/db组明显升高(P < 0.05)。见图4。
3 讨论
非酒精性脂肪性肝病是代谢综合征的肝脏表现,与肥胖、高脂血症、2型糖尿病等多种因素密切相关[9]。非酒精性脂肪性肝病与高尿酸血症以及痛风也密切相关[10]。本研究所研究的动物db/db小鼠是由于在瘦素受体基因中发生异常的剪接导致瘦素受体发生缺失突变而产生肥胖、高血糖、高胰岛素、脂肪肝等表现,常用于非酒精性脂肪性肝病的实验研究[11]。
本研究利用ECH给予db/db小鼠灌胃治疗,观察ECH对糖尿病小鼠肝脂质代谢的影响,结果显示,db/db组小鼠血清中TC、TG、LDL-C、ALT、AST显著高于db/m组,血清HDL-C显著低于db/m组;病理检查显示,db/db组小鼠肝脏组织出现细胞肿胀、空泡变性、脂质沉积和炎症细胞浸润。与db/db组小鼠比较,db/db+ECH组小鼠血清TC、TG、LDL-C、ALT、AST显著降低,血清HDL-C显著升高,并且病理检查显示db/db+ECH组肝细胞空泡细胞数目明显减少,胞质含脂肪滴减少,脂肪肝得到明显的改善,证实ECH能减轻db/db肝脏脂肪变性,对db/db小鼠肝脏具有保护作用。
过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)在非酒精性脂肪性肝病的发病机制中占有重要地位[12]。PPAR-α活化后促进脂质代谢的主要机制有:调控很多线粒体和过氧化物酶体脂肪酸β氧化的很多关键酶,如CPT-1等[13];促进长链、支链脂肪酸氧化[14];活化后调节脂蛋白的合成和组装,减少极低密度脂蛋白的量[15];活化后间接调节胆汁酸的合成,促进胆固醇排泄[16];活化后可抑制炎症基因的表达。有研究发现,在非酒精性脂肪性肝病患者或是长期过度摄食富含大量脂类食物的动物模型中,PPAR-α在肝脏的表达显著降低[17-18]。Everett等[19]在用PPAR-α基因敲出鼠模型研究发现,其肝脏游离脂肪酸含量显著增多,脂质代谢明显紊乱,肝脏出现明显的脂肪变性。这些发现都说明PPAR-α在非酒精性脂肪性肝病的发病机制中发挥了重要作用。CPT-1是脂肪酸β氧化中的限速酶,在脂肪肝病中起着非常重要的作用[20]。本研究结果显示,db/db组小鼠肝脏组织中PPAR-α、CPT-1 mRNA水平较db/m组明显降低;在db/db+ECH组小鼠肝脏组织中PPAR-α、CPT-1 mRNA水平较db/db组显著升高,说明ECH可以调节TG和TC的生物合成和吸收,影响db/db小鼠的脂质代谢,并通过调节肝脏脂质代谢关键酶的表达水平来保护肝脏功能。
综上所述,本研究表明ECH对db/db小鼠的肝功能具有保护作用,其机制可能与上调肝脏组织中PPAR-α和CPT-1表达从而改善脂质代谢有关。
[参考文献]
[1] Perla FM,Prelati M,Lavorato M,et al. The Role of Lipid and Lipoprotein Metabolism in Non-Alcoholic Fatty Liver Disease [J]. Children(Basel),2017,4(6):46.endprint
[2] Fan J,Li H,Nie X, et al. MiR-30c-5p ameliorates hepatic steatosis in leptin receptor-deficient(db/db)mice via down-regulating FASN [J]. Oncotarget,2017,8(8):13450-13463.
[3] 胡晓娜,周灿灿,保志军.非酒精性脂肪性肝病及肝细胞癌的相关性研究进展[J].中华消化杂志,2016,36(12):864-866.
[4] Tu PF,Wang B,Deyama T,et al. Analysis of phenylethanoid glycosides of Herba cistanchis by RP-HPLC [J]. Yao Xue Xue Bao,1997,32(4):294-300.
[5] 雷箴,温韬.松果菊苷对刀豆蛋白A所致急性肝损伤小鼠的保护作用及对细胞外组蛋白的影响[J].解放军医学杂志,2016,41(2):97-102.
[6] You SP,Ma L,Zhao J et al. Phenylethanol Glycosides from Cistanche tubulosa Suppress Hepatic Stellate Cell Activation and Block the Conduction of Signaling Pathways in TGF-beta1/smad as Potential Anti-Hepatic Fibrosis Agents [J]. Molecules,2016,21(1):102.
[7] 中華医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-166.
[8] Schmittgen TD,Livak KJ. Analyzing real-time PCR data by the comparative C(T)method [J]. Nat Protoc,2008,3(6):1101-1108.
[9] 范竹萍.非酒精性脂肪性肝病研究热点及防治管理[J].中华健康管理学杂志,2015,9(2):140-141.
[10] 郭凯锋,陈海冰.高尿酸血症、痛风与非酒精性脂肪肝的相关性研究进展[J].中华糖尿病杂志,2015,7(9):581-584.
[11] Tesch GH,Lim AK. Recent insights into diabetic renal injury from the db/db mouse model of type 2 diabetic nephropathy [J]. Am J Physiol Renal Physiol,2011,300(2):F301-F310.
[12] 徐磊,厉有名.过氧化物酶体增殖物激活受体α在脂肪性肝病发病机制中的作用[J].中华肝脏病杂志,2005, 13(9):715-717.
[13] Kallwitz ER,McLachlan A,Cotler SJ. Role of peroxisome proliferators-activated receptors in the pathogenesis and treatment of nonalcoholic fatty liver disease [J]. World J Gastroenterol,2008,14(1):22-28.
[14] Ip E,Farrell GC,Robertson G,et al. Central role of PPARalpha-dependent hepatic lipid turnover in dietary steatohepatitis in mice [J]. Hepatology,2003,38(1):123-132.
[15] Watts GF,Barrett PH,Ji J,et al. Differential regulation of lipoprotein kinetics by atorvastatin and fenofibrate in subjects with the metabolic syndrome [J]. Diabetes,2003, 52(3):803-811.
[16] Li F,Patterson AD,Krausz KW,et al. Metabolomics reveals an essential role for peroxisome proliferator-activated receptor alpha in bile acid homeostasis [J]. J Lipid Res,2012,53(8):1625-1635.
[17] Fraulob JC,Souza-Mello V,Aguila MB,et al. Beneficial effects of rosuvastatin on insulin resistance,adiposity,inflammatory markers and non-alcoholic fatty liver disease in mice fed on a high-fat diet [J]. Clin Sci(Lond),2012, 123(4):259-270.
[18] Souza-Mello V,Gregorio BM,Cardoso-de-Lemos FS,et al. Comparative effects of telmisartan,sitagliptin and metformin alone or in combination on obesity,insulin resistance,and liver and pancreas remodelling in C57BL/6 mice fed on a very high-fat diet [J]. Clin Sci(Lond),2010, 119(6):239-250.
[19] Everett L,Galli A,Crabb D. The role of hepatic peroxisome proliferator-activated receptors(PPARs)in health and disease [J]. Liver,2000,20(3):191-199.
[20] Vonghia L,Magrone T,Verrijken A,et al. Peripheral and Hepatic Vein Cytokine Levels in Correlation with Non-Alcoholic Fatty Liver Disease(NAFLD)-Related Metabolic,Histological,and Haemodynamic Features [J]. PLoS One,2015,10(11):e0143380.
(收稿日期:2017-06-23 本文编辑:张瑜杰)endprint
