阜新某鸡场大肠埃希菌四环素类药物敏感性试验及耐药基因检测
2017-11-16张雅为刘耀川朱江巍赵晓彤顾贵波
张雅为,高 锋,刘耀川,朱江巍,魏 澍,王 军,赵 培,赵晓彤,顾贵波
(1.辽宁省动物疫病预防控制中心,辽宁沈阳 110164;2.辽宁农业职业技术学院,辽宁营口 115009;3.辽宁省重大动物疫病应急中心,辽宁沈阳 110161)
阜新某鸡场大肠埃希菌四环素类药物敏感性试验及耐药基因检测
张雅为1,高 锋2,刘耀川3,朱江巍3,魏 澍1,王 军1,赵 培1,赵晓彤1,顾贵波1
(1.辽宁省动物疫病预防控制中心,辽宁沈阳 110164;2.辽宁农业职业技术学院,辽宁营口 115009;3.辽宁省重大动物疫病应急中心,辽宁沈阳 110161)
大肠埃希菌能够引起鸡大肠杆菌病,对养殖业危害巨大。检测阜新某鸡场分离的33株鸡源大肠埃希菌对6种临床常用的四环素类药物的敏感性,并对四环素耐药基因进行检测。结果表明,大肠埃希菌分离株对土霉素和脱氧土霉素高度耐药;对四环素和多西环素中度耐药;对金霉素和强力霉素敏感。在33株大肠埃希菌分离株中检测出tetB、tetC、tetM、tetK、tetL 5种四环素耐药基因,未检出tetA基因,tetK检出率最高。
鸡大肠埃希菌;四环素类;耐药;基因
大肠埃希菌为鸡大肠杆菌病的主要致病菌,该菌在饲料、饮水及饲养环境中广泛分布,极易造成集约化养鸡场中鸡大肠杆菌病大规模暴发。病鸡主要以大肠埃希菌败血症为主[1-2],其他症状包括肉芽肿、输卵管炎症、腹膜炎等,给养殖业带来巨大经济损失[3-4]。四环素类药物作为临床常用的广谱抗生素,常用于治疗大肠埃希菌引起的多种疾病。该类药物主要通过抑制细菌具体蛋白合成而发挥抑菌作用。但随着该类药物的长期使用,多种细菌包括大肠埃希菌已对其产生不同程度的耐药性。目前已发现多种四环素类药物的耐药基因,大致可分为三类,即外排泵类耐药基因、核糖体保护基因及灭活酶基因。病原菌在耐药基因的介导下可对一种或多种四环素类药物产生不同程度的耐受,给疾病治疗及预防带来困难[5-8]。
本试验对阜新某鸡场分离的大肠埃希菌分离株进行四环素类药物敏感性试验,分析该场大肠埃希菌对四环素类药物的耐药情况。并根据药敏试验结果,设计四环素类药物耐药基因特异性引物,筛查大肠埃希菌分离株对四环素类药物产生耐药性的分子机制,为该场鸡大肠杆菌病治疗及耐药性机理筛查奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 33株大肠埃希菌分离株于阜新某鸡场病死鸡的肝脏中分离,大肠埃希菌分离株经麦康凯鉴别培养基及肠杆菌科生化常规鉴定管鉴定,于辽宁省动物疫病预防控制中心保存。大肠埃希菌标准株ATCC25922,辽宁省动物疫病预防控制中心提供。
1.1.2 试剂 营养琼脂、营养肉汤(NB)、MH(B)培养基、酵母提取物、麦康凯琼脂、MH(A)琼脂,北京奥博星生物技术有限公司产品;GoldenView染色液,天根生化科技(北京)有限公司产品;DNA标准DL 2 000、DNA标准DL 5 000、琼脂糖,宝生物工程(大连)有限公司产品;2×TaqPCR Master Mix、ddH2O,北京全式金生物技术有限公司产品;细菌基因组DNA提取试剂盒,博迈德生物科技有限公司产品。
1.1.3 药物标准品 四环素(纯度86.4%)、土霉素(纯度93.3%)、多西环素(纯度76.3%),中国兽医药品监察所产品;金霉素(纯度73.3%)、强力霉素(纯度82.3%)、脱氧土霉素(纯度86.6%),北京中海生物科技有限公司产品。
1.1.4 主要仪器 隔水式电热恒温培养箱、立式不锈钢高压蒸汽灭菌消毒器、无菌洁净工作台、微量可调节加样器(Eppendorf)、电动移液器(Thermo)、梯度PCR扩增仪(T100 Thermal Cycler BIO-RAD)、数码凝胶成像与分析系统(Gel Dox XR+ Bio-Rad)等,辽宁省动物疫病预防控制中心提供。
1.2 方法
1.2.1 药物最小抑菌浓度(Minimal Inhibitory Concentration,MIC)测定 根据美国临床实验室标准委员会(Clinical Laboratory Standards Institute, CLSI)2013版推荐的方法,采用微量肉汤稀释法测定6种四环素类药物对33株大肠埃希菌分离株的最小抑菌浓度。
1.2.1.1 冻存菌的活化 将保存于-20 ℃的33株鸡大肠埃希菌分离株甘油菌,以划线培养的方式接种于无菌的麦康凯琼脂培养基中,并于37℃倒置过夜培养。培养结束后,挑取培养基中的典型的有红色金属光泽的圆形菌落,接种于无菌的NB肉汤培养基中,于37℃振荡培养至菌液OD 600 nm=0.6~0.8之间后可用于试验。
1.2.1.2 四环素类药物的配制 根据CLSI推荐方法及药物标准品的有效成分含量,用相应的溶剂对药物进行配置。将药物配制成终浓度为1 280 μg/mL的原药液,置-20℃保存备用。
1.2.1.3 MIC测定 测定药物MIC时,将培养的菌液用M-H肉汤进行1 000倍稀释,将菌液稀释成浓度为1×105CFU/mL的工作菌液。同时采用倍比稀释法将抗菌药物进行稀释,使药液的浓度范围在0.25 μg/mL~128 μg/mL之间。将100 μL菌液及100 μL药液加入96孔U型底细胞培养板中,37℃过夜培养。以能够抑制细菌生长的最小浓度为该药物的MIC,每个分离株重复3个平行,以大肠埃希菌标准株ATCC25922为质控菌。
1.2.2 四环素类耐药基因筛查
1.2.2.1 大肠埃希菌分离株基因组DNA提取 按照细菌基因组DNA提取试剂盒说明书操作步骤,对大肠埃希菌分离株基因组DNA进行提取。大肠埃希菌分离株活化、培养方法参考步骤1.2.1.1。提取的基因组DNA经15 g/L的琼脂糖凝胶电泳检测提取效果。
1.2.2.2 四环素类耐药基因引物合成 根据NCBI中GenBank已公布的四环素耐药基因序列,使用Primer软件设计特异性引物,引物由上海生工生物工程技术服务有限公司进行合成。具体的基因名称、引物序列等信息见表1。
1.2.2.3 耐药基因PCR扩增 耐药基因PCR反应体系见表2。PCR扩增条件为:94 ℃预变性4 min;94 ℃ 30 s,47 ℃~56 ℃ 30 s,72 ℃ 2 min,共35个循环;最终72℃ 7 min后于4℃保存。PCR扩增反应结束后,取5 μL PCR扩增产物,用15 g/L的琼脂糖凝胶进行电泳检测。

表1 四环素耐药基因引物序列Table 1 The primer sequences of tetracycline resistance genes
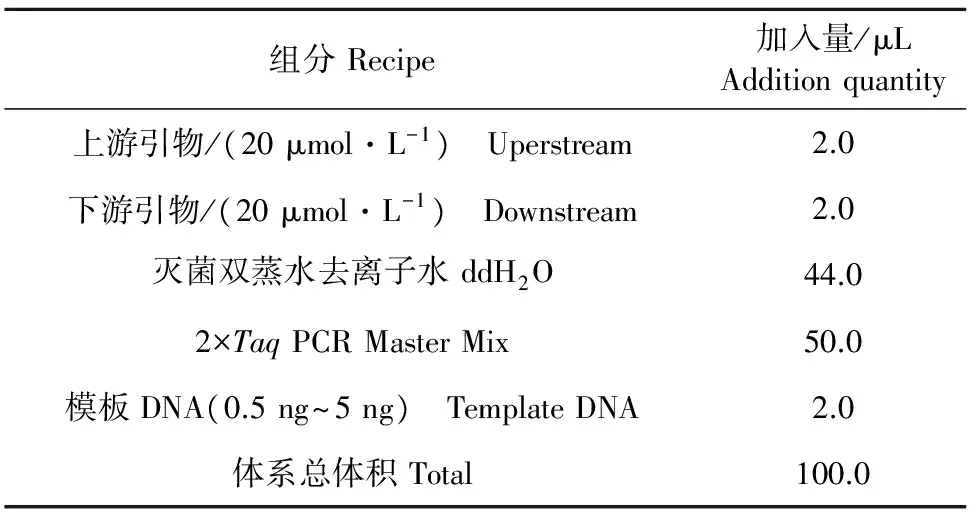
表2 四环素耐药基因PCR反应体系Table 2 PCR reaction system of tetracycline resistance genes
2 结果
2.1 大肠埃希菌分离株药物敏感性试验
33株鸡大肠埃希菌分离株对受试的6种四环素类药物的敏感性试验结果见表3。
由表3可知,33株鸡大肠埃希菌分离株对受试的6种四环素类药物已产生不同程度的耐药性,其中对土霉素及脱氧土霉素耐药率最高,分别为90.9%及84.8%;对四环素和多西环素耐药率相对较高,分别为63.6%和30.3%;对金霉素和强力霉素较为敏感,耐药率分别为18.2%和12.1%。
2.2 大肠埃希菌分离株基因组DNA提取结果
使用细菌基因组DNA提取试剂盒,提取33株鸡大肠埃希菌分离株的基因组DNA,提取的基因组DNA经15 g/L的琼脂糖凝胶电泳检测,部分提取结果见图1。
2.3 四环素耐药基因筛查结果
以大肠埃希菌分离株基因组DNA为模板,6种四环素类耐药基因引物对分离株耐药基因携带情况进行筛查,检测出携带tetB、tetC、tetL、tetK、tetM基因,未检出tetA基因(图2)。

表3 大肠埃希菌分离株药物敏感性试验结果Table 3 Drug sensitivity test results of E.coli isolates
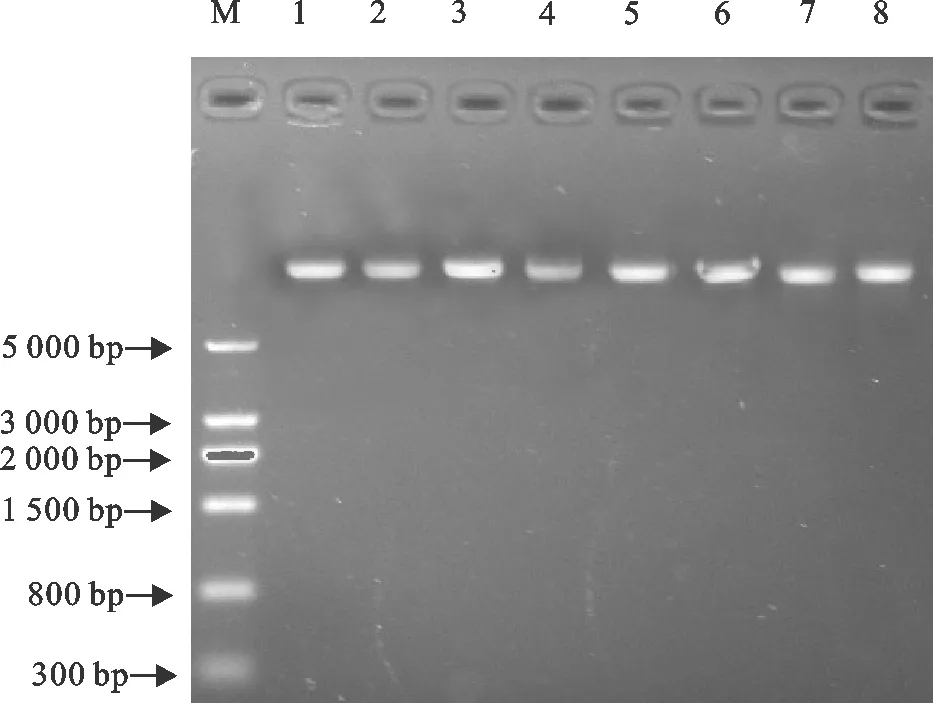
M.DNA标准DL 5 000;1~8.部分大肠埃希菌分离株基因组DNAM.DNA Marker DL 5 000;1-8.Genomic DNA of E.coli isolates图1 部分大肠埃希菌基因组DNA电泳结果Fig.1 Electrophoresis results of genomic DNA of E.coli isolates
四环素类耐药基因筛查结果表明,在33株大肠埃希菌分离株中,共检出6株tetB阳性菌株、5株tetC阳性菌株、5株tetM阳性菌株、11株tetK阳性菌株、9株tetL阳性菌株,未检出tetA阳性株。tetA、tetB、tetC、tetM、tetK、tetL的检出率分别为0(0/36)、16.7%(6/36)、13.9%(5/36)、13.9%(5/36)、30.6%(11/36)、25%(9/36)。tetK为该场鸡大肠埃希菌主要四环素耐药基因。
33株大肠埃希菌分离株中最多携带3种筛查的耐药基因,携带0~3种耐药基因的菌株分别占21.2%(7/33)、54.5%(18/33)、18.2%(6/33)、6.1%(2/33),携带1种耐药基因的菌株占比最多,其次为未携带耐药基因的菌株,同时携带3种耐药基因的分离株占比最少。
3 讨论
鸡大肠杆菌病给养殖业带来巨大经济损失。四环素类药物作为其治疗药物之一,已广泛使用于临床疾病治疗。由于药物的长期使用,多种病原菌在选择压力的作用下已对其逐渐产生耐药性,给疾病治疗及预防带来困难。本试验结果表明,受试场鸡大肠埃希菌分离株对临床常用的四环素类抗菌药物已产生不同程度的耐药性。其中对土霉素及脱氧土霉素高度耐药,对四环素及多西环素耐药率相对较高,对金霉素和强力霉素较为敏感。与其他地区报道的耐药情况不尽相同,如张扬等[9]报道江西地区鸡源大肠埃希菌分离株对四环素及多西环素耐药率较高,分别为84%和75%,刘香敏等[2]报道山东地区鸡源大肠埃希菌对四环素较为敏感,李海花等[10]报道天津地区禽大肠埃希菌对金霉素耐药性较高。

M.DNA标准DL 2 000;1、4、7、10、13、16.阴性对照;2、5、8、11、14、17.tetA、tetB、tetC、tetM、tetK、tetL阳性对照;3、6、9、12、15、18.tetA、tetB、tetC、tetM、tetK、tetL筛查结果M.DNA Marker DL 2 000;1,4,7,10,13,16.Negative control;2,5,8,11,14,17.tetA,tetB,tetC,tetM,tetK,tetL positive control;3,6,9,12,15,18.tetA,tetB,tetC,tetM,tetK,tetL screening result图2 四环素类耐药基因筛查电泳结果Fig.2 Electrophoresis of tetracycline resistance gene screening results of E.coli isolates
本试验在33株大肠埃希菌分离株中共筛查到tetB、tetC、tetM、tetK、tetL 5种四环素类耐药基因,其中tetK分离率最高,为该场大肠埃希菌中主要的四环素类耐药基因。耐药基因分离情况与相关文献报道也存在差异,如张扬等[9]在鸡源大肠埃希菌中发现tetA基因,而本研究并未检测出该基因;江西地区主要四环素耐药基因为tetA及tetB,而本研究饲养场中的主要耐药基因为tetK。不同的药物敏感性及耐药基因筛查结果,可能与地区间药物使用习惯及治疗方式有关[11]。
在本试验的33株大肠埃希菌分离株中,大部分分离株只携带1种四环素类耐药基因,极少数分离株同时携带3种耐药基因。说明四环素类药物耐药基因在病原菌,特别是大肠埃希菌中普遍存在,虽然同时携带3种耐药基因的分离株较少,但由于其携带耐药基因数量较多,能够介导病原菌对四环素类抗生素的多药耐药,因此造成危害较大,需要引起注意[12]。
[1] 贺永明,鄂禄祥.肉鸡大肠杆菌与沙门氏菌混合感染的诊治[J].黑龙江畜牧兽医,2016(2):105-106.
[2] 刘香敏,王 平,郭妍妍,等.鸡源致病性大肠杆菌血清型鉴定及耐药性分析[J].黑龙江畜牧兽医,2015(9):188-191.
[3] 刘玉华,王琳琳,方向红,等.鸡源大肠杆菌超广谱β-内酰胺酶的检测及耐药性分析[J].中国畜牧兽医,2014,41(12):271-275.
[4] Jafan R A,Motamedi H,Malekj E,et al.Phylogenetic typing and detection of extended-spectrum β-lactamases inEscherichiacoliisolates from broiler chickens in Ahvaz,Iran[J].Vet Res Forum,2016,7(3):227-233.
[5] 徐旺烨,樊 琛,乔薪瑗,等.34株鸡大肠杆菌的分离鉴定及致病力分析[J].中国动物传染病学报,2016,24(4):41-47.
[6] 吕传武,徐希兰.鸡大肠杆菌病防治[J].山东畜牧兽医,2014,35(7):24-25.
[7] Fu T,Du X D,Cheng P P,et al.Characterization of an rmtB-carrying Incl1 ST136 plasmid in avianEscherichiacoliisolates from chickens[J].J Med Microbiol, 2016,doi:10.1099/jmm.0.000240.
[8] 林大捷.鸡大肠杆菌分离鉴定与药敏试验研究[J].黑龙江畜牧兽医,2015(4):108-110.
[9] 张 扬,陈丽鹏,吴 华,等.鸡源大肠杆菌四环素耐药基因检测[J].江西农业学报,2014,26(1):94-96.
[10] 李海花,白鹏勋,张 莉,等.天津4种特色引进家禽大肠埃希菌的分离鉴定及药敏试验[J].动物医学进展,2016,37(8):112-115.
[11] Al-Bahry S N,Al-Mashani B M,Al-Ansari A S,et al.Escherichiacolitetracycline efflux determinants in relation to tetracycline residues in chicken[J].Asian Pac J Trop Med,2013,6(9):718-722.
[12] Olowe O A,Idris O J,Taiwo S S.Prevalence of tet genes mediating tetracycline resistance inEscherichiacoliclinical isolates in Osun State,Nigeria[J].Eur J Microbiol Immunol,2013,3(2):135-140.
TetracyclineSensitivityTestandDrugResistanceGeneDetectionofEscherichiacoliinOneChickenFarmofFuxin
ZHANG Ya-wei1, GAO Feng2, LIU Yao-chuan3, ZHU Jiang-wei3, WEI Shu1, WANG Jun1, ZHAO Pei1, ZHAO Xiao-tong1, GU Gui-bo1
(1.AnimalDiseasePreventionandControlCenterinLiaoningProvince,Shenyang,Liaoning,110164,China;2.LiaoningAgrculturalTechnicalCollege,Yingkou,Liaoning,115009,China;3.MajorAnimalEpidemicEmergencyCenterinLiaoningProvince,Shenyang,Liaoning,110161,China)
E.colicould cause chicken colibacilosis and bring huge harm to breeding industry.In this study,33E.coliisolates were obtained from a chicken breeding farm in Fuxin area,and antibiotic sensitivity test was taken out to detect the sensitivity of isolates to 6 kinds of tetracyclines which commonly used in clinical treatments.And drug resistance genes were screened.The results showed that, isolates were highly resistant to oxytetracycline and doxycyclinum,moderately resistant to tetracycline and doxycylcline,and sensitive to duomycin and deoxytetracycline.5 kinds of resistance genes were screened in 33E.coliisolates,the positive genes were tetB,tetC,tetM,tetK and tetL,none isolates was positive for tetA gene,and tetK was the major resistance gene.
E.coli;tetracyclines;antibiotic resistance;resistance gene
2016-12-13
辽宁省农业领域青年科技创新人才培养计划项目(2015015)
张雅为(1981-),女,辽宁丹东人,高级兽医师,硕士,主要从事预防兽医学相关研究。
S852.612;S858.31
B
1007-5038(2017)10-0118-04
