牛IgG Fc片段与FnBPB-ClfA串联表达及其对金黄色葡萄菌性奶牛乳腺炎的免疫效果
2017-11-16郝永清赵红梅李松建
崔 健,郝永清,赵红梅,杜 琳,李松建
(内蒙古农业大学兽医学院微生物学与免疫学实验室,内蒙古呼和浩特 010018)
牛IgG Fc片段与FnBPB-ClfA串联表达及其对金黄色葡萄菌性奶牛乳腺炎的免疫效果
崔 健,郝永清*,赵红梅,杜 琳,李松建
(内蒙古农业大学兽医学院微生物学与免疫学实验室,内蒙古呼和浩特 010018)
为了提高金黄色葡萄球菌(S.aureus)黏附素FnBPB-ClfA基因表达蛋白对奶牛的免疫效力,应用RT-PCR扩增奶牛IgG Fc基因片段与构建的金黄色葡萄球菌(S.aureus)FnBPB-ClfA黏附素基因串联构建质粒pMD19T-Fc-FnBPB-ClfA,并通过双酶切将其克隆于pET32a(+),以构建质粒pET32a-Fc-FnBPB-ClfA并进行诱导表达。以盐酸左旋咪唑(LH)或氢氧化铝(ALUM)为佐剂,与纯化的重组蛋白( bFc-FnBPB-ClfA)混合以首次免疫肌肉注射,加强免疫乳头管灌注或首次免疫、二次免疫及三次免疫均以肌肉注射方式免疫临近干奶期的奶牛。用间接ELISA和Western blot对各组牛血清中的抗体进行监测,评价免疫效果。结果显示,以LH为佐剂免疫的(A组)牛21 d时抗体水平最高,可达到1∶1 600;而以ALUM为佐剂免疫的B组和C组抗体水平分别为1∶800和1∶400。IgG水平动态监测结果表明,以LH为佐剂免疫牛的血清中特异性抗体上升趋势明显高于其他免疫组。研究结果表明,以首次免疫肌肉注射,加强免疫乳头管灌注的方式较好,并且bFc-FnBPB-ClfA与LH佐剂混合后免疫奶牛能最有效激发奶牛免疫反应。
金黄色葡萄球菌;奶牛IgG Fc;重组蛋白Fc-FnBPB-ClfA
随着人民生活水平的快速提升,人们对牛奶品质的要求也上升到了一个新的高度,奶牛乳腺炎则是限制乳品质量的重要一环。由金黄色葡萄球菌(S.aureus)所引发的奶牛乳腺炎是影响奶牛业发展、阻碍牛奶品质提升的严重疾病[1]。多年来,防治乳腺炎的措施主要是乳头药浴和抗菌药物注射,抗菌药物治疗的成功与否不但与感染病原菌的种类和感染程度有关[2],而且这种方法长期使用会使细菌产生抗药性以及导致乳品中抗菌药物的残留。所以,寻找更好更安全的途径和方法控制乳房炎的流行已成为奶牛业发展的迫切需求[3]。由于奶牛乳腺特殊的解剖学特性,致使其容易受到病原微生物的侵入而发生炎症,也使得奶牛乳腺炎的防治成为世界性难题。在美国和欧洲的牛场使用的J5疫苗在降低革兰阴性菌引发的乳房炎的严重性上有一定效果[4]。
有研究表明,金黄色葡萄球菌黏附上皮细胞或细胞外基质蛋白被认为是早期感染的关键[5]。其中纤连结合蛋白B (fibronection-binding protein B,Fn-BPB) 是金黄色葡萄球菌的一种重要抗原[6-7],其在研究金黄色葡萄球菌致病性及亚单位疫苗中有很重要的地位[8]。凝集因子A (clumping factor A, ClfA) 是S.aureus黏附于奶牛乳腺上皮细胞并引起乳腺炎所必需的黏附因子[9-10]。本研究将IgG的Fc基因片段克隆后与FnBPB-ClfA基因进行串联,经原核表达制备Fc-FnBPB-ClfA重组蛋白,通过免疫临产期奶牛,比较其免疫效果。
1 材料与方法
1.1 材料
1.1.1 菌株质粒S.aureusD4阳性菌株、pET-FnBPB-ClfA重组质粒及表达载体pET-32a(+),内蒙古农业大学兽医学院微生物与免疫学实验室经鉴定后保存。
1.1.2 主要试剂 pMD19-T Simple Vector、QuickCutEcoRⅠQuickCutXhoⅠ、RNA iso Plus、DNA Marker DL 2 000、T4 DNA Ligase ,TaKaRa 公司产品;2×EasyTaqPCR SuperMix、Trans1-T1感受态、蛋白Marker、BCA蛋白定量试剂盒,北京全式金生物技术有限公司产品;铝胶盐水、聚偏二氟乙烯膜(PVDF膜),Millipore公司产品;牛外周血淋巴细胞分离液,天津市灏洋生物制品科技有限责任公司产品。
1.2 方法
1.2.1 牛IgG Fc片段的PCR扩增 根据GenBank中公布的牛IgG1重链基因序列(x62916.1),利用Primer5.0设计一对扩增IgG Fc段基因的上、下游引物,Fc-f:5′-CACGAATTCATGGTTGATCCCACATGCAAACCAT-3′(EcoR Ⅰ)/Fc-r:5′-agatccgccacctccTTTACCCGCAGACTTAGAGGT-3′(小写字母为Linker)。
采集新鲜牛血提取牛淋巴细胞并从淋巴细胞中提取总RNA,通过RT-PCR,扩增牛的IgG Fc片段。将PCR产物回收纯化。送上海生工生物工程技术服务有限公司测序。
1.2.2 牛IgG Fc片段与S.aureusFnBPB-ClfA的串联 参照文献[5-7],将测序正确的牛IgG Fc基因片段利用Fc片段的上游引物Fc-f和FnBPB-ClfA片段的下游引物5′-CCGCTCGAGTTACTCATCAGGTTGTTCAGG-3′(XhoⅠ),通过SOE-PCR将Fc片段与已构建的FnBPB-ClfA基因片段进行串联[11-13],扩增Fc-FnBPB-ClfA融合基因。将Fc-FnBPB-ClfA基因与pMD19T载体连接,转化至Trans1-T1感受态细胞中,提取质粒并进行酶切鉴定,筛选阳性质粒送上海生工生物工程技术服务有限公司测序,测序正确的质粒命名为pMD19-T-Fc-FnBPB-ClfA。
1.2.3 重组表达质粒的构建 将重组质粒pMD19T-Fc-FnBPB-ClfA和pET32a(+)通过EcoRⅠ和XhoⅠ分别进行双酶切,回收目的基因和载体片段,以T4 DNA连接酶连接后,转化至E.coliBL21(DE3)。提取质粒pET32a-Fc-FnBPB-ClfA,通过菌液PCR对其进行初筛,选取阳性的重组质粒再用EcoRⅠ和XhoⅠ进行双酶切鉴定,并选取阳性结果送上海生工生物工程技术服务有限公司测序。
1.2.4 目的蛋白的诱导表达 将含有pET32a-Fc-FnBPB-ClfA的重组菌接种于LB Amp+的液体培养基中,以含有空质粒pET32a(+)的重组菌作为阴性对照,35℃ 175 r/min 培养,当菌液 OD 600 nm值达0.3~0.7时,加IPTG至终浓度为0.6 mmol/L 35℃继续振荡培养过夜。利用镍层析柱进行蛋白纯化,取适量诱导表达菌液及纯化后的蛋白进行SDS-PAGE分析,考马斯亮蓝R250染色并脱色后观察。BCA蛋白定量试剂盒测定纯化后的蛋白浓度。
1.2.5 疫苗的制备
1.2.5.1 铝盐佐剂疫苗的制备 将铝盐佐剂(ALUM)与测定终浓度的蛋白以体积比1∶1方式配比,摇床振荡17 min,充分混匀,得到铝盐佐剂疫苗。
1.2.5.2 盐酸左旋咪唑佐剂疫苗的制备 将盐酸左旋咪唑用灭菌的PBS溶解至浓度为10 mg/mL的盐酸左旋咪唑溶液,后用0.22 μm的无菌滤器过滤除菌,即得到10 mg/mL盐酸左旋咪唑佐剂(10 mg/mL LH),将其与1.2.5.1所述蛋白以体积比1∶1方式配比,充分混匀,即为10 mg/mL盐酸左旋咪唑佐剂疫苗。
1.2.6 动物分组及试验设计
1.2.6.1 动物分组及免疫 将60头临近干奶期并且经CMT检测的隐性乳房炎奶牛随机分为A、B、C、D 4组,每组15头,每次以蛋白量5 mg/头进行注射免疫。A组(LH组)注射盐酸左旋咪唑佐剂疫苗,首次肌肉注射免疫,加强免疫乳头管灌注;B组(ALUM组)注射铝盐佐剂疫苗,免疫方法同A组;C组(Muscle组)注射铝盐佐剂疫苗,进行3次肌肉免疫;D组(PBS组)为对照组。每次采血从各组中随机采集5头牛的血分离血清。免疫时间及部位见表1。
1.2.6.2 血清中特异性抗体动态监测 以1.2.4所述蛋白作为抗原,用灭菌PBS稀释,每孔0.5 μg包被ELISA板,以各组免疫后0、14、21、28、60 d的呈梯度稀释的奶牛血清为一抗,兔抗牛的HRG-IgG(1∶4 000)为二抗, TMB显色液显色,测定其OD 450 nm值,用间接ELISA监测牛血清中抗体变化;将待检血清倍比稀释至1∶100~1∶3 200兔抗牛的HRG-IgG(1∶4 000)为二抗,对各组的特异性抗体进行间接ELISA检测。以P/N≥2.1(P为试验组血清,N为对照组血清)作为阳性临界值的判定。
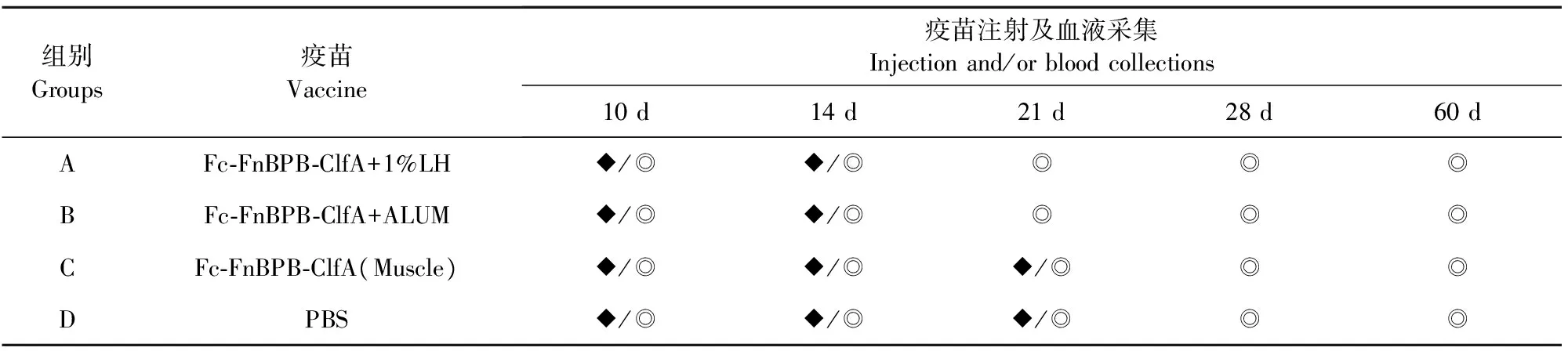
表1 实验动物处理方式Table 1 Experimental animal treatment modes
注:◆表示免疫时间,◎表示采集血液。
Note:◆Means immune time,◎Means blood collection.
1.2.6.3 Western blot检测 将目的蛋白与蛋白SDS-PAGE上样缓冲液混合,进行SDS-PAGE凝胶电泳后将蛋白转印至PVDF膜,以50 g/L脱脂乳为封闭液进行封闭8 h,PBST洗4次,每次15 min;用1∶200稀释的抗体滴度最高的免疫牛血清为一抗,4℃孵育过夜;PBST洗,方法同上,兔抗牛IgG-HRP二抗(1∶4 000)室温1 h 30 min;PBST洗,同上;ECL显色并观察。
2 结果
2.1 融合基因Fc-FnBPB-ClfA的扩增和重组质粒的构建
提取牛的外周血淋巴细胞提取的总RNA (图1),以反转录得到的cDNA作为模板,通过PCR扩增的产物进行电泳检测,在699 bp左右有明显条带,与预期结果相符(图2)。以牛IgG Fc和FnBPB-ClfA两段片段为模板,利用Fc基因的上游引物以及基因FnBPB-ClfA基因的下游引物,通过SOE-PCR将以上两段基因扩增串联。经琼脂糖凝胶电泳检测,在2 000 bp左右有明显条带,与预期结果相符,经测序,目的基因全长2 130 bp,与设计一致(图3)。将重组质粒pMD19T-Fc-FnBPB-ClfA及pET32a(+)用EcoRⅠ和XhoⅠ分别进行双酶切(图4),将Fc-FnBPB-ClfA融合基因克隆于pET32a(+)载体中,构建重组质粒pET32a-Fc-FnBPB-ClfA。经测序,重组质粒中Fc片段序列与GenBank中B.taurus基因序列(x62916.1)完全一致;FnBPB片段与参考株S.aureus(CP003979.1)及ClfA片段与S.aureus(JQ278699.1)相应序列的同源性均为99%,表明重组质粒构建成功。
2.2 血清中抗体效价检测结果
采用间接ELISA,分别对免疫组及对照组0、14、21、28、60 d的牛血清中抗体进行测定(表2)。对加强免疫后7 d的牛血清进行抗体效价检测,每组3个平行,取平均值。结果显示,A组牛的血清抗体效价均可达1∶1 600(图5),表明A组的免疫效果优于其他组。

M.DNA 标准DL 2 000;1.总RNAM.DNA Marker DL 2 000;1.Total RNA图1 总RNA产物电泳Fig.1 Electrophoresis of total RNA products
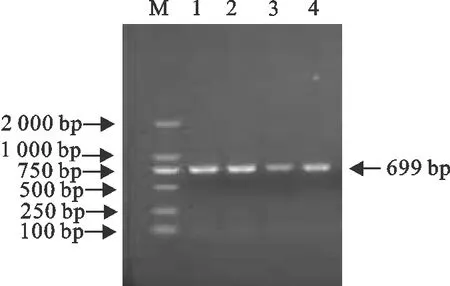
M.DNA 标准DL 2 000;1~4.Fc基因M.DNA Marker DL 2 000;1-4.Fc gene图2 Fc基因的PCR扩增Fig.2 PCR amplification of Fc gene
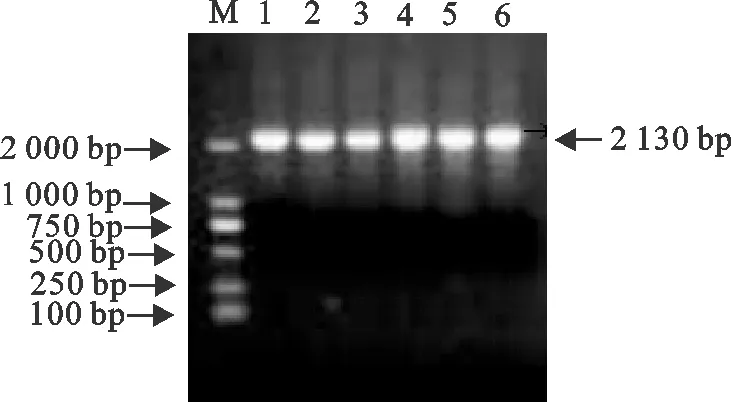
M.DNA 标准DL 2 000;1~6.Fc PCR产物M.DNA Marker DL 2 000;1-6.PCR products of Fc-FnBPB-ClfA gene图3 Fc-FnBPB-ClfA的PCR扩增Fig.3 SOE-PCR amplification of Fc-FnBPB-ClfA gene
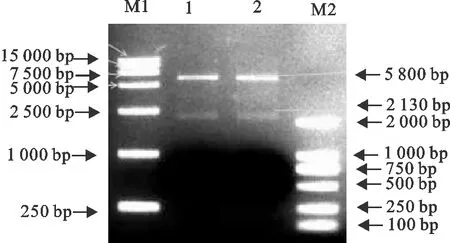
M1.DNA 标准DL 15 000;M2.DNA 标准DL 2 000;1、2.pET32a- Fc-FnBPB-ClfAEcoR Ⅰ/ Xho ⅠM1.DNA Marker DL 15 000;M2.DNA Marker DL 2 000;1,2.pET32a- Fc-FnBPB-ClfAEcoR Ⅰ/ Xho Ⅰ图4 重组表达质粒pET32a-Fc-FnBPB-ClfA的双酶切鉴定Fig.4 Identification of plasmid pET32a-Fc-FnBPB-ClfA by enzyme digestion
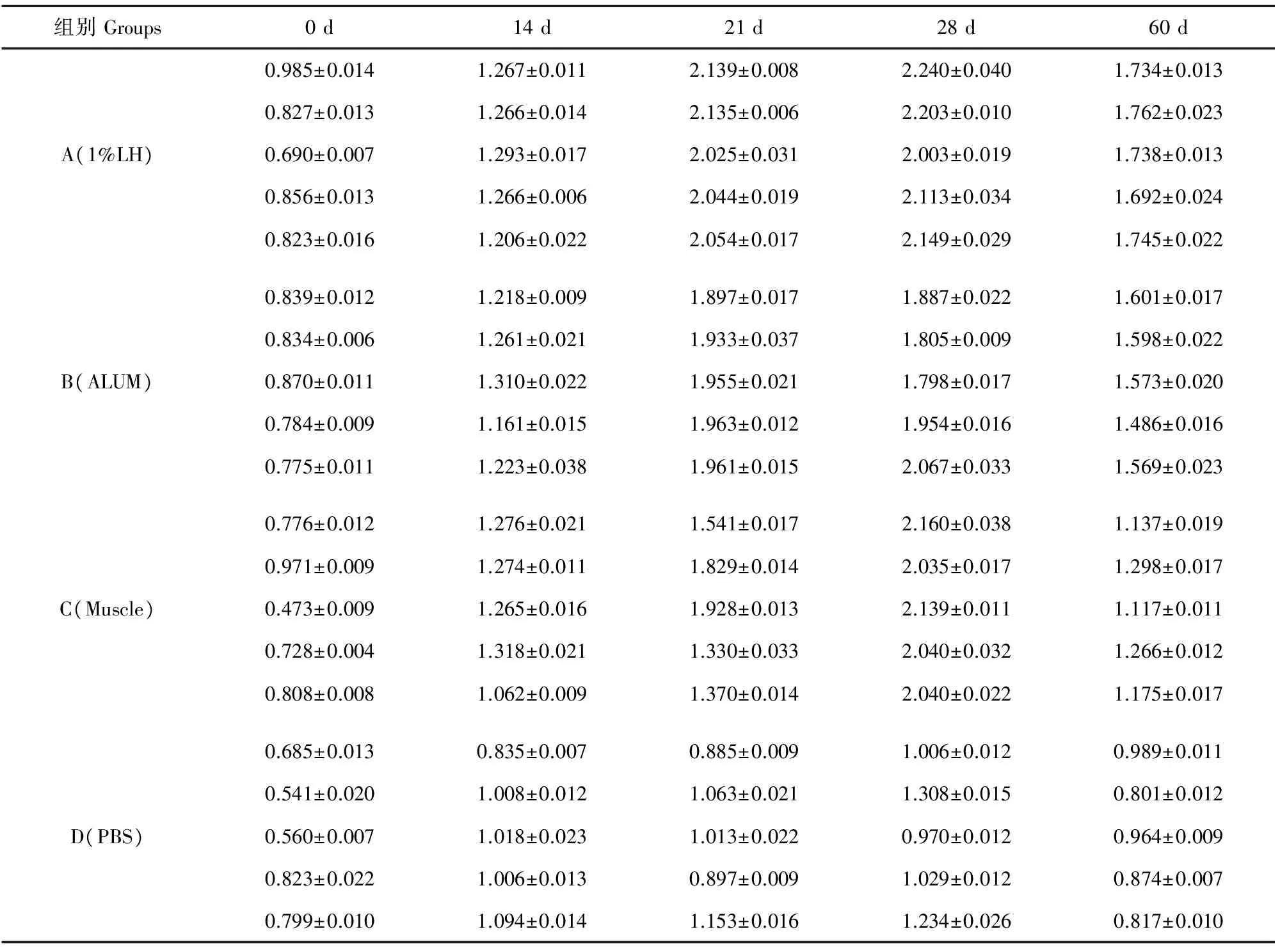
表2 牛血清抗体测定结果Table 2 Determination results of bovine serum antibodies

图5 免疫血清IgG抗体水平Fig.5 Dynamics of the antibody levels in sera of cows immunized with Fc-FnBPB-ClfA
由表2可以看出,各组中经首免、加强免疫或3次免疫后,其特异性抗体的水平在28 d前,随着时间呈现递增趋势,28 d后特异性抗体含量缓慢下降。其中A组奶牛的血清中特异性IgG含量在达到峰值时含量最高且下降时要比C组的奶牛抗体含量下降缓慢,与对照组相比差异极显著(P<0.01) ;C组测得的光密度值与对照组比较差异显著(P<0.05),仅次于A组光密度值;B组测得的光密度值与对照组相比差异显著(P<0.05)。
2.3 Western blot检测结果
以优化的条件对蛋白进行大量表达,收集蛋白上清液,纯化上清中的可溶性目的蛋白,其蛋白分子质量为78 ku。用Western blot对以LH为佐剂的疫苗免疫奶牛后采集14 d、21 d的血清及对照组血清进行了免疫学分析,结果见图6和图7。
3 讨论
Fc受体(Fc receptor,FcRn)首次发现于啮齿类动物的肠上皮细胞中[14],且能在反刍动物、啮齿动物及人的乳腺中表达。FcRn是识别IgG Fc片段的特异性受体,也是跨黏膜屏障转运IgG的唯一受体[15]。潘海婷等[16]研究证明,克隆大鼠IgG Fc基因与FnBPB-ClfA基因串联表达蛋白对大鼠进行免疫,效果优于用FnBPB-ClfA单独免疫大鼠。并且于乳头管免疫的效果要优于肌肉免疫。本试验以提取的奶牛外周血淋巴细胞中提取总RNA反转录获得的cDNA为模板克隆奶牛IgG Fc片段,通过SOE-PCR与带有Linker序列的FnBPB-ClfA基因串联,构建质粒pET32a-Fc-FnBPB-ClfA,经诱导表达并纯化后的蛋白经SDS-PAGE电泳及Western blot分析可知,bFc-FnBPB-ClfA有良好的免疫活性,将其作为疫苗与不同佐剂(LH、ALUM)混合,并以不同途径免疫注射奶牛,各组中以方式A进行免疫的牛血清效价在21 d时可达到1∶1 600,并且血清中IgG的含量呈上升趋势,递增趋势优于其他免疫方式。
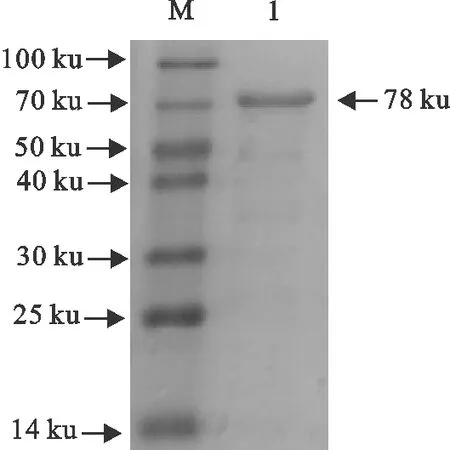
M.蛋白分子质量标准; 1.Fc-FnBPB-ClfA洗脱上清液M.Protein molecular weight Marker;1.Eluant of Fc-FnBPB-ClfA supernatant图6 目的蛋白Fc-FnBPB-ClfA的SDS-PAGE检测Fig.6 SDS-PAGE result of Fc-FnBPB-ClfA protein
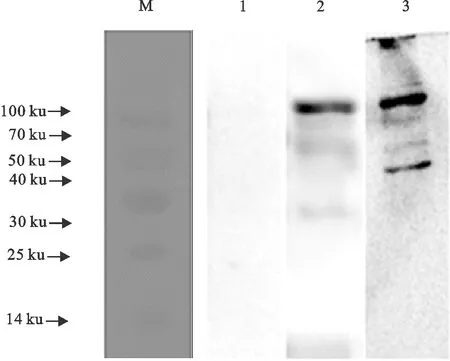
M.蛋白分子质量标准;1.阴性对照;2.14 d血清;3.21 d血清M.Protein molecular weight Marker;1.Negative control;2.14 d serum;3.21 d serum图7 重组目的蛋白的Western blot检测Fig.7 Western blot test of target protein
奶牛乳头管是感染S.aureus的首要部位,将疫苗通过乳头管灌注到乳房内部,即免疫乳腺的途径,能够更直接增强宿主抵御病原微生物的能力。Fc基因片段能够与乳腺上皮细胞中的FcRn特异性结合,介导黏膜免疫,通过FcRn的胞转作用将抗原复合物转运至基底层,穿越上皮屏障,使抗原与抗原递呈细胞等发生反应,产生有效的局部免疫反应。同时,FcRn可以保护IgG,维持血液中高抗体浓度循环,避免其被降解,延长血清中IgG半衰期。因此,将Fc-FnBPB-ClfA通过乳头管免疫奶牛能对S.aureus起到更好的防御作用。
[1] Jonsson S,Pulkkinen M O.Mastitis today:incidence,prevention and treatment[J].Ann Chir Gynsecol Suppl,1994,208:84-87.
[2] Barkema H W,Schukken Y H,Zadoks R N.Invited review:The role of cow,pathogen,and treatment regimen in the therapeutic success of bovineStaphylococcusaureusmastitis[J].J Dairy Sci,2006,89(6):1877-1895.
[3] Guler L,Ok U,Gunduz K,et al.Antimicrobial susceptibility and coagulase gene typing ofStaphylococcusaureusisolated from bovine clinical mastitis cases in Turkey[J].J Dairy Sci,2005,88(9):3149-3154.
[4] Gonzalez R N,Cullor J S,Jasper D E,et al.Prevention of clinical coliform mastitis in dairy cows by a mutantEscherichiacolivaccine [J].Can J Vet Res,1989,53(3):301.
[5] Cifrian E,Guidry A J,O'Brien C N,et al.Adherence ofStaphylococcusaureusto cultured bovine mammary cells[J].J Dairy Sci,1994,77:970-983.
[6] Kuypers J M,Proctor R A.Reduced adherence to traumatized rat heart valves by low-fibronectin binding mutant ofStaphylococcusaureus[J].Infect Immum,1989,57:2306-2312.
[7] Vercelloctti G M N,Lussenhop D,Peterson P K,et al.Bacterial adherence to fibronectin and endothelial cells:a possiblemechanism for bacterial tissue tropism [J].Lab Clin Med,1984,103:34-43.
[8] Foster T J.Potentials for vaccination against infections caused byStaphylococcusaureus[J].Vaccine,1991,16:159-166.
[9] Nour El-Din A N,Shkreta L,Talbot B G,et al.DNA immunization of dairy cows with the clumping factor A ofStaphylococcusaureus[J].Vaccine,2006,24(12):1997-2006.
[10] Salmon H.The mammary gland and neonate mucosal immunity [J].Vet Immunol Immunopathol,1999,72(1-2):143-155.
[11] 范 鑫, 郝永清, 张爱荣, 等.金黄色葡萄球菌黏附素FnBPB-ClFA 共表达质粒的构建与原核表达[J].中国兽医科学,2011(2):173-177.
[12] 姜晓娟,郝永清,张爱荣,等.金黄色葡萄球菌凝聚因子A区基因的克隆表达及表达产物的免疫学特性[J].中国兽医科学,2009,7:626-631.
[13] 史冬艳, 郝永清, 张爱荣.奶牛乳房炎金黄色葡萄球菌FnbpB-D 基因的表达及其抗血清活性[J].中国预防兽医学报,2010,32(5):356-359.
[14] Roopenian D C,Akilesh S.FcRn:the neonatal Fc receptorcomes of age [J].Nat Rev Immunol,2007,7(9):715-725.
[15] Li Z L,Palaniyandi S,Zeng R Y,et al.Transfer of IgG in the female genital tract by MHC class I-related neonatal Fc receptor (FcRn) confers protective immunity to vaginal infection[J].Proc Natl Acad Sci U S A,2011,108(11):4388-4393.
[16] 潘海婷,郝永清.大鼠IgG Fc 片段与金黄色葡萄球菌黏附素FnBPB-ClfA 的融合表达及其免疫学特性[J].中国预防兽医学报,2015,37(4):299-303.
ExpressionofaFusionProteinFc-FnBPB-ClfAofStaphylococcusaureusandItsImmuneEffectagainstCowMastitis
CUI JIan,HAO Yong-qing,ZHAO Hong-mei,DU Lin,LI Song-jian
(LaboratoryofMicrobiologyandImmunology,CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Hohhot,InnerMongolia,010018,China)
The cow IgG Fc gene was fused to FnBPB-ClfA gene by SOE-PCR and cloned into pET-32a (+) vector to express the recombinant protein of rFc-FnBPB-ClfA inE.coli.Then the lactating cows were immunized with PBS or purified recombinant protein (bFc-FnBPB-ClfA) with the adjuvant levamisole hydrochloride (LH) or aluminum hydroxide (ALUM).Immunizatioin in the ways of muscle-muscle or muscle-muscle-muscle or muscle-teat canal to the nearly dry period of dairy cows.Indirect ELISA method and Western blot were used to monitor the antibody in the sera of cows in each group.The results showed that the antibody level arrived the highest at 21 d using LH as adjuvant,and could reach 1∶1 600,and the antibody levels of B group and C group were 1∶800 and 1∶400.The results of this study indicatd that bFc-FnBPB-ClfA and LH adjuvant can effectively stimulate immune response in dairy cows.
Staphylococcusaureu;cow IgG Fc gene;fusion protein Fc-FnBPB-ClfA
2017-03-02
国家自然科学基金项目(31460664);农牧交错区生态型现代奶业生产模式研究与示范项目(2012BAD12B09-02)
崔 健(1992-),男,黑龙江牡丹江人,硕士研究生,主要从事微生物与免疫学研究。*
S857.26;S852.611
A
1007-5038(2017)10-0027-06
