外源性甲状腺素对胎儿酒精效果模型仔鼠生长及神经系统发育的影响
2017-11-16金文玉金昭伶金正勇池永学金福
金文玉,金昭伶,金正勇,池永学,金福
(延边大学附属医院,吉林延吉133000)
外源性甲状腺素对胎儿酒精效果模型仔鼠生长及神经系统发育的影响
金文玉,金昭伶,金正勇,池永学,金福
(延边大学附属医院,吉林延吉133000)
目的探讨外源性甲状腺素对胎儿酒精效果(FAE)模型仔鼠脑损伤的改善作用。方法取SD孕鼠18只,随机分为对照组、模型组、治疗组,每组6只。从受孕第6天开始至分娩,模型组、治疗组每日摄取22%乙醇20 mL,对照组每日摄取与模型组相同热卡、含8%糖的牛奶。各组分娩后保留仔鼠10只,并与母鼠分离,由代理母鼠养育。对照组、模型组仔鼠第1~10天每日颈后皮下注射生理盐水2 μL/g,治疗组仔鼠每日颈后皮下注射2.5 μg/mL L- 甲状腺素2 μL/g。观察各组仔鼠出生第7、14、21、28天体质量、血浆甲状腺素水平、脑组织脑源性神经营养因子(BDNF)含量及BDNF阳性浦肯野细胞变化。结果治疗组和对照组仔鼠出生各时间点体质量、血浆甲状腺素水平及脑组织BDNF含量均明显高于模型组同期(P均<0.01),而治疗组和对照组仔鼠出生各时间点比较P均>0.05。治疗组和对照组仔鼠出生第7天开始小脑皮质中均可观察到排列整齐的BDNF阳性浦肯野细胞,且出生第28天时治疗组较对照组BDNF阳性浦肯野细胞数量更多,排列更整齐,突起更长,并可见部分分支。模型组各时间点均可观察到延迟增长和分化的浦肯野细胞。结论外源性甲状腺素可纠正FAE模型仔鼠的低甲状腺素状态,抑制BDNF阳性浦肯野细胞变性,改善FAE导致的神经系统发育障碍。
胎儿酒精效果;外源性甲状腺素;脑源性神经营养因子;仔鼠
胎儿酒精综合征(FAS)是指母孕期饮酒导致的子代认知行为异常、特征性颜面部畸形以及生长发育迟缓[1]。研究发现,部分母孕期饮用中等量乙醇并伴营养失调者子代虽无FAS的典型表现,但可出现行为和认识障碍为主要表现的胎儿酒精效果(FAE),特别是胎儿脑发育关键时期连续饮酒数日,更容易引起FAE[2],并将对胎儿造成伴随终生的运动功能发育延迟,学习、记忆及言语困难[3]。甲状腺素是维持机体正常生理功能和促进生长发育所必需的,在孕期对胎儿的脑发育具有重要作用。母孕期摄取乙醇可影响其子代甲状腺的正常发育,继而影响甲状腺素分泌,影响胎儿脑细胞与脑组织构成;甲状腺素缺乏时,甚至可导致胎儿脑组织蛋白合成障碍,与FAE的发生密切相关[4,5]。2014年10月~2016年4月,我们观察了外源性甲状腺素对FAE模型仔鼠脑组织脑源性神经营养因子(BDNF)表达的影响,旨在探讨其对FAE脑损伤的改善作用。
1 材料与方法
1.1 材料 雌性SD大鼠36只、雄鼠12只,SPF级,12~13周龄,体质量230~250 g,购自上海斯莱克实验动物有限责任公司。RT- 2100C型酶联免疫检测仪,美国Rayto公司;罗氏Cobas E602型电化学发光分析仪,德国罗氏公司;L- 甲状腺素、3′- DAB,美国Sigma公司;BDNF一抗,德国Chemicon公司;马抗鼠二抗、ABC试剂盒,美国Vector公司;BDNF ELISA试剂盒,美国Promega公司。
1.2 FAE模型制备 将36只雌鼠与12只雄鼠按3∶1进行交配,以雌鼠阴道内发现栓塞之日作为受孕日,即受孕第0天。每只雌鼠受孕后单笼饲养。受孕第6天,随机取18只孕鼠,随机分为对照组、模型组、治疗组,每组6只。剩余18只孕鼠作为代理母组,孕期正常饮水和摄食。三组出生仔鼠24 h内与母鼠分离,由代理母组养育。代理母组仔鼠处死。模型组:孕鼠从受孕第6天持续至分娩,每日摄取22%乙醇20 mL(热量约为145 J),制作FAE模型[6];所生仔鼠出生1~10天每日颈后皮下注射生理盐水2 μL/g。治疗组:孕鼠处理同模型组,所生仔鼠出生1~10天每日颈后皮下注射2.5 μg/mL L- 甲状腺素2 μL/g。对照组:孕鼠从受孕第6天持续至分娩,每日摄取与模型组同热卡、含8%糖的牛奶35 mL;所生仔鼠出生1~10天每日颈后皮下注射生理盐水2 μL/g。各组仔鼠出生24 h称量体质量,淘汰体质量偏高或偏低仔鼠,每组保留10只仔鼠。
1.3 相关指标观察
1.3.1 仔鼠体质量 各组仔鼠分别于出生第7、14、21、28天,称量并记录其体质量。
1.3.2 血浆甲状腺素水平 称量体质量后,乙醚麻醉,心脏取血,4 ℃、3 000 r/min离心3 min,取血浆,-20 ℃冰箱保存。采用罗氏Cobas E602型电化学发光分析仪检测血浆甲状腺素。
1.3.3 脑组织BDNF蛋白含量 各组仔鼠心脏取血后处死,取相同部位脑组织约100 mg;充分剪碎后加入RIPA- PMSF(100∶1),4 ℃充分匀浆,97 ℃水浴3 min,4 ℃、12 000 r/min离心10 min,取上清液,-20 ℃保存待测。采用ELISA法检测脑组织BDNF蛋白含量。所有操作严格按BDNF ELISA试剂盒说明进行。
1.3.4 脑组织BDNF阳性浦肯野细胞形态及数量 各组仔鼠分别于出生第7、14、21、28天随机取3只,麻醉后4%多聚甲醛心脏灌流,直至灌流液澄清;取脑组织,4%多聚甲醛固定,300 g/L蔗糖脱水24 h,常规冰冻切片,切片厚度35 μm;切片经PBS冲洗3 min×3次,含3% H2O2的PBS孵育30 min;PBS冲洗3 min×3次,5%马血清室温孵育30 min;PBS冲洗5 min×3次,BDNF一抗(1∶200)湿盒中室温孵育1 h,4 ℃过夜;PBS冲洗5 min×5次,马抗鼠二抗(1∶200)室温孵育2 h;PBS冲洗5 min×5次;加入ABC复合物(1∶100),室温反应1 h;TBS冲洗3次,DAB染色5 min,PBS冲洗3 min×3次;常规脱水并封片,显微镜下观察BDNF阳性浦肯野细胞形态及数量变化。

2 结果
2.1 各组仔鼠出生后体质量、血浆甲状腺素水平及脑组织BDNF含量变化 见表1。
2.2 各组仔鼠出生后脑组织BDNF阳性浦肯野细胞形态及数量变化 见插页Ⅱ图6。出生第7天,模型组仅可少数淡染且轮廓不清的BDNF阳性浦肯野细胞,未见明显突起;对照组可见数量较多的BDNF阳性浦肯野细胞,且能观察到部分深入内颗粒层的BDNF阳性浦肯野细胞突起;治疗组BDNF阳性浦肯野细胞数量少于对照组,但排列整齐,也可见部分突起。出生第14天,模型组虽可见大量BDNF阳性浦肯野细胞,但未成单层排列且未见明显突起;对照组和治疗组均可见呈单层排列且染色较强的BDNF阳性浦肯野细胞,细胞轮廓清晰,深入内颗粒层的细胞突起明显。出生第21天,模型组可见单层排列不明显的BDNF阳性浦肯野细胞,对照组和治疗组BDNF阳性浦肯野细胞均呈明显单层排列,并见深入内颗粒层的较长突起。出生第28天,模型组仅见极少量BDNF阳性浦肯野细胞,而对照组和治疗组仍可见大量BDNF阳性浦肯野细胞,轮廓完整,呈规则单层排列,且治疗组BDNF阳性浦肯野细胞数量更多、排列更整齐、突起更长,并可见部分分支。
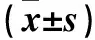
表1 各组仔鼠出生后体质量、血浆甲状腺素水平 及脑组织BDNF蛋白含量变化
注:与对照组同期比较,*P<0.01;与模型组同期比较,#P<0.01;与同组出生7天比较,△P<0.01;与同组出生14天比较,▲P<0.01;与同组出生21天比较,▽P<0.01。
3 讨论
孕期饮用乙醇可引起母体下丘脑-垂体-甲状腺轴紊乱,促甲状腺激素受体功能失调,对促甲状腺激素释放激素出现钝化反应,直接导致T3、T4水平下降,最终导致母体血液乃至子宫内低甲状腺素状态[7]。而甲状腺素是胎儿早期脑发育的调控激素,特别是孕18~20周,胎儿甲状腺发育尚不完全,此时神经元的迁徙以及宫内脑发育的其他关键因素在很大程度上取决于母体甲状腺素的供应[8]。而孕期饮酒导致母体血液以及子宫内低甲状腺素状态会引起胎儿神经元迁徙延迟,发育受阻,对胎儿神经系统将造成不可逆损伤[9]。
本研究结果显示,模型组仔鼠出生7、14、21、28天血浆甲状腺素水平明显低于对照组同期,提示胎儿期乙醇暴露确能导致仔鼠体内低甲状腺素状态。治疗组仔鼠出生7天血浆甲状腺素水平明显高于模型组同期;治疗组仔鼠出生14天血浆甲状腺素水平与对照组相当,但明显高于模型组;治疗组仔鼠出生21天血液甲状腺素水平低于出生14天,但仍明显高于模型组,考虑为下丘脑负反馈调节所致;治疗组仔鼠出生28天血浆甲状腺素水平与对照组相当,但明显高于模型组同期。提示外源性甲状腺素可改善孕期饮酒导致的仔鼠低甲状腺素状态。
研究发现,出生或发育早期体内甲状腺素水平降低可使动物神经系统功能、血液生化等多方面出现异常,如儿童最常见的内分泌疾病——克丁病,临床表现为患儿身材矮小、发育迟缓等。本研究结果显示,治疗组和对照组各时间点体质量均明显高于模型组,提示外源性甲状腺素能促进孕期乙醇暴露仔鼠生长。
浦肯野细胞是小脑皮质5种神经元细胞中惟一的传出神经元,在运动协调中起着至关重要的作用,且对内环境极其敏感[10]。BDNF为神经营养因子中的广谱因子,是神经系统发展的调节器[11]。BDNF可促进周围和中枢神经元存活、代谢、分化,并能修复损伤,最终促进受损神经元再生。研究发现,胎儿期乙醇暴露对仔鼠神经系统影响的直接后果是在特定区域和时间介导神经细胞凋亡和突触受损,继而抑制神经营养因子的表达和功能[12];在乙醇诱导的神经毒性作用下,BDNF及其相关的信号传导可发生急性耐受[13],表明BDNF可用于治疗神经退行性疾病[14]。本研究结果显示,三组仔鼠出生7~28天脑组织BDNF蛋白含量均呈降低趋势;模型组仔鼠出生7~28天脑组织BDNF蛋白含量均低于对照组和治疗组同期,而治疗组仔鼠出生7~28天脑组织BDNF蛋白含量虽低于对照组同期,但差异无统计学意义。提示外源性甲状腺素可使治疗组仔鼠脑组织BDNF蛋白合成增加。
研究发现,胎儿期乙醇暴露仔鼠脑组织中可观察到细胞质延迟成熟的浦肯野细胞,而延迟成熟的浦肯野细胞产生的原因可能是由于乙醇和(或)其代谢产物的有害影响,也可能是由于血浆甲状腺素水平降低所致[15]。本研究治疗组和对照组仔鼠出生第7天小脑皮质中均可观察到呈单层或多层排列且染色较强的BDNF阳性浦肯野细胞,细胞轮廓清晰,深入内颗粒层的细胞突起明显;出生28天时治疗组较对照组BDNF阳性浦肯野细胞数量更多,排列更整齐,突起更长,并可见部分分支;而模型组各时间点均可观察到延迟增长和分化的浦肯野细胞。提示外源性甲状腺素对FAS引起的脑损伤有改善作用。
综上所述,外源性甲状腺素可纠正胎儿期乙醇暴露仔鼠的低甲状腺素状态,抑制BDNF阳性浦肯野细胞变性,促进BDNF与其特异性受体结合,并加速其发育,使胎儿期乙醇暴露导致的神经系统损伤修复,最终促进受损神经元再生,继而改善FAE引发的神经系统发育障碍。但这种改善是否能持续至成年期乃至老年期仍需进一步研究证实。
[1] Astley SJ. Fetal alcohol syndrome prevention in Washington State: evidence of success[J]. Paediatr Perinat Epidemiol, 2004,18(5):344- 351.
[2] Hankin JR. Fetal alcohol syndrome prevention research[J]. Alcohol Res Health, 2002,26(1):58- 65.
[3] Le Duc D. Fetal alcohol spectrum disorder: molecular insights into neural damage reduction[J]. Neural Regen Res, 2015,10(11):1764- 1766.
[4] 李建宁,赵迎春,何岚,等.妊娠期亚临床甲状腺功能减退症对其后代智力的影响及干预效果分析[J].中国医科大学学报,2015,44(1):64- 67.
[5] Ceccanti M, De Nicolò S, Mancinelli R, et al. NGF and BDNF long- term variations in the thyroid, testis and adrenal glands of a mouse model of fetal alcohol spectrum disorders[J]. Ann Ist Super Sanita, 2013,49(4):383- 390.
[6] Wali Gul Mokhles,金正勇,许春花,等.出生前接触酒精对新生大鼠大脑发育中BDNF和TrkB的影响[J].延边大学医学学报,2013,36(2):83- 87.
[7] Tunc- Ozcan E, Ullmann TM, Shukla PK, et al. Low- dose thyroxine attenuates autism- associated adverse effects of fetal alcohol in male offspring′s social behavior and hippocampal gene expressio[J]. Alcohol Clin Exp Res, 2013,37(11):1986- 1995.
[8] Wilcoxon JS, Kuo AG, Disterhoft JF, et al. Behavioral deficits associated with fetal alcohol exposure are reversed by prenatal thyroid hormone treatment: a role for maternal thyroid hormone deficiency in FAE[J]. Mol Psychiatry, 2005,10(10):961- 971.
[9] Nathaniel EJ, Nathaniel DR, Nathaniel LM, et al. Effect of thyroxine replacement therapy on the growth patterns of body, brain and cerebellum in the neonatal hypothyroid rat[J]. Exp Neurol, 1988,101(1):1- 16.
[10] 钱洁,祝建,张军,等.不同培养基对小鼠小脑浦肯野细胞发育的影响[J].同济大学学报(医学版),2004,25(6):473- 476.
[11] Pandey SC. A critical role of brain- derived neurotrophic factor in alcohol consumption[J]. Biol Psychiatry, 2016,79(6):427- 429.
[12] Friedman WJ, Olson L, Persson H. Cells that express brain- derived neurotrophic factor mRNA in the developnig postnatal rat brain[J]. Eur J Neurosci, 1991,3(7):688- 697.
[13] Huang MC, Chen CH, Chen CH, et al. Alterations of serum brain- derived neurotrophic factor levels in early alcohol withdrawal[J]. Alcohol Alcohol, 2008,43(3):241- 245.
[14] Tapia- Arancibia L, Rage F, Givalois L, et al. Effects of alcohol on brain- derived neurotrophic factor mRNA expression in discrete regions of the rat hippocampus and hypothalamus[J]. J Neurosci Res, 2001,63(2):200- 208.
[15] 金文玉,金福,金昭伶.外源性甲状腺素对孕期持续摄取酒精母鼠新生子鼠大脑发育的影响[J].延边大学医学学报,2015,38(3):164- 167.
10.3969/j.issn.1002- 266X.2017.36.012
R72
A
1002- 266X(2017)36- 0040- 03
2016- 11- 04)
