食管鳞癌组织PI3KCA、PI3KCB表达变化及其与患者临床病理参数的关系
2017-11-16刘海青温菲菲李扬扬高向前张香芝吴淑华1
刘海青,温菲菲,李扬扬,高向前,张香芝,吴淑华1,
(1 滨州医学院,山东滨州256603;2 博兴县中医医院;3 滨州医学院附属医院)
食管鳞癌组织PI3KCA、PI3KCB表达变化及其与患者临床病理参数的关系
刘海青1,2,温菲菲3,李扬扬3,高向前3,张香芝3,吴淑华1,3
(1 滨州医学院,山东滨州256603;2 博兴县中医医院;3 滨州医学院附属医院)
目的探讨磷脂酰肌醇- 3- 激酶催化亚单位α(PI3KCA)、磷脂酰肌醇- 3- 激酶催化亚单位β(PI3KCB)在食管鳞癌发生、发展中的作用。方法选择食管鳞癌组织(鳞癌组织)126例份、低级别食管上皮内瘤变组织(低级别瘤变组织)32例份、高级别食管上皮内瘤变组织(高级别瘤变组织)34例份、正常食管黏膜组织(正常组织)30例份。采用免疫组化法检测各组织PI3KCA、PI3KCB阳性表达率,分析鳞癌组织PI3KCA、PI3KCB阳性表达与患者临床病理参数的关系。采用Spearman相关分析法分析各组织PI3KCA、PI3KCB阳性表达的关系。结果鳞癌组织、高级别瘤变组织PI3KCA、PI3KCB阳性表达率均高于低级别瘤变组织及正常组织(P均<0.05)。低分化、有淋巴结转移、TNM分期高的鳞癌组织中PI3KCA、PI3KCB阳性表达率高于高分化、无淋巴结转移、TNM分期低的鳞癌组织(P均<0.05)。鳞癌组织PI3KCA、PI3KCB阳性表达与患者年龄、性别及肿瘤大小、部位、浸润深度均无相关性(P均>0.05)。鳞癌组织、高级别瘤变组织PI3KCA阳性表达与PI3KCB阳性表达均呈正相关关系(r分别为0.289、0.254,P均<0.05),正常组织、低级别瘤变组织PI3KCA阳性表达与PI3KCB阳性表达无相关性(r分别为0.121、0.145,P均>0.05)。结论食管鳞癌组织PI3KCA、PI3KCB高表达,二者表达变化协同促进食管鳞癌的发生、发展。
食管鳞状细胞癌;上皮内瘤变;磷脂酰肌醇- 3- 激酶催化亚单位α;磷脂酰肌醇- 3- 激酶催化亚单位β
食管癌是消化系统常见的恶性肿瘤,患者5年生存率较低[1]。磷脂酰肌醇- 3- 激酶/蛋白激酶B(PI3K/AKT)信号通路作为细胞内重要的信号转导通路之一,与人类多种肿瘤的发生、发展密切相关,其异常活化在促进正常发育细胞向癌细胞转化过程中发挥重要作用[2~8]。磷脂酰肌醇- 3- 激酶催化亚单位α(PI3KCA)或磷脂酰肌醇- 3- 激酶催化亚单位β(PI3KCB)基因突变可导致其蛋白产物PI3Kp110α和PI3Kp110β表达增多,继而上调PI3K活性,激活PI3K/AKT信号通路,通过影响下游分子表达变化导致细胞代谢紊乱、细胞周期失调等,进而促使细胞癌变。但目前关于PI3KCA、PI3KCB在食管癌发生、发展中作用的相关报道较少。为此,本研究探讨了PI3KCA、PI3KCB在食管鳞癌发生、发展中的作用。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 选择2007年1月~2009年12月滨州医学院附属医院保存的食管鳞癌组织(鳞癌组织)126例份。纳入标准:经组织病理检查确诊;患者临床病理资料完整;患者均首次确诊肿瘤,术前未行放疗或化疗。标本来源患者男86例、女40例,年龄42~74(65.0±3.8)岁;肿瘤直径:<4 cm 72例,≥4 cm 54例;肿瘤部位:颈段+胸上段20例,胸中段+胸下段106例;肿瘤组织分化程度:低分化18例,中分化66例,高分化42例;浸润深度:黏膜及黏膜下层16例,肌层20例,外膜90例;有淋巴结转移68例,无淋巴结转移58例;2009年美国肿瘤研究联合会和国际癌症防治联合会共同制定的肿瘤TNM分期:Ⅰ、Ⅱ期58例,Ⅲ、Ⅳ期68例。另选低级别食管上皮内瘤变组织(低级别瘤变组织)32例份,标本来源患者男20例、女12例,年龄45~64(55.0±4.1)岁;高级别食管上皮内瘤变组织(高级别瘤变组织)34例份,标本来源患者男21例、女13例,年龄47~68(58.0±3.2)岁;正常食管黏膜组织(正常组织)30例份,标本来源人群男19例、女11例,年龄46~70(60.0±4.2)岁。各组织来源者性别、年龄具有可比性。本研究经滨州医学院附属医院医学伦理委员会批准,患者或其家属知情同意。
1.2 PI3KCA、PI3KCB表达检测 采用免疫组化法。将各组标本置于10%甲醛中固定,石蜡包埋,3 μm厚连续切片。石蜡切片常规脱蜡至水,3% H2O2去除内源性过氧化物酶活性,柠檬酸高温高压抗原修复。分别加入1∶150鼠抗人PI3KCA单克隆抗体、1∶250鼠抗人PI3KCB单克隆抗体,4 ℃孵育过夜,PBS冲洗,加入通用型二抗,DAB显色,苏木素复染,脱水透明,封片。用PBS代替一抗作为空白对照,用已知PI3KCA阳性表达的脑组织切片、已知PI3KCB阳性表达的扁桃体组织切片作为阳性对照。以细胞质出现黄色、棕褐色颗粒为PI3KCA、PI3KCB阳性表达。采用双盲法在每张切片上随机观察10个400倍视野,每个视野计数100个细胞,观察细胞染色强度,计数阳性细胞百分比。细胞染色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞百分比:≤5%为0分,>5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。根据细胞染色强度和阳性细胞百分比综合判定阳性表达,二者得分相乘≥4分为阳性表达,<4分为阴性表达。
1.3 统计学方法 采用SPSS20.0统计软件。计数资料比较采用χ2检验。相关性分析采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组织PI3KCA、PI3KCB阳性表达比较 鳞癌组织、高级别瘤变组织PI3KCA与PI3KCB阳性表达率均高于低级别瘤变组织及正常组织(P均<0.05);而鳞癌组织与高级别瘤变组织、正常组织与低级别瘤变组织比较P均>0.05。见表1。
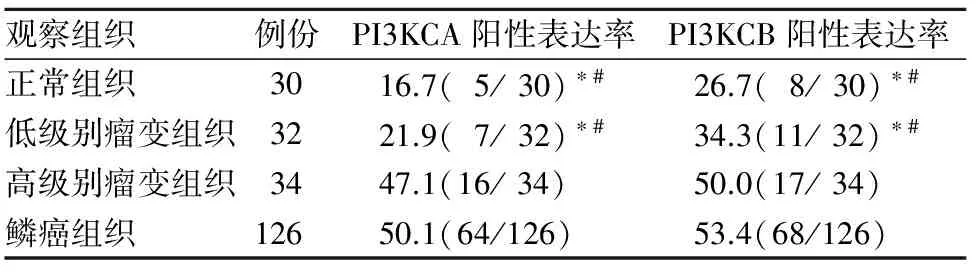
表1 各组织PI3KCA、PI3KCB阳性表达率比较(%)
注:与鳞癌组织比较,*P<0.05;与高级别瘤变组织比较,#P<0.05。
2.2 鳞癌组织PI3KCA、PI3KCB阳性表达与患者临床病理参数的关系 低分化、有淋巴结转移的鳞癌组织中PI3KCA与PI3KCB阳性表达率明显高于高分化、无淋巴结转移的鳞癌组织(P均<0.05)。鳞癌组织PI3KCA、PI3KCB阳性表达与患者年龄、性别及肿瘤大小、部位、浸润深度均无相关性(P均>0.05)。见表2。
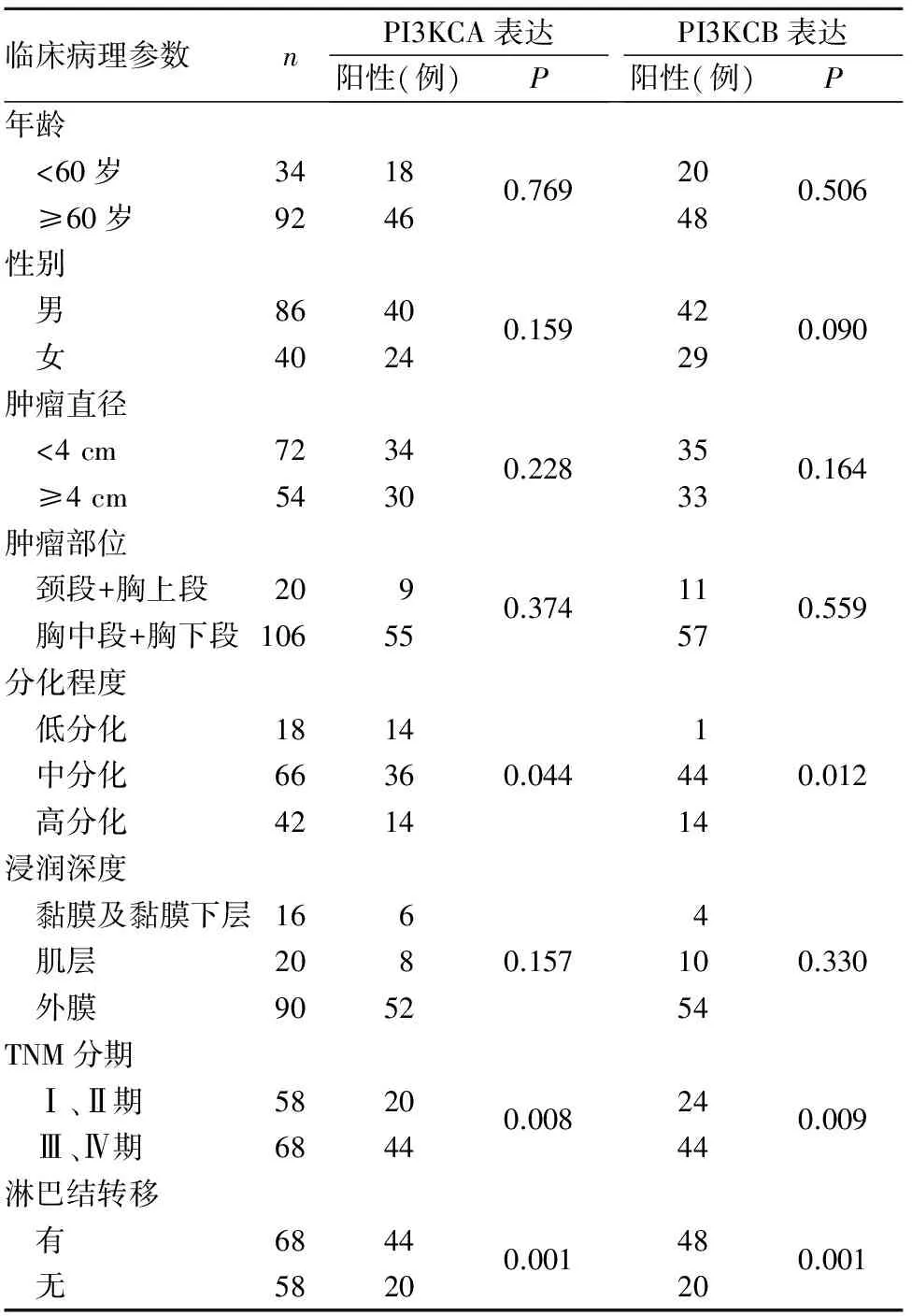
表2 鳞癌组织PI3KCA、PI3KCB阳性表达 与患者临床病理参数的关系
2.3 各组织PI3KCA、PI3KCB阳性表达的关系 鳞癌组织、高级别瘤变组织PI3KCA阳性表达与PI3KCB阳性表达均呈正相关关系(r分别为0.289、0.254,P均<0.05),正常组织、低级别瘤变组织PI3KCA阳性表达与PI3KCB阳性表达均无相关性(r分别为0.121、0.145,P均>0.05)。
3 讨论
PI3K/AKT信号通路作为细胞内重要的信号转导通路之一,与人类多种肿瘤的发生、发展密切相关,其异常活化在促进正常发育细胞向癌细胞转化过程中发挥重要作用。研究表明,在人类多种恶性肿瘤中存在PI3K/AKT信号通路的转导异常[2~8]。PI3Kp110作为PI3K的催化亚基,目前共发现4个成员,分别为p110α、p110β、p110δ和p110γ。PI3KCA编码的p110α、PI3KCB编码的p110β在细胞中广泛存在,正常表达时能够调控DNA合成、促进细胞正常发育,异常表达则与肿瘤的发生、发展密切相关[9,10]。PI3KCA基因突变可导致其蛋白产物PI3Kp110α表达增多,接受细胞外表皮生长因子信号并通过Ras蛋白传递后激活,磷酸化下游AKT蛋白,持续激活PI3K/AKT信号通路,导致细胞过度增殖。目前关于p110β在肿瘤发生、发展中的作用及其机制尚不明确。
绝大多数食管癌来自上皮内瘤变的恶变,即正常黏膜→低级别上皮内瘤变→高级别上皮内瘤变→癌,其中由低级别或高级别上皮内瘤变演变为浸润癌的相对危险度分别为9.8、28.3[11]。Choi等[12]研究发现,PI3Kp110α过表达与宫颈癌的进展呈正相关关系,即PI3Kp110α表达在1、2、3级宫颈上皮内瘤样病变组织及浸润癌组织中的表达逐渐增加。本研究结果显示,在鳞癌组织、高级别瘤变组织中PI3KCA、PI3KCB阳性表达率明显高于低级别瘤变组织和正常组织,提示在食管黏膜病变发展到高级别上皮内瘤变或癌变的过程中存在PI3KCA、PI3KCB表达异常,PI3KCA、PI3KCB表达增加可能是食管鳞癌发生、发展过程中的危险因素之一。本研究鳞癌组织与高级别瘤变组织PI3KCA、PI3KCB阳性表达率比较无明显统计学差异,提示PI3KCA、PI3KCB表达增加发生在癌变的早期阶段,可能是食管癌发生的始动因素之一。因此,深入研究PI3KCA、PI3KCB在食管上皮内瘤变演进到食管癌过程中的作用,对于早期治疗上皮内瘤变、预警食管癌的发生以及防治食管癌具有重要的临床意义[13]。
Soler等[14]研究发现,PI3Kp110α异常表达与肿瘤血管形成有关。在乳腺癌、子宫内膜癌、恶性胶质瘤等恶性肿瘤组织及细胞中均存在PI3Kp110β高表达[15~18]。Liu等[19]报道,通过特异性靶向shRNA(短发夹状RNA)干扰PI3Kp110β基因导致PI3Kp110β表达下调可抑制结肠癌细胞增殖,并诱导细胞凋亡、阻滞细胞周期。Jeong等[20]通过干扰RNA沉默PI3Kp110β基因促进PTX介导的细胞凋亡,降低细胞增殖活性。本研究结果显示,PI3KCA、PI3KCB阳性表达与食管鳞癌患者年龄、性别及肿瘤大小、部位、浸润深度等均无相关性;而与肿瘤组织分化程度、淋巴结转移相关,即分化程度低、发生淋巴结转移的食管鳞癌组织PI3KCA、PI3KCB阳性表达率明显高于分化程度高、未发生淋巴结转移的食管鳞癌组织,提示PI3KCA、PI3KCB阳性表达升高与食管鳞癌的恶性潜能相关。
近年来,PI3K在肿瘤中所起的作用逐渐成为研究热点。但在同一组织中PI3KCA、PI3KCB表达的关系尚不明确。孟晓等[21]研究发现,在管状腺瘤低级别上皮内瘤变组织中PI3Kp110α和PI3Kp110β表达呈正相关关系,在癌组织及管状腺瘤高级别上皮内瘤变组织、正常黏膜组织中二者表达无相关性。本研究结果显示,在高级别瘤变组织及鳞癌组织中PI3KCA阳性表达与PI3KCB阳性表达呈正相关关系,在低级别瘤变组织及正常组织中二者阳性表达无相关性。提示在食管癌的发生、发展过程中,PI3KCA、PI3KCB表达增加可能协同促进细胞增殖及细胞异型程度进展。
综上所述,食管鳞癌组织PI3KCA、PI3KCB高表达,二者表达变化协同促进食管鳞癌的发生、发展。
[1] Napier KJ, Scheerer M, Misra S. Esophageal cancer: a review of epidemiology, pathogenesis, staging workup and treatment modalities[J]. World J Gastrointest Oncol, 2014(6):112- 120.
[2] De Laurentiis A, Pardo OE, Palamidessi A, et al. The catalytic class I(A) PI3K isoforms play divergent roles in breast cancer cell migration[J]. Cell Signal, 2011,23(3):529- 541.
[3] Lee SH, Poulogiannis G, Pyne S, et al. A constitutively activated form of the p110beta isoform of PI3- kinase induces prostatic intraepithelial neoplasia in mice[J]. Proc Natl Acad Sci U S A, 2010,107(24):11002- 11007.
[4] 李龙,姜晨,罗文全,等.PI3K信号通路激活对卵巢癌转移耐药的影响[J].山东医药,2013,53(38):93- 95.
[5] Baba Y, Nosho K, Shima K, et al. Phosphorylated AKT expression is associated with PI3KCA mutation, low stage, and favorable outcome in 717 colorectal cancers[J]. Cancer, 2011,117(7):1399- 408.
[6] De Marco C, Rinaldo N, Bruni P, et al. Multiple genetic alterations within the PI3K pathway are responsible for AKT activation in patients with ovarian carcinoma[J]. PLoS One, 2013,8(2):e55362.
[7] 张凌云,曲秀娟,刘云鹏,等.PI3K/AKT信号通路在RANKL诱导的SGC- 7901胃癌细胞迁移中的作用[J].山东医药,2012,52(8):52- 54.
[8] Weigelt B, Warne PH, Lambros MB, et al. PI3K pathway dependencies in endometrioid endometrial cancer cell lines[J]. Clin Cancer Res, 2013,19(13):3533- 3544.
[9] Xing M. Recent advances in molecular biology of thyroid cancer and their clinical implications[J]. Otolaryngol Clin North Am, 2008,41(6):1135- 1146.
[10] Yuan TL, Cantley LC. PI3K pathway alterations in cancer: variations on a theme[J]. Oncogene, 2008, 27(41):5497- 5510.
[11] Wang GQ, Abnet CC, Shen Q, et al. Histological precursors of oesophageal squamous cell carcinoma: results from a 13 year prospective follow up study in a high risk population[J]. Gut, 2005,54(2):187- 192.
[12] Choi SK, Hong YO, Lee WM, et al. Overexpression of PI3K- p110α in the progression of uterine cervical neoplasia and its correlation with pAkt and DJ- 1[J]. Eur J Gynaecol Oncol, 2015,36(4):389- 393.
[13] Vanhaesebroeck B, Whitehead MA, Pineiro R. Molecules in medicine mini- review: isoforms of PI3K in biology and disease[J]. J Mol Med (Berl), 2016,94(1):5- 11.
[14] Soler A, Serra H, Pearce W, et al. Inhibition of the p110α isoform of PI3- kinase stimulates nonfunctional tumor angiogenesis[J]. J Exp Med, 2013,210(10):1937- 1945.
[15] Janku F, Tsimberidou AM, Garrido- Laguna I, et al. PI3KCA mutations in patients with advanced cancers treated with PI3K/AKT/mTOR axis inhibitors[J]. Mol Cancer Ther, 2011,10(3):558- 565.
[16] Utermark T, Rao T, Cheng H, et al. The p110α and p110β isoforms of PI3K play divergent roles in mammary gland development and tumorigenesis[J]. Genes Dev, 2012,26(14):1573- 1586.
[17] Zhu Q, Youn H, Tang J, et al. Phosphoinositide 3- OH kinase p85alpha and p110beta are essential for androgen receptor transactivation and tumor progression in prostate cancers[J]. Oncogene, 2008,27(33):4569- 4579.
[18] 高向前,吴淑华.结直肠癌组织中PI3KCB蛋白表达及其与多药耐药基因产物的相关性[J].山东医药,2012,52(14):7- 9.
[19] Liu W, Wang G, Cao X, et al. Down- regulation of p110β expression increases chemosensitivity of colon cancer cell lines to oxaliplatin[J]. J Huazhong Univ Sci Technolog Med Sci, 2012,32(2):280- 286.
[20] Jeong JY, Kim KS, Moon JS, et al. Targeted inhibition of phosphatidyl inositol- 3- kinase p110β, but not p110α, enhances apoptosis and sensitivity to paclitaxel in chemoresistant ovarian cancers[J]. Apoptosis, 2013,18(4):509- 520.
[21] 孟晓,吴淑华,李杨扬,等.PI3Kp110不同亚单位在结直肠癌腺瘤癌变中的表达及相关性[J].世界华人消化杂志,2013,21(8):661- 666.
ExpressionchangesofPI3KCAandPI3KCBinesophagealsquamouscellcarcinomaanditsrelationshipwithclinicopathologicalparametersofpatients
LIUHaiqing1,WENFeifei,LIYangyang,GAOXiangqian,ZHANGXiangzhi,WUShuhua
(1BinzhouMedicalUniversity,Binzhou256603,China)
ObjectiveTo investigate the role of PI3KCA and PI3KCB protein in the occurrence and development of esophageal squamous cell carcinoma.MethodsTotally 126 cases of esophageal squamous cell carcinoma tissues, 32 cases of high- grade intraepithelial neoplasia (HGIN) tissues, 34 cases of low- grade intraepithelial neoplasia (LGIN) tissues, and 30 cases of normal esophageal mucosa were collected. The positive expression rate of PI3KCA and PI3KCB were detected by immunohistochemistry. The correlations between PI3KCA and PI3KCB expression and the patients’ clinicopathological features were analyzed in esophageal carcinoma. Spearman analysis was used to analyze the correlations between PI3KCA and PI3KCB in the four groups.ResultsThe expression of PI3KCA and PI3KCB in the esophageal squamous cell carcinoma tissues and HGIN tissues was significantly higher than that in the normal esophageal mucosa and LGIN tissues (bothP<0.05). The expression of PI3KCA and PI3KCB was higher in patients with low degree of tumor differentiation, high TNM stage and lymph node metastasis than in patients with high degree of tumor differentiation, low TNM stage and without lymph node metastasis (bothP<0.05). Other characteristics, such as age, gender, tumor size, tumor site and depth of invasion were not associated with PI3KCA and PI3KCB expression levels (allP>0.05). The expression of PI3KCA was positively correlated with PI3KCB in HGIN tissues and esophageal squamous cell carcinoma tissues (r=0.289, 0.254, bothP<0.05), whereas no correlation was found between PI3KCA and PI3KCB expression between LGIN tissues and normal esophageal mucosa (r=0.121, 0.145, bothP>0.05).ConclusionBoth PI3KCA and PI3KCB are highly expressed in the esophageal squamous cell carcinoma, and the increased expression of PI3KCA and PI3KCB synergistically promotes the the occurrence and development of esophageal squamous cell carcinoma.
esophageal squamous cell carcinoma; intraepithelial neoplasia; PI3KCA; PI3KCB
山东省科技发展计划项目(2010GSF10259)。
刘海青(1985- ),女,住院医师,主要研究方向为食管癌的发病机制。E- mail: boxingliuhaiqing@163.com
吴淑华(1961- ),女,教授,硕士研究生导师,主要研究方向为肿瘤的病理生理机制。E- mail: wsh6108@126.com
10.3969/j.issn.1002- 266X.2017.36.004
R735.1
A
1002- 266X(2017)36- 0013- 04
2016- 12- 12)
·作者·编者·读者·
《山东医药》关于摘要与关键词的说明
论著需附中、英文摘要(包括目的、方法、结果、结论四部分)。中文摘要300~500字,英文摘要400~500个实词。英文摘要尚应包括文题、作者姓名(汉语拼音)。论著、基础研究、临床研究、综述与讲座需标引关键词2~5个,尽量使用美国国立医学图书馆编辑的最新版《Index Medicus》中医学主题词表(MeSH)所列的词。英文关键词中的缩写词应按MeSH还原为全称。
