姜曲海猪肌肉FoxO1基因表达水平与组织学特性的相关研究
2017-11-16朱淑斌赵旭庭倪黎纲周春宝
朱淑斌,赵旭庭,倪黎纲,徐 盼,陶 勇,庄 勋,周春宝*
(1.江苏农牧科技职业学院,江苏 泰州 225300;2.姜曲海猪保种场,江苏 泰州 225300)
姜曲海猪肌肉FoxO1基因表达水平与组织学特性的相关研究
朱淑斌1,赵旭庭1,倪黎纲1,徐 盼1,陶 勇1,庄 勋2,周春宝1*
(1.江苏农牧科技职业学院,江苏 泰州 225300;2.姜曲海猪保种场,江苏 泰州 225300)
【目的】探究姜曲海猪不同部位肌肉FoxO1基因mRNA的发育变化规律,结合屠宰试验分析FoxO1基因mRNA表达水平对肌肉组织学特性的影响。【方法】选取初生、1、2、4、6、8月龄姜曲海猪各5只,屠宰后取背最长肌、比目鱼肌、腓肠肌和半腱肌检测肌原纤维直径,用荧光实时定量PCR法检测姜曲海猪不同部位肌肉FoxO1基因mRNA表达水平,分析其在不同时期的变化及其与肌肉肌原纤维直径的关系。【结果】①随月龄增加,背最长肌、比目鱼肌、半腱肌和腓肠肌的肌原纤维直径变化规律基本一致,从出生到1月龄,生长速度最快,2月龄后逐渐趋于稳定。②姜曲海猪不同肌肉部位FoxO1基因mRNA表达的发育性变化模式不同,具有组织特异性,背最长肌和半腱肌FoxO1基因的表达量总体呈现下降—上升—下降趋势,比目鱼肌和腓肠肌FoxO1基因的表达量总体呈现上升—下降—上升。③姜曲海猪不同肌肉部位基因的表达量与肌原纤维直径相关分析表明,FoxO1基因的表达量与不同年龄时背最长肌、比目鱼肌、半腱肌和腓肠肌无显著相关性(P>0.05)。【结论】姜曲海猪不同部位肌肉肌原纤维生长发育变化基本相同;不同部位肌肉FoxO1基因表达模式不同;同月龄FoxO1基因的表达量在不同部位肌肉中表达量显著不同。FoxO1基因的表达量与不同部位肌肉肌原纤维生长发育无显著性相关。
姜曲海猪;骨骼肌;FoxO1基因;组织学特性
【研究意义】随着人民生活水平的不断提高,对猪肉品质提出了更高的要求。姜曲海猪是中国特有的宝贵地方品种,因其肉质细腻、香味浓郁而备受消费者的青睐,是养猪业中生产优质猪肉较好的素材。在肉品质研究中表明,肌纤维性状对猪肌肉的生长发育和肉品质特性有着十分重要的影响[1]。由于组织学性状只有动物屠宰才能检测,耗费大量人力物力和财力,因此,用DNA标记辅助选择(MAS)对提高猪肉品质是十分有意义的[2]。【前人研究进展】猪的肉质性状是由微效多基因调控,受多个主效基因和候选基因调控[3]。肌肉组织主要是由肌纤维、结缔组织和肌内脂肪组成[4],骨骼肌最基本的结构是肌纤维,因此肌纤维特性对肉的品质有十分重要影响[5]。近年来多项研究均发现叉头转录因子FoxO1基因在肌细胞分化和肌肉的形成中具有重要作用[6-7],并且FoxO1基因在调控时与MSTN和MyoD基因之间存在着相互关系,FoxO1基因在这个信号传导通路中起着重要的介导作用[8-10]。FoxO家族是INS/IGF-1(Insulin/Insulin-like Growth Factor 1)信号通路中的关键转录调控因子,FoxO1是FoxO家族中发现最早的成员,FoxO1基因在进化上高度保守,目前,该基因定位于猪的11号染色体,其氨基酸序列中含有3个高度保守的蛋白激酶B(PKB)磷酸化基因序列,受PI3K/PKB磷酸化级联通路的调节,FoxO1的活性与磷酸化状态直接相关[11-12],其与成肌细胞分化及脂肪细胞代谢有很大关联,FoxO1作为潜在因子与骨骼肌的分化以及成肌细胞分化中的肌管形成有重要关系[13-15],且与Ⅰ型(TypeⅠ)和Ⅱb型(TypeⅡb)肌纤维基因的表达关系密切[16]。杨燕军研究了不同经济类型猪品种骨骼肌中,同一品种不同肌纤维类型FoxO1基因mRNA的表达丰度都存在显著差异[17]。王玲报道了牛FoxO1基因单倍型组合对肌肉的剪切力、肌纤维直径和肌纤维密度的遗传效应达到显著水平[18]。因此,FoxO1基因可能是影响肌纤维特性的遗传标记。【本研究切入点】目前FoxO1基因研究主要集中在人和啮齿类动物上,在家畜上的研究较少,仅在猪和牛上有少量报道。在猪上尚未见到有关FoxO1基因表达与肌肉组织性特性相关性研究报道。【拟解决的关键问题】本试验利用荧光实时定量PCR技术,检测姜曲海猪不同部位肌肉FoxO1基因表达的发育性变化,结合屠宰试验分析FoxO1基因表达水平对肌肉组织特性的影响,探讨FoxO1的功能及作用机理提供理论依据,进而筛选出FoxO1作为猪肉肉质性状的侯选基因提供理论基础,为姜曲海猪资源利用和开发提供参考。
1 材料与方法
1.1 试验材料
选择姜曲海猪30只(姜曲海种猪场),其中0、1、2、4、6、8月龄各5只,屠宰后取背最长肌、比目鱼肌、腓肠肌、半腱肌不同部位肌肉组织,样品保存于-70 ℃,用于提取组织RNA;不同肌肉部位取5 mm3肉样,置于2.5 %戊二醛液固定,4 ℃下保存,以备制片。
1.2 试验方法
1.2.1 组织学特性 将固定在2.5 %的戊二醛溶液中的组织块进行修成1 mm3大小,置于2.5 %戊二醛溶液中继续固定,经PBS冲洗后,用锇酸固定,梯度乙醇脱水,经包埋聚合进行超薄切片,经醋酸铀和柠檬酸铅双染色,进行透射电镜观察,测定肌原纤维直径。
1.2.2 引物合成 根据NCBI公布的猪FoxO1基因的cDNA序列(NM_214014.2),采用Primer premier 5.0和Oligo6.0软件设计目的基因引物,F:5′-TACCCACCCTCGGCGGCA-3′,R:ATGGTGCCTGGTGAAGACTG,产物预期长度152 bp,退化温度60℃;β-actin,F:5′-ACACGGTGCCCATCTACGAG-3′,R:5′-GCTTCTCCTTGATGTCCCGC-3′,产物预期长度165 bp,退化温度60 ℃。引物由上海生工合成。
1.2.3 组织总RNA提取、反转录 用RNA提取试剂盒提取总RNA,使用RNA纯化试剂盒进行RNA纯化。具体操作按试剂盒要求完成,反转录产物储存在-20 ℃。
1.2.4 实时荧光定量PCR和标准曲线的制作 利用SYBR PrimeScriptTMRT-PCR Kit进行二步法实时荧光定量PCR检测,每个样品3个重复。在LC-480Ⅱ型荧光定量PCR仪上进行扩增。
取表达目的基因的总RNA为模板合成cDNA作为标准品,进行梯度稀释,稀释后样品作模板,分别用目的基因引物和内参基因引物进行扩增。同时在60~95 ℃进行融解曲线分析,并绘制目的基因和内参基因的标准曲线。
1.3 统计分析
结果均用平均值±标准差表示。不同生长时期肌肉组织特性、基因表达量的差异和同一生长期不同肌肉部位基因表达量的差异用SPSS13.0软件包中的ANOVA进行分析,基因的表达量与肌肉组织学指标进行相关分析。
2 结果与分析
2.1 姜曲海猪不同肌肉部位组织学特性
图1表明,姜曲海猪背最长肌、比目鱼肌、半腱肌和腓肠肌的肌原纤维直径变化规律基本一致,从出生到1月龄,生长速度最快,2月龄后逐渐趋于稳定,4月龄后各部位肌原纤维直径变化不大。由此可见,姜曲海猪在胚胎期粗细肌丝未分化发育完善,从初生至1月龄期间是迅速分化、发育的重要时期。
2.2 姜曲海猪肌肉FoxO1基因mRNA表达水平的发育性变化
从图2可见,每条标准曲线的R2都达到0.99,因此可采用本方法和上述引物进行后续试验分析。
用RT-PCR法对姜曲海猪0、1、2、4、6和8月龄时4个不同部位肌肉的FoxO1基因mRNA表达量(图3)进行分析,结果(图4)显示,姜曲海猪不同肌肉部位FoxO1基因mRNA表达的发育性变化模式不同,姜曲海猪背最长肌该基因的表达量6月龄时达到最高,与其它各月龄相比均差异显著(P<0.05),总体呈现先下降—上升—下降趋势,2月龄最低,8月龄时有所回升;比目鱼肌该基因表达量1月龄时有明显的上升,达到最高值,除8月龄以外,与其余各月龄相比差异显著(P<0.05),然后开始下降,4月龄表达量达到最低,总体趋势与背最长肌相反,即先上升—下降—上升;半腱肌该基因表达量,总体趋势与背最长肌相同,出生后到2月龄,呈下降趋势,但幅度不大,差异不显著,2月龄到6月龄,呈上升趋势,6月龄表达量与初生时相近,与1月龄和2月龄差异显著(P<0.05),6月龄后表达量下降;腓肠肌该基因表达量,1月龄最高,与其它各月龄均差异显著(P<0.05),基因表达量总体呈现上升—下降—上升—下降。同一月龄不同部位肌肉FoxO1基因mRNA表达量分析发现:出生时该基因背最长肌表达量显著高于比目鱼肌、半腱肌和腓肠肌(P<0.05);1月龄时半腱肌显著低于背最长肌、比目鱼肌和腓肠肌(P<0.05);2月龄时腓肠肌表达量最高,与背最长肌和半腱肌差异显著(P<0.05),与比目鱼肌差异不显著;4月龄时半腱肌显著高于背最长肌和比目鱼肌(P<0.05),与腓肠肌差异不显著;6月龄时背最长肌显著高于比目鱼肌、半腱肌和腓肠肌(P<0.05);8月龄时比目鱼肌显著高于背最长肌、半腱肌和腓肠肌(P<0.05)。
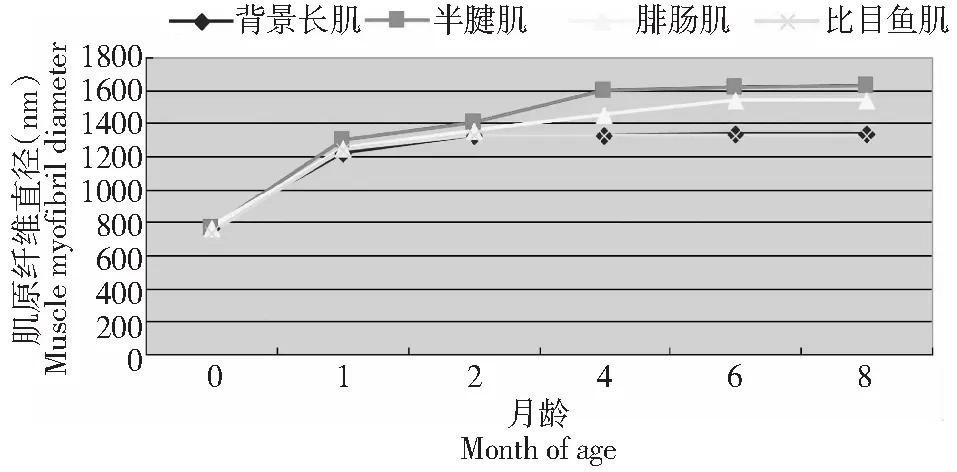
图1 姜曲海猪不同肌肉部位肌原纤维直径的发育性变化Fig.1 Developmental changes of myofibril diameter in different anatomical muscles of Jiangquhai swine
A:FoxO1基因标准曲线;B:FoxO1基因溶解曲线;C:内参基因标准曲线; D:内参基因溶解曲线A:Standard curve of FoxO1 gene;B:Melting curve of FoxO1 gene;C:Standard curve of β-actin gene; D:Melting curve of β-actin gene图2 FoxO1、β-actin的标准曲线和熔解曲线Fig.2 The standard and melting curve of FoxO1 and β-actin genes
A:FoxO1基因实时扩增曲线;B:内参基因实时扩增曲线;C:FoxO1基因扩增产物溶解曲线; D:内参基因扩增产物溶解曲线A:The amplification curve of FoxO1 gene;B:The amplification curve of β-actin gene;C:The melting curve of FoxO1 gene; D:The melting curve of β-actin gene图3 FoxO1、β-actin实时扩增曲线图和扩增产物溶解曲线Fig.3 The amplification and melting curve of FoxO1 and β-actin genes
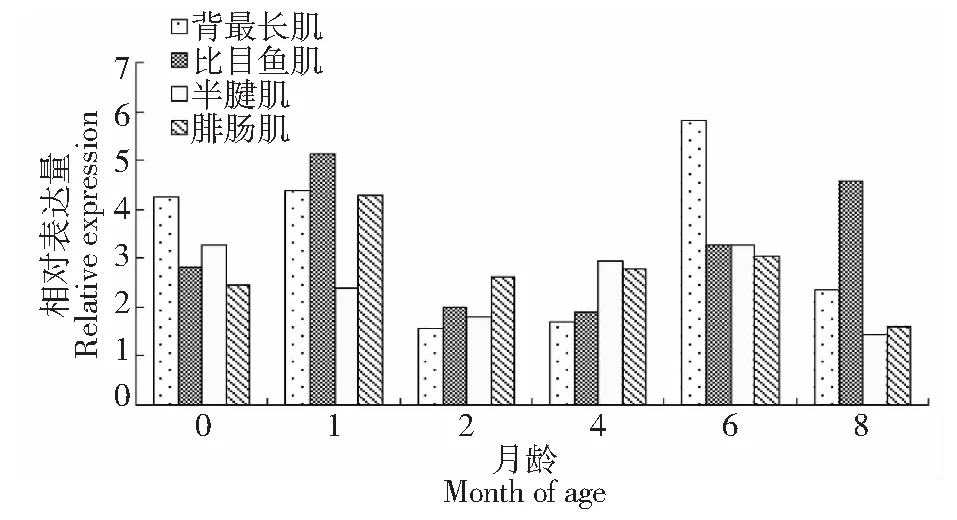
图4 姜曲海猪肌肉FoxO1基因表达的发育性变化Fig.4 Developmental changes of muscle FoxO1 mRNA expression in Jiangquhai swine
2.3 姜曲海猪不同肌肉组织FoxO1基因表达水平与肌纤维发育的相关性
对姜曲海猪肌肉不同部位FoxO1基因的表达量与肌原纤维直径的相关分析(表1)表明,FoxO1基因的表达量与不同年龄时背最长肌、比目鱼肌、半腱肌和腓肠肌有相关性,从初生到8月龄,相关系数均未达到显著水平。但从猪初生到1月龄期间是肌纤维迅速分化、发育的重要时期。在这个时期内,比目鱼肌和腓肠肌中FoxO1基因的表达量与肌原纤维直径呈显著正相关,而在背最长肌和半腱肌中FoxO1基因的表达量与FoxO1基因的表达量呈负相关,由此可见,FoxO1基因在不同部位肌肉调控发育分化方式是不同的。
3 讨 论
大量研究表明,FoxO1在成肌细胞分化中起关键作用。Hribal等[19]报道了过量表达FoxO1抑制成肌细胞分化为肌管,相反,显性失活FoxO1能部分恢复C2C12细胞的分化抑制,通过siRNA抑制FoxO1的表达来增加肌浆球蛋白的表达,结果有利于肌细胞分化。Bois等[20]研究表明,在鼠中,FoxO1在成肌细胞分化中调控肌管融合的速率,原因是增强FoxO1显性失活突变体的基因表达阻止肌管形成,而FoxO1野生型的无此作用。Allen等[21-22]研究报道了对大鼠、小鼠和细胞系的研究结果,FoxO1可能作为潜在因子通过抑制MyoD表达来阻止骨骼肌分化。本试验发现,FoxO1基因mRNA表达的发育性变化在姜曲海猪肌肉中有明显的组织差异性,且在姜曲海猪肌肉发育过程中FoxO1基因mRNA表达模式不同,在背最长肌和半腱肌中呈先下降后上升再下降趋势,而在腓肠肌和比目鱼肌中呈先上升后下降趋势;同月龄FoxO1基因的表达量在背最长肌、比目鱼肌、半腱肌和腓肠肌中表达量显著不同,原因可能因为不同位置骨骼肌机能不同,活动强度也有很大差异,与杨燕军[17]研究结果一致,其机理可能是FoxO1基因通过影响MyoD基因mRNA表达途径,进而调控骨骼肌的发育。表明FoxO1基因可能是影响猪肌肉生长发育的候选基因,且该基因可能对特定类型肌纤维发育有一定的积极调控作用,与FoxO1基因的生理作用一致。

表1 姜曲海猪不同肌肉部位FoxO1基因的表达水平与肌原纤维直径的相关性分析
大多数陆栖脊椎动物的肌纤维数目在出生前就已确定,如猪在胚胎期90 d肌纤维的数目就已不再发生变化,基本趋于稳定[23],因此动物出生后肌肉的生长发育实际是肌原纤维的分化及发育。骨骼肌是由混杂的肌纤维组成[24]。肌纤维类型的种类和超微结构的不同决定了肌肉不同的代谢和生理学功能[25]。根据形态学和功能方面的差异,骨骼肌纤维可分红肌(I型)、白肌(II型)和中间肌[26]。本研究中取肌肉样时考虑到不同肌肉组织中各肌纤维组成比例有很大差异,选择有代表性的:比目鱼肌属于慢红肌纤维类型;而腓肠肌和背最长肌则红肌纤维和白肌纤维基本相当[27];半腱肌属于快白肌类型。研究结果表明,FoxO1基因在不同肌肉中表达量存在较大差异,提示FoxO1基因调控其中某一类型肌纤维的分化,在姜曲海猪初生的第一个月是肌肉分化、发育最重要时期,在比目鱼肌和腓肠肌中1月龄时FoxO1基因表达量与初生相比显著升高,而背最长肌变化不大,因比目鱼肌以红肌为主,说明FoxO1基因调控红肌生长发育,与杨燕军[17]研究结果一致。肌肉组织中肌纤维类型的组成并非一成不变,肌纤维类型转化是所有猪种的种质特性,由于遗传因素的影响,猪种间只有量的差异,而无质的区别[28],转化的次序为慢肌→快红肌→中间型快肌→快白肌[29-30],形态上呈现出肌纤维肥大(纤维直径增大)的变化。猪肉肌纤维类型与生理动态转化平衡有关。这种转化的动态平衡受机体生长阶段和肌肉运动方式的多种因素影响。本研究中发现FoxO1基因表达在肌肉生长发育后期无明显规律,可能与不同肌肉肌纤维转化有关。
本文仅在转录水平上研究了姜曲海猪FoxO1基因的发育性变化对肌肉组织学特性的影响,而未在蛋白质水平上研究其发育性变化对肌肉组织学特性的影响。FoxO1基因mRNA表达的发育性变化在姜曲海猪不同肌肉中有明显的组织差异性,但无较明显的规律。FoxO1基因mRNA水平和肌原纤维直径存在相关,可能是因为姜曲海猪肌肉FoxO1的调控作用不是发生在mRNA水平上,而有可能在翻译后的蛋白质水平上。FoxO1基因在蛋白质水平上对肌肉组织学特性的影响情况还需进一步研究。
4 结 论
姜曲海猪不同部位肌肉肌原纤维生长发育变化基本相同。不同部位肌肉FoxO1基因表达模式不同,背最长肌和半腱肌FoxO1基因的表达量总体呈现下降—上升—下降趋势,比目鱼肌和腓肠肌FoxO1基因的表达量总体呈现上升—下降—上升。同月龄FoxO1基因的表达量在背最长肌、比目鱼肌、半腱肌和腓肠肌中表达量显著不同。FoxO1基因的表达量与不同年龄时背最长肌、比目鱼肌、半腱肌和腓肠肌肌原纤维有相关性,相关系数均未达到显著水平。FoxO1基因调控肌肉生长发育,调控的分子机制有待于进一步研究。
[1]高儒松,程志斌,杨正华. 肌纤维类型与猪肉品质的关系[J].中国畜牧兽医,2009(4):191-195.
[2]Meuwissen T H E, Goddard M E. The use of marker haplotypes in animal breeding schemes[J].Geneticts Selection Evolution,1996,28(2):161-176.
[3]Wood J D, Richardson R I, Nute G R, et al.Effects of fatty acids on meat quality:a review[J].Meat Science,2003,66:21-32.
[4]高儒松,张春霞,赵红艳. 肌肉组织学特性与肉品质的关系[J].肉类研究,2009(5):11-15.
[5]陈 璐,金邦荃,刘兴余,等. 猪骨骼肌组织学特性与猪肉嫩度关系的研究[J]. 食品科学,2009(1):11-14.
[6]Allen D L,Unterman T G.Regulation of myostatin expression and myoblast differentiation by FoxO and SMAD transcription factors[J].Physiol Cell Physiol,2007,292(1):C188-199.
[7]Kamei Y,Miura S,Suzuki M,et al.Skeletal muscleFoxO1(FKHR)-transgenic mice have less skeletal muscle mass,down-regulated type I(slow twitch/red muscle)fiber genes,and impaired glycemic control[J].J Biol Chem,2004,279:41114-41123.
[8]Siriett V,Nicholas G,Berry C,et al.Myostatin negatively regulates the expression of the steroid receptor co-factor ARA70[J].Cell.Physiol.,2006,206(1):255-263.
[9]Allen D L,Unterman T G.Regulation of myostatin expression and myoblast differentiation by FoxO and SMAD transcription factors[J].Physiol Cell Physiol,2007,292(1):C188-199.
[10]McFarlane C,Plummer E,Thomas M,et al.Myostatin induces cachexia by activating the ubiquitin proteolytic system through an NF-kappaB-independent,FoxO1-dependent mechanism[J].Cell.Physiol.,2006,209(2):501-514.
[11]Tsai K L,Sun Y J,Huang C Y,et al.Crystal structure of the human FOXO3a-DBD/DNA complex suggests the effects of post-translational modification[J].Nucleic Acids Res,2007,35:6894-6994.
[12]Kops G J,Burgering B M.Forkhead transcription factors:new insights into protein kinase B(c-akt) signaling[J].Mol.Med,1999,77:656-665.
[13]Nakae J,Kitamura T,Kitamura Y,et al.The forkhead transcription factorFoxO1 regulates adipocyte differentiation[J].Dev Cell,2003,4(1):119-129.
[14]Brunet A,Sweeney L B,Sturgill J F,et al.Stress-dependent regulation of FOXO transcription factors by the SIRT1 deacetylase[J].Science,2004,303(5 666):2011-2015.
[15]Hribal M L,Nakae J,Kitamura T,et al.Regulation of insulin-like growth factor-dependent myoblast differentiation by Foxo forkhead transcription factors[J].The Journal of Cell Biology,2003,162(4):535-541.
[16]Kamei Y, Miura S, Suzuki M,et al. Skeletal muscleFoxO1(FKHR)-transgenic mice have less skeletal muscle mass,down-regulated type I(slow twitch/red muscle)fiber genes,and impaired glycemic control[J].J Biol Chem,2004,279:41114-41123.
[17]杨燕军. 猪FoxO1基因cDNA的克隆及其组织表达研究[M].杨陵:西北农林科技大学,2007.
[18]王 玲. 普通牛FoxOI、FoxO3、FoxO4基因的克隆、表达及其对一肉质性状的遗传效应分析[D].成都:四川农业大学,2010.
[19]Hribal M L, Nakae J, Kitamura T,et al. Regulation of insulin-like growth factor-dependent myoblast differentiation by Foxo forkhead transcription factors[J].The Journal of Cell Biology,2003,162(4):535-541.
[20]Bois P R J,Brochard V F,Salin-Cantegrel A V A,et al.FoxO1a-cyclic GMP-dependent kinase I interactions orchestrate myoblast fusion[J].Mol Cell Biol,2005,25:7645-7656.
[21]Allen D L,Unterman T G. Regulation of myostatin expression and myoblast differentiation by FoxO and SMAD transcription factors[J].Physiol Cell Physiol,2007,292(1):C188-199.
[22]McFarlane C, Plummer E, Thomas M,et al. Myostatin induces cachexia by activating the ubiquitin proteolytic system through an NF-kappaB-independent,FoxO1-dependent mechanism[J].Cell.Physiol.,2006,209(2):501-514.
[23]PICARD B, LEFAUCHEUR L, BERRI C, et al. Muscle fibre ontogenesis in farm animal species[J]. Reprod Nutr Dev,2002,42:415-431.
[24]Karlsson A H,Klont R E,Fernandez X. Skeletal muscle fibres as factors for pork quality[J].Livestock Production Science,1999,60(2):255-269.
[25]Pette D. Plasticity in skeletal,cardiac,and smooth muscle:historical perspectives: plasticity of Mammalian skeletal muscle[J].Journal of Applied Physiology, 2001,90(3):1119-1124.
[26]Suzuki A, Goll D E, Stromer M H, et al.[alpha]-Actinin from red and white porcine muscle[J].Biochimica et Biophysica Aeta(BBA)-Protein Structure,1973,295(1):188-207.
[27]Maltin C A, Delday M I, Baillie A G,et al. Fiber-type composition of nine rat muscle.I.changes during the first year of life[J].Physiol Endocrinol Metab,1989,257: 823-827.
[28]胡来根,潘锡桂,蒋达明.猪肌纤维类型转化规律的研究[J].河南农业科学, 1999, (3): 28-31.
[29]ASHMORE C R, DOERR L, FOSTER G, et a.l. MEAT SCIENCE: Respiration of Mitochondria Isolated from Dark-Cutting Beef [ J]. Journal of Animal Sci-ence, 1971, 33(3): 574-577.
[30]LEFAUCHEUR L, ECOLAN P, PLANTARD L, et a.l. New insights into muscle fiber types in the pig [J]. Journal of Histochemistry and Cytochemistry,2002, 50 (5): 719-730.
AssociationofFoxO1GeneExpressionwithHistologicalCharacteristicsinJiangquhaiSwineMuscles
ZHU Shu-bin1,ZHAO Xu-ting1, NI Li-gang1,XU Qan1, TAO Yong1,ZHUANG Xun2, ZHOU Chun-bao1*
(1. Jiangsu Animal Husbandry and Veterinary College, Jiangsu Taizhou 225300,China; 2.Mational Jiangquhai Pig Breed Conservation Farm, Jiangsu Taizhou 225300,China )
【Objective】The objectives of this study were to investigate the developmental changes of the Forkhead box O1(FoxO1) mRNA level in different parts of muscles in Jiangquhai Swine and its effect on muscle histological characteristics. 【Method】Jiangquhai Swine at 0,1,2,4,6,8 months age were selected to investigate the developmental changes ofFoxO1 mRNA expression and its effect on myofibril diameter in four different parts of muscles. Five animals were slaughtered to collect samples from longissimus dorsi muscle, soleus muscle, gastrocnemius muscle and semitendinosus muscle. for the purpose of determining the muscle myofibril diameter and extracting total RNA in order to investigate the developmental changes of theFoxO1 mRNA expression by real-time PCR. 【Result】With growing, myofibril diameter developed with the same law among longissimus dorsi muscle, soleus muscle, gastrocnemius muscle and semitendinosus muscle.They growed fastest in the first month, it gradually stabilized after 2 month.FoxO1 mRNA expression level was different in different parts of muscles in Jiangquhai swine and has tissues-dependent. In longissimus dorsi muscle and gastrocnemius muscleFoxO1 mRNA expression level was declined in the two month ,then increased slowly and declined with growing; Soleus muscle and semitendinosus muscleFoxO1 mRNA expression level presented increasing-decreasing-increasing with growing;FoxO1 mRNA expression level in longissimus dorsi muscle, soleus muscle, gastrocnemius muscle and semitendinosus muscle were related to myofibril diameters(P>0.05). 【Conclusion】Myofibril diameter developed with the same law in different parts of muscles in Jiangquhai swine;FoxO1 mRNA expression level was different in different parts of muscles;In the same monthFoxO1 mRNA expression level has tissues-dependent in muscles of four different parts in Jiangquhai swine.FoxO1 mRNA expression was effect on myofibril diameters.
Jiangquhai swine; Skeletal muscle;FoxO1 gene; histological characteristics
1001-4829(2017)10-2376-06
10.16213/j.cnki.scjas.2017.10.036
2016-12-29
江苏省农业三新工程项目“苏姜猪持续选育及良种繁育体系建设”(SXGC[2016]297);产学研联合创新资金-前瞻性联合研究项目“苏姜猪新品种持续选育技术创新研究及产业化开发”(BY2014124);凤凰人才工程
朱淑斌(1977-),女,黑龙江哈尔滨人,博士研究生,研究方向动物遗传育种,Tel:13952601225,E-mail:zhushubin2003@163.com,*为通讯作者。
S813.24
A
(责任编辑 李 洁)
