具翼烟草(Nicotiana alata)核型、C带与rDNA染色体定位研究
2017-11-16王霖娇任学良盛茂银杜家颖温培才
王霖娇,任学良,盛茂银,杜家颖,温培才
1 贵州师范大学,喀斯特研究院,贵州贵阳宝山北路180号 550001;2 国家喀斯特石漠化防治工程技术研究中心,贵州贵阳宝山北路180号 550001;3 贵州省烟草科学研究院,贵州贵阳云龙滩坝路29号 550081
具翼烟草(Nicotiana alata)核型、C带与rDNA染色体定位研究
王霖娇1,2,任学良3,盛茂银1,2,杜家颖1,温培才1
1 贵州师范大学,喀斯特研究院,贵州贵阳宝山北路180号 550001;2 国家喀斯特石漠化防治工程技术研究中心,贵州贵阳宝山北路180号 550001;3 贵州省烟草科学研究院,贵州贵阳云龙滩坝路29号 550081
采用去壁低渗法、BSG法和双色荧光原位杂交技术,分别开展了具翼烟草(Nicotiana alata)的核型分析、C显带与45S和5S rDNA染色体定位研究。4个具翼烟草收集系根尖细胞有丝分裂中期染色体平均核型为2n = 2x = 12m + 6st,染色体臂比的变异幅度为1.14~4.22,平均臂比值为2.17,最长与最短染色体之比为2.16,属2B型。C带研究结果显示,具翼烟草中期染色体C带丰富,多态性良好,共显带25条,包括7条着丝粒带、15条端带和3条中间带。45S和5S rDNA染色体定位研究结果显示,具翼烟草根尖细胞有丝分裂中期染色体细胞相分别显示了3对45S rDNA和2对5S rDNA基因位点信号,45S rDNA基因位点分别位于I S、III S、V L上,2对5S rDNA基因位点分别位于I L、IV S上(字母L和S分别代表染色体长臂和短臂,罗马数字代表同源染色体序号)。在I号同源染色体上同时存在45S和5S rDNA基因位点。研究结果对烟草属系统起源、遗传进化以及遗传育种等领域的进一步研究具有重要的参考价值。
烟草;核型;染色体;荧光原位杂交;C带
烟草属(Nicotiana L.)植物种类众多,全世界分布约70余种,系茄科植物中第5大家族[1],Knapp将其分为13个组[1]。烟草在全世界广泛分布,各式各样的生境孕育了多种多样的野生烟草种质资源[2-5]。这些野生种质长期在野外生境条件下生存、繁育、进化,形成了抗病、抗虫、抗旱、抗冻等特性,蕴含着栽培种质中不具备的大量优质基因、高产基因和抗逆基因[6],是烟草遗传育种和种质创新的重要资源[4-5]。具翼烟草(N. alata Link and Otto)是重要的烟草野生种,有限的多年生草本,高0.6~1.5m,全体被粘毛,原产墨西哥和乌拉圭,中国很多地方都有栽培。耐旱,抗病,抗逆性突出,花色艳丽,气味芳香,基因组小,是烟草种质创新、拓宽烟草遗传背景研究的重要野生种质资源[2]。
核型、染色体显带等细胞学研究是开展物种系统进化、遗传育种、种质创新等研究的重要基础[7]。烟草属植物核型分析方面虽有一些研究报道[8-10],由于工作开展得较早,对染色体分类采用类似两点二区系统(长臂:短臂等于1:1者为m,>1:1<3:1者为sm,>3:1者为st,该命名系统比较粗放,现已废除)[11],加之烟草染色体数目复杂(2n=18, 20, 24, 28, 32, 36,38, 40, 42, 44, 46, 48)[11-15],种子和根尖较小,操作困难,限于当时的技术水平,大部分结果欠准确。而且这些核型分析主要集中在栽培烟草物种[8,11-12],野生烟草未见报道。具翼烟草的核型分析、C显带以及45S rDNA和5S rDNA的FISH(荧光原位杂交)染色体定位更是空白。开展具翼烟草的核型分析、C显带和rDNA染色体物理定位等细胞学研究对进一步阐明烟草属植物种间亲缘关系及其系统演化、烟草遗传育种与种质创新具有重要意义。
1 材料与方法
1.1 植物材料
试验材料野生烟草种具翼烟草4个收集系(9001-10,9201-5,9255-6,9262-6)均来自于贵州省烟草科学研究院种质资源保育中心。
1.2 染色体制片
具翼烟草种子在40℃蒸馏水浸泡50 min后,播种在潮湿滤纸上,置于培养皿内,27℃下萌发;待根长至0.5~1 cm时,切下,放入饱和α-溴奈溶液室温预处理4~5 h;蒸馏水清洗3次,经卡诺I氏(乙醇:冰醋酸=3:1)固定液固定过夜;蒸馏水清洗3次后,放入蒸馏水前低渗1 h,用3%纤维素-果胶酶混合液37℃下处理2.5 h,清洗3次后,放入蒸馏水后低渗1 h;涂片,晾干,镜检备用。
1.3 核型分析
将上述去壁低渗法制成的染色体制片空气干燥1 d后,3% Giemsa染液染色1 h,冲洗干净、火焰干燥,Olympus BX51显微镜镜检、照相,进行核型分析,具体方法参照李懋学和陈瑞阳[16]的分析方法。染色体命名依据臂比(臂比=长臂长度/短臂长度),按照Levan等[17]的命名规则进行命名。按Stebbin[18]的核型分类标准对染色体核型进行分类。染色体相对长度(%)=染色体实际测量长度÷染色体组实际测量总长度×100。
1.4 C带显带与分析
将上述染色体制片进行Giemsa C带显带。显带方法如下:常温下饱和Ba(OH)2溶液处理20 min,蒸馏水水洗后,2×SSC 60℃处理3 h,水洗、气干,3% Giemsa染色50 min。蒸馏水冲洗,气干,选取染色体分散较好、显带清晰的细胞相照相。参照李国珍[19]的方法对染色体Giemsa C带显带的类型、数目以及组成进行统计分析。
1.5 45S和5S rDNA染色体定位
1.5.1 探针标记
含有45S和5S rDNA序列的pBluescripty来源于日本京都大学植物资源与分子遗传实验中心。45S rDNA片段长为9.1 kb,包括18S、5.8S、25S编码区和非转录间隔区序列,5S rDNA片段长450 bp。依据生工生物工程(上海)有限公司缺刻平移方法进行探针标记,45S rDNA用地高辛(Digoxigenin-dUTP)标记,5S rDNA用生物素(Biotin-dUTP)标记。
1.5.2 原位杂交及检测
参照盛茂银[20]的方法稍加改进。杂交液的配制及探针变性:每张片子大约需要30 μL杂交液,含50%的去离子甲酰胺(美国Sigma公司),10%的硫酸葡聚糖(美国Sigma 公司),2 × SSC,50 mg/L ssDNA,2 mg/L 的探针DNA,75℃变性5 min,待用。
染色体变性及杂交:将染色体制片置于80℃变性液中变性3 min,在-20℃下依次用75%、95%、和100%的酒精脱水5 min,气干后,滴加杂交液,加22 mm × 22 mm盖玻片,于保湿皿中37℃杂交12~48 h。
原位杂交信号的荧光检测:2 × SSC在室温及37℃各洗10 min,1 × PBS室温洗1次,5 min。加入抗体,37℃下杂交50 min,去掉盖破片,再用1 ×PBS温室洗3次,每次5min。
1.5.3 图像检测及分析
染色体制片用加入抗淬灭剂Vectorshield(vector lab)的 5 mg/L DAPI(4’, 6-diamidino-2-phenylindole)复染,荧光原位杂交信号观察由Olympus BX53显微镜完成,利用DP70 CCD照相装置俘获图像,运用Photoshop CS 10.0软件进行测量和图像处理。
2 结果与分析
2.1 具翼烟草的根尖有丝分裂细胞染色体的核型分析
4个具翼烟草收集系根尖细胞有丝分裂染色体观察结果表明,具翼烟草系二倍体,染色体组共18条染色体,2n=2x=18。从图1和表1可以看出:具翼烟草染色体较小,绝对长度为1.68 ~ 4.76 μm,相对长度为3.80 ~ 10.76。不同收集系的核型具有一定的差异:9001-10的核型公式为2n = 2x = 12m + 6st,第5、6、7号同源染色体为近端部着丝粒染色体,其余为中部着丝粒染色体,染色体臂比的变异幅度为1.05~5.25,平均臂比值为2.19,最长与最短染色体之比为2.17,属2B型。9201-5的核型公式为2n = 2x =12m + 2sm + 4st,第6号同源染色体为近中部着丝粒染色体,第5、7号同源染色体为近端部着丝粒染色体,其余为中部着丝粒染色体,染色体臂比的变异幅度为1.15~3.02,平均臂比值为1.84,最长与最短染色体之比为2.83,属2B型。9255-6的核型公式为2n= 2x = 6m + 6sm + 6st,第2、3、4号同源染色体为近中部着丝粒染色体,第5、6、7号染色体为近端部着丝粒染色体,其余为中部着丝粒染色体,染色体臂比的变异幅度为1.25~4.75,平均臂比值为2.37,最长与最短染色体之比为1.93,属2A型。9262-6的核型公式为2n = 2x = 8m + 4sm +6st,第3、4号同源染色体为近中部着丝粒染色体,第5、6、7号同源染色体为近端部着丝粒染色体,其余为中部着丝粒染色体,染色体臂比的变异幅度为1.05~4.95,平均臂比值为2.27,最长与最短染色体之比为1.76,属2A型。
4个具翼烟草收集系根尖细胞有丝分裂中期染色体平均核型为2n = 2x = 12m + 6st,第5、6、7号同源染色体为近端部着丝粒染色体,其余为中部着丝粒染色体,染色体臂比的变异幅度为1.14~4.22,平均臂比值为2.17,最长与最短染色体之比为2.16,属2B型。

图1 4个具翼烟草收集系根尖有丝分裂中期染色体及其配对1标尺=3 μmFig.1 Karyotype and pairing of metaphase chromosomes of four N.alata population plants 1 bar=3 μm
2.2 具翼烟草根尖细胞有丝分裂中期染色体的C带分析
具翼烟草根尖细胞有丝分裂中期染色体经BSG法处理后,获得的C分带谱带清晰。图2的A、B和C分别为具翼烟草根尖细胞C显带染色体中期细胞相、C显带中期核型、C显带核型模式图,C显带的类型和数目统计见表2。具翼烟草根尖细胞中期染色体C带有着丝粒带、端带和中间带3种类型,无随体带。着丝粒带、端带和中间带分别显示了7条、15条和3条,共25条。9对同源染色体均有条带显示,其中第1号同源染色体显带最丰富,显示4条带,第2、3、4、5和8号同源染色体显带数目次之,显带3条,第6、7和9号同源染色体显带最少,仅显示2条带。结果表明,具翼烟草根尖细胞有丝分裂中期染色体C带丰富,多态性良好,同源染色体间C带有一定的差异,为单染色体鉴定提供一定的依据。

图2 具翼烟草根尖中期染色体C带及其模式图Fig. 2 C-banding and its idiogram of mitotic metaphase chromosomes of root tip cells in N. alata
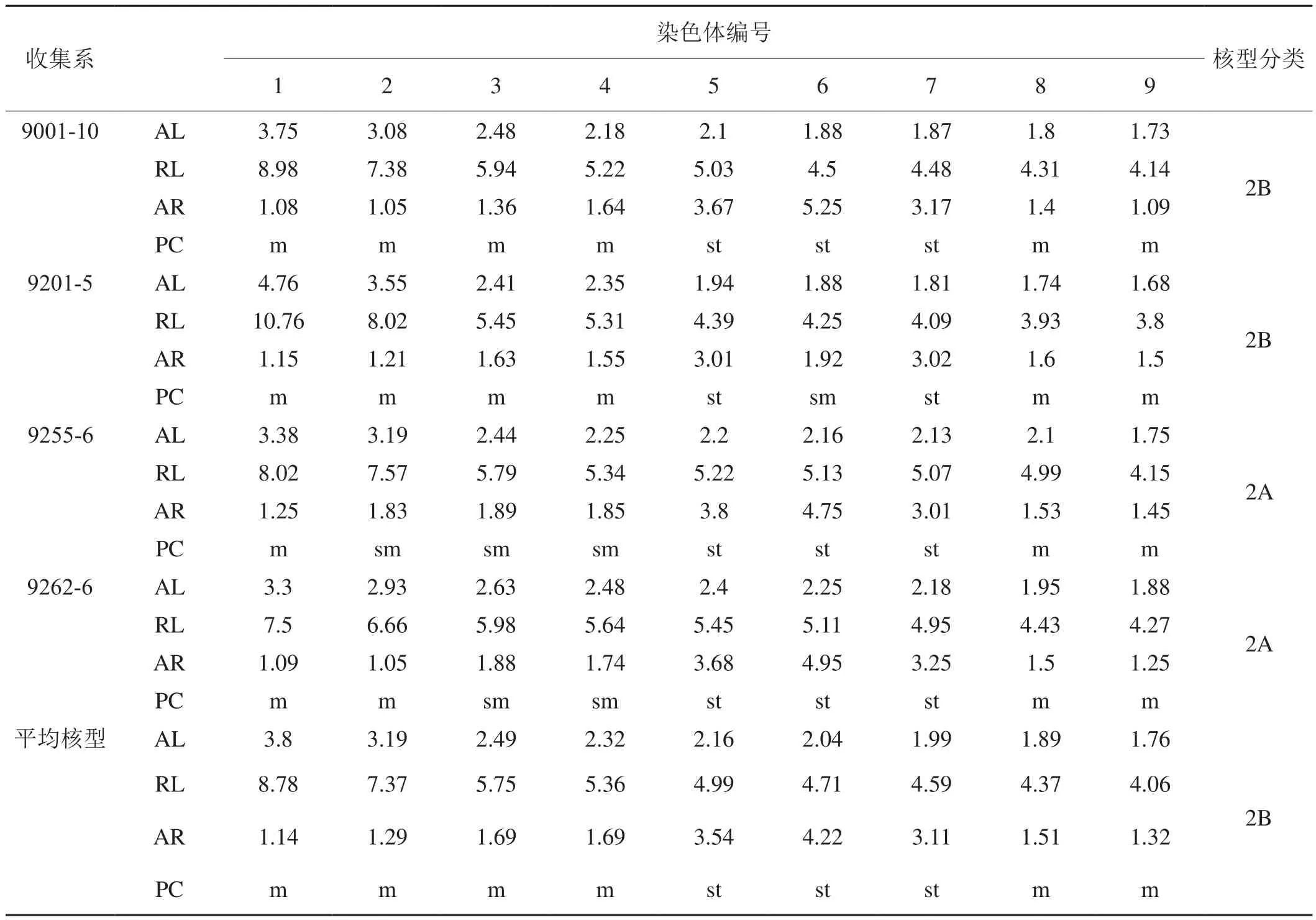
表1 4个具翼烟草收集系根尖细胞有丝分裂中期染色体核型参数Tab. 1 Karyotype parameters of metaphase chromosomes of root tip cells of four N. alata population plants
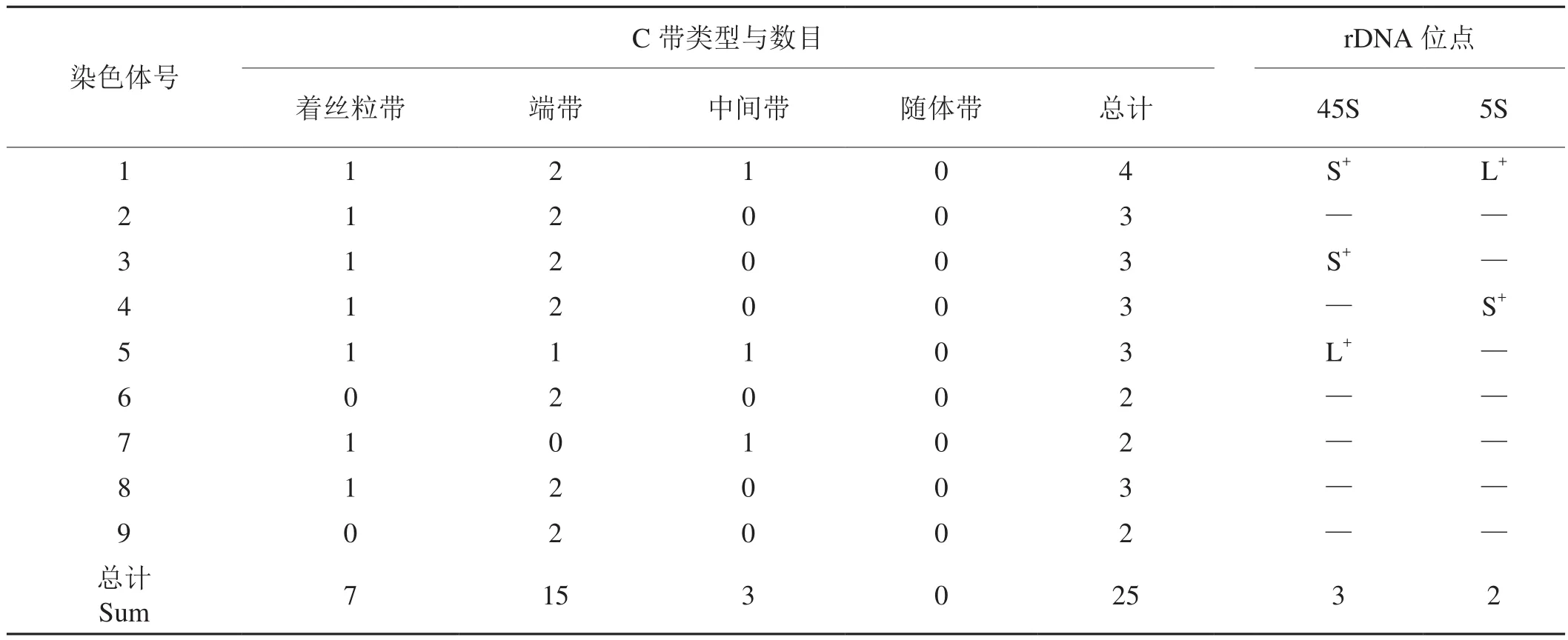
表2 具翼烟草有丝分裂中期染色体C带与45S和5S rDNA染色体定位Tab. 2 C-banding and chromosomal location of 45S and 5S rDNA of mitotic metaphase chromosomes in N. alata
2.3 具翼烟草的根尖细胞中期染色体的45S和5S rDNA物理定位
图3-A为分别用生物素标记的5S rDNA和地高辛标记的45S rDNA探针与具翼烟草根尖细胞中期染色体的荧光原位杂交结果,红色信号显示为5S rDNA位点的位置,绿色信号显示为45S rDNA位点的位置。图3-B是依据荧光原位杂交信号的位置和数目建立的具翼烟草45S和5S rDNA基因位点FISH核型模式图。结果显示具翼烟草中期染色体细胞相显示有2对红色信号(5S rDNA基因位点)和3对绿色信号(45S rDNA基因位点)。3对45S rDNA基因位点分别位于IS、IIIS、VL上,2对5S rDNA基因位点分别位于IL、IVS上(L和S分别代表染色体长臂和短臂,罗马数字代表同源染色体序号,下同)。杂交结果还显示,在3对45S rDNA基因位点的杂交信号中,IS处的信号最强,而在2对5S rDNA基因位点的杂交信号中,IL处的信号最强(图3-A)。在第1对同源染色体上同时存在45S rDNA和5SrDNA基因位点。
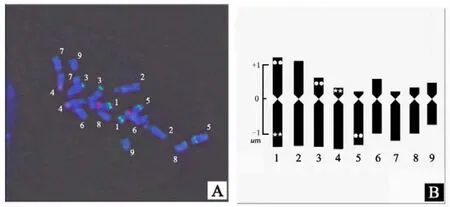
图3 具翼烟草根尖中期染色体45S和5S rDNA染色体定位及其模式图Fig. 3 Chromosomal location of 45S and 5S rDNA and its diogram of mitotic metaphase chromosomes of root tip cells in N. alata
3 讨论
3.1 具翼烟草的核型
关于烟草的核型分析,一直以来尽管有不少学者进行了这方面的研究[21-23],但由于烟草染色体微小和当时技术水平的限制,一直未能获得准确可靠的结果[12]。至今为止,普通烟草仍未见标准核型报道[12],野生烟草种类更是缺乏核型分析方面的研究,这给烟草细胞遗传学的进一步深入开展造成了困难。本研究首次报道了运用去壁低渗法开展了具翼烟草4个不同收集系的核型分析,结果显示具翼烟草4个不同收集系间的核型存在明显的差异,平均核型为2n = 2x = 12m +6st,染色体臂比的变异幅度为1.14~4.22,平均臂比值为2.17,最长与最短染色体之比为2.16,属2B型。研究结果为该野生种质资源开发利用和烟草属的遗传进化等研究提供了基础资料。
植物核型演化的大致趋势是由对称至不对称,具有较对称核型的物种在系统演化上大多属于比较古老或原始的物种,而进化上较高级的物种常常为不对称核型[18]。本研究结果显示具翼烟草核型属于2B对称性核型,暗示其在系统演化上是相对原始的种类,这与前人在烟草其他种类上研究结果一致[11-15,21-23]。烟草在系统演化上是一个极其复杂的一个类群,染色体数目异常复杂[11-15,21-23]。Goodspeed等和Smith基于烟草60余种中有27个种X=12,12个种X=24,二者之和占总种数的60%,推断该属的染色体基数或形式上的染色体基数为X=12,24对染色体的种可能都是双二倍体起源的,2n=24或2n=48的整倍体种可能是由于发生了个别或一些染色体丢失,从而形成了2n = 18,20 或 2n = 28,32,36,38,40,42,44 和46 的非整倍体种[11]。本文报道的具翼烟草(2n=18)核型为该属植物的染色体组进化提供了重要的资料,但要阐明该属植物染色体的系统进化还需要大量的深入研究,尤其是针对关键种的研究。
3.2 具翼烟草rDNA染色体物理定位与单染色体鉴定
真核生物的核糖体基因(rDNA)是一个串联的多基因家族,在进化过程中相当保守,可以分布在染色体组中一对或几对同源染色体上[24]。大量研究结果显示,5S rDNA位点在染色体上的位置以及拷贝数在进化过程中相当保守[25-27],而45S rDNA位点不管是在染色体上的分布还是拷贝数在进化过程中都是较易发生变化[25]。杂交、染色体不等交换、重排、隐蔽rDNA拷贝数等都可能导致染色体组rDNA位点和数目发生变化[20,26-27]。本研究首次报道了具翼烟草45S和5S rDNA的双色荧光原位杂交染色体物理定位研究。结果显示具翼烟草根尖细胞有丝分裂中期染色体组具有较丰富的rDNA基因位点,有3对45S rDNA基因位点和2对5S rDNA基因位点分布。烟草在其悠久的栽培历史和广泛的传播过程中大量的杂交和对不同自然生态环境的适应变异,可能导致了其染色体组rDNA位点多态性增加。因此广泛的烟草属植物rDNA物理定位研究将是开展普通烟草起源进化、染色体精细结构分析、遗传育种等领域研究的十分重要途径。
单染色体鉴定是植物细胞遗传、染色体辅助育种等领域研究的重要前提。运用三代基因测序技术,开展单染色体基因测序和作图,将对物种的基因工程、分子辅助育种、遗传与进化等研究具有极其重要意义[23]。由于烟草染色体微小、同源染色体间差异不明显,传统核型分析难以区分单染色体严重阻碍了其在烟草种质创新和分子辅助育种等领域的应用[23]。近年来,随着生物技术的不断发展,染色体的精细研究得到了长足发展,特别是荧光原位杂交技术的出现。荧光原位杂交技术已在许多染色体微小、难以区分的物种中得到应用,取得了良好的效果[20,24-27]。本研究基于荧光原位杂交技术首次成功将具翼烟草45S和5S rDNA进行染色体物理定位,并结合传统核型分析和Giemsa C带特征,将具翼烟草9对同源染色体进行区分,为烟草单染色体测序作图以及进一步的细胞遗传学、遗传育种等研究开辟了一条重要的途径。
4 结论
1)研究首次报道了具翼烟草4个收集系的核型分析和45S、5S rDNA的双色荧光原位杂交染色体物理定位研究。
2)具翼烟草4个收集系的平均核型为2n = 2x =12m + 6st,染色体组rDNA基因位点较丰富,有3对45S rDNA基因位点和2对5S rDNA基因位点分布。
3)研究结果对烟草属系统起源、遗传进化以及遗传育种等领域的进一步研究具有重要的参考价值,但要阐明该属植物染色体的系统进化还需要大量的深入研究,尤其是针对不同染色体基数关键种的研究。
[1] Knapp S, Chase M W, Clarkson J J. Nomenclatural changes and a new sectional classi fi cation in Nicotiana (Solanaceae)[J]. Taxon, 2004, 53(1): 73-82.
[2] 张兴伟, 冯全福, 杨爱国, 等. 中国烟草种质资源分布利用情况分析[J]. 植物遗传资源学报, 2016, 17(3): 507-516.ZHANG Xingwei, FENG Quanfu, YANG Aiguo, et al.Analysis of tobacco (Nicotiana tabacum L.) germplasm distribution and utilization in China[J]. Journal of Plant Genetic Resources, 2016, 17(3): 507-516.
[3] 蒋予恩. 我国烟草资源概况[J]. 中国烟草科学, 1988,10(1): 42-46.JIANG Yuen. Overview of tobacco resources in China[J].Chinese Tobacco Science, 1988, 10(1): 42-46.
[4] 张铭真, 李晓辉, 王袁, 等. 烟草种质资源的遗传多样性分析[J]. 湖南农业大学学报:自然科学版, 2016, 42(3):280-286.ZHANG Mingzhen, LI Xiaohui, WANG Yuan, et al.Analysis of genetic diversity of germplasm resources of Nicotiana tabacum[J]. Journal of Hunan Agriculture University: Nature Science, 2016, 42(3): 280-286.
[5] Lewis R S, Milla S R, Levin J S. Molecular and genetic characterization of Nicotiana glutinosa L. chromosome segments in tobacco mosaic virus-resistant tobacco accessions[J]. Crop Science, 2005, 45(6): 2355-2362.
[6] Golz J F, Su V, Clarke A E, et al. A molecular description of mutations a ff ecting the pollen component of the Nicotiana alata S locus[J]. Genetics, 1999, 152: 1123-1135.
[7] 李懋学, 张赞平. 植物染色体及其研究技术[M]. 北京:中国农业出版社, 1996: 3-40.LI Maoxue, ZHANG Zanping. Plant chromosome and its research technique[M]. Beijing: Chinese Agriculture Press,1996: 3-40.
[8] Kenton A, Parokonny A S, Gleba Y Y, et al. Characterization of the Nicotiana tabacum L. genome by molecular cytogenetics[J]. Molecular and General Genetics, 1993,240: 159-169.
[9] 张赞平. 烟草属植物的核型及其演化[J]. 洛阳农专学报,1996, 16(2): 20-27.ZHANG Zanping. Karyotype and evolution of genus Nicotiana L.[J]. Journal of Luoyang Agriculture College,1996, 16(2): 20-27.
[10] 程晓蕾, 郭俊成. 烟草染色体显带技术试验研究[J]. 烟草科技, 1994, 3: 37-38.CHEN Xiaolei, GUO Juncheng. Studies on chromosome banding technique of tobacco[J]. Tobacco Science &Technology, 1994, 3: 37-38.
[11] 张赞平, 侯小改, 孟丽. 三种烟草属植物的核型分析[J].植物学通报, 1997, 14(增刊): 49-54.ZHANG Zanping, HOU Xiaogai, MENG Li. Karyotype analysis of three species in Nicotiana[J]. Chinese Bulletin of Botany, 1997, 14(Supplement): 49-54.
[12] 侯小改, 曲忠庆, 张赞平. 栽培烟草的核型研究[J]. 武汉植物学研究, 1997, 15(3): 208-214.HOU Xiaogai, QU Zhongqing, ZHANG Zanping.Karyotype studies of cultivated tobacco[J]. Journal of Wuhan Botanical Research, 1997, 15(3): 208-214.
[13] 朱惠琴, 张宪银, 薛庆中. 烟草染色体倍性快速鉴定方法[J]. 农业生物技术学报, 2006, 14(2): 255-258.ZHU Huiqin, ZAHNG Xianyin, XUE Qingzhong. Rapid determination of ploidy level of chromosome in Tobacco(Nicotiana tabacum)[J]. Chinese Journal of Agricultural Biotechnology, 2006, 14(2): 255-258.
[14] 程晓蕾, 郭俊成, 贺渔生, 等. 烟草染色体制片技术与核型分析[J]. 安徽农业大学学报, 2001, 28(4): 431-434.CHENG Xiaolei, GUO Juncheng, HE Yusheng, et al. Study on chromosome technique and karyotype of tobacco[J].Journal of Anhui Agriculture University, 2001, 28(4): 431-434.
[15] Lim K Y, Matyasek R, Lichtenstein C P, et al. Molecular cytogenetic analyses and phylogenetic studies in the Nicotiana section Tomentosae[J]. Chromosoma, 2000,109(4): 245-258.
[16] 李懋学, 陈瑞阳. 关于植物核型分析的标准化问题[J].武汉植物学研究, 1985, 3(4): 297-302.LI Maoxue, CHEN Ruiyang. A suggestion on the standardization of karyotype analysis in plants[J]. Journal of Wuhan Botanical Research, 1985, 3(4): 297-302.
[17] Leven A, Fredga K, Sandberg A A. Nomenclature for centromeric position on chromosomes[J]. Hereditas, 1964,52: 201-220.
[18] Stebbins Q L. Chromosomal evolution in higher plant[M].London: Edward Arnold. 1971.
[19] 李国珍. 染色体及其研究方法[M]. 北京: 科学出版社,1985: 10.LI Guozhen. Chromosome and its research methods[M].Beijing: Chinese Science Press, 1985: 10.
[20] 盛茂银. 栽培荞麦45S和5S rDNA的染色体物理定位研究[J]. 植物遗传资源学报, 2013, 14(2): 317-321.SHENG Maoyin. Physical mapping of the 45S and 5S rDNA of cultivated buckwheat[J]. Journal of Plant Genetic Resources, 2013, 14(2): 317-321.
[21] Lim K Y, Matyasek R, Kovarik A, et al. Genome evolution in allotetraploid Nicotiana[J]. Biological Journal of the Linnean Society, 2004, 82, 599-606.
[22] Nalamura R, Kitamura S, Inoue M, et al. Karyotype analysis of Nicotiana Kawakamii Y. Ohashi using DAPI banding and rDNA FISH[J]. Theoretical and Applied Genetics, 2001,102: 810-814.
[23] Wu F, Tanksley S D. Chromosomal evolution in the plant family Solanaceae[J]. BMC Genomics, 2010, 11: 182-193.
[24] 佘朝文, 宋运淳. 植物荧光原位杂交技术的发展及其在植物基因组分析中的应用[J]. 武汉植物学研究, 2006,24(4): 365-376.SHE Chaowen, SONG Yunchun. Progress of plant FISH technique and its applications in the analysis of plant genome[J]. Journal of Wuhan Botanical Research, 2006,24(4): 365-376.
[25] Abbo S, Miller T E, Reader S M, et al. Detection of ribosomal DNA sites in lentil and chickpea by fl uotescent in situ hybridization[J]. Genome, 2004, 37: 713-716.
[26] Volkov R A, Komarova N Y, Hemleben V. Ribosomal RNA in plant hybrids: inheritance, rearrangement, expression[J].Systematics and Biodiversity, 2007, 5: 1-16.
[27] Li L J, Arumuganathan K. Physical mapping of sorted chromosomes 45S and 5S rDNA on maize metaphase and by FISH[J]. Hereditas, 2001, 134: 141-145.
:WANG Linjiao, REN Xueliang,SHENG Maoyin, et al. Study on karyotype, C-banding and rDNA chromosome locus in Nicotiana alata [J]. Acta Tabacaria Sinica, 2017, 23(1)
*Corresponding author. Email:shmoy@163.com
Study on karyotype, C-banding and rDNA chromosome locus in Nicotiana alata
WANG Linjiao1,2,REN Xueliang3,SHENG Maoyin1,2*,DU Jiaying1,WEN Peicai1
1 Karst Research Institute, Guizhou Normal University, Guiyang 550001, China;2 National Engineering Research Center for Karst Rocky Desertification Control, Guiyang 550001, China;3 Institute of Guizhou Tobacco Science, Guiyang 550081, China
The karyotype, C-banding, and chromosome locus of 45S and 5S rDNA of Nicotiana alata were studied by methods of wall digestion and hypotonic treatment, BSG, and double color fl uorescent in situ hybridization, respectively. Karyotype analysis of root tip cells of four N. alata accessions showed that the average karyotype formula was 2n = 2x = 12m + 6st, the variation and average value of arm ratio was 1.14~4.22 and 2.17, respectively. The rate of the longest and minimum chromosome was 2.16, and the karyotype classi fi cation was 2B of Stebbins system (1971). Results of C-banding study showed that chromosome C-banding of N. alata was abundant with 25 bands being displayed, including 7 centromeric bands, 15 terminal bands, and 3 intercalary bands. Results of FISH study showed, in metaphase chromosomes of root tip cell of N. alata, there were three pairs of 45S rDNA loci, locating on IS, IIIS, and VL, respectively (L and S represented chromosome long and short arm respectively, and the Roman number indicated chromosomes serial number; the same hereinafter), and two pairs of 5S rDNA loci, locating on IL and IVS, respectively. Pair I of homologous chromosome had loci of both 45S and 5S rDNA. These results could provide reference for studies on phylogenesis of genus Nicotiana, and were of great signi fi cance to genetic breeding and germplasm innovation in tobacco.
Nicotiana; karyotype; chromosome; FISH; C-banding
王霖娇,任学良,盛茂银,等. 具翼烟草(Nicotiana alata)核型、C带与rDNA染色体定位研究[J]. 中国烟草学报,2017,23(1)
烟草行业重点实验室专项经费资助项目(中烟办[2014]5号),国家重点研发计划项目课题(2016YFC0502603),贵州省社会发展攻关计划项目(黔科合SZ字[2014]3036号)
王霖娇(1982—),硕士,讲师,研究方向:植物资源开发利用,Tel:0851-86690478,Email: wlj111717@163.com
盛茂银(1980—),博士,教授,研究方向:喀斯特植物资源开发利用,Tel:0851-86690478, Email: shmoy@163.com
2016-08-01;< class="emphasis_bold">网络出版日期:
日期:2017-01-25
