湖羊HPG轴组织中LRH-1表达定位分析
2017-11-16王利红
王利红,张 伟
(江苏农牧科技职业学院,江苏 泰州 225300)
湖羊HPG轴组织中LRH-1表达定位分析
王利红,张 伟
(江苏农牧科技职业学院,江苏 泰州 225300)
为深入了解肝受体类似物-1(Liver Receptor Homolog-1, LRH-1)蛋白在湖羊下丘脑-垂体-卵巢轴组织中的表达分布,本研究应用免疫组织化学和酶联免疫吸附测定方法检测了湖羊母羊下丘脑、垂体、卵巢、输卵管和子宫组织中LRH-1的表达.结果表明:LRH-1免疫阳性颗粒在下丘脑和垂体组织的分泌细胞、卵巢卵泡颗粒细胞、输卵管黏膜上皮分泌细胞和子宫腺细胞中均有分布;随湖羊发情周期的变化,下丘脑、垂体、卵巢、输卵管和子宫组织中LRH-1蛋白表达量差异显著,除下丘脑组织在发情期与间情期间存在显著差异(P<0.05)外,其他组织在各阶段间均存在极显著差异(P<0.01);发情后期,下丘脑和卵巢组织中LRH-1蛋白表达量相对最高;间情期,输卵管组织中表达量相对最高;发情前期,垂体和子宫组织中表达量相对最高.结果显示,LRH-1蛋白的表达与湖羊HPG轴各组织功能存在相关性.
湖羊;肝受体类似物-1;下丘脑-垂体-卵巢轴;免疫组化;酶联免疫吸附测定
肝受体类似物-1(Liver Receptor Homolog‐1,LRH‐1,也称NR5A2)属于NR5A或Ftz-F1核受体亚家族.LRH‐1自小鼠肝脏中克隆出来以后,已采用原位杂交、RT‐PCR、Northern杂交和免疫组化等方法证明LRH‐1 mRNA和LRH‐1蛋白在人、小鼠、羊等多种动物的脑、消化系统、泌尿生殖系统的组织中存在,对动物的胚胎发育、分化、胆固醇代谢、胆汁酸的动态平衡以及类固醇激素生成等方面发挥着重要的作用[1-2].在湖羊组织中,已在脑、复胃、肠及生殖系统等组织中检测到LRH‐1 mRNA的存在[3],但LRH‐1蛋白在湖羊组织细胞中的表达定位分布则尚未见相关报道.本研究采用免疫组织化学方法,对湖羊母羊下丘脑-垂体-性腺轴(Hypothalamus Pituitary Gonadal Axis,HPG轴)的下丘脑、垂体和卵巢组织以及输卵管、子宫组织进行LRH‐1蛋白表达分布检测,并通过酶联免疫吸附测定(ELISA)方法探索这些组织中LRH‐1蛋白在发情周期4个阶段(发情前期、发情期、发情后期、间情期)的表达量变化,以期深入研究湖羊LRH‐1的生理学作用与生殖功能间关系,为探寻绵羊新的生殖调控方法提供参考依据.
1 材料与方法
1.1 实验样本 从健康湖羊母羊群中随机选取发情周期4个阶段(发情期、发情后期、间情期和发情前期)的实验样本各3只,宰杀后迅速开腹,采集下丘脑、垂体和生殖系统组织样各2份,1份用PBS清洗后在4%多聚甲醛中固定24 h,之后,制成石蜡组织切片,用于免疫组化检测;另1份存于液氮中用于ELISA检测.本研究所选湖羊样本均来自江苏西来原生态农业有限公司.
1.2 主要试剂 APES(3-氨丙基三乙氧基硅烷)、DAB购自武汉博士德公司;0.01mol/L 枸橼酸盐缓冲液、复合消化液、DAB显色试剂盒、水溶性封片剂、多聚体IgG‐HRP均购自Boster公司;苏木素染液,LRH‐1抗体(MAB4086)购自Millipore公司;NR5A2 ELISA 试剂盒购自GBD公司.
1.3 免疫组化染色 组织切片置于二甲苯中脱蜡,之后水化,抗原修复,滴加5%BSA封闭液,滴加一抗、二抗孵育,DAB显色,苏木精复染,蒸馏水冲洗,梯度乙醇脱水、二甲苯透明、水溶性封片剂封片,显微镜观察.
1.4 ELISA检测 将组织样匀浆处理,离心取上清液,之后,按ELISA试剂盒说明书操作,将50 μL样品加入反应孔中,37℃孵育1 h,洗涤后于各反应孔中加酶标抗体0.1 mL,37℃孵育1 h,洗涤后每孔加入50 μL底物液显色,20~25℃15 min.加终止液50 μL,在ELISA检测仪上,于450 nm处读OD值.
1.5 统计分析 试验所得数据经SPSS 19.0软件进行单因素方差分析,结果以平均值±标准差表示,P<0.05为差异显著.
2 结果与分析
2.1 LRH‐1在湖羊下丘脑和垂体中的分布 在湖羊下丘脑组织中,LRH‐1免疫阳性颗粒在下丘脑的神经分泌细胞中大量存在.在垂体组织中,则少数垂体分泌细胞中存在LRH‐1免疫阳性颗粒(图1).
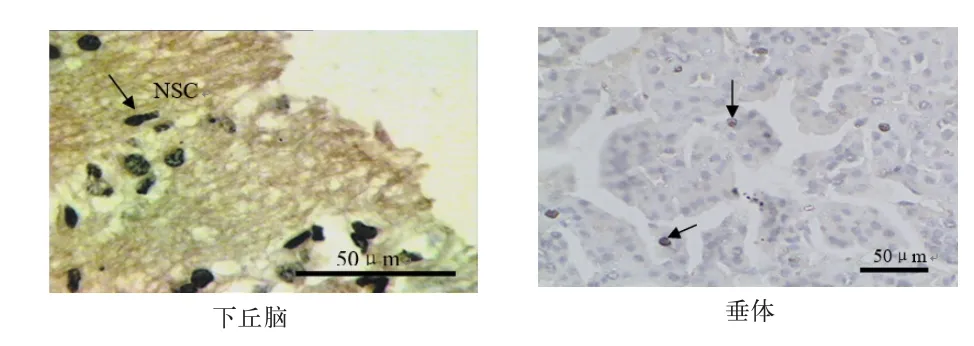
图1 LRH-1在湖羊下丘脑和垂体组织中的分布
2.2 LRH‐1免疫阳性细胞在湖羊卵巢组织中的分布在卵巢组织中,LRH‐1免疫阳性颗粒在卵泡颗粒细胞中大量分布(图2).
2.3 LRH‐1在湖羊输卵管组织中的分布 LRH‐1免疫阳性颗粒在输卵管黏膜上皮的部分分泌细胞中有分布(图3).
2.4 LRH‐1免疫阳性细胞在湖羊子宫中的分布 在湖羊子宫腺细胞中,有少数细胞为LRH‐1免疫阳性细胞 (图4).
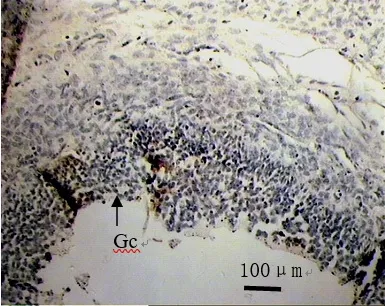
图2 LRH-1免疫阳性细胞在卵巢卵泡上的分布
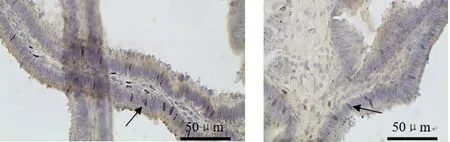
图3 LRH-1免疫阳性细胞在输卵管中的分布
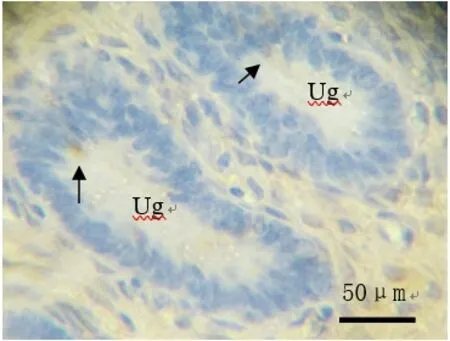
图4 LRH-1免疫阳性细胞在子宫中的分布
2.5 发情周期不同阶段湖羊HPG轴组织中LRH‐1表达量检测 采用ELISA方法,对发情周期不同阶段的湖羊下丘脑、垂体、卵巢、输卵管和子宫组织样进行LRH‐1表达量检测,结果见表1.
从表1可看出,在所检测的5个组织样中,均有丰富的LRH‐1蛋白表达,且随湖羊发情周期阶段的不同,表达量差异显著(P<0.05).除下丘脑组织在发情期与间情期间存在显著差异(P<0.05)外,其他阶段均存在极显著差异(P<0.01).从各组织中LRH‐1表达量变化趋势看,下丘脑和卵巢组织中LRH‐1蛋白表达在发情后期最高;输卵管组织中,则在发情后期蛋白表达量逐渐增加,在间情期时达最高值,此后表达量下降,至发情期时达最低值;垂体和子宫组织样中LRH‐1蛋白表达量从发情期逐渐递增,至发情前期时达最高值.

表1 湖羊发情周期不同阶段HPG轴各组织中LRH-1表达ELISA检测结果 pg/mL
3 讨 论
下丘脑和垂体是动物重要的内分泌系统调节和激素分泌器官,对于保持动物机体内环境的相对平衡和稳定、调节动物生殖周期活动起着重要的作用.Higashiyama等[4]在小鼠脑组织的下丘脑弓状核和丘脑室旁核区域检测到LRH‐1阳性细胞,提示LRH‐1可能参与调节动物采食活动以及将下丘脑-垂体-肾上腺活动的信息传递到大脑边缘区的作用[5].本研究在湖羊下丘脑和垂体组织的分泌细胞中均检测到LRH‐1免疫阳性颗粒,表明LRH‐1与湖羊下丘脑和垂体组织的激素合成分泌功能存在一定的相关性.从发情周期不同阶段湖羊下丘脑和垂体组织中LRH‐1表达量变化趋势看,LRH‐1表达量极高值分别出现在发情后期和发情前期,这种蛋白表达量变化趋势与课题组前期研究中检测到的LRH‐1 mRNA在下丘脑和垂体组织中最高表达量分别在发情后期和发情前期的结果相似[6],表明湖羊下丘脑和垂体组织中LRH‐1 mRNA和LRH表达趋势具有相似性.湖羊下丘脑和垂体组织中LRH‐1的表达变化具体与哪些激素的分泌存在相关性,有待后续深入研究.
在动物卵巢卵泡中,颗粒细胞给卵母细胞提供所需的能量和物质,控制着卵母细胞的生长.已有相关报道证实在动物卵巢中有大量的LRH‐1基因表达,且表达主要集中在卵泡颗粒细胞和妊娠期的黄体细胞中[7],表明LRH‐1可能在这些细胞里调控SR‐BI和CYP19的表达,进而调控雌激素的生物合成[8-10].Duggavathi等[11]对比敲除LRH‐1基因小鼠和正常小鼠卵巢上卵泡发育和排卵的研究结果显示,敲除LRH‐1基因的小鼠卵巢上虽有卵泡发育,但未有卵泡破裂排卵,如采用超排处理,仍未见卵子排出的现象,表明该基因与动物的卵泡发育及卵子成熟有关.Higashiyama等[4]在小鼠卵巢中检测到有较强的表达信号,提示LRH‐1在动物生殖机能方面具有重要调控作用,进一步研究发现该基因不仅参与调节动物性腺中芳香化酶的表达,并且还通过介导黄体3β-羟基脱氢酶II表达来促进孕激素的合成[12].与其他相关报道相似,本研究在湖羊卵巢卵泡颗粒细胞中检测到较强的LRH‐1免疫阳性颗粒,表明湖羊LRH‐1与颗粒细胞功能间存在相关性.输卵管和子宫是配子运行、成熟以及早期胚胎发育及着床的重要部位.前期研究工作结果已证实,在湖羊输卵管和子宫组织中存在LRH‐1 mRNA的表达[13],此次,通过免疫组织化学实验检测到LRH‐1免疫阳性颗粒在湖羊输卵管黏膜上皮的分泌细胞和子宫腺细胞中均有分布,提示LRH‐1与湖羊生殖道腺体的分泌功能存在一定的关系.众所周知,当母畜卵巢卵泡破裂排出卵子后,排卵处即开始形成黄体,在生殖激素的作用下,生殖道(输卵管和子宫)内环境发生孕向变化,上皮分泌细胞分泌功能逐渐增强,为早期胚胎发育提供充足的营养,这一变化过程处于母畜的发情后期和间情期(即黄体期).本研究中,湖羊输卵管及子宫中LRH‐1的表达量变化在发情期均相对最低,此后,表达量逐渐增加,这一变化正与母畜黄体期生殖道孕向变化相符,进一步表明LRH‐1与湖羊生殖道分泌细胞的功能有关.
4 结 论
LRH‐1在湖羊下丘脑、垂体、输卵管和子宫组织的分泌细胞和卵巢卵泡的颗粒细胞中有分布,且LRH‐1表达量在发情周期4个阶段的组织间存在显著差异,提示LRH‐1与湖羊HPG轴功能以及生殖道内环境变化有关联.
[1] 温海霞, 刘国艺, 倪江. 孤儿核受体同系物‐1 以及与雌激素相互调节作用[J]. 生殖医学杂志, 2007, 16(2):124‐128.
[2] Grgurevic N, Tobet S, Majdic G. Widespread expression of liver receptor homolog 1 in mous brain[J]. Neuro Endocrinol Lett, 2005, 26:541‐547.
[3] 王利红, 高勤学, 张伟, 等. 湖羊Lrh‐1基因cDNA序列及组织表达谱分析[J]. 畜牧兽医学报, 2012, 43(9):1360‐1368.
[4] Higashiyama H, Kinoshita M, Asano S. Expression profiling of liver receptor homologue 1(LRH‐1) in mouse tissues using tissue microarray[J]. J Mol Hist, 2007, 38:45‐52.
[5] Van Den Top M, Spanswick D. Integration of metabolic stimuli in the hypothalamic arcuate nucleus[J]. Prog Brain Res, 2006, 153:141‐154.
[6] 张 伟, 张尧, 张君胜, 等. Lrh‐1基因在湖羊HPG轴中表 达量变化研究[J]. 安徽农业科学, 2012, 40(19):10175‐10177.
[7] Christie W W. Lipid metabolism in ruminant animals[M].Oxford: Perganian Press, 1981, 279‐362.
[8] Schoonjans K, Annicotte JS, Huby T, et al. Liver receptor homolog 1 controls the expression of the scavenger receptor class B type I[J]. EMBO Rep, 2002, 3:1181‐1187.
[9] Boerboom D, Pilon N, Behdjani R, et al. Expression and regulation of transcripts encoding two members of the NR5A nuclear receptor subfamily of orphan nuclear receptors, steroidogenic factor‐1 and NR5A2,in equine ovarian cells during the ovulatory process[J].Endocrinology, 2000, 141:4647‐4656.
[10] Fayard E, Auwerx J, Schoonjans K. LRH‐1: an orphan nuclear receptor involved in development, metabolism and steroidogenesis[J]. Trends Cell Bio, 2004, 14(5): 250‐260.
[11] Duggavathi R, Volle D H, Mataki C, et al. Liver receptor homolog 1 is essential for ovulation [J]. Genes Dev, 2008,22(14):1871‐1876.
[12] Peng N, Kim J W, Rainey W E, et al. The role of the orphan nuclear receptor, liver receptor homologue‐1, in the regulation of human corpus luteum3b‐hydroxysteroid dehydrogenase type II[J]. J Clin Endocrinal Metab, 2003,88: 6020‐6028.
[13] Wang L H, Zhang W, Ji J L, et al. Molecular characterization and expression analysis of the Lrh‐1 gene in Chinese Hu sheep[J].Genet Mol Res, 2013,12(2):1490‐1500.
S827.3
A
10.19556/j.0258-7033.2017-11-058
2017-04-21;
2017-08-13
江苏省高校"青蓝工程"培养对象项目(2014);江苏农牧科技职业学院"凤凰人才工程"培养对象项目(10434014001)
王利红(1975-),女,山西人,副教授,博士,主要从事动物遗传繁育研究,E-mail:wanglihong345@126.com
