多指标评价不同干燥工艺及切片对三叶青质量的影响Δ
2017-11-16陈翔郭海波刘婷许景景郑国平舟山市食品药品检验检测研究院药品检验检测室浙江舟山316021
陈翔,郭海波,刘婷,许景景,郑国平(舟山市食品药品检验检测研究院药品检验检测室,浙江舟山316021)
多指标评价不同干燥工艺及切片对三叶青质量的影响Δ
陈翔*,郭海波,刘婷,许景景,郑国平(舟山市食品药品检验检测研究院药品检验检测室,浙江舟山316021)
目的:研究不同干燥工艺和切片对三叶青质量的影响,优选三叶青的干燥处理方式。方法:分别采用2种处理方式(切片、不切片)及5种干燥方法(阴干、晒干、热风干燥、微波干燥、冷冻干燥)对三叶青块根进行处理,分别干燥3.5 h~213.0 h后,以药材中总黄酮、多糖、总多酚和β-谷甾醇的含量为指标,对比分析不同干燥工艺对三叶青质量的影响。结果:与不切片比较,三叶青切片后可缩短干燥时间,减少药材中活性成分的损耗。5种干燥方法中,冷冻干燥对三叶青中活性成分保留效果最好,切片干燥后药材中总黄酮、多糖、总多酚和β-谷甾醇的含量分别约为18.5、92.7、9.19、0.344 mg/g;微波干燥次之,随后依次为热风干燥、阴干和晒干。各干燥方法间有效成分含量差异有统计学意义(P<0.05或P<0.01)。结论:不同干燥工艺对三叶青质量有明显影响;从成本、有效成分含量及实用性等综合分析,三叶青宜采用切片后在60℃热风干燥的方式处理。
三叶青;干燥工艺;热风干燥;总黄酮;总多酚;多糖;β-谷甾醇
三叶青为葡萄科植物三叶崖爬藤(Tetratigma hemsleyanum Diels et Gilg)的块根,又名金线吊葫芦、蛇附子、石老鼠等,是一种传统中草药,具有清热解毒、消肿止痛、化痰散结的功效[1]。其药用记载最早见于《本草纲目》,并在各类中药典籍[2-3]和地方药材标准[4]中均有收载,主要用于高热惊厥、肺炎、哮喘、咽痛、瘰疬、肝炎等症的治疗。现代药理学研究表明,三叶青还具有明显的抗肿瘤活性[5-6],进一步凸显了其药用价值,市场对其关注度也不断上升。
三叶青中化学成分种类繁多,以黄酮类、多糖类、酚酸类和甾体类成分为主,是三叶青中的主要活性物质,具有重要的药用价值和经济效益[7-8]。熊科辉等[9]曾比较了三叶青在不同干燥方式下干燥前、后总黄酮、总多酚和多糖的含量变化,发现干燥工艺对上述化学成分的含量具有显著影响。但该研究仅考察了冷冻干燥、真空干燥和热风干燥3种方法,结果以冷冻干燥为最佳干燥方法,但该法受到投入成本高、干燥时间长、批次处理量少等因素的制约,不适合大规模推广。同时,由于三叶青块根较小,切片工序烦琐,种植户多习惯将新鲜块根直接进行干燥,这与规范要求[1]不符。目前,有关三叶青的研究主要集中在提取工艺[10]、化学成分[11]、药理药效[12]、人工栽培等方面,对三叶青干燥工艺的研究较少。因此,笔者结合药材生产特点,以三叶青中总黄酮、多糖、总多酚和β-谷甾醇4种活性成分的含量为评价指标,采用综合加权法,考察不同处理方式(切片、不切片)和不同干燥方法(阴干、晒干、热风干燥、微波干燥、冷冻干燥)对三叶青活性成分保留的影响,为三叶青药材的产业化奠定基础。
1 材料
1.1 仪器
BS124S电子分析天平(德国Sartorius公司);UV2700紫外分光光度计(日本Shimadzu公司);UF260电热恒温鼓风干燥箱(德国Memmert公司);台式真空冷冻干燥机(美国Labconco公司);HHS11-8电热恒温水浴锅(上海博迅实业有限公司);H2500R高速离心机(湖南湘仪实验室仪器开发有限公司);111B高速中药粉碎机(瑞安市永历制药机械有限公司);P70D20TL-D4微波炉(广东格兰仕集团有限公司);KQ-300VDE超声波清洗机(昆山舒美超声仪器有限公司);Waters ACQUITY Arc液相色谱系统、2424蒸发光散射检测器(美国Waters公司)。
1.2 药材与试剂
三叶青于2016年11月中旬采集于浙江省舟山市万花谷种植基地(为减小个体差异影响,特别选择品种、年份、环境均一致的三叶青样本),样本经本院郑国平主任中药师鉴定均为葡萄科植物三叶崖爬藤的块根;芦丁(批号:100080-201610,纯度:92.6%)、D-无水葡萄糖(以下简称葡萄糖,批号:110833-201506,纯度:99.9%)、没食子酸(批号:110831-201605,纯度:90.8%)、β-谷甾醇(批号:110851-201608,纯度:97.0%)对照品均购自中国食品药品检定研究院;水为超纯水,甲醇为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 加工方法
挑选形态完整、大小相近的三叶青块根,洗净,沥干,一部分作为不切片样品,另一部分切成厚度为7 mm的片状,作为切片处理样品。将样品按以下5种干燥方法[13]分别进行加工处理:(1)阴干:置于室内阴凉通风处;(2)晒干:置于室外阳光下晾晒;(3)热风干燥:置于电热鼓风干燥箱内,设定温度60℃,恒温烘干;(4)微波干燥:置于微波炉中,低火模式下间歇加热;(5)冷冻干燥:置于冷冻干燥机内,设定温度为-55℃,真空度为0.02 psi(1 psi=6.895 kPa)。除微波干燥每隔2 min翻动1次外,其余干燥方法均每隔3 h翻动1次,直至连续2次测定的质量差小于1 g时终止干燥。将干燥后样品粉碎,过3号筛,置于干燥器中,备用。
2.2 水分测定
取不同干燥方法下的三叶青粉适量,按照2015年版《中国药典》(四部)水分测定法项下第二法[14]测定。结果,各样品的水分含量均低于12%,结果见表1。
2.3 含量测定
2.3.1 总黄酮含量

表1 不同干燥工艺样品水分测定结果Tab1 Determination results of moisture content of samples by different drying technologies
(1)芦丁标准曲线绘制:参照沙棘总黄酮含量测定方法[15],以芦丁质量浓度(mg/mL)为横坐标(x)、吸光度为纵坐标(y)进行线性回归,得回归方程为y=10.660 1x+0.030 6(r=0.999 1)。结果表明,芦丁检测质量浓度线性范围为0.017 3~0.086 5 mg/mL。
(2)供试品溶液制备:取三叶青粉约2 g,精密称定,置于锥形瓶中,加75%乙醇20 mL,超声(功率:300 W,频率:40 kHz)提取2次,每次30 min,滤过;滤液合并至50 mL量瓶中,加75%乙醇定容,即得。
(3)含量测定:精密量取供试品溶液1 mL,置于10 mL量瓶中,显色处理,测定吸光度,根据回归方程计算三叶青总黄酮含量。
2.3.2 总多酚含量
(1)溶液制备:①对照品溶液。精密称取没食子酸对照品13.19 mg,置于50 mL量瓶中,加乙醇溶解,摇匀,即得。②供试品溶液。同“2.3.1(2)”项下方法制备。
(2)方法学考察:①标准曲线的制备。分别精密量取0.5、0.8、1.2、1.5、2.0 mL的对照品溶液,置于25 mL量瓶中,参考刘丹等[16]报道的方法,以没食子酸质量浓度(mg/mL)为横坐标(x)、吸光度为纵坐标(y)进行线性回归,得回归方程为y=8.249 3x-0.025 7(r=0.998 4)。结果表明,没食子酸检测质量浓度线性范围为0.004 8~0.019 1 mg/mL。②精密度试验。取对照品溶液测定5次,记录吸光度,计算RSD为1.31%(n=5)。③重复性试验。精密称取同一样品(切片,阴干)6份,按“2.3.1(2)”项下方法制备供试品溶液并测定,计算总多酚含量的RSD为2.04%(n=6)。④准确度试验。精密称取已知含量的样品(切片,阴干)9份,每份约1.0 g,分别按已知含量的80%、100%、120%3个水平加入对照品适量,按“2.3.1(2)”项下方法制备供试品溶液并测定,计算回收率,结果平均加样回收率为96.21%(RSD=1.80%,n=9)。
2.3.3 多糖含量
(1)多糖标准曲线绘制:参考黄精多糖含量测定方法[15],以葡萄糖质量浓度(mg/mL)为横坐标(x)、吸光度为纵坐标(y)进行线性回归,得回归方程为y=50.558 9x-0.0219 9(r=0.997 6)。结果表明,葡萄糖检测质量浓度线性范围为0.004 2~0.042 1 mg/mL。
(2)供试品溶液制备:取三叶青粉约0.5 g,精密称定,置于50 mL量瓶中,加40 mL水,沸水浴中加热2 h,放冷,定容,离心(转速:5 000 r/min,半径:9.6 cm)10 min;精密量取上清液5 mL,加无水乙醇20 mL,4℃静置过夜,离心(转速:6 000 r/min,半径:9.0 cm)5 min,弃上清;沉淀用80%乙醇洗涤后离心(转速:6 000 r/min,半径:9.0 cm)5 min,重复3次;沉淀用水溶解,定容至25 mL量瓶,即得。
(3)含量测定:精密量取供试品溶液2 mL,置于10 mL具塞试管中,显色处理,测定吸光度,根据回归方程计算三叶青多糖含量。2.3.4β-谷甾醇含量
(1)色谱条件:色谱柱为岛津Inertsil ODS-3(250 mm×4.6 mm,5 μm);流动相为甲醇[17];流速为0.7 mL/min;柱温为30℃;漂移管温度为40℃;载气压力为40 psi;进样量为10 μL。
(2)溶液制备:①对照品溶液。精密称取β-谷甾醇对照品18.21 mg,置于100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得。②供试品溶液。取三叶青粉约2 g,精密称定,置于具塞锥形瓶中,加入氯仿50 mL,浸泡1 h,超声(功率:300 W,频率:40 kHz)30 min,滤过;滤液蒸干,残渣加甲醇溶解,转移至10 mL量瓶中,稀释至刻度,摇匀,即得。
(3)方法学考察:①标准曲线的制备。分别精密吸取1、2、5、8、10 μL对照品溶液,分别注入液相色谱仪中,按上述色谱条件测定色谱峰面积。以β-谷甾醇峰面积的自然对数为纵坐标(y)、对照品溶液质量浓度的自然对数为横坐标(x)进行线性回归,得回归方程为y=1.186 1x-5.584 0(r=0.999 8)。结果表明,β-谷甾醇检测质量浓度线性范围为0.176 6~1.766 4 μg/mL。②精密度试验。取同一份供试品溶液,连续进样5次,记录峰面积,计算RSD为0.42%(n=5)。③重复性试验。精密称取同一样品(切片,阴干)6份,按“(2)②”项下方法制备供试品溶液,在上述色谱条件下分别进样测定,计算β-谷甾醇含量的RSD为1.87%(n=6)。④稳定性试验。精密吸取同一份供试品溶液,分别于0、2,4、8、12 h进样,测定峰面积,计算RSD为1.13%(n=5)。⑤准确度试验。精密称取已知含量的样品(切片,阴干)9份,每份约1.0 g,分别按已知含量的80%、100%、120%3个水平加入对照品,按“(2)②”项下方法制备供试品溶液,在上述色谱条件下分别进样测定,计算回收率,结果平均加样回收率为97.05%(RSD=1.27%,n=9)。
2.4 综合评分结果
黄酮、多糖、多酚和β-谷甾醇均是三叶青的重要活性成分,且在药材中含量丰富、功效明确。采用综合加权评分法[18],设定上述4种成分含量(Y1、Y2、Y3、Y4)的权重系数各为0.25,按综合评分(Y)计算公式Y=0.25Y1/Y1max+0.25Y2/Y2max+0.25Y3/Y3max+0.25Y4/Y4max,求出各干燥工艺处理后样品的综合评分,结果见表2。
由表2可见,与不切片比较,三叶青切片后可缩短干燥时间,减少药材中活性成分的损耗;5种干燥方法中,冷冻干燥对三叶青中活性成分保留效果最好,切片干燥后药材中总黄酮、多糖、总多酚和β-谷甾醇的含量分别约为18.5、92.7、9.19、0.344 mg/g。
表2 不同干燥工艺样品中活性成分的含量比较(±s,n=3)Tab2 Comparison of contents of active ingredients in samples by different drying technologies(±s,n=3)
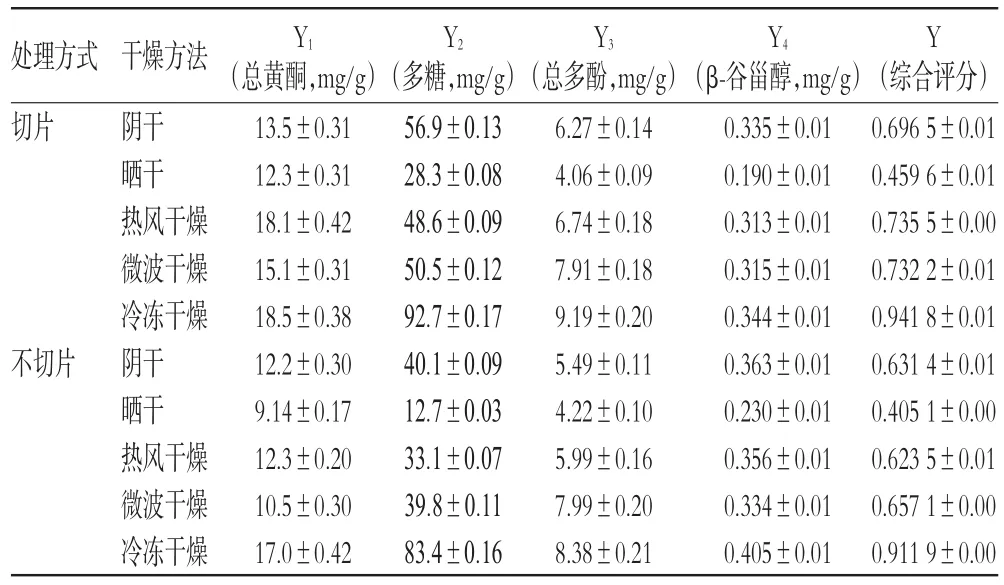
表2 不同干燥工艺样品中活性成分的含量比较(±s,n=3)Tab2 Comparison of contents of active ingredients in samples by different drying technologies(±s,n=3)
处理方式切片Y1Y2Y3Y4Y不切片干燥方法阴干晒干热风干燥微波干燥冷冻干燥阴干晒干热风干燥微波干燥冷冻干燥(总黄酮,mg/g)13.5±0.31 12.3±0.31 18.1±0.42 15.1±0.31 18.5±0.38 12.2±0.30 9.14±0.17 12.3±0.20 10.5±0.30 17.0±0.42(多糖,mg/g)56.9±0.13 28.3±0.08 48.6±0.09 50.5±0.12 92.7±0.17 40.1±0.09 12.7±0.03 33.1±0.07 39.8±0.11 83.4±0.16(总多酚,mg/g)6.27±0.14 4.06±0.09 6.74±0.18 7.91±0.18 9.19±0.20 5.49±0.11 4.22±0.10 5.99±0.16 7.99±0.20 8.38±0.21(β-谷甾醇,mg/g)0.335±0.01 0.190±0.01 0.313±0.01 0.315±0.01 0.344±0.01 0.363±0.01 0.230±0.01 0.356±0.01 0.334±0.01 0.405±0.01(综合评分)0.696 5±0.01 0.459 6±0.01 0.735 5±0.00 0.732 2±0.01 0.941 8±0.01 0.631 4±0.01 0.405 1±0.00 0.623 5±0.01 0.657 1±0.00 0.911 9±0.00
2.5 双因素方差分析
采用SPSS 19.0统计软件,对数据进行双因素方差分析,其中主效应A为2种处理方式,主效应B为5种干燥方法,结果见表3。

表3 主体间效应的检验结果Tab3 Test result for between-subjects effects
由表3可知,主效应A、B对三叶青质量均有极显著影响(P<0.01),而且主效应B(5种干燥方法)影响更明显。相同干燥方法下,切片处理的三叶青中活性成分含量均高于不切片处理的样品,原因可能是由于切片处理后缩短了干燥时间,从而减少了总黄酮、总多酚和多糖成分的损耗。再进一步采用Tukey HSD检验法对主效应B(将阴干、晒干、热风干燥、微波干燥、冷冻干燥方式依次设为B1、B2、B3、B4、B5)进行多重比较分析,结果见表4。
由表4可知,B2(晒干)和B5(冷冻干燥)测定结果与其他方法比较均有极显著差异(P<0.01);B1(阴干)与B3(热风干燥)、B3(热风干燥)与B4(微波干燥)比较均有显著差异(P<0.05)。这提示不同干燥方法对三叶青质量影响较大,其中冷冻干燥效果最佳,随后依次为微波干燥、热风干燥、阴干和晒干。
3 讨论
干燥作为保证中药材品质的重要措施,是药材加工中一个必不可少的工艺过程。目前,中药材干燥方法可分为常温干燥、加热干燥和低温干燥3大类,各类干燥方法所需时间不同,对药材成分影响各异[19],应根据药材特性和加工效率选择合适的干燥工艺。本文通过考察不同干燥方法对三叶青中以黄酮、多糖、多酚、甾醇为代表的活性成分的影响,发现冷冻干燥能较好地保留三叶青中的活性成分,是最佳的干燥方法;微波干燥和60℃热风干燥效果相近,且稍优于阴干;晒干对三叶青总多酚和多糖的损耗较明显,得到的药材质量也明显劣于其他干燥方法,因此不适合作为三叶青的干燥方法。

表4 主效应B的Tukey HSD检验结果Tab4 Results of Tukey HSD test of main effect B
切片处理与不切片处理的三叶青在相同干燥条件下,前者因为增加了比表面积,大幅缩短了干燥时间,药材中的总黄酮、总多酚和多糖含量均高于后者;β-谷甾醇含量虽相对较低,但切片干燥后的三叶青药材质量仍优于不切片干燥的药材。这为药材炮制规范中“切厚片,干燥”这一工序的合理性提供了试验支持。
根据上述研究结果,三叶青最佳干燥工艺为切厚片后冷冻干燥,但冷冻干燥设备成本高、批次处理量少,不适合产业化推广。微波干燥虽处理时间短,但在干燥期间需间隔数分钟取出翻动1次,释放热量,待冷却至室温后继续干燥,如此反复,人力成本较高;另干燥后药材切面为浅棕色,与现行标准中的性状描述不符,需进一步研究其护色工艺。阴干方法操作简单、成本低,但干燥时间长,遇到阴雨天药材易腐败变质,且暴露在环境中易受到污染。而三叶青在60℃下热风干燥所需时间少于冷冻干燥,干燥后药材质量也较优。故综合干燥成本、药材质量和产业推广等各方面,笔者认为将新鲜的三叶青块根切片后,采用60℃热风干燥是较适宜的干燥工艺。
[1] 浙江省食品药品监督管理局.浙江省中药炮制规范[S].北京:中国医药科技出版社,2016:5.
[2] 中国医学科学院药物研究所.中药志[M].北京:人民卫生出版社,1959:219.
[3] 江苏新医学院.中药大辞典[M].上海:上海人民出版社,1986:2123.
[4] 湖南省食品药品监督管理局.湖南省中药材标准[S].长沙:湖南科学技术出版社,2010:143.
[5] 王静,彭昕.三叶青提取物诱导人肝内胆管癌HCCC-9810细胞凋亡的研究[J].中国药师,2015,18(7):1081-1085.
[6] 李华美,魏克民.三叶青乙酸乙酯提取物对小鼠Lewis肺癌的抑制作用[J].医学研究杂志,2012,41(9):112-115.
[7] 吴舟涛,朱玲燕,吴学谦,等.三叶青化学成分和抗肿瘤作用研究进展[J].中南药学,2017,15(3):319-324.
[8] 马丹丹,李伟平,马哲龙,等.三叶青多糖抗肝损伤作用的研究[J].医学研究杂志,2012,41(1):33-36.
[9] 熊科辉,吴学谦,许海顺,等.不同干燥方法对三叶青活性成分含量的影响[J].中国药业,2015,24(8):48-50.
[10] 刘琴,林玲.三叶青有效成分的提取效果分析[J].海峡药学,2014,26(3):70-72.
[11] 林婧,纪明妹,黄泽豪,等.三叶青的化学成分及其体外抗肿瘤活性研究[J].中国药学杂志,2017,52(4):658-663.
[12] 曾美玲,沈耐涛,吴赛伟,等.基于UPLC-Triple-TOF/MS方法的三叶青化学成分分析[J].中草药,2017,48(5):33-42.
[13] 徐兰芳,鲁芹飞,张扬,等.干燥方法对铁皮石斛质量的影响研究[J].中国药房,2015,26(13):1808-1811.
[14] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:104.
[15] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:184、307.
[16] 刘丹,江帆,丁小艳,等.黔产刺梨果中总多酚的含量测定及其干燥方式考察[J].中国实验方剂学杂志,2016,22(23):20-23.
[17] 刘宇文,殷红妹,邹耀华,等.HPLC-ELSD法测定三叶青中的β-谷甾醇的含量[J].中华中医药学刊,2012,30(6):1387-1389.
[18] 房方,李祥,郭戎,等.多指标正交试验法优选紫石英最佳炮制工艺[J].中成药,2010,32(10):1733-1736.
[19] 单鸣秋,张丽,丁安伟.中药材饮片干燥技术的研究进展[J].中成药,2011,33(7):1216-1219.
Effects of Different Drying Technologies and Slicing on the Quality of Tetrastigma hemsleyanum by Multi-indexes Evaluation
CHEN Xiang,GUO Haibo,LIU Ting,XU Jingjing,ZHENG Guoping(Drug Inspection and Testing Laboratory,Zhoushan Institute for Food and Drug Control,Zhejiang Zhoushan 316021,China)
OBJECTIVE:To study the effects of different drying technologies and slicing on the quality of Tetrastigma hemsleyanum,and optimize the drying methods for T.hemsleyanum.METHODS:2 treatment methods(slicing and no slicing)and 5 drying methods(drying in the shade,drying in the sunlight,hot-air drying,microwave drying and freeze drying)were respectively adopted for the T.hemsleyanum root.After drying for 3.5-213.0 h,using the total flavonoids,total polyphenols,polysaccharides and β-sitosterol as indexes,effects of different drying technologies on the quality of T.hemsleyanum were comparatively analyzed.RESULTS:Compared with no slicing,sliced T.hemsleyanum can shorten the drying time and reduce the loss of active ingredients.In the 5 drying methods,freeze drying was the best for keeping the active ingredients in T.hemsleyanum.After drying,the contents of total flavonoids,polysaccharides,total polyphenols and β-sitosterol were 18.5 mg/g,92.7 mg/g,9.19 mg/g and 0.344 mg/g respectively,followed by microwave drying,hot-air drying,drying in the shade and drying in the sunlight.The contents of active ingredients had statistical significance by each drying methods(P<0.05 orP<0.01).CONCLUSIONS:Different drying technologies have obvious effects on the quality of T.hemsleyanum.Slicing and hot-air drying at 60℃were suggested as suitable method forT.hemsleyanum in terms of cost,content of active ingredients and practicability.
Tetrastigma hemsleyanum;Drying technology;Hot-air drying;Total flavonoids;Total polyphenols;Polysaccharides;β-sitosterol
R283
A
1001-0408(2017)31-4441-04
DOI 10.6039/j.issn.1001-0408.2017.31.31
舟山市公益类科技项目(No.2015C31045)
*副主任药师,硕士。研究方向:药材加工与中药质量控制。电话:0580-2183120。E-mail:cx_1983@163.com
2017-04-05
2017-06-29)
(编辑:刘萍)
