熟地黄、山茱萸、茯苓单煎液与合煎液中毛蕊花糖苷、没食子酸煎出量的变化Δ
2017-11-16杨明明王慧娜缪红张万红赵桂琴承德医学院中药研究所河北承德067000河北省中药研究与开发重点实验室河北承德067000承德市中医院中医门诊部河北承德067000
杨明明,王慧娜,缪红,2,张万红,赵桂琴,2#(.承德医学院中药研究所,河北承德067000;2.河北省中药研究与开发重点实验室,河北承德067000;.承德市中医院中医门诊部,河北承德067000)
·实验研究·
熟地黄、山茱萸、茯苓单煎液与合煎液中毛蕊花糖苷、没食子酸煎出量的变化Δ
杨明明1*,王慧娜1,缪红1,2,张万红3,赵桂琴1,2#(1.承德医学院中药研究所,河北承德067000;2.河北省中药研究与开发重点实验室,河北承德067000;3.承德市中医院中医门诊部,河北承德067000)
目的:考察熟地黄、山茱萸及茯苓单煎液与合煎液中毛蕊花糖苷、没食子酸煎出量的变化,为深入研究合煎液的药效物质基础提供科学依据。方法:分别制备熟地黄、山茱萸、茯苓的单煎液、两两合煎液及三药合煎液,采用高效液相色谱法检测各煎液中熟地黄的有效成分毛蕊花糖苷和山茱萸的有效成分没食子酸的煎出量,并进行比较。结果:与熟地黄单煎液比较,茯苓+熟地黄合煎液中毛蕊花糖苷煎出量降低(P<0.01),山茱萸+熟地黄和三药合煎液中毛蕊花糖苷煎出量升高(P<0.01);与山茱萸单煎液比较,各合煎液中没食子酸煎出量均降低(P<0.01)。结论:山茱萸、茯苓与熟地黄合煎时对熟地黄中毛蕊花糖苷的煎出分别具有一定的促进、抑制作用;熟地黄、茯苓与山茱萸合煎对山茱萸中没食子酸的煎出均有一定的抑制作用。推测毛蕊花糖苷可能是合煎液发挥药效作用的主要成分之一。
熟地黄;茯苓;山茱萸;合煎;单煎;毛蕊花糖苷;没食子酸;煎出量
山茱萸、熟地黄及茯苓多以单味或复方入药,均有改善学习记忆能力的作用[1]。药理研究表明,熟地黄水提物可增加脑内促红细胞生成素的表达并改善衰老大鼠的学习记忆能力[2];山茱萸多糖可改善血管性痴呆大鼠的学习记忆能力[3];茯苓水提物能改善化学药物所致学习记忆障碍小鼠的学习记忆能力[4]。
本课题组前期选取临床或药理试验结果显示具有良好增强学习记忆能力的几种药材,根据补肾、补肝脾、利水的原则组方并制备成水煎液,通过小鼠水迷宫实验进行活性筛选。实验结果表明,熟地黄、山茱萸、茯苓合煎液组与单煎液组及空白对照组比较,合煎液组在增强小鼠学习记忆能力方面作用较强。
毛蕊花糖苷为熟地黄中的代表性成分[5],能明显改善D-半乳糖所致亚急性衰老模型小鼠的学习记忆能力障碍[6]。山茱萸中的代表性成分为马钱苷、莫诺苷、没食子酸等[7],其中马钱苷、莫诺苷可通过提高D-半乳糖致衰星形胶质细胞的增殖能力,使衰老细胞的抗氧化能力增强,从而发挥抗衰老作用[8];没食子酸能够显著改善侧脑室注射链脲霉素所造成的大鼠记忆障碍[9]。结合前期药理实验结果,本课题组推测合煎液中毛蕊花糖苷、没食子酸、马钱苷及莫诺苷煎出量的变化或许与合煎液药效的提高有一定关系。为探讨合煎液增强小鼠学习记忆作用优于单煎液的物质基础,本研究拟对合煎液中的已知活性成分毛蕊花糖苷、没食子酸的煎出量与其单煎液中的煎出量进行比较。
1 材料
1.1 仪器
AG-245电子分析天平(瑞士Mettler-Toledo公司);1200高效液相色谱仪,包括Chemstation化学工作站、二极管阵列检测器(DAD),均来源于美国安捷伦科技有限公司。
1.2 药材、对照品与试剂
熟地黄(批号:1608001)、山茱萸(批号:1608001)、茯苓(批号:1608003)均购自北京同仁堂承德连锁药店有限公司,经军事医学科学院生药学博士李彬鉴定,分别是玄参科地黄(Rehmanniae glutinosa Libosch.)块根的加工炮制品熟地黄(Rehmanniae radix preparata)、山茱萸科山茱萸(Cornus officinalis Sieb.et Zucc.)的干燥成熟果肉和多孔菌科真菌茯苓[Poria cocos(Schw.)Wolf]的干燥菌核;毛蕊花糖苷对照品(成都普菲德生物技术有限公司,批号:150401,纯度:99.9%);没食子酸对照品(北京盈泽纳新化工技术研究院,批号:16022801,纯度:99.0%);水为超纯水,乙腈为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 浸膏的制备与出膏率的测定
2.1.1 组别设计试验共设7组,分别为单煎液-1组(山茱萸20 g)、单煎液-2组(熟地黄20 g)、单煎液-3组(茯苓20 g)、合煎液-1组(山茱萸、熟地黄、茯苓各20 g)、合煎液-2组(山茱萸、熟地黄各20 g)、合煎液-3组(山茱萸、茯苓各20 g)、合煎液-4组(熟地黄、茯苓各20 g)。
2.1.2 浸膏的制备(1)合煎液-1组:称取熟地黄20 g、山茱萸20 g、茯苓20 g,置于烧杯中,加10倍量的水浸泡12 h,煎煮45 min后滤过,保留煎液;在药渣中加入约600 mL水,再煎煮20 min,滤过,保留煎液。参考文献[10-11]方法,将2次煎液合并且浓缩至150 mL左右,置于蒸发皿中,在鼓风干燥箱中60℃干燥72 h,再置于干燥器中干燥30 min后,迅速精密称质量。(2)其余各组:按各组药材取量后,参照合煎液-1组方法制备干浸膏。
2.1.3 出膏率的测定将7组煎液按照“2.1.2”项下方法浓缩、干燥、称质量后计算出膏率(%)[浸膏质量(g)/原药材质量(g)×100%]。经计算,各组出膏率分别为单煎液-1组58.0%、单煎液-2组46.5%、单煎液-3组5.5%、合煎液-1组35.8%、合煎液-2组52.1%、合煎液-3组31.6%、合煎液-4组35.5%。
2.2 毛蕊花糖苷和没食子酸的含量测定
2.2.1 色谱条件2种成分采用的色谱柱均为ZORBAX Eclipse XDB-Phenyl C18(250 mm×4.6 mm,5 μm)。(1)毛蕊花糖苷。流动相:乙腈-0.1%醋酸水溶液(17∶83);流速:1 mL/min;检测波长:334 nm;柱温:30℃;进样量:20 μL。(2)没食子酸。流动相:乙腈-0.3%磷酸水溶液(7∶93);流速:1 mL/min;检测波长:240 nm;柱温:30℃;进样量:10 μL。
2.2.2 对照品溶液的制备分别精密称定毛蕊花糖苷对照品及没食子酸对照品适量,分别加入各自的流动相,制备成毛蕊花糖苷、没食子酸质量浓度分别为4.1、11.3 μg/mL的对照品溶液。
2.2.3 毛蕊花糖苷供试品溶液的制备(1)合煎液-1组。参考2015年版《中国药典》(一部)方法[5],以1 g熟地黄原药材为准,根据出膏率计算后,精密称定1.1 g干浸膏于圆底烧瓶中,精密加入甲醇50 mL,称定质量;加热回流30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过。精密量取续滤液25 mL,减压回收至溶剂近干,残渣用流动相溶解后,将溶液转移至5 mL量瓶中,加流动相至刻度,摇匀,即得。(2)其他组。均以1 g熟地黄原药材为准,根据出膏率计算后,精密称定一定质量干浸膏,参照“2.2.3(1)”项下方法制备。
2.2.4 没食子酸供试品溶液的制备(1)合煎液-1组。参考文献[7]方法,以0.2 g山茱萸原药材为准,根据出膏率计算后,精密称定0.22 g干浸膏置于具塞锥形瓶中,精密加入25 mL的80%甲醇,密塞,称量;加热回流1 h,放冷,再称量,用80%甲醇补足减失的质量,摇匀,滤过。精密量取续滤液10 mL,减压回收至溶剂近干,残渣用流动相溶解后转移至10 mL量瓶中,加流动相至刻度,摇匀,即得。(2)其他组。均以0.2 g山茱萸原药材为准,根据出膏率计算后,精密称定一定质量干浸膏后,参照“2.2.4(1)”项下方法制备。
2.2.5 测定方法取上述各组供试品溶液及对照品溶液,进样测定;计算煎出量,即每煎1 g熟地黄原药材所煎出的毛蕊花糖苷量(mg/g)、每煎1 g山茱萸原药材所煎出的没食子酸量(mg/g)。
各供试品溶液及对照品溶液的色谱图见图1、图2。
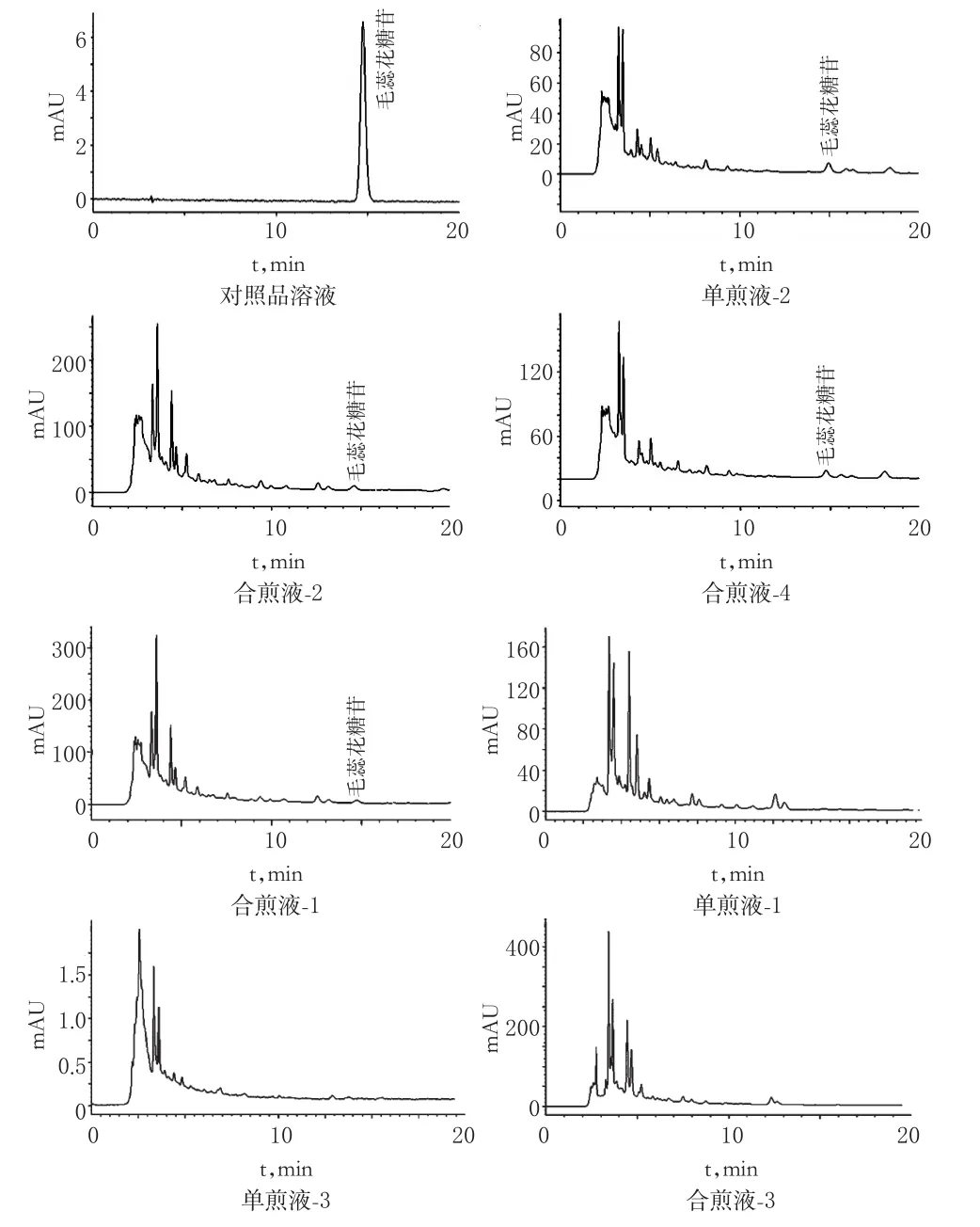
图1 毛蕊花糖苷高效液相色谱图Fig1 HPLC chromatograms of verbascoside

图2 没食子酸高效液相色谱图Fig2 HPLC chromatograms of gallic acid
2.2.6 线性关系考察精密称定毛蕊花糖苷对照品0.5 mg,置于50 mL量瓶中,加流动相溶解并稀释至刻度;分别精密量取1、2、3、4、6、8 mL,置于10 mL量瓶中,加流动相稀释至刻度,摇匀,按上述色谱条件,分别进样20 μL。以峰面积为纵坐标(y)、毛蕊花糖苷进样量为横坐标(x)进行线性回归,得回归方程为y=33.946 x-6.821 9(r2=0.999 5)。结果表明,毛蕊花糖苷进样量线性范围为0.000 4~0.003 2 μg。另精密吸取没食子酸对照品溶液0.5、1、5、10、15、20 μL,进样测定。以峰面积为纵坐标(y)、进样量为横坐标(x)进行线性回归,得回归方程为y=1 037.8x+0.376 6(r2=1.000 0),表明没食子酸进样量线性范围为0.005 7~0.226 4 μg。
2.2.7 精密度试验按相关方法操作并计算,结果毛蕊花糖苷与没食子酸对照品溶液峰面积的RSD分别为1.7%、2.2%(n=6),表明仪器精密度良好。
2.2.8 重复性试验按相关方法操作并计算,结果毛蕊花糖苷与没食子酸煎出量的平均值分别为0.042 7、0.705 6 mg/g,RSD分别为2.5%、1.6%(n=6),表明方法重复性良好。
2.2.9 稳定性试验按相关方法操作,分别将供试品溶液(合煎液-1组)放置0、2、4、8、12、24 h后进样分析并计算,结果毛蕊花糖苷、没食子酸峰面积的RSD分别为2.1%、2.2%(n=6),表明供试品溶液在24 h内基本稳定。
2.2.10 准确度试验按相关方法操作并计算,结果毛蕊花糖苷、没食子酸的加样回收率分别为98.4%~102.5%(平均值为100.2%,RSD=1.5%,n=6)、98.7%~102.2%(平均值为100.2%,RSD=1.4%,n=6)
2.2.11 样品测定结果取“2.1.1”项下7个组样品,每组6份,按照“2.1.2”“2.2.3”“2.2.4”项下方法分别制备毛蕊花糖苷及没食子酸供试品溶液。按“2.2.1”项下色谱条件进样检测,每份均进样2次。结果,只在含有熟地黄的组中测出毛蕊花糖苷,只在含有山茱萸的组中测出没食子酸。对煎出量数据采用SPSS 17.0统计软件处理并采用成组t检验进行分析比较。不同煎液中毛蕊花糖苷、没食子酸煎出量测定结果见表1、表2。
结果表明,各组煎液中的煎出量比较差异均有统计学意义(P<0.01)。各组合煎液与熟地黄单煎液比较:山茱萸与熟地黄合煎后,其毛蕊花糖苷煎出量的增加率为23.2%;茯苓与熟地黄合煎后,毛蕊花糖苷煎出量的减少率为2.0%;山茱萸、茯苓与与熟地黄合煎后,毛蕊花糖苷煎出量的增加率为8.9%。各组合煎液与山茱萸单煎液比较:熟地黄与山茱萸合煎后,没食子酸煎出量的减少率为8.3%;茯苓与山茱萸合煎后,没食子酸煎出量的减少率为3.5%;熟地黄、茯苓与山茱萸合煎后,没食子酸煎出量的减少率为9.0%。可见,山茱萸对熟地黄中毛蕊花糖苷的煎出具有促进作用,而茯苓对熟地黄中毛蕊花糖苷的煎出有一定的抑制作用;熟地黄与茯苓以及山茱萸合煎后均对山茱萸中没食子酸的煎出有抑制作用。
表1 含熟地黄的各组供试品溶液中毛蕊花糖苷的煎出量测定结果(±s,n=6)Tab1 Results of verbascoside decoction amount in test sample solutions containing rehmanniae radix preparata in each group(±s,n=6)

表1 含熟地黄的各组供试品溶液中毛蕊花糖苷的煎出量测定结果(±s,n=6)Tab1 Results of verbascoside decoction amount in test sample solutions containing rehmanniae radix preparata in each group(±s,n=6)
注:与单煎液-2组比较,**P<0.01;“+”表示增加,“-”表示减少Note:vs.single decoction-2 group,**P<0.01;“+”means increase,“-”means decrease
与单煎液-2组比较煎出量增加/减少率,%+(8.9±3.8)+(23.2±4.2)-(2.0±1.9)组别单煎液-2组合煎液-1组合煎液-2组合煎液-4组煎出量,mg/g 0.039 2±0.000 5 0.042 7±0.000 9**0.048 3±0.001 0**0.038 4±0.000 2**
表2 含山茱萸的各组供试品溶液中没食子酸的煎出量测定结果(±s,n=6)Tab2 Results of gallic acid decoction amount in test sample solutions containing corni fructus in each group(±s,n=6)

表2 含山茱萸的各组供试品溶液中没食子酸的煎出量测定结果(±s,n=6)Tab2 Results of gallic acid decoction amount in test sample solutions containing corni fructus in each group(±s,n=6)
注:与单煎液-1组比较,**P<0.01;“-”表示减少Note:vs.single decoction-1 group,**P<0.01;“-”means decrease
组别单煎液-1组合煎液-1组合煎液-2组合煎液-3组与单煎液-1组比较煎出量增加/减少率,%-(9.0±0.2)-(8.3±0.3)-(3.5±0.3)煎出量,mg/g 0.775 5±0.001 3 0.705 6±0.000 7**0.711 5±0.000 9**0.748 2±0.001 1**
3 讨论
本文探讨了山茱萸、熟地黄、茯苓合煎液中毛蕊花糖苷和没食子酸煎出量的变化。结果表明,山茱萸对熟地黄中毛蕊花糖苷的煎出具有一定的促进作用,茯苓对熟地黄中毛蕊花糖苷的煎出具有一定的抑制作用;熟地黄和茯苓对山茱萸中没食子酸的煎出均有一定的抑制作用。毛蕊花糖苷在三药合煎液中的煎出量与熟地黄单煎液比较,煎出量增加;没食子酸在三药合煎液中的煎出量与山茱萸单煎液比较,煎出量降低。结合前期药理实验结果,笔者推测合煎液中毛蕊花糖苷煎出量的增加可能是合煎液药效优于熟地黄单煎液的原因之一;也可能是在合煎过程中,产生了某些新的药效成分,或者可能是毛蕊花糖苷、没食子酸与合煎液中的其他药效成分含量达到一个合适的水平,从而显示出更好的药效[12]。从图1、图2中还可以发现,各供试品溶液中部分峰的高度也存在一定差异,提示合煎使不同组分的煎出量发生了变化,这很可能也是合煎液与单煎液药效差异的原因之一。
不同药材中的成分差异很大,故各煎液的出膏率差异也可能较大。本试验中,茯苓单煎液的出膏率只有5.5%,与其他组差异过大。经过查阅文献[13]可知,因为茯苓中含有93%以上的茯苓多糖,而茯苓多糖难溶于水,当茯苓用水煎煮后,不溶于水的茯苓多糖会被当作药渣除去,故茯苓单煎液的出膏率很低。
有文献报道茯苓中含有茯苓酸,并对其含量进行了高效液相色谱分析[14]。故本课题组在前期试验中除了对毛蕊花糖苷及没食子酸的煎出量进行检测外,还对茯苓酸的煎出量也进行了检测。在茯苓单煎液中检测到茯苓酸,煎出量为20.83 μg/g,但在合煎液中却未检测到茯苓酸。可能的原因有两个:一是在合煎液中茯苓酸煎出量较低,无法测出;二是可能在合煎过程中茯苓酸发生了化学反应,转化生成了其他物质。
考虑到合煎液中各待测成分的干燥温度与损失率的关系,如合煎液中已知成分梓醇在干燥温度50~60℃时的损失率最低[10],故在出膏率测定部分本课题组将《中国药典》中浸出物测定法的方法“水浴上蒸干后,于105℃干燥3 h[11]”,调整为“直接在鼓风干燥箱中60℃干燥72 h”。在测定没食子酸含量时,本课题组最初选择80%甲醇作为对照品及供试品的溶剂,但进样后色谱峰峰形异常(出现前沿及重叠峰),难以进行煎出量测定。于是将溶解溶剂改为流动相[乙腈-0.3%磷酸水溶液(7∶93)]后再进样检测,色谱峰前沿及重叠峰消失,峰形正常,可以进行正常检测。笔者分析,这可能与没食子酸的溶解性及特殊结构有关。
综上,本文的相关研究成果为后续熟地黄、山茱萸、茯苓合煎液药效成分的分离纯化及活性评价奠定了基础,也为深入阐明三药合煎液的药效物质基础提供了科学依据。
[1] 臧彩霞,鲍秀琦,孙华,等.中药复方治疗阿尔茨海默症的研究进展[J].中药药理与临床,2016,32(4):157-161.
[2] 李许,何然,王红玉,等.D-半乳糖致衰老大鼠脑内促红细胞生成素表达下调及熟地黄的逆转作用[J].中国药学杂志,2016,51(18):1562-1568.
[3] 李永格,刘庆春,等.山茱萸多糖对血管性痴呆大鼠学习记忆能力的影响及其机制研究[J].中国药房,2016,27(7):889-891.
[4] 张敏,陈冬雪,孙晓萌.茯苓水提液对小鼠学习记忆的影响[J].北华大学学报,2012,13(1):62-64.
[5] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:125.
[6] 高莉,彭晓明,霍世霞,等.毛蕊花糖苷改善D-半乳糖致亚急性衰老小鼠脑损伤的作用[J].中草药,2014,45(1):81-84.
[7]常增荣,李姣,郝博,等.中药山茱萸炮制前后特征化学成分的分析[J].药物分析杂志,2015,35(2):338-343.
[8] 马艳霞,王明艳,姜泽群,等.山茱萸活性成分对D-半乳糖致衰星形胶质细胞影响的实验研究[J].中国药理学通报,2014,30(12):1688-1692.
[9] Mansouri MT,Behnam BN,Farbood Y,et al.Gallic acid prevents memory deficits and oxidative stress induced by intracerebroventricular injection of streptozotocin in rats[J].Pharmacol Biochem Behav,2013,111(4):90-96.
[10] 李叶贝,张仲欣,许丹,等.生地干燥过程中梓醇损失的探讨[J].河南科技,2014,12(24):69-71.
[11] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:202.
[12] 于淼,韩佳瑞,焦拥政,等.中药及中药复方剂量阈、治疗窗的构建及思考[J].中医杂志,2011,52(20):1793-1794.
[13] 陈华.茯苓服用方法的建议[J].中药材,1996,19(3):157.
[14] 李蒙,王光忠,聂磊,等.茯苓不同部位中茯苓酸含量比较研究[J].时珍国医国药,2015,26(12):2858-2860.
Decoction Amount Changes of Verbascoside and Gallic Acid in Single Decoction and Combined Decoction of Rehmanniae Radix Preparata,Corni Fructus and Poria
YANG Mingming1,WANG Huina1,MIAO Hong1,2,ZHANG Wanhong3,ZHAO Guiqin1,2(1.Institute of Chinese Mateia Medica,Chengde Medical College,Hebei Chengde 067000,China;2.Hebei Key Laboratory of Research and Development for TCM,Hebei Chengde 067000,China;3.Chengde Hospital of TCM Outpatient Department of Chinese Medicine,Hebei Chengde 067000,China)
OBJECTIVE:To investigate the decoction amount changes of verbascoside,gallic acid in single decoction and combined decoction of rehmanniae radix preparata,corni fructus and poria,and provide scientific basis for further study of effective substance basis.METHODS:The single decoction,combined decoction with each 2 medicine and combined decoction with the 3 medicines of rehmanniae radix preparata,corni fructus and poria,were respectively prepared.HPLC was adopted to detect and compare the decoction amount of active component verbascoside in rehmanniae radix preparata and active component gallic acid in corni fructus in each group.RESULTS:Compared with single decoction of rehmanniae radix preparata,the decoction amount of verbascoside was decreased in combined decoction of poria+rehmanniae radix preparata(P<0.01),decoction amount of verbascoside was increased in combined decoction of corni fructus+rehmanniae radix preparata or combined decoction with the 3 medicines(P<0.01).Compared with single decoction of corni fructus,the decoction amount of gallic acid in each combined decoction was decreased(P<0.01).CON
CLUSIONS:The combined decoction of rehmanniae radix preparata,corni fructus and poria has certain promotion and inhibition effects on the decoction of verbascoside in rehmanniae radix preparata and inhibition effect on the decoction of gallic acid in corni fructus.It is speculated verbascoside may be one of the main components in combined decoction playing the role of effectiveness.
Rehmanniae radix preparata;Poria;Corni fructus;Combined decoction;Single decoction;Verbascoside;Gallic acid;Decoction amount
R283
A
1001-0408(2017)31-4350-05
DOI 10.6039/j.issn.1001-0408.2017.31.08
国家科技支撑计划项目(No.2011BAI07B04);河北省教育厅项目(No.ZD2016061);河北省中医药管理局项目(No.2015034);河北省高校重点学科建设项目(No.冀教高〔2013〕4号)
*硕士研究生。研究方向:中草药活性成分的分离纯化及含量测定。E-mail:yangminming92@sina.com
#通信作者:教授,博士。研究方向:天然活性产物。E-mail:zhaoguiqin1971@sina.com
2017-03-13
2017-05-06)
(编辑:刘萍)
