蒙药匝迪-5对慢性应激抑郁模型大鼠脑内单胺神经递质的影响
2017-11-16呼日乐巴根佟海英萨础拉呼和木仁乌兰其其格莲花白龙王布和朝鲁
呼日乐巴根,佟海英,萨础拉,呼和木仁,乌兰其其格,莲花,白龙,王布和朝鲁
蒙药匝迪-5对慢性应激抑郁模型大鼠脑内单胺神经递质的影响
呼日乐巴根1,佟海英2,萨础拉1,呼和木仁1,乌兰其其格1,莲花1,白龙1,王布和朝鲁1
(1.内蒙古医科大学,内蒙古 呼和浩特 010110;2.北京中医药大学,北京 100029)
目的:观察蒙药匝迪-5对CUM大鼠海马、前额叶皮质单胺递质的影响,探讨其作用机制。方法:将60只SD雄性大鼠按体质量随机分为正常组、模型组、西药组和蒙药低、中、高剂量组,每组10只。采用慢性不可预见性应激结合孤养的方法造模,以体质量变化、Open-field实验进行行为学评价及酶联免疫法(ELISA)检测大鼠海马和前额叶皮质5-HT、NE、DA的含量。结果:与正常组相比,模型组大鼠体质量增长缓慢,Open-Field实验水平活动得分和垂直活动得分降低,海马和前额叶皮质组织5-HT、DA及NE的含量显著降低(P<0.05,P<0.01)。与模型组相比,西药组和蒙药各剂量组可不同程度改善模型大鼠行为改变,其中氟西汀和匝迪-5高、中剂量可不同程度提高模型大鼠海马和前额叶皮质5-HT、DA、NE的含量(P<0.05,P<0.01),低剂量作用不明显。结论:匝迪-5的抗抑郁机制可能通过提高脑内5-HT、NE、DA的含量发挥作用。
匝迪-5;抑郁症;大鼠;单胺类神经递质
抑郁症(depression)是以行为上出现异常表现,心境低落为主要症状的精神障碍性疾病,具有高发病率、复发率、难治愈特点的常见病[1]。在全球范围内抑郁症所带来的伤残损失已经排在所有疾病的第二位,在我国总负担排名中居首位,在西方抑郁症的疾病负担预测到2030年将位列首位[2]。抑郁症的发病机制十分复杂,与遗传、生物化学、社会心理等多种因素有关,随着抑郁症研究的不断发展,通过多层次,多角度研究,提出了多种假说,但其发病机制尚不明确。我们前期研究中已成功造模,并证实匝迪-5可改善抑郁大鼠行为及学习记忆能力[3]。本实验研究基于抑郁症发病机制研究中发挥主导作用的“单胺假说”[4-5],旨在研究匝迪-5对CUM大鼠海马、前额叶皮质单胺类神经递质的影响,探讨其抗抑郁机制。
1 实验材料
1.1 动物
健康SD大鼠60只,雄性,体质量(200±20)g。购于北京维通利华实验动物技术有限公司,合格证号SCXK-(京)2012-0004。
1.2 药品与试剂
匝迪-5(内蒙古库伦蒙药厂,批号Z15020881);盐酸氟西汀胶囊(山西仟源制药股份有限公司,批号H20073985);5-羟色氨(5-HT)试剂盒(批号CSB-E08364r)、多巴胺(DA)试剂盒(批号CSB-E08660r)、去甲肾上腺素(NE)试剂盒(批号CSB-E07022r)等ELISA试剂盒(武汉华美生物工程有限公司)。
1.3 仪器
OFT-100型自主活动视频分析系统;MULTISKAN MK3全自动多功能酶标仪;ST16R台式高速冷冻离心机;YLS-19A大鼠电动断头器;Thermo-991超低温冰箱;BSA124S-CW电子天秤;手术刀、镊子等器材。
2 实验方法
2.1 动物分组
将60只SD大鼠适应性饲养1周后按体质量随机分为6组,分别为正常组、模型组、西药组、蒙药低、中、高剂量组,每组10只。
2.2 给药方法与剂量
造模第一天开始对各组大鼠进行灌胃给药。除正常组和模型组外,蒙药低、中、高剂量组分别给予匝迪-5研细末0.2、0.4、0.8 g/kg;西药组给予盐酸氟西汀3.6 mg/kg。按1.0 ml/100 g体积灌胃,每日固定时间给药,连续21 d。
2.3 造模
由慢性轻度不可预见性应激刺激(CUMS)配合孤养的方法进行复制模型。除正常组群养外,其余组单笼孤养,并给予21 d的不同刺激,包括禁食禁水24 h,高速水平震荡15 min,潮湿垫料24 h,4℃冷水游泳5 min,45℃热刺激5 min,夹尾1 min,昼夜颠倒12 h等。每日随机进行一种刺激,同类刺激不连续使用,21 d内每种刺激最多使用3次[6-7]。
2.4 检测项目
2.4.1 体质量变化
实验过程中观察各组大鼠的一般状态外,检测造模前、造模后第7 d、第14 d和第21 d的大鼠体质量动态变化。
2.4.2 Open-Field自主活动
采用动物活动视频分析系统,箱体规格为(长×宽×高)50 cm×50 cm×30 cm,箱内壁为黑色,底面划分为大小相等的9个等边方格,上方放置摄像机。末次给药次日,将动物放置于底面中心方格内,记录大鼠在3 min内水平活动和垂直活动情况(以大鼠穿越敞箱底面格数为水平活动得分,以直立次数为垂直活动得分)。
2.4.3 标本制备与检测
实验结束时,10%水合氯醛麻醉大鼠(剂量为0.3 ml/100 g),断头处死,开颅取大脑,在冰袋上迅速剥离海马及前额叶皮质,称重、放置速冻管、液氮速冻,并保存于-80℃超低温冰箱待测。利用酶联免疫吸附法(ELISA)按照试剂盒操作说明测试海马、前额叶皮质5-HT、DA、NE等单胺递质的水平。
2.5 统计学处理
3 结果
3.1 大鼠体质量变化情况比较
结果见表1,实验第7 d、14 d 和 21 d 模型组体质量较正常组显著降低,差异有统计学意义(P<0.05,P<0.01)。与模型组比较,实验第14 d蒙药中剂量组体质量显著增加,差异有统计学意义(P<0.01);实验第21 d西药组和蒙药中、低剂量组大鼠体质量显著增加,差异有统计学意义(P<0.05,P<0.01)。

表1 匝迪-5对各组大鼠体质量变化的影响
注:与正常组比较,△P<0.05,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.2 Open-Field自主活动情况比较
实验结果显示,与正常组相比,模型组大鼠水平穿越格数和直立次数均明显减少,差异有统计学意义(P<0.01)。与模型组相比,西药及蒙药中、高剂量组大鼠水平穿越格数明显增多,差异有统计学意义(P<0.05,P<0.01);高剂量组大鼠直立次数明显增多,差异有统计学意义(P<0.01)。结果见表2。
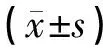
表2 匝迪-5对各组大鼠Open-Field自主活动的影响
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01。
3.3 对大鼠脑内5-HT含量的影响
实验结果显示,与正常组相比,模型组大鼠海马和前额叶皮质5-HT的含量均显著降低,差异有统计学意义(P<0.05)。与模型组相比,西药及蒙药中、高剂量组大鼠海马和前额叶皮质5-HT的含量均显著增加,差异有统计学意义(P<0.05);低剂量组大鼠脑内5-HT的含量与模型组相比无显著差异。结果见表3。
3.4 对大鼠脑内DA含量的影响
实验结果显示,与正常组相比,模型组大鼠海马和前额叶皮质DA的含量均显著降低,差异有统计学意义(P<0.01)。与模型组相比,西药及蒙药高剂量组大鼠海马和前额叶皮质DA的含量均显著增加,差异有统计学意义(P<0.05);中剂量组海马DA的含量显著增加,差异有统计学意义(P<0.05),低剂量组大鼠脑内DA的含量与模型组相比无显著差异。结果见表4。

表3 匝迪-5对各组大鼠海马、前额叶皮质5-HT含量的影响
注:与正常组比较,△P<0.05;与模型组比较,*P<0.05。

表4 匝迪-5对各组大鼠海马、前额叶皮质DA含量的影响
注:与正常组比较,△△P<0.01;与模型组比较,*P<0.05。
3.5 对大鼠脑内NE含量的影响
实验结果显示,与正常组相比,模型组大鼠海马和前额叶皮质NE的含量均显著降低,差异有统计学意义(P<0.05,P<0.01)。与模型组相比,西药及蒙药高剂量组大鼠海马和前额叶皮质NE的含量均显著增加,差异有统计学意义(P<0.05);低、中剂量组大鼠脑内NE的含量与模型组相比无显著差异。结果见表5。

表5 匝迪-5对各组大鼠海马、前额叶皮质NE含量的影响
注:与正常组比较,△P<0.05,△△P<0.01;与模型组比较,*P<0.05。
4 讨论
抑郁症的发病机制十分复杂,其发病机制尚不完全清楚,单胺类神经递质系统功能紊乱是抑郁症发病机制中重要的假说之一。目前主流观点认为中枢单胺类神经递质,5-HT、DA和NE含量减少,尤其是5-HT的绝对或相对缺乏是抑郁症发生的最有意义的病理生理机制[8-9]。迄今为止,已有20余种抑郁症动物模型,其中慢性不可预见性应激刺激(CUMS)和孤养两种经典造模方法的配合使用被广泛应用于抑郁症的生物学机制研究,并建立相应的动物模型进行抗抑郁药物研究[10-12]。这种模型模拟人类抑郁症的慢性、低水平的应激源导致特定的抑郁症状,慢性轻度应激使动物长时间处于应激状态,其发展的病理机制更接近导致人类抑郁症发生的主要原因之一,即日常生活压力状态。CUMS模拟抑郁症发病的压力源,加以孤养模拟患者失去亲人或社会支持的孤独状态,造成孤养动物的抑郁状态,在某种程度上模拟人类抑郁症的临床表现。
本实验研究中发现,接受21 d的应激刺激之后大鼠体质量变化缓慢,自主活动明显降低,其行为变化与文献报道一致。前额叶皮质和海马与抑郁症的发病密切相关,其中前额叶皮质是情绪调控的高级中枢,在认知、感觉和运动等多级协调体系中发挥重要作用。海马作为与情绪和认知关系密切的重要脑区,在调节情绪,学习和记忆,行为等方面发挥着重要作用,也是应激反应的高位调节中枢。因此,研究海马和前额叶皮质单胺递质的代谢变化,对于药物的抗抑郁作用十分重要。匝迪-5(别名为肉豆蔻-5味丸)源于蒙药古方,以肉豆蔻为主药,配以土木香、木香、广枣、荜茇等5种天然药物配伍组成。具有祛心“赫依”功能,主要用于心烦失眠,心神不安,对心“赫依”病尤为有效。蒙医临床上常用于治疗冠心病、心绞痛及失眠抑郁、神经衰弱等病症,疗效肯定[13-14]。
本实验结果显示,模型大鼠海马和前额叶皮质5-HT、DA和NE的含量显著降低(P<0.05,P<0.01),给予氟西汀和匝迪-5干预之后模型大鼠体质量及行为改变得以改善,并显著增加海马和前额叶皮质5-HT、DA和NE的含量(P<0.05)。提示本方对抑郁模型大鼠脑内单胺类神经递质具有调控作用,其机制可能与提高海马和前额叶皮质组织中5-HT、DA和NE的含量有关。
[1] 修丽娟,杨玉兴,魏品康.抑郁症中医研究回顾与展望[J].中西医结合学报,2008,6(4):416-421.
[2] 王旭东,乔明琦,张樟进,等.中医药治疗抑郁症的研究进展[J].南京中医药大学学报,2016,32(1):92-96.
[3] 呼日乐巴根,席迎春,呼和木仁,等.匝迪-5味丸对慢性抑郁模型大鼠行为及学习记忆能力的影响[J].世界中西医结合杂志,2015,10(10):1367-1370.
[4] Chopra K, Kumar B, Kuhad A. Pathobiological targets of depression[J].Expert Opin Ther Targets, 2011,15(4):379-400.
[5] Yatham LN,Goldstein JM,Vieta E,et al.Atypical antipsychotics in bipolar depression: potential mechanisms of action[J].J Clin Psychiatry,2005,66(5):40-48.
[6] Katz RJ.Animal models and human depressive disorders[J].Neurosci Biobehav Rev,1981,5(2):231-246.
[7] Willner P,Towell A,Sampson D,et a1.Reduction of sucrose preference by chronic unpredictable mild stress,and its restoration by a tricyclic antidepressant[J].Psychopharmacology(Berl),1987,93(3):358-364.
[8] Catena Dell’Osso M,Rotella F,Dell’Osso A,et a1.Inflammation,serotonin and major depression[J].Curr Drug Targets,2013,14(5):571-577.
[9] Gardner A,Boles RG.Beyond the serotonin hypothesis:mitochondria,inflammation and neurodegeneration in major depression and affective spectrum disorders[J].Prog Neuropsychopharmaeol Biol Psychiatry,2011,35(3):730-743.
[10] 秦琴,刘利学.抑郁症动物模型概述及评价[J].实验动物科学,2010,27(1):53-59.
[11] 高杉,李苒.抑郁症动物模型及其评价标准研究进展[J].天津中医药大学学报,2012,31(1):57-60.
[12] 周敏,王晓斌.慢性不可预轻度应激抑郁症动物模型研究进展[J].泸州医学院学报,2013,36(6):651-654.
[13] 吴双英,白玉霞,哈旦宝力高.蒙药匝迪-5味丸的研究进展[J].中国民族医药杂志,2009,15(5):63-66.
[14] 刘耀东,郭春丽,张丽萍,等.蒙药匝迪-5、逍遥散联合心理疗法治疗脑卒中后抑郁症[J].中国民族医药杂志,2007,13(9):10-11.
EffectsofMongolianMedicineZadi-5onMonoamineNeurotransmittersofChronicStressRatswithDepression
Hurilebagen1,TONG Hai-ying2,Sachula1,Huhemuren1,Wulanqiqige1,LIAN Hua1,BAI Long1,WANG Buhechaolu1
(1.InnerMongoliaMedicalUniversity,Hohhot010110,China;2.BeijingUniversityofChineseMedicine,Beijing100029,China)
Objective: To observe the influence of Mongolian medicine Zadi-5 on monoamine neurotransmitters in the hippocampus and prefrontal cortex of the depression model rats, and to explore its mechanism of the action. Methods:60 male SD rats were randomly divided into the normal group, the model group, the western medicine group and the Mongolian medicine groups (low dose, medium dose and high dose), with 10 rats in each group. Unpredictable mild stress stimulation combined with isolation was used for establishing depression models in the rats. Behavior evaluation was conducted in terms of weight changes and open-field experiments, and the contents of 5-HT, NE and DA in the hippocampus and prefrontal cortex were tested by ELISA method. Results: The increase of body weight in the model group was slower, the levels of open-field horizontal and vertical activity scores, and the contents of 5-HT, DA and NE in hippocampus and prefrontal cortex were significantly decreased compared to the normal group (P<0.05,P<0.01). Compared to the model group, the western medicine group and each Mongolian medicine group improved the behaviour changes more or less. The increase of neurotransmitters were more significant in the western medicine(Fluoxetine) group, and in the medium-dose and high-dose Mongolian medicine (Zadi-5) group (P<0.05,P<0.01); however, the changes were not obvious in the low-dose Mongolian medicine group. Conclusion: The anti-depression mechanism of Zadi-5 may be related to increasing the contents of 5-HT, NE and DA in the brain.
Zadi-5; Depression; Rats; Monoamine neurotransmitters
R285.5
A
1002-2406(2017)06-0005-04
内蒙古自然科学基金项目(No.2015MS0893)
呼日乐巴根(1981-),男,博士,主要研究方向:蒙医药现代化研究。
2016-10-12
修回日期:2016-10-30
