脓毒症患者并发ARDS的早期危险因素分析
2017-11-16葛建辉
葛建辉
脓毒症患者并发ARDS的早期危险因素分析
葛建辉
目的探讨脓毒症患者从发病到入院6h内并发急性呼吸窘迫综合征(ARDS)的早期危险因素以及早期液体管理的重要性。方法回顾149例脓毒症患者的临床特点,采用单因素分析以及多因素logistic回归分析寻找与ARDS早期进展有关的危险因素。结果31例患者(20.8%)入院后发生ARDS,25例(16.8%)发生脓毒性休克。在单因素分析中,APACHE II评分、6h内液体入量、住院时间、有无脓毒性休克、肺部感染、胰腺炎、输血制品、急腹症、呼吸急促(HR>30次/min)、低氧血症(SpO2<95%)、低蛋白血症和FiO2>0.35两组间的差异均有统计学意义(均P<0.05)。多因素分析中APACHE II评分(OR=1.10,95%CI:1.07~1.13)、入院6h内总液体入量(OR=1.15,95%CI:1.03~1.29)、脓毒症休克(OR=2.57,95%CI:1.62~4.08)、肺部感染(OR=2.31,95%CI:1.59~3.36)、胰腺炎(OR=3.86,95%CI:1.33~11.24)、急腹症(OR=3.77,95%CI:1.37~10.41)和呼吸急促(OR=1.41,95%CI:1.00~1.97)为发生ARDS的独立危险因素。结论脓毒症患者早期出现ARDS的独立危险因素在不伴有脓毒性休克的患者中为APACHE II评分、休克、肺源感染、胰腺炎和急腹症等,而在伴有脓毒性休克的患者中主要为液体出入量。
脓毒症急性呼吸窘迫综合征早期液体复苏
急性呼吸窘迫综合征(ARDS)是重症监护室最常见的病症,10%重症患者在住院期间并发ARDS。脓毒症一直被认为是ARDS进展的主要危险因素[1]。一些研究证实,约40%ARDS患者同时伴有脓毒症[2-3]。以往的研究多是观察患者在监护室住院期间疾病的进展情况[4],而目前的研究已对脓毒症的早期诊断和治疗达成了广泛共识和重视[5]。多项研究表明,随着对这些指南的依从性增加,脓毒症患者病死率和结局有所改善[6-7]。但对于急诊科脓毒症患者早期ARDS的相关风险因素研究较少[8-9]。早期液体复苏是脓毒性休克患者复苏的重要组成部分之一。最近研究表明,脓毒症患者实施早期液体复苏管理后病死率远低于按照以往液体复苏方案实施者[10-12]。有研究证实,在脓毒症患者住院期间,大液体量的复苏和积极的液体平衡方案效果较差[13-16],容易导致肺水肿加重并进展为ARDS。因此,需要高度重视脓毒症患者的早期液体复苏管理。本研究对脓毒症患者从发病到入院6h内并发ARDS的早期危险因素以及早期液体管理的重要性作一探讨。
1 资料和方法
1.1 一般资料2013年4月至2017年4月我院急诊重症监护室收治脓毒症患者149例,男54例,女95例。原发病包括脓毒性休克27例,肺部感染62例,急腹症15例,胰腺炎10例,部分患者同时存在多种基础疾病。纳入标准:(1)结合临床表现及病史明确诊断为脓毒症或脓毒性休克;(2)不伴随有其他严重危及生命的急症;(3)脓毒症诊断时间≤6h;(4)有完整的临床随访资料。排除标准:(1)创伤引起的失血性休克;(2)外科手术后48h内的脓毒症;(3)入院时存在ARDS诊断的患者。
脓毒症诊断标准:有明确的感染部位及感染症状,全身性感染相关性器官功能衰竭评分(SOFA)≥2分。脓毒性休克诊断标准:输注30ml/kg晶体后的收缩压(SBP)仍<90mmHg,血清乳酸水平≥2mmol/L,需要运用升压药物维持平均动脉压≥65mmHg。ARDS的诊断标准详见表1。

表1 ARDS诊断标准
1.2 方法将脓毒症的患者根据入院后有无ARDS进展分为ARDS组和非ARDS组,患者入院后收集以下变量:年龄、性别、BMI、入院诊断、合并症(高血压、糖尿病、慢性肾脏病、冠状动脉疾病)、APACHEⅡ分,记录患者的6h液体出入量(指晶体量、胶体量以及其他输液的总和),以及治疗过程中的并发症发生情况,如低氧血症、低蛋白血症等。
1.3 统计学处理应用SPSS16.0统计软件,计量资料用表示,组间比较采用独立样本t检验;计数资料组间比较采用χ2检验;单变量分析中P<0.05的风险因素输入到多变量模型中,运用logistic回归分析脓毒症与ARDS发展关系的独立危险因素,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料共有31例(20.8%)患者在入院后并发ARDS,其中17例发生在入院2d内,14例发生在入院5d内。两组共有12例患者删失(死亡或自动出院),其中ARDS组8例,非ARDS组4例。发展为ARDS的平均时间为(2.5±1.7)d,ARDS组的APACHEⅡ评分、6h内液体入量均明显高于非ARDS组(均P<0.05);ARDS患者的住院天数为(19.3±11.4)d,非ARDS组患者为(7.5±4.3)d(P<0.05);ARDS组发生脓毒性休克的比例显著高于非ARDS组(P<0.05)。详见表2。
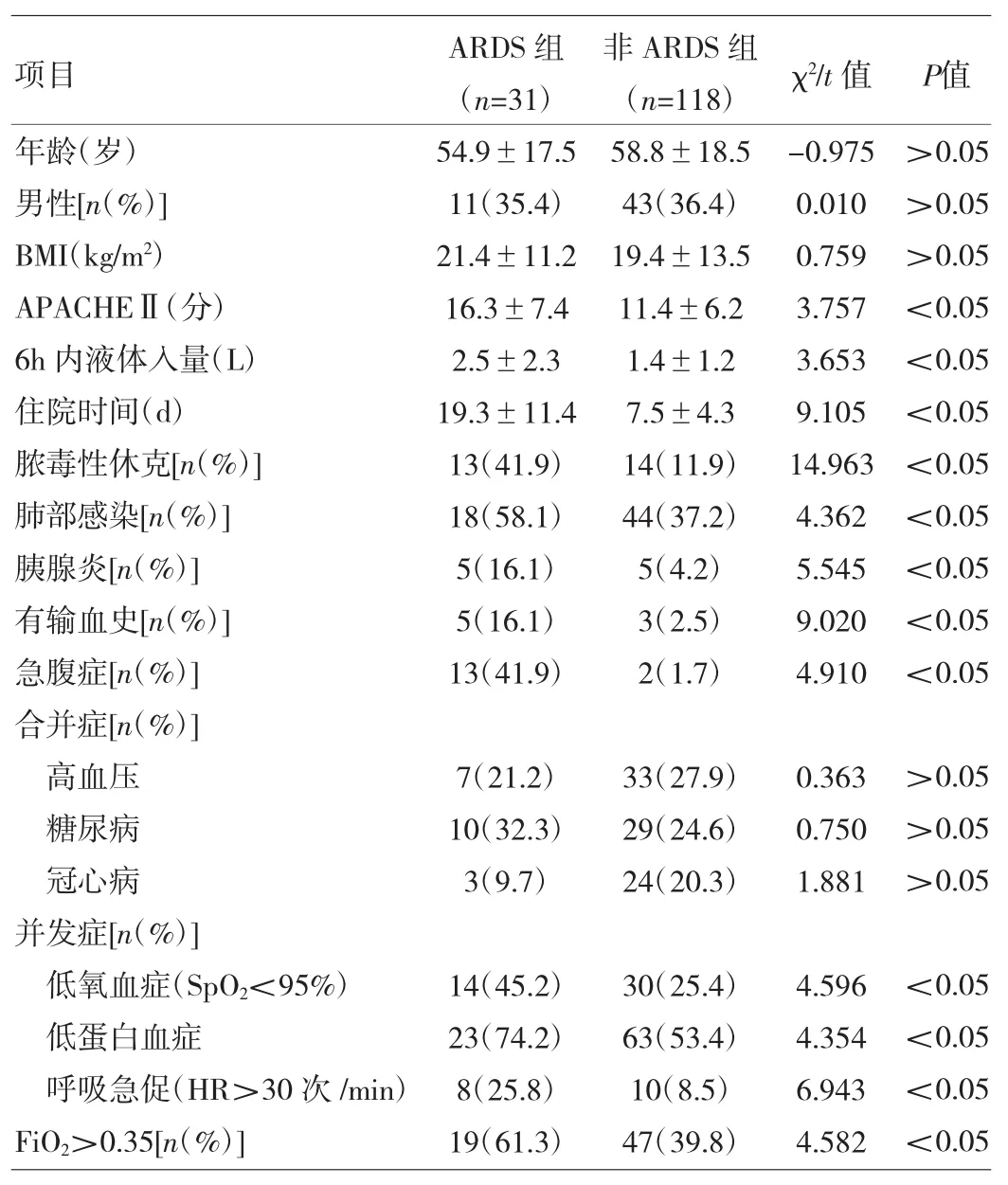
表2 两组患者一般资料的比较
2.2 单因素及多因素分析结果在单因素分析中,APACHEⅡ评分、6h内液体入量、住院时间、有无脓毒性休克、肺部感染、胰腺炎、输血制品、急腹症、呼吸急促、低氧血症、低蛋白血症和FiO2>0.35在两组间的差异均有统计学意义(均P<0.05)。多因素分析模型中APACHEⅡ评分、入院6h内总液体入量、脓毒症休克、肺部感染、胰腺炎、急腹症和呼吸急促为独立危险因素,详见表3。
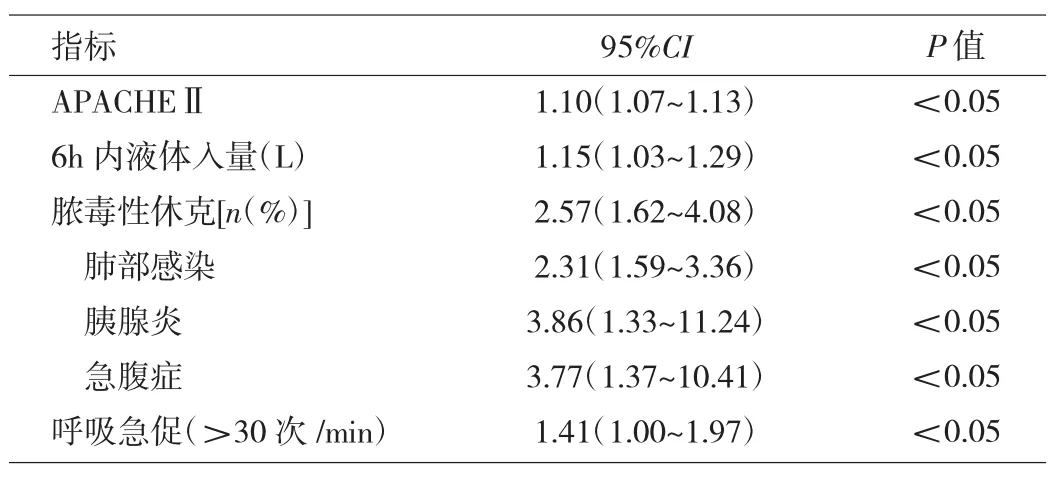
表3 多变量分析模型结果
另外,ARDS发生率随入院6h内液体总入量的增加而增加(见图1)。进一步分析发现,在脓毒性休克亚组中,6h内液体入量不是ARDS进展的危险因素(OR=1.05,95%CI:0.87~1.28,P=0.621),但是在无脓毒性休克亚组中,6h内液体入量确是ARDS进展的危险因素(OR=1.21,95%CI:1.05~1.38,P=0.011)。
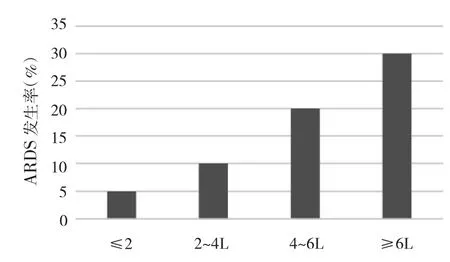
图1 入院6h内液体入量与ARDS的关系
3 讨论
脓毒症患者并发ARDS已经被广为报道,尽管发生ARDS的脓毒症患者病死率仅有6%,但仍显著高于非ARDS的脓毒症患者[1-3]。本研究重点关注在脓毒症患者早期液体管理对ARDS进展的影响。
本研究发现,APACHEⅡ评分、6h内液体入量、住院时间、有无脓毒性休克、肺部感染、胰腺炎、输血制品、急腹症、呼吸急促、低氧血症、低蛋白血症和FiO2>0.35在两组间的差异均有统计学意义。Jia等[17]证明在入院48h内给予机械通气的患者中,积极的液体平衡管理与ARDS进展有关。此外,在脓毒症休息初始复苏后,保守的液体管理策略不仅增加了患者的生存期而且还让机械通气的患者尽早脱机[18]。多项研究表明,增加血管外肺水与ARDS患者的病死率相关[19]。脓毒性休克患者的积极液体平衡也与病死率增加有关[13]。
相反,败血症的早期复苏的标志是炎症标志物指标的降低[20]。因此,脓毒症早期阶段液体复苏实际上是有益的,通过限制炎症级联反应进而降低ARDS的发病率。一项研究表明,当脓毒症患者在发病6h内诊断为ARDS进展,降低病死率的最佳策略是早期的液体复苏以及随后的保守液体管理[21]。先前的调查表明,在入院24h内液体入量的增加对于严重的脓毒症和脓毒性休克患者并没有增加ARDS的发生风险[22]。本研究结果显示,在没有脓毒性休克的患者中6h内的液体入量与ARDS发展之间依然具有相关性。这可能表明,没有休克的脓毒症患者在早期液体过量的情况下处于ARDS进展的最高风险。
尽管以往的多次随机对照试验对脓毒症患者的不同早期复苏方案进行比较,但是对于早期液体复苏和ARDS进展的这种关系尚未得到很好的研究,并且这些试验并没有把ARDS发生率作为结果来观察。早期目标导向治疗(EGDT)试验也没有测量ARDS的发生率[23]。本研究发现疾病的严重程度、肺部感染、休克是脓毒症患者ARDS进展的危险因素,这与其他研究结果一致[8]。此外,还发现胰腺炎和急腹症同样是脓毒症患者发生ARDS的危险因素。这主要是与肺和腹部已被确定为ARDS患者最常见的感染源有关[24]。其中以肺炎为基础的脓毒症导致ARDS进展的原因是多因素的。这类患者肺部有直接损伤,以及脓毒症炎症性级联引起间接损伤,均可导致ARDS进展。此外,ARDS也是重症胰腺炎的主要并发症,是导致急性胰腺炎患者1周内死亡的主要原因[25]。输注血液制品是危重患者肺损伤和ARDS进展的已知危险因素[26]。本研究发现与ARDS在单变量分析中具有关联性,但是多变量分析却没有相关性,由于本研究只有6.8%的患者接受了血液制品,没有足够证据证明这种关联。
因此对于早期脓毒症患者,应尽早给予早期液体复苏并且控制在合适剂量,早期液体入量过多会加重脓毒症患者ARDS的进展。此外,本研究的缺陷在于首先,数据样本量较小,仍需扩大样本量来进一步说明问题。其次,本研究没有采集到与脓毒症患者ARDS进展有关的危险因素数据,如抗生素和乳酸水平。第三,由于本文为回顾性研究,有一些协变量的数据不完整。最后,本研究仅能证实关联性,但不能证明因果关系。因此下一步研究需进一步证实初始流体管理与ARDS发展之间的关系。
[1] Johnson C L,Soeder Y,Dahlke M H,et al.Concise Review:Mes-enchymal Stromal Cell-Based Approaches for the Treatment of Acute Respiratory Distress and Sepsis Syndromes[J].Stem Cells TranslMed,2017,6(4):1141-1151.doi:10.1002/sctm.16-0415.
[2] Oliynyk O V,Pereviznyk B O,Yemiashev O V,et al.The Effectiveness of Corticosteroid Usage in Complex Therapy for Severe Sepsis and Acute Respiratory Distress Syndrome in Cases of Severe Traumatic Brain Injury[J].Adv Clin Exp Med,2016,25(6):1223-1226.doi:10.17219/acem/61013.
[3] Day Y J,Chen K H,Chen Y L,et al.Preactivated and Disaggregated Shape-Changed Platelets Protected Against Acute Respiratory Distress Syndrome Complicated by Sepsis Through Inflammation Suppression[J].Shock,2016,46(5):575-586.
[4] Iscimen R,Cartin-Ceba R,Yilmaz M,et al.Risk factors for the development of acute lung injury in patients with septicshock:an observational cohort study[J].Crit Care Med,2008,36(5):1518.doi:10.1097/CCM.0b013e31816fc2c0.
[5] Dellinger R P,Levy M M,Rhodes A,et al.Surviving sepsis campaign:international guidelines for management ofsevere sepsis and septic shock:2012[J].Crit Care Med,2013,41(2):580-637.doi:10.1097/CCM.0b013e31827e83af.
[6] Levy M M,Rhodes A,Phillips G S,et al.Surviving Sepsis Campaign:association between performance metricsand outcomes in a 7.5-year study[J].Crit Care Med,2015,43(1):3-12.doi:10.1097/CCM.0000000000000723.
[7] Damiani E,Donati A,Serafini G,et al.Effectof performance improvement programs on compliance with sepsisbundles and mortality:a systematic review and meta-analysis of observationalstudies[J].PLoS ONE,2015,10(5):e0125827.doi:10.1371/journal.pone.0125827.
[8] Mikkelsen M E,Shah C V,Meyer N J,et al.The epidemiology of acute respiratory distress syndrome in patientspresenting to the emergency department with severe sepsis[J].Shock,2013,40(5):375-381.doi:10.1097/SHK.0b013e3182a64682.
[9] Fuller B M,Mohr N M,Dettmer M,et al.Mechanical ventilation and acute lung injury in emergency departmentpatients with severe sepsis and septic shock:an observational study[J].Acad E-merg Med,2013,20(7):659-669.doi:10.1111/acem.12167.
[10] Pro C I,Yealy D M,Kellum J A,et al.Arandomized trial of protocol-based care for early septic shock[J].N Engl J Med,2014,370(18):1683-1693.doi:10.1056/NEJMoa1401602.
[11] Investigators A,Group A C T,Peake S L,et al.Goal-directed resuscitation for patients with early septic shock[J].NEngl J Med,2014,371(16):1496-1506.doi:10.1056/NEJMoa1404380.
[12] Mouncey P R,Osborn TM,Power G S,et al.Trialof early,goaldirected resuscitation for septic shock[J].N Engl J Med,2015,372(14):1301-1311.doi:10.1056/NEJMoa1500896.
[13] Boyd J H,Forbes J,Nakada T A,et al.Fluid resuscitationin septic shock:a positive fluid balance and elevated centralvenous pressure are associated with increased mortality[J].Crit Care Med,2011,39(2):259-265.doi:10.1097/CCM.0b013e3181feeb15.
[14] Micek S T,Mc Evoy C,Mc Kenzie M,et al.Fluid balance and cardiac function in septic shock as predictors of hospitalmortality[J].Crit Care,2013,17(5):R246.doi:10.1186/cc13072.
[15] Oliveira F S,Freitas F G,Ferreira E M,et al.Positive fluid balance as a prognostic factor for mortality and acutekidney injury in severe sepsis and septic shock[J].J Crit Care,2015,30(1):97-101.doi:10.1016/j.jcrc.2014.09.002.
[16] Sirvent J M,Ferri C,Baro A,et al.Fluid balance in sepsisand septic shock as a determining factor of mortality[J].Am J Emerg Med,2015,33(2):186-189.doi:10.1016/j.ajem.2014.11.016.
[17] Jia X,Malhotra A,Saeed M,et al.Risk factors forARDS in patients receiving mechanical ventilation for>48h[J].Chest,2008,133:853-861.doi:10.1378/chest.07-1121.
[18] 陈齐红,郑瑞强,林华,等.不同液体管理策略对感染性休克患者[J].中国危重病急救医学,2011,23(3):142-145.
[19] Jozwiak M,Silva S,Persichini R,et al.Extravascular lung water is an independent prognostic factor in patientswith acute respiratory distress syndrome[J].Crit Care Med,2013,41(2):472-480.doi:10.1097/CCM.0b013e31826ab377.
[20] Erikson K,Liisanantti J H,Hautala N,et al.Retinal arterial blood flow and retinal changes in patients with sepsis:preliminary study using fluorescein angiography[J].Crit Care,2017,21(1):86.doi:10.1186/s13054-017-1676-3.
[21] Murphy C V,Schramm G E,Doherty J A,et al.The importance of fluid management in acute lung injury secondary toseptic shock[J].Chest,2009,136(1):102-109.doi:10.1378/chest.08-2706.
[22] Chang D W,Huynh R,Sandoval E,et al.Volumeof fluids administered during resuscitation for severe sepsis and septicshock and the development of the acute respiratory distress syndrome[J].JCrit Care,2014,29(6):1011-1015.doi:10.1016/j.jcrc.2014.06.005.
[23] Rivers E,Nguyen B,Havstad S,et al.Earlygoal-directed therapy in the treatment of severe sepsis and septic shock[J].N Engl J Med,2001,345(19):1368-1377.doi:10.1056/NEJMoa010307.[24]Sheu C C,Gong M N,Zhai R,et al.Theinfluence of infection sites on development and mortality of ARDS[J].Intensive Care Med,2010,36(6):963-970.doi:10.1007/s00134-010-1851-3.
[25] Mangi A M,Bansal V.Pre-hospital use of inhaled corticosteroids and inhaled beta agonists and incidence of ARDS:A population-based study[J].Acta Med Acad,2015,44(2):109-116.doi:10.5644/ama2006-124.138.
[26] Kidane B,Plourde M,Leydier L,et al.RBC transfusion is associated with increased risk of respiratory failure after pneumonectomy[J].J Surg Oncol,2017,115(4):435-441.doi:10.1002/jso.2454.
Risk factors for development of acute respiratory distress syndrome in septic patients
GE Jianhui.
Departmentof Emergency Medicine,the First Hospital of Ninghai County,Ningbo 315600,China
Objective To assess the risk factors of acute respiratory distress syndrome(ARDS)in septic patients.Methods One hundred and forty nine patients with sepsis admitted in emergency department of our hospital from April 2013 to April 2017 were enrolled.Univariate and multivariate logistic regression analyses were performed to assess the risk factors associated with early development of ARDS.ResultsAmong 149 patients ARDS developed in 31 cases(20.8%)after admission and septic shock developed in 25 cases(16.8%).Univariate analysis showed that the occurence of ARDS was significantly associated with APACHE II score,volume of fluid intake within 6h,length of hospital stay,septic shock,pulmonary infection,pancreatitis,blood transfusion,acute abdomen,tachypnea(HR>30/min),low oxygenemia(SpO2<95%),hypoproteinemia and FiO2>0.35(P<0.05).Multivariate analysis showed that APACHE II score(OR=1.10,95%CI:1.07-1.13),total fluid intake(L)within 6h of admission(OR=1.15,95%CI:1.03-1.29),septic shock(OR=2.57,95%CI:1.62-4.08),pulmonary infection(OR=2.31,95%CI:1.59-3.36),pancreatitis(OR=3.86,95%CI:1.33-11.24),acute abdomen(OR=3.77,95%CI:1.37-10.41)and tachypnea(OR=1.41,95%CI:1.00-1.97)were independent risk factors for ARDS.ConclusionAPACHE II score,septic shock,lung infection,pancreatitis and acute abdomen are early independent risk factors for ARDS in septic patients,while for those with septic shock ARDS is mainly related to the volume of fluid intake.
Sepsis Acute respiratory distress syndrome Early fluid resuscitation
10.12056/j.issn.1006-2785.2017.39.20.2017-1141
315600宁海县第一医院急诊医学科
葛建辉,E-mail:wading1012@163.com
2017-05-18)
(本文编辑:严玮雯)
