磁共振ADC全容积直方图区分肺癌常见病理类型的价值
2017-11-16江苏省常州市武进人民医院放射科
江苏省常州市武进人民医院放射科
(江苏 常州 213002)
许建兴 刘良卿 王开香 梅 莉 郑建刚 沈 烨 赵卫忠
磁共振ADC全容积直方图区分肺癌常见病理类型的价值
江苏省常州市武进人民医院放射科
(江苏 常州 213002)
许建兴 刘良卿 王开香 梅 莉 郑建刚 沈 烨 赵卫忠
目的探讨磁共振弥散加权成像(DWI)的表观弥散系数(ADC)全容积直方图对肺癌常见病理类型的鉴别诊断价值。方法回顾性分析经病理证实的肺癌35例,在磁共振工作站ADC图上绘制整个肿瘤病灶的感兴趣区,用软件得出整个肿瘤的全容积ADC直方图,获得整个肿瘤的平均ADC值(ADCmean),分别对常见肺癌病理类型进行统计学比较。结果经ADC全容积直方图分析,肺小细胞癌的ADCmean明显小于非小细胞癌,差别有统计学意义(P<0.001);鳞状细胞癌的ADCmean低于腺癌,差别有统计学意义(P<0.05)。结论ADC全容积直方图分析可以客观地提供肿瘤的整体信息,能区别肺癌常见病理类型之间的差异,对肺癌的诊断有潜在优势。
肺癌;弥散加权成像;表观弥散系数;直方图
目前肺癌是最常见的恶性肿瘤之一,死亡率高。肺癌也仍是低诊断率的癌症之一,尤其是对于不同的组织学类型诊断更加困难,需通过支气管镜、穿刺活检或手术后病理来确诊。随着磁共振多通道线圈、并行采集技术和运动伪影抑制等技术的研发和应用,磁共振扩散加权成像(DWI)在胸部的应用越来越广泛[1-2]。DWI是能够在活体检测水分子微观运动的功能成像技术,水分子的微观运动会引起质子自旋的相位弥散,从而导致信号衰减,此信号衰减可通过计算表观扩散系数(apparent diffusion coefficient,ADC)来量化;既往大多数研究是在肿瘤单一层面手工绘制感兴趣区(region of interest,ROI)来获得肿瘤的平均ADC值[3-5],未能利用整个肿瘤的ADC信息。ADC全容积直方图分析是用来描述整个肿瘤同样信号强度的像素数,描述肿瘤弥散异质性的方法,在肿瘤定性、分级或疗效评估中已显示出其优越性[6-13]。本文旨在用ADC全容积直方图来分析肺癌常见病例类型的ADC值差异,为临床治疗和预后提供更多有价值的信息。
1 材料与方法
1.1 临床资料2015年5月至2016年7月,35名病理组织学(手术、支气管镜活检或穿刺活检)证实为肺癌的患者行常规MRI和DWI检查,检查前未接受任何放疗和化疗。患者平均年龄67岁(45~83岁)。其中腺癌16例,鳞状细胞癌l1例,小细胞癌8例。
1.2 磁共振成像采用西门子Avanto 1.5T(Magnetom Avanto,Siemens AG,Erlangen,Germany)超导磁共振成像系统和体部表面线圈,患者采取仰卧位头先进,进行常规磁共振和DWI序列扫描。DWI序列采用单次激发自旋回波-平面回波成像序列(spin echo-echo planar imaging,SE-EPI),在自由呼吸状态下采集图像,b值分别取50s/mm2、800s/mm2,同时在X、Y、Z轴三个方向上施加敏感梯度脉冲。DWI数据通过相对应的ADC图进行定量评价,有丰富MRI诊断经验的放射科医生在未知病理结果的情况下,独立测量完成。运用第三方软件,在ADC图上沿肿瘤边界在每一层面勾画感兴趣区(region of interest,ROI),最终生成三维感兴趣区(3D VOIs),再用软件对VOIs进行分析,生成整个肿瘤的ADC全容积直方图,为简化计算和统计,我们以整个肿瘤全容积直方图的平均ADC值(ADCmean)来比较肺癌常见病理类型的ADC值差异。
1.3 统计学分析使用SPSS 17.0统计分析软件。采用两独立样本t检验分析不同组织类型肺癌ADC值的差异,将P<0.05定义为有统计学差异。
2 结 果
35例肺癌在T1WI上呈等信号,T2WI呈稍高信号,DWI上呈明显高信号.ADC图上呈不同程度低信号。经过对整个肿瘤的全容积直方图分析,肺腺癌、鳞状细胞癌和非小细胞癌的ADCmean分别为(1.398±0.203)×10-3mm2/s、(1.148±0.254)×10-3mm2/s和(0.814±0.132)×10-3mm2/s。小细胞癌的ADCmean明显小于非小细胞癌,差别有统计学意义(P<0.001);鳞状细胞癌的ADCmean低于腺癌,差别有统计学意义(P<0.05)。
3 讨 论
磁共振功能成像中的DWI技术,能够在活体检测水分子微观运动,提供组织病理生理学信息。DWI目前已成熟应用于头部急性脑缺血、颅内肿瘤以及脱髓鞘疾病的诊断,并且随着MR软硬件技术发展,DWI也已广泛地应用到体部的影像学检查中。对于磁共振在肺部成像,虽然与CT比较,呼吸运动伪影难以避免,但MRI及其DWI技术在肺部的应用也越来越广泛。DWI是根据水分子弥散率的不同而成像,虽然影响水分子弥散的因素很多,但我们是通过选择不同的b值计算病变的ADC值差异来提供诊断信息,所以成像的关键是b值的选择。由于MRI扫描设备不同,设置的序列和扫描参数不同,胸部DWI检查的最佳b值存在争论,没有统一。既往普遍认为随着b值的增加,所得图像的扩散权重加大,不同组织之间的对比增加,b值差越大的图像测得的ADC值越准确,但同时也会导致图像信噪比降低。本单位选择b值为50s/mm2和800s/mm2。
DWI最大优点是可以将病变显示为具有高对比度的高信号,同时它可以提供一个量化的生理参数ADC值,不同的组织结构表现出不同的ADC值,从而可用ADC值来研究组织类型和组织特征[14-15]。既往文献[16]认为:腺癌的生长方式为代替生长,癌细胞沿肺泡壁生长替代柱状上皮细胞,底层结构保存;鳞状细胞癌则为团块状生长方式,癌细胞压缩式增殖和非替代性侵犯;小细胞癌通常为小圆形或卵圆形细胞,细胞密集程度较高,细胞外空间相对较小。三种病理类型肺癌的生长方式不同导致细胞构成的差异,从而表现为细胞密度的差异,在DWI上表现为信号差异,最终导致ADC值的不同;小细胞癌的细胞密度高于非小细胞癌,所以ADC值应该低于非小细胞癌;腺癌的细胞密度低于鳞状细胞癌,从而ADC值应该高于鳞状细胞癌。既往Liu等[17-18]的研究也表明小细胞癌和非小细胞癌的ADC值存在差异;赵希彤等[19-20]认为腺癌ADC值明显高于鳞状细胞癌。
直方图分析是用来显示不同强度信号在肿瘤中的分布,描述肿瘤的异质性。直方图在分析整个肿瘤时可消除感兴趣区绘制时的任意性。既往许多文献[6-13]认为直方图分析的重复性更好,肿瘤的异质性变化可以通过直方图来直观地表示,可获得肿瘤相关定量描述性参数。ADC全容积直方图是显示整个肿瘤所有体素ADC值的频数分布柱形图,直观显示ADC值的范围和分布状态,包括最小ADC值,最大ADC值,平均ADC值,各百分位ADC值水平,以及直方图峰度和偏度等参数。有研究[22]认为肿瘤细胞增殖最旺盛的部分,细胞核分裂最活跃,结构最致密,水分子弥散明显受限,ADC值较低,因而10%ADC值最能反映肿瘤细胞的病理及分化程度。但本研究认为肺癌周围气体较多,肿瘤内部亦可存在气体,气体噪声、伪影及邻近结构等极端数值可能影响10%ADC值的测量结果(图1)。所以,本研究选择受这些极端数值影响较小的ADCmean来比较肺癌的常见病理类型。直方图分析结果表明小细胞癌的ADCmean值明显小于非小细胞癌,鳞状细胞癌的ADCmean值则低于腺癌,差别均有统计学意义,与既往文献[17-22]报道一致。同时我们也发现肺小细胞癌的直方图峰值位于非小细胞癌的左侧,鳞状细胞癌的直方图峰值则位于腺癌的左侧,此表现结果提示我们可通过直方图频数分布柱形图来直观区分肺癌的病理类型。
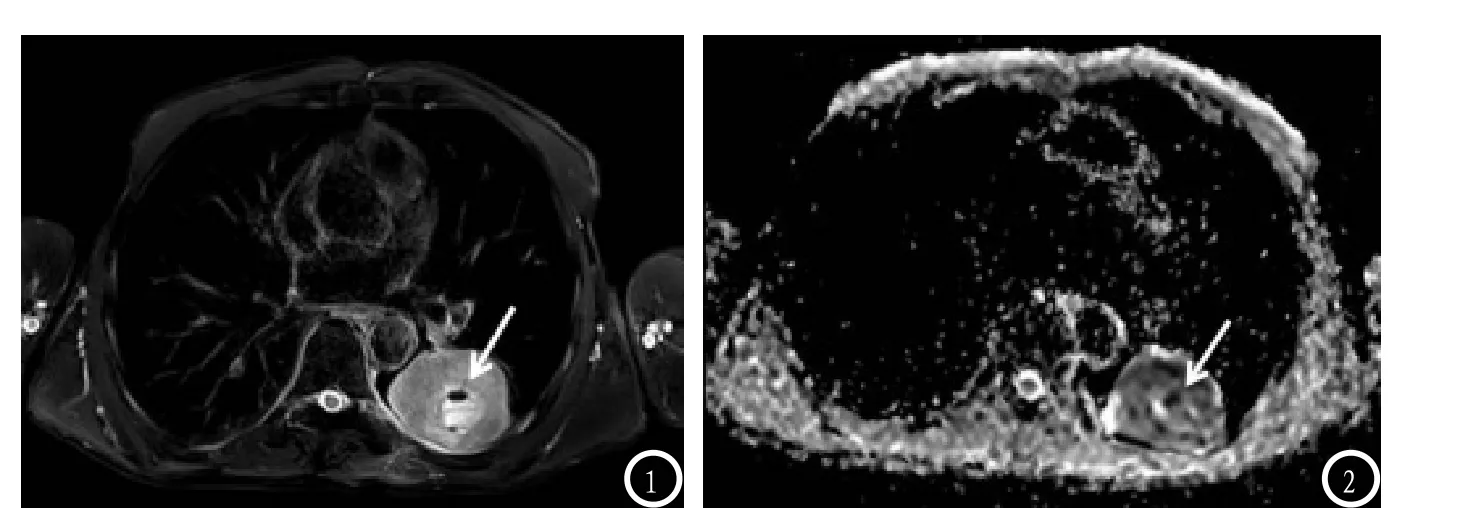
图1-2 男性 66 岁 鳞状细胞癌,T2WI(1),显示瘤内穿刺活检后的少量气体(白箭),ADC图(2)显示气体(白箭)可导致极端数值,影响10%ADC值的结果。
本研究也有一些局限性:第一,招募病例数较少,未来将扩大病例样本量来进一步证实不同组织学类型间ADC值的差异,同时还可以对组织切片及DWI图像进行微观精确对照研究。第二,整个肿瘤病灶的ADC直方图,可获得肿瘤各百分比ADC值及直方图的偏度和峰度,计算较复杂,工作量较大,我们将在今后的工作中进行研究,并尝试获得ADC 直方图分析时相关定量参数的阈值。第三,我们使用的b值为50s/mm2和800s/mm2,并没有使用其他的 b值,所以我们不能确定肺癌成像的最佳b值,进一步使用DWI其他b值来诊断是必要的。
总之,对于描述肺癌特征,ADC值是一个重要的参数,相对于腺癌,小细胞癌和鳞状细胞癌更倾向于拥有较低的ADC值,这在某种程度上提供了一种可以鉴别肺癌病理类型的方法。依靠ADC全容积直方图来精确估计病理类型还有些困难,但作为诊断肺癌的辅助手段之一,其对于肺癌的病理类型的评估具有很大的潜力。
[1] Kanauchi N,Oizumi H,Honma T,et a1.Role of diffusionweighted magnetic resonance imaging for predicting of tumor invasiveness for clinical stage IA non-small cell lung cancer [J].Eur J Cardiothorac Surg,2009,35(4):707-711.
[2] Matoba M,Tonami H,Kondou T,et a1.Lung carcinoma:diffusionweighted MR imaging-preliminary evaluation with apparent diffusion coefficient[J].Radiology,2007,243(2):570-577.
[3] Razek AA,Fathy A,Gawad TA.Correlation of apparent diffusion coefficient value with prognostic parameters of lung cancer[J].J Comput Assist Tomogr,2011,35(2):248-252.
[4] Herneth AM,Guccione S,Bednarski M.Apparent Diffusion Coefficient:a quantitative parameter for in vivo tumor characterization[J].European journal of radiology,2003,45(3):208-213.
[5] Koyama H,Ohno Y,Seki S,et al.Value of diffusion-weighted MR imaging using various parameters for assessment and characterization of solitary pulmonary nodules[J].European journal of radiology,2015,84(3):509-515.
[6] Seung Hyun C,Gab Chul K,Yun-Jin J,et al.Locally advanced rectal cancer:postchemoradiotherapy ADC histogram analysis for predicting a complete response[J].Acta Radiologica,2015,56(9):1042-1050.
[7] Se Jin A,Seung Hong C,Young-Jae K,et al.Histogram Analysis of Apparent Diffusion Coefficient Map of Standard and High B-value Diffusion MR Imaging in Head and Neck Squamous Cell Carcinoma:A Correlation Study with Histological Grade[J].Academic Radiology,2012,19(10):1233-1240.
[8] Jeongwon L,Seung Hong Choi,Ji-Hoon K,Chul-Ho S,Sooyeul L,Jaeseung Jeong.Glioma grading using apparent diffusion coefficient map:application of histogram analysis based on automatic segmentation[J].NMR Biomed,2014,27(9):1046-1052.
[9] Shi-Teng Suo M,Xiao-Xi Chen M, Yu Fan B,et al.Histogram Analysis of Apparent Diffusion Coefficient at 3.0 T in Urinary Bladder Lesions:Correlation with Pathologic Finding s[J]. Academic Radiology,2014,21(8):1027-1034.
[10]Lu SS,Kim SJ,Kim N,et al.Histogram analysis of apparent diffusion coefficient maps for differentiating primary CNS lymphomas from tumefactive demyelinating lesions[J].AJR Am J Roentgeno,2015,204(4):827-834.
[11]Qing Wang MMa,Hai Li MMb,Xu Yan PDc,et al.Histogram analysis of diffusion kurtosis magnetic resonance imaging in differentiation of pathologic Gleason grade of prostate cancer[J].Urol Oncol,2015;33(8):337(e315-e324).
[12]Zhang YD,Wang Q,Wu CJ,et al.The Histogram Analysis of Diffusion-Weighted Intravoxel Incoherent Motion(IVIM)Imaging for Differentiating the Gleason grade of Prostate Cancer[J]. European Radiology,2015,25(4):994-1004.
[13]Liang HY,Huang YQ,Yang ZX,et al.Potential of MR histogram analyses for prediction of response to chemotherapy in patients with colorectal hepatic metastases[J].Eur Radiol,2016,26(7):2009-2018.
[14]Satoh S,Kitazume Y,Ohdama S,et al.Can malignant and benign pulmonary nodules be differentiated with diffusion weighted MRI[J].Am J Roentgenol,2008,191(2):464-470.
[15]Wu LM,Xu JR,Hua J,et al.Can diffusion-weighted imaging be used as a reliable sequence in the detection of malignant pulmonary nodules and masses?[J].Magnetic resonance imaging,2013,31(2):235-246.
[16]E Brambilla,W.D.Travis,T.V.Colby,et a1.The new World Health Organization classification of lung tumours[J].Eur Respir J,2001,18(6):1059-1068.
[17]Liu H,Liu Y,Yu T,et al.Usefulness of diffusionweighted MR imaging in the evaluation of pulmonary lesions[J].Eur Radiol,2010,20(4):807-815.
[18]Razek A A,Fathy A,Gawad T A,Correlation of apparent diffusion coefficient value with prognostic parameters of lung cancer[J].J Comput Assist Tomogr,2011,35(2):248-252.
[19]赵希彤,么金龙.扩散加权磁共振成像及表观扩散系数在肺癌组织学诊断中的作用[J].中国医科大学学报,2011,40(5):449-451.
[20]Matoba M,Tonami H,Kondou T,et a1.Lung carcinoma:diffusionweighted mrimaging--preliminary evalumion with apparent diffusion coefficient[J].Radiology,2007,243(2):570-577.[21]邓启明,邱维加,张培平,等.扩散加权成像鉴别肺部良恶性病变的价值[J].中国CT和MRI杂志,2012,10(01):35-37.
[2 2]温淑蓉.直方图分析法鉴别中央带前列腺癌与低信号增生结节的研究[J].放射学实践,2016,31(11):1076-1079.
(本文编辑: 刘龙平)
The Value of Histogram-based Apparent Diffusion Coefficient in Distinguishing Common Pathological Subtypes of Lung Cancer
XU Jian-xing, LIU Liang-qing, WANG Kai-xiang, et al., Department of Radiology,Changzhou Wujin People's Hospital, Changzhou 213002, Jiangsu Province, China
ObjectiveTo evaluate whether histogram analysis of apparent diffusion coefficient (ADC) values can be used to differentiate common pathological subtype of lung cancers.MethodsThirty-five lung cancer patients were retrospective1y analyzed.ADC histogram was obtained from the entire tumor volume. ADCmean were obtained in a MR work station through software. ResultsThe ADCmean was significantly lower in small cell carcinomas than that in that non-small cell carcinomas. The ADCmean was significantly lower in squamous cell carcinomas than that in adenocarcinomas.ConclusionHistogram analysis of ADC values in lung cancers has potential for differentiating histologic subtypes,providing information about the entire tumor.
Lung Cancer; Diffusion Weighted Imaging; Apparent Diffusion Coefficient;Histogram
R734.2;R445.2
A
10.3969/j.issn.1672-5131.2017.11.005
赵卫忠
2017-09-18