CD147在尖锐湿疣组织中的表达及其介导的发病机制*
2017-11-14韩永智肖洁平李小红董秀芹
林 静, 韩永智, 肖洁平, 李小红, 董秀芹
广东省人民医院,广东省医学科学院皮肤科,广州 510080
CD147在尖锐湿疣组织中的表达及其介导的发病机制*
林 静, 韩永智, 肖洁平, 李小红, 董秀芹
广东省人民医院,广东省医学科学院皮肤科,广州 510080
目的探讨CD147在尖锐湿疣组织中的表达及其在尖锐湿疣发病机制中的作用。方法收集30例尖锐湿疣(condyloma acuminata,CA)皮损组织作为CA组,另取30例男性包皮组织作为对照组,采用免疫组化染色检测组织CD147、PCNA、CD31表达,以CD31染色情况计算微血管密度(microvascular density,MVD),分析CA皮损组织CD147表达和PCNA、MVD的相关性。采用小干扰RNA(siRNA)技术抑制角质形成细胞HaCaT细胞中CD147的表达,按照处理方式分为空白对照组、CD147-siRNA组和CD147-NC组,MTT法检测细胞增殖能力,流式细胞术检测细胞凋亡率和周期分布,Real-time PCR检测CD147、VEGF、PCNA mRNA表达,Western blot检测VEGF、增殖细胞核抗原(PCNA)蛋白表达。结果CA组皮损组织CD147表达阳性率为83.3%,PCNA表达阳性率为70.0%,对照组包皮组织分别为36.7%和40.0%,CA组CD147、PCNA表达阳性率明显高于对照组(均P<0.05);CA组MVD值为(35.81±6.54)条/mm2,对照组为(12.74±4.75)条/mm2,CA组MVD值明显高于对照组(P<0.01);相关性分析显示:CA组皮损组织CD147与PCNA表达呈正相关关系(r=0.753,P<0.05),CD147表达与MVD值亦呈正相关关系(r=0.872,P<0.05)。细胞实验中,与CD147-NC组比较,CD147-siRNA组处理48、72、96 h后HaCaT细胞的增殖能力明显降低(均P<0.05);CD147-siRNA组细胞凋亡率明显高于CD147-NC组(P<0.01),CD147-siRNA组G2/M期所占比例明显低于CD147-NC组,S期所占比例明显高于CD147-NC组(均P<0.01);CD147-siRNA组PCNA、VEGF的mRNA和蛋白表达明显低于CD147-NC组(均P<0.01)。结论CA皮损组织中CD147呈多数阳性表达,且CD147的表达与PCNA表达及MVD均呈正相关;下调CD147表达可以抑制角质形成细胞HaCaT的增殖,其作用机制可能与降低细胞周期蛋白和调控血管新生有关。
CD147; 增殖细胞核抗原; 尖锐湿疣; 血管新生; 细胞增殖
尖锐湿疣(condyloma acuminata,CA)是全球范围内最常见的性传播疾病之一,主要由人类乳头瘤病毒(human papillomavirus,HPV)感染所致,其中最常见的病毒亚型为HPV6/11[1-4]。CA具有生长快、治疗后容易复发的特点,部分病例还有发生恶变的可能。以往对CA发病的分子机制研究发现,转化生长因子-β1(transforming growth factor-β1,TGF-β1)、环氧合酶-2(cyclooxygenase-2,COX-2)、表皮生长因子(epidermal growth factor,EGF)等可能与CA有关。CD147是一种属于免疫球蛋白超家族的跨膜糖蛋白,广泛分布于多种细胞、组织和器官,并可在细胞的分化、增殖、粘附等生物学行为中发挥重要作用。研究显示CD147与角质形成细胞的增殖和分化相关,可能是细胞高增殖和低分化状态的标志分子[5]。国内外还有研究发现CD147可能通过直接和间接的作用促进肿瘤细胞和基质细胞分泌血管内皮细胞生长因子(vascular endothelial growth factor,VEGF),刺激血管新生,从而促进肿瘤浸润及转移[6]。有文献报道,CA皮损中CD147的表达高于正常皮肤,但迄今为止,CD147与CA进展的关系及其作用机制尚未明确。本研究通过分析CA皮损中CD147、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达情况及微血管密度(microvascular density,MVD)计数,以及抑制角质形成细胞HaCaT中CD147的表达后细胞的增殖能力、细胞凋亡率、细胞周期分布等的变化,探讨CD147与CA组织中角质形成细胞增殖、血管新生的关系。
1 材料与方法
1.1 样本采集
选择2015年7月至2015年12月在广东省人民医院皮肤性病科门诊就诊的30例CA患者作为CA组,男21例,女9例,年龄18~47岁,平均(27.8±4.9)岁。纳入标准:①经病理学证实为尖锐湿疣;②病程≥3个月;③就诊前1个月未进行抗CA治疗。排除标准:①长期使用糖皮质激素或免疫调节剂;②合并病毒感染或其他性传播疾病;③妊娠或哺乳期妇女。另选择同期在医院行包皮切除的男性人群30例作为对照组,排除使用免疫抑制剂或合并其他性传播疾病者,年龄20~37岁,平均(27.4±4.3)岁。CA组和对照组年龄差异无统计学意义(P>0.05),具有可比性。将疣体组织和包皮组织剪下,置于4%甲醛中固定待用。
1.2 实验试剂与仪器
角质形成细胞株HaCaT(美国菌种保藏中心,ATCC);通用型SP检测试剂盒(北京中杉金桥生物科技公司);DMEM培养液(美国Gibco公司);M-MLV反转录酶(Promega公司);Trizol试剂(美国Invitrogen公司);CD147-siRNA和非特异性阴性对照(CD147-NC)序列由上海生工生物工程技术公司合成,CD147-siRNA序列:5′-GUAAUGACUAGGGCUAUUA-3′,阴性对照序列:5′-CGUA-UGCGCGUACUCUAAUTT-3′;脂质体Lipofectamine 2000TM(美国Invitrogen公司);ECL化学发光试剂盒(Millipore公司);鼠抗人VEGF单克隆抗体、鼠抗人CD147单克隆抗体、鼠抗人PCNA单克隆抗体、鼠抗人CD31单克隆抗体均购自美国Santa Cruz公司。Real-time PCR仪(Bio-Rad公司);BD FACSAria Ⅲ流式细胞分选仪(BD公司);ECL化学发光试剂盒(Millipore公司)。
1.3 免疫组织化学染色检测组织CD147、PCNA、CD31表达
按照SP检测试剂盒说明书,PBS代替一抗作为阴性对照,石蜡切片经二甲苯脱蜡,梯度乙醇水化,微波加热修复抗原,再滴加3%过氧化氢阻断内源性过氧化物。PBS冲洗3次,在每张切片上滴加1滴山羊血清工作液,室温孵育30 min,再滴加1滴一抗,4℃孵育过夜。第2天用PBS缓冲液冲洗3次,再滴加1滴生物素标记的二抗,室温继续孵育30 min。滴加1滴链霉素抗生物素蛋白-过氧化物酶溶液,室温孵育30 min,滴加1滴DAB显色液,DAB染色后苏木精复染,自来水冲洗,脱水透明后中性树胶封固,显微镜下观察。
1.4 免疫组织化学染色结果判定
以出现黄色或褐色颗粒作为阳性染色。随机选择5个视野进行阳性细胞计数,阳性结果判定参考以下标准,染色强度:0分,无染色;1分,淡染色;2分,中等强度染色;3分,强染色。阳性细胞数:0分,<5%;1分,5%~;2分,26%~;3分,51%~;4分,>75%。免疫染色评分(IRS)以染色强度和阳性细胞比例综合判定,两者相乘,IRS评分0~12分,其中≤4分为阴性,>4分为阳性。
MVD计数:首先在低倍镜(×40)下观察高血管密度区,再在高倍镜下(×200)下统计CD31阳性染色的毛细血管和微小血管数,以5个高倍镜视野血管数的平均值表示。
1.5 细胞分组与处理
HaCaT细胞接种于DMEM培养液(含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素),在培养箱中37℃、5%CO2培养。细胞融合70%时进行转染,转染前将CD147-siRNA或CD147-NC用800 μL的PBS溶解,使之终浓度为200 nmol/L。按照转染类型将细胞分为3组:CD147-siRNA组、CD147-NC组和空白对照组(Mock),CD147-siRNA组:将1 μL Lipofectamine 2000与2.5 μL CD147-siRNA混匀,静置5 min,再加入400 μL细胞悬液,37℃、5%CO2继续培养6 h,更换培养液。再培养48 h后进行转染后其他检测操作。CD147-NC组加入2.5 μL CD147-NC,其余操作同CD147-siRNA组。Mock组仅加入1 μL Lipofectamine 2000脂质体,其余操作同CD147-siRNA组。
1.6 MTT法检测细胞增殖能力
取处于对数生长期的HaCaT细胞,用不含血清的培养液将细胞调整为1×105个/mL。将细胞接种于96孔板(200 μL/孔),置于培养箱中继续培养。分别于培养24、48、72、96 h后,向每孔中加入浓度为200 μg/mL的MTT溶液20 μL,37℃孵育4 h,再加入150 μL DMSO溶液,充分振荡均匀后,于570 nm处检测吸光度值。
1.7 流式细胞术检测细胞周期
细胞接种于6孔板中(1×106个/孔),将细胞培养液更换为不含血清的培养液,饥饿处理过夜。胰蛋白酶消化,离心收集细胞,培养液重悬,继续培养24 h。收集贴壁细胞,加入70%乙醇于-20℃固定12 h。第2 天弃去固定液,加入RNA酶和PI染液,室温染色30 min,按照流式细胞仪操作说明书上机检测,每次实验平行操作3次。
1.8 流式细胞术检测细胞凋亡率
收集各组贴壁细胞,胰蛋白酶消化后,2 500 r/min离心5 min,收集上清液,PBS重悬细胞。依次加入400 μL PI和5 μL Annexin Ⅴ-FITC染液,避光孵育20 min,按照流式细胞仪的操作说明书,调节激发光波长,1 h内上机检测,每次实验平行操作3次。
1.9 Real-time PCR检测CD147、VEGF、PCNA mRNA表达
收集贴壁细胞,胰蛋白酶消化后离心,加入Trizol试剂,冰浴上反应5 min提取总RNA。取2 μg总RNA进行反转录,反转录体系:dNTP 2 μL,M-MLV逆转录酶1 μL,1×buffer 4 μL,加入ddH2O补充至20 μL。以反转录产物作为模板进行PCR扩增,反应条件:95℃预变性30 s,95℃变性5 s,60℃退火30 s,72℃延伸2 min,总计40个循环。CD147引物上游:5′-CATAACCTCTGTCACGAGCAGT-3′,下游:5′-CTGAATGCCCTGACACTGTCC-3′;VEGF引物上游:5′-GTCCACCGCA-AATGCTTCTA-3′,下游:5′-TGCTGTCACCTTCACCGTTC-3′;PCNA引物上游:5′-CAGCTGGCAGAAACACCGAGCAA-3′,下游:5′-CGAGCACAAGCACAGGAGGTATA-3′;β-actin引物上游:5′-ACCATGAGTGATCAGCAGC-3′,下游:5′-CACATAGACTGGGGACCAGG-3′。定量分析结果以Ct值表示,以β-actin作为内参,2-ΔΔCt作为目的基因相对表达量。
1.10 Western blot检测VEGF、PCNA蛋白表达
收集贴壁细胞,胰蛋白酶消化后离心,加入1 mL RIPA裂解液置于冰浴上裂解30 min,4℃条件下离心15 min,BCA蛋白浓度试剂盒检测蛋白纯度。将20 μg蛋白提取液置于10% SDS-PAGE电泳分离,常规湿法转膜,加入5%脱脂牛奶孵育封闭2 h。分别加入VEGF、PCNA抗体,4℃孵育24 h。再滴加二抗37℃孵育2 h。PBS冲洗3次,按照ECL化学发光显影试剂盒显影,以β-actin作为内参照,分析目的条带相对表达量。
1.11 统计学方法
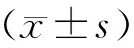
2 结果
2.1 CA组和对照组组织CD147、PCNA蛋白阳性率比较
CA组83.3%皮损组织CD147蛋白阳性表达,70.0%病例PCNA蛋白表达阳性,对照组包皮组织分别有36.7%CD147阳性表达和40.0%PCNA表达阳性,CA组组织CD147、PCNA蛋白阳性表达率明显高于对照组,两组间差异具有统计学意义(P<0.05),见表1,图1。

表1 CA组和对照组组织CD147、PCNA蛋白表达阳性情况(例)Table 1 Expression of CD147 and PCNA in CA and control groups(n)
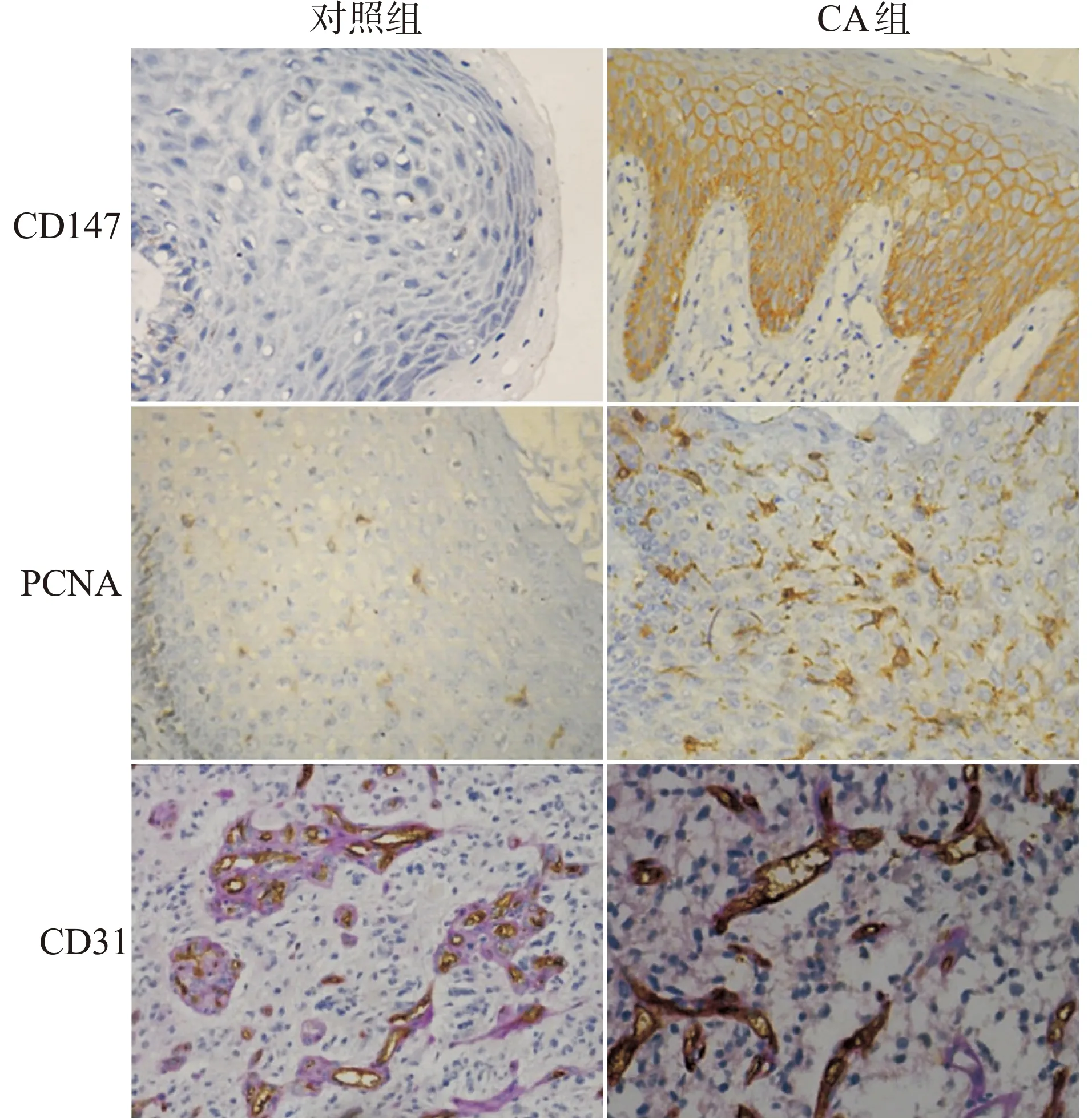
图1 CD147、PCNA、CD31在CA组和对照组组织中的表达(×200)Fig.1 Expression of CD147,PCNA and CD31 in CA and control groups(×200)
2.2 CA组和对照组组织MVD计数比较
CD31是一种敏感的血管标记物,用于标记毛细血管和微小血管,CD31阳性细胞表现为在细胞质或细胞核呈棕褐色或褐色颗粒(图1)。经过计算,CA组MVD值为(35.81±6.54)条/mm2,对照组为(12.74±4.75)条/mm2,CA组MVD值明显高于对照组(t=15.633,P<0.01)。
2.3 CD147与PCNA、MVD相关性分析
在CA患者皮损组织中,CD147呈阳性表达的组织PCNA表达和MVD值也明显增加,CD147与PCNA呈正相关关系(r=0.753,P<0.05),CD147与MVD值亦呈正相关关系(r=0.872,P<0.05)。
2.4 抑制CD147表达对HaCaT细胞增殖的影响
Real-time PCR检测结果显示,CD147-siRNA组CD147 mRNA表达明显低于CD147-NC组(P<0.05,图2A),说明CD147表达下调的HaCaT细胞构建成功。MTT法检测HaCaT细胞增殖情况,结果显示,与CD147-NC组比较,CD147-siRNA组处理48、72、96 h后细胞增殖能力明显降低(均P<0.05),CD147-NC组和空白对照组各时段细胞增殖能力比较差异无统计学意义(均P>0.05,图2B)。
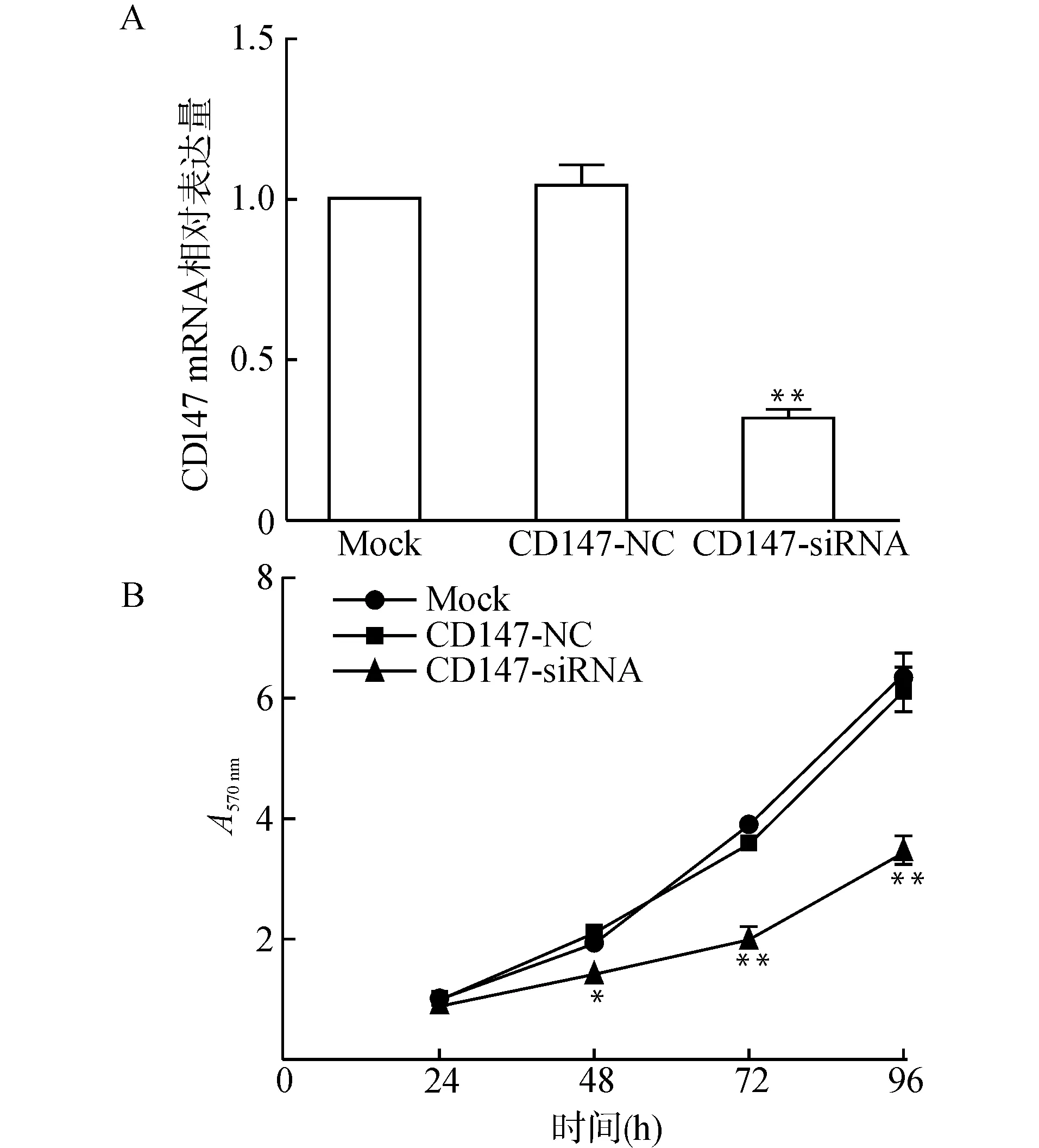
A:各组HaCaT细胞CD147 mRNA表达;B:各组HaCaT细胞增殖能力;与CD147-NC组比较,*P<0.05 ** P<0.01图2 各组HaCaT细胞CD147mRNA表达及细胞增殖能力比较Fig.2 Comparison of the CD147mRNA expression and proliferation of HaCaT cells between groups
2.5 抑制CD147表达对HaCaT细胞凋亡及周期分布的影响
流式细胞术检测各组细胞凋亡率,结果显示CD147-siRNA组细胞凋亡率明显高于CD147-NC组(P<0.01),CD147-NC组和空白对照组细胞凋亡率比较差异无统计学意义(P>0.05,图3A)。细胞周期检测结果显示,CD147-siRNA组G2/M期所占比例明显低于CD147-NC组,S期所占比例明显高于CD147-NC组(均P<0.01,图3B);CD147-NC组与空白对照组各细胞周期分布比例比较差异无统计学意义(均P>0.05)。
2.6 抑制CD147表达对HaCaT细胞PCNA、VEGF表达的影响
Real-time PCR和Western blot检测结果显示,CD147-siRNA组PCNA、VEGF mRNA和蛋白表达明显低于CD147-NC组(均P<0.01),CD147-NC组与空白对照组PCNA、VEGF mRNA和蛋白表达比较差异无统计学意义(均P>0.05,图4 )。

A:流式细胞术检测HaCaT细胞凋亡;B:流式细胞术检测HaCaT细胞周期分布;与CD147-NC组比较,** P<0.01图3 各组HaCaT细胞凋亡率和细胞周期分布比较Fig.3 Comparison of the cell apoptosis rate and cell cycle distribution of HaCaT cells between groups

A:各组细胞PCNA mRNA表达;B:Western blot检测各组细胞PCNA蛋白表达;C:各组细胞VEGF mRNA表达;D:Western blot检测各组细胞VEGF蛋白表达;与CD147-NC组比较,** P<0.01图4 各组HaCaT细胞PCNA、VEGF表达水平Fig.4 Expression of PCNA and VEGF of HaCaT cells in each group
3 讨论
病理学证实CA皮损处的角质形成细胞存在分化和增殖状态的异常[7-8],短时间内过度增殖会形成巨大型CA,给患者的生活、工作造成极大影响,甚至存在恶变的可能。因此探讨CA疾病进展的机制,对预防CA过度增生具有重要意义。有学者认为CA是一种细胞免疫介导的皮肤疾病[9],免疫异常能够活化和释放一系列细胞因子,参与机体的增殖和修复。CA主要表现为上皮细胞异常增殖,因此过度增生是CA的典型特征之一。CD147是一种属于免疫球蛋白超家族成员的跨膜糖蛋白,在器官形成、组织修复、细胞粘附和胚胎发育等方面发挥重要作用。Nishibaba等[10]称干扰恶性黑色素瘤细胞中CD147的表达可在体外抑制细胞的增殖,并且可以抑制裸鼠移植瘤组织中PCNA的表达以及瘤体的生长。汪成等[11]采用重组慢病毒Lv-shRNA-CD147感染乳腺癌细胞,结果显示CD147基因沉默可下调乳腺癌细胞增殖、迁移相关蛋白(β-catenin、MMP2、MMP9)表达,抑制三阴性乳腺癌细胞的增殖和迁移。
目前关于CD147与皮肤病的报道较少,Zhao等[12]证实CD147与银屑病外周血T淋巴细胞的活化和增殖潜能相关,CD147可能是银屑病治疗的潜在靶分子。PCNA是一种周期蛋白,处于增殖周期的细胞PCNA蛋白均有表达,PCNA表达水平也是细胞增殖状态敏感的生物标记物之一[13]。本研究发现CA皮损组织PCNA蛋白阳性率明显高于对照组,提示CA细胞存在过度增殖情况。肖汉龙等[14]报道称CA细胞的增殖活性明显强于正常表皮细胞,CA皮损处PCNA蛋白表达和增殖指数也显著高于对照组(正常组织)。上述报道也证实了本研究的结果。细胞的过度增殖必须依赖于充足的血供,MVD是评价血管新生能力最直接的客观指标[15],CD31是重糖化Ⅰ型跨膜蛋白,对内皮细胞具有高度敏感性,常用于标记血管内皮细胞。本研究通过CD31染色技术评价CA组织微血管形成能力,结果显示CA组MVD值明显高于对照组,提示CA细胞通过微血管的形成,使细胞获得充足的营养供应,最终导致CA细胞过度增殖。既往有报道称在细胞快速增殖下,跨膜糖蛋白CD147表达上调可以激活葡萄糖转运蛋白1(GLUT-1)并提供细胞增殖所必需的能量供应[16],激活的GLUT-1也会引起血管新生以转运足够的营养,VEGF表达随之增加,细胞获得充分的能量后诱导细胞快速增殖,PCNA表达上调。相关性分析也显示在CA皮损组织CD147与PCNA和MVD呈正相关,与熊浩等[17]报道一致。
角质形成细胞是表皮的重要组成成分,发生CA时,患者皮损处角质形成细胞的角蛋白谱发生明显变化,促进角质形成细胞的增殖[18-19]。本研究利用角质形成细胞HaCaT作为研究对象,进一步分析抑制CD147表达对HaCaT细胞生物学行为和蛋白谱表达的变化。研究结果显示,CD147-siRNA组细胞凋亡率明显升高;在细胞周期分布方面,CD147-siRNA组G2/M期所占比例明显降低,S期所占比例明显升高,说明抑制CD147表达能够使HaCaT细胞周期阻滞于S期,这可能是导致细胞凋亡增加的原因。MTT检测结果也证实CD147-siRNA组细胞增殖能力明显降低,陈明亮等[20]采用白藜芦醇通过抑制角蛋白K17抑制HaCaT细胞的增殖,但是角蛋白K17下调的诱导机制该作者未进行说明。本研究结果显示CD147-siRNA组PCNA、VEGF mRNA和蛋白表达明显低于CD147-NC组和空白对照组,提示CD147可能通过阻滞细胞周期和抑制血管新生调节HaCaT细胞的增殖。
综上所述,CA组织CD147呈高阳性表达,CD147表达水平与PCNA、MVD呈正相关;下调CD147表达可以抑制角质形成细胞HaCaT的增殖,其作用机制可能与降低细胞周期蛋白和调控血管新生有关。CD147有望成为CA治疗的潜在作用靶点之一。
[1] Kazlouskaya V,Shustef E,Allam S H,et al.Expression of p16 protein in lesional and perilesional condyloma acuminata and bowenoid papulosis:Clinical significance and diagnostic implications[J].J Am Acad Dermatol,2013,69(3):444-449.
[2] 田欣欣,王睿,姜玲波,等.山东地区1225例男性尖锐湿疣患者HPV感染亚型分析[J].中国男科学杂志,2016,30(7):41-45.
[3] 李婧,蒋宁,岳晓丽,等.7省(自治区)性病门诊首诊性病患者中HIV检测和感染状况分析[J].中华流行病学杂志,2016,37(3):358-361.
[4] Kreuter A,Wieland U.Lack of efficacy in treating condyloma acuminata and preventing recurrences with the recombinant quadrivalent human papilloniavirus vaccine in a case series of immunoconipetent patients[J].J Am Acad Dermatol,2013,68(1):179-180.
[5] 余世明,初同伟,廖通权,等.CD147抗体对破骨细胞中基质金属蛋白酶活性影响的体外研究[J].中国免疫学杂志,2012,28(3):205-209,216.
[6] Grupp K,Höhne T S,Prien K,et al.Reduced CD147 expression is linked to ERG fusion-positive prostate cancers but lacks substantial impact on PSA recurrence in patients treated by radical prostatectomy[J].Exp Mol Pathol,2013,95(2):227-234.
[7] 肖汉龙,陶娟,刘辉峰,等.尖锐湿疣组织中蛋白酪氨酸磷酸酶-1和表皮生长因子受体的表达[J].临床皮肤科杂志,2013,42(8):458-460.
[8] Shi Y J,Yang J,Yang W.Mechanistic investigation of immunosuppression in patients with condyloma acuminata[J].Mol Med Rep,2013,8(2):480-486.
[9] 解方,李承新.尖锐湿疣免疫学发病机制研究进展[J].传染病信息,2015,28(3):175-178.
[10] Nishibaba R,Higashi Y,Su J,et al.CD147-targeting siRNA inhibits cell-matrix adhesion of human malignant melanoma cells by phosphorylating focal adhesion kinase[J].J Dermatol,2012,39(1):63-67.
[11] 汪成,庄志刚,单鸣,等.CD147基因沉默抑制三阴性乳腺癌细胞增殖的作用机制[J].上海交通大学学报:医学版,2017,37(3):305-311.
[12] Zhao S,Chen C,Liu S,et al.CD147 promotes MTX resistance by immune cells through up-regulating ABCG2 expression and function[J].J Dermatol Sci,2013,70(3):182-189.
[13] Unek G,Ozmen A,Ozekinci M,et al.Immunolocalization of cell cycle proteins(p57,p27,cyclin D3,PCNA and Ki67)in intrauterine growth retardation(IUGR)and normal human term placentas[J].Acta Histochem,2014,116(3):493-502.
[14] 肖汉龙,陶娟,刘辉峰,等.p-STAT3及其靶基因CyclinD1在尖锐湿疣组织中的表达[J].中国皮肤性病学杂志,2013,27(1):13-15.
[15] Simonetti O,Lucarini G,Rubini C,et al.Microvessel density and VEGF,HIF-1α expression in primary oral melanoma:Correlation with prognosis[J].Oral Dis,2013,19(6):620-627.
[16] Yang S,Qi F,Tang C,et al.CD147 promotes the proliferation,invasiveness,migration and angiogenesis of human lung carcinoma cells[J].Oncol Lett,2017,13(2):898-904.
[17] 熊浩,黎倩,刘清秀,等.尖锐湿疣角质形成细胞中陷窝蛋白1的表达与细胞增殖和凋亡的相关性[J].中华皮肤科杂志,2016,49(5):318-323.
[18] 李璟蓉,王建琴,方锐华,等.miR-145对人角质形成细胞系HaCaT细胞增殖、凋亡和细胞周期的影响[J].中华皮肤科杂志,2015,48(6):416-420.
[19] Lyng F M,Desplanques M,Jella K K,et al.The importance of serum serotonin levels in the measurement of radiation-induced bystander cell death in HaCaT cells[J].Int J Radiat Biol,2012,88(10):770-772.
[20] 陈明亮,李吉,孙磊,等.白藜芦醇对UVA照射人角质形成细胞株的保护作用及机制探讨[J].中华皮肤科杂志,2008,41(11):745-748.
ExpressionofCD147inCondylomataAcuminateandCD147-mediatedPathogenesis
Lin Jing,Han Yongzhi,Xiao Jieping et al
DepartmentofDermatology,GuangdongAcademyofMedicalSciences,GuangdongGeneralHospital,Guangzhou510080,China
ObjectiveTo explore the expression of CD147 in condyloma acuminata(CA) tissues and its role in the pathogenesis of CA.MethodsThirty cases of CA were enrolled in the study.The CA lesions(n=30)were selected to the CA group,with 30 normal males foreskin tissues serving as control group.The expression of CD147,proliferating cell nuclear antigen(PCNA),and CD31 in tissues was immunohistochemically measured.The microvascular density(MVD)was represented by CD31 staining.The correlation between CD147 and PCNA or MVD in CA tissues was analyzed.siRNA was used to inhibit the expression of CD147 in HaCaT cells,which were later divided into blank control group,CD147-NC and CD147-siRNA groups according to the different treatment methods.The cell proliferation was measured by MTT assay,and the cell apoptosis rate and cell cycle were detected by flow cytometry.The expression of CD147,VEGF and PCNA mRNA and the expression of VEGF and PCNA protein were measured by Real-time PCR and Western blot,respectively.ResultsThe CD147 positive rate was 83.3% in CA group and 36.7% in control group.The PCNA positive rate was 70.0% in CA group and 40.0% in control group.The CD147 and PCNA positive rates were significantly higher in CA group than in control group(P<0.05).The MVD value was(35.81±6.54)/mm2in CA group,significantly higher than in control group[(12.74±4.75)/mm2,P<0.01].Correlation analysis showed that CD147 was positively correlated with PCNA(r=0.753,P<0.05)and with MVD(r=0.872,P<0.05).Additionally,the cell proliferation was found to be significantly suppressed 48,72 and 96 h after treatment in CD147-siRNA group as compared with CD147-NC group(P<0.05).The cell apoptosis rate was significantly higher in CD147-siRNA group than in CD147-NC group (P<0.01).The G2/M ratio was significantly lower and the S phase ratio significantly higher in CD147-siRNA group than in CD147-NC group(P<0.01).The mRNA and protein expression of PCNA and VEGF was much lower in CD147-siRNA group than in CD147-NC group(P<0.01).ConclusionCD147 is overexpressed in CA tissues,and the expression is positively correlated with the PCNA expression and MVD.Down-regulating the expression of CD147 can inhibit the proliferation of HaCaT cells,which may be associated with the decreased expression of cell cycle proteins and the regulation of angiogenesis.
CD147; proliferating cell nuclear antigen; condyloma acuminata; angiogenesis; cell proliferation
*广东省医学科学技术研究基金资助项目(No.A2015148)
林 静,女,1981年生,副主任医师,医学硕士,E-mail:linjing0077@sina.com
R759
10.3870/j.issn.1672-0741.2017.05.010
(2017-04-07 收稿)
