银杏总黄酮对NAFLD大鼠脂联素信号通路的影响*
2017-11-14周晓黎李轶西高晓阳杨家耀时昭红
周晓黎, 张 书, 舒 磊, 李轶西, 高晓阳, 杨家耀, 时昭红
武汉市第一医院消化内科,武汉 430022
银杏总黄酮对NAFLD大鼠脂联素信号通路的影响*
周晓黎, 张 书, 舒 磊, 李轶西, 高晓阳, 杨家耀, 时昭红△
武汉市第一医院消化内科,武汉 430022
目的探讨银杏总黄酮对非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)大鼠脂联素信号通路的影响。方法利用高脂饲料喂养法构建NAFLD大鼠模型。72只SPF级雄性大鼠分为正常对照组、NAFLD模型组和银杏总黄酮治疗组3组,每组24只。测定各组大鼠体质量及肝指数,光镜观察肝脏组织形态改变,RT-PCR法检测大鼠肝脏AdipoR2 mRNA、PPARα mRNA的表达,Western blot法检测各组大鼠肝脏AdipoR2、PPARα、AMPK蛋白表达以及AMPK蛋白磷酸化水平。结果NAFLD大鼠造模成功。第4周末,与正常对照组大鼠相比,模型组及治疗组大鼠体质量与肝指数均增高(均P<0.05),肝脏AdipoR2 mRNA、PPARα mRNA的表达水平降低,肝脏AdipoR2、PPARα、AMPK蛋白表达以及AMPK蛋白磷酸化水平降低,差异有统计学意义(均P<0.05);模型组与治疗组相比,肝脏AdipoR2 mRNA、PPARα mRNA的表达水平差异无统计学意义(均P>0.05),肝脏AdipoR2、PPARα、AMPK蛋白表达及AMPK蛋白磷酸化水平差异无统计学意义(均P>0.05)。第8、12周末,模型组大鼠体质量与肝指数水平逐渐增高,肝脏AdipoR2 mRNA、PPARα mRNA的表达水平,AdipoR2、PPARα、AMPK蛋白表达水平及AMPK蛋白磷酸化逐渐下降;治疗组大鼠体质量及肝指数逐渐接近正常对照组,肝脏AdipoR2 mRNA、PPARα mRNA的表达水平增高(均P<0.05),AdipoR2、PPARα、AMPK蛋白表达及AMPK蛋白磷酸化水平逐渐增高(均P<0.05)。结论银杏总黄酮能控制大鼠体质量与肝指数,提高大鼠肝脏AdipoR2 mRNA、PPARα mRNA和AdipoR2、PPARα、AMPK蛋白表达水平,并使AMPK蛋白磷酸化水平升高。推测银杏总黄酮可能通过增强脂联素信号通路的活性,一方面减少肝细胞异常凋亡,另一方面促进线粒体内脂肪酸的氧化,从而减轻NAFLD的肝损伤,阻止NAFLD的进展。
银杏总黄酮; 非酒精性脂肪性肝病; 脂联素; 信号通路
随着社会经济的发展,人们生活水平的提高,加上人口老龄化等多种因素的作用,脂肪肝及相关疾病的患病率持续增长,在我国以非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)为最常见的肝病[1]。统计表明患NAFLD的高危因素有:肥胖、高胆固醇饮食、不良生活方式、遗传因素等[2],甚至空气污染也可能是NAFLD的危险因素[3]。NAFLD不仅导致肝脏的不良结局,而且可以导致多种肝外器官并发症[4-5],如慢性肾脏病(chronic kidney disease,CKD)、心血管疾病(cardiovascular disease,CVD)、2型糖尿病(type 2 diabetes mellitus,T2DM)、癌症[6]等。相当数量的NAFLD患者未经肝硬化过程即发展为肝细胞癌(hepatocellular carcinoma,HCC)[7-8],严重影响人们的生活质量。银杏总黄酮(total ginkgo flavone-glycoides)是银杏叶的主要有效成分,包括银杏双黄酮(gilobetin),异银杏双黄酮(isoginkgetin)等,具有扩张血管、降血脂、抗炎、调节内分泌和基础代谢、抗肿瘤等功能。为研究银杏总黄酮对NAFLD的药理作用及可能的临床应用价值,本实验建立大鼠NAFLD模型,观察银杏总黄酮对NAFLD大鼠肝脏组织及脂联素信号通路中AdipoR2、PPARα和AMPK、P-AMPK等的影响,探讨银杏总黄酮对NAFLD大鼠肝脏的保护机制。
1 材料与方法
1.1 实验材料
72只SPF级SD雄性大鼠,体重(100±20) g,购自湖北省实验动物研究中心,合格证号SCXK(鄂)2015-0018,实验单位使用许可证编号SYXK(鄂)2014-0030。银杏总黄酮(武汉市第一医院制剂中心制备);Trizol试剂盒(美国Gibco公司,15596-026);逆转录酶(Promega公司M1701);AdipoR2一抗(Santa Cruz公司,SC-46751)、PPARα一抗(Bioworld公司,BS1689)、AMPK一抗(Bioworld公司,BS1009)、P-AMPK一抗(Bioworld公司,BS5003)。光学显微镜(日本Olympus);PCR仪(美国BIO-RAD公司);逆转录仪(德国Eppendorf公司)。
1.2 实验方法
1.2.1 NAFLD大鼠模型的建立 按照随机分组原则将72只大鼠平均分为正常对照组、NAFLD模型组(简称模型组)、银杏总黄酮治疗组(简称治疗组)。正常对照组采用普通饲料进行饲养,NAFLD模型制备参见文献[9]。高脂食料配方:普通饲料+ 2%胆固醇+ 14%猪油。银杏总黄酮治疗组于造模第5周开始采用银杏总黄酮250 mg/(kg·d)灌胃治疗,每日1次。正常对照组及NAFLD模型组给予等量的生理盐水灌胃。每组分别于第4、8、12周末处死8只大鼠,留取肝脏标本。
1.2.2 肝指数测定 肝指数=肝湿重/体重3×100%。
1.2.3 病理学检查 取部分肝组织于10%甲醛液中固定,石蜡包埋、切片,苏木精-伊红染色后在光镜下观察肝脏组织病理变化。对脂肪变性程度进行分级、评分。低倍镜下观察,脂滴细胞数/总细胞数>1/3即诊断为脂肪肝。
1.2.4 RT-PCR法检测大鼠肝组织AdipoR2mRNA、PPARα mRNA的表达 用Trizol试剂盒抽提肝组织总RNA,紫外分光光度仪检测其浓度及纯度,用M-MLV逆转录酶进行反转录,以适量cDNA为模板扩增目标基因片段,电泳2 h,溴化乙啶溶液染色10 min;扫描,计算与β-肌动蛋白比值作为相对表达量。PCR引物序列采用Primer premier 5.0软件设计,由上海英骏公司合成。AdipoR2mRNA基因序列号NM_001037979.1,上游引物序列5′-TGGGGATCTTTTATATGTTTCG-3′,下游引物序列5′-CATAATGCAAGGTAGGGATGAT-3′。PPARα mRNA基因序列号NM_013196.1,上游引物序列5′-AGAAGTTGCAGGAGGGGATT-3′,下游引物序列5′-CTTCTTGATGACCTGCACGA-3′。
1.2.5 Western blot法检测大鼠肝脏AdipoR2、PPARα、AMPK蛋白表达以及AMPK蛋白磷酸化水平 取肝组织匀浆约100 mg,PBS洗涤离心3次,加蛋白提取液200 μL混匀,充分研磨、裂解、离心后,取上清液,测总蛋白浓度,-20℃保存备用。配制10% SDS-聚丙烯酰胺凝胶,上样,电泳分离,转膜,脱脂奶粉4℃封闭,用1×TBST缓冲液漂洗后加入一抗,室温下孵育2 h,TBS洗涤,室温下二抗孵育2 h。加显色液1 μL,X线底片曝光,显影、定影,扫描定量分析。
1.3 统计学方法
2 结果
2.1 各组大鼠体质量及肝指数比较
模型组大鼠在第4、8、12周末体质量及肝指数逐步增加,与正常对照组比较差异有统计学意义(均P<0.05),各个时段的模型组之间比较亦有统计学差异(均P<0.05)。治疗组第4周末与模型组比较,差异无统计学意义(均P>0.05),第8、12周末与模型组比较,体质量及肝指数降低,差异有统计学意义(均P<0.05),第12周末治疗组与对照组比较差异无统计学意义(均P>0.05)。见表1。
2.2 各组大鼠肝组织病理学改变
光镜观察正常对照组大鼠肝组织小叶结构完整,肝窦正常,肝细胞索排列整齐,细胞核位于细胞中央,核圆,细胞质均匀丰富,肝细胞内无脂肪滴沉积。NAFLD模型组肝小叶界限不清,肝细胞索排列紊乱,部分肝窦消失,肝细胞体积明显增大,细胞核偏移,胞内可见脂滴空泡,间质组织中有淋巴细胞和浆细胞浸润。银杏总黄酮治疗组肝脏损伤程度明显减轻,脂肪变肝细胞较模型组明显减少,肝脏结构完整,胞质内仅见少量脂肪空泡,肝细胞炎症表现显著减轻。见图1。

表1 各组大鼠体质量及肝指数的比较Table 1 Comparision of body mass and liver index of rats between groups(±s)
与同周次正常对照组比较,*P<0.05;与同周次模型组比较,#P<0.05
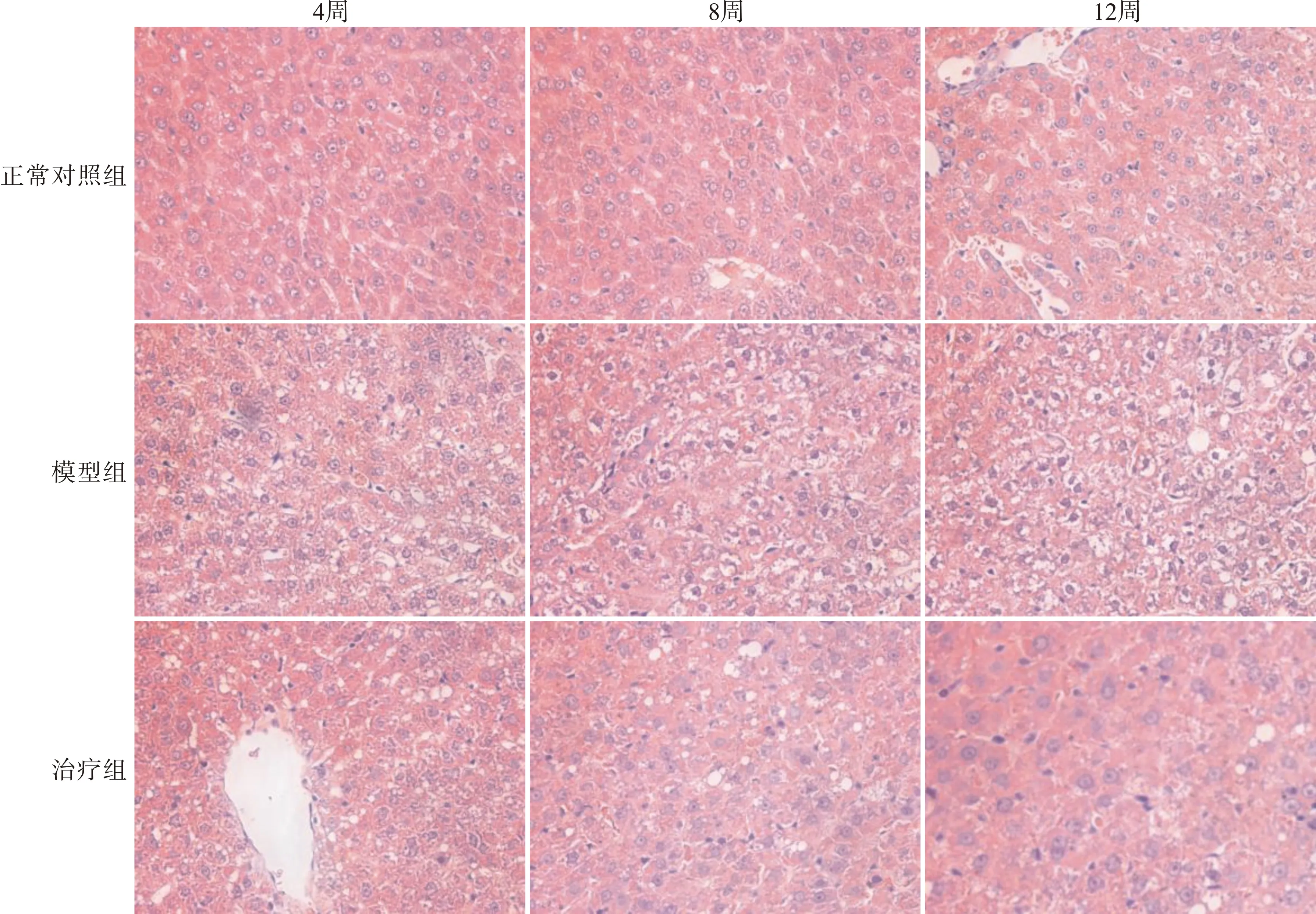
图1 苏木精-伊红染色观察各组大鼠肝组织病理学变化(×400)Fig.1 HE staining of rat hepatic tissues(×400)
2.3 RT-PCR法检测大鼠肝组织AdipoR2 mRNA、PPARα mRNA表达
第4周末,模型组及治疗组与正常对照组比较,AdipoR2及PPARα的mRNA表达量均降低,差异有统计学意义(均P<0.05);而治疗组与模型组之间差异无统计学意义(均P>0.05)。第8周末,模型组、治疗组与正常对照组比较,AdipoR2及PPARα mRNA表达量均下降,差异有统计学意义(均P<0.05);且治疗组AdipoR2及PPARα mRNA表达量较模型组均有较大提高,差异有统计学意义(均P<0.05)。第12周末,模型组与正常对照组、治疗组比较,AdipoR2及PPARα mRNA表达量均下降,差异有统计学意义(均P<0.05);治疗组水平回升,与正常对照组比较,差异无统计学意义(均P>0.05)。正常对照组在第4、8、12周末,AdipoR2 mRNA及PPARα mRNA表达量差异无统计学意义(P>0.05);模型组在相应时间段表达量逐步下降(P<0.05);治疗组在相应时间段表达量逐步增加(P<0.05)。见图2。
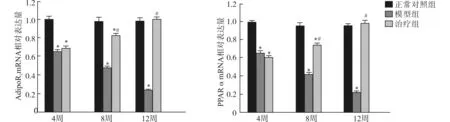
与同周次正常对照组比较,*P<0.05;与同周次模型组比较,#P<0.05图2 大鼠肝组织中AdipoR2和PPARα mRNA表达Fig.2 Expression of AdipoR2 and PPARα mRNA in rat hepatic tissues
2.4 Western blot法检测大鼠肝脏组织AdipoR2、PPARα、AMPK蛋白表达以及AMPK蛋白磷酸化水平
第4周末,与正常对照组比较,模型组及治疗组AdipoR2、PPARα、AMPK的蛋白表达量以及AMPK蛋白磷酸化水平下降,差异有统计学意义(均P<0.05)。第8周末,模型组与治疗组AdipoR2、PPARα、AMPK蛋白表达以及AMPK蛋白磷酸化水平仍较正常对照组低(均P<0.05);治疗组与模型组比较,各项指标水平升高,差异有统计学意义(均P<0.05)。第12周末,与正常对照组和治疗组比较,模型组各项指标水平均下降,差异有统计学意义(均P<0.05);治疗组与正常对照组比较,各项指标的差异无统计学意义(均P>0.05)。正常对照组在第4、8、12周末,各项指标的差异无统计学意义(P>0.05);模型组各项指标的表达水平逐步下降,组间均数差异有统计学意义(P<0.05);治疗组各项指标的表达水平逐步增加,组间均数差异有统计学意义(P<0.05)。见图3、图4。
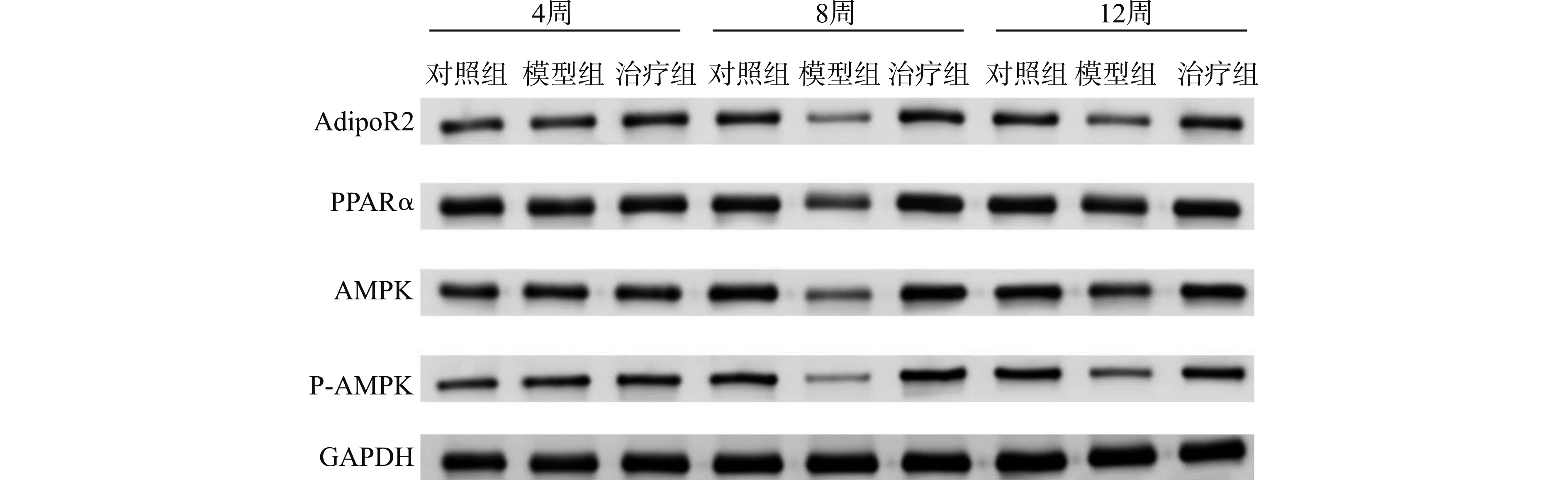
图3 Western blot检测大鼠肝组织中AdipoR2、PPARα、AMPK蛋白、AMPK蛋白磷酸化的表达Fig.3 Western blot analysis of the expression of AdipoR2,PPARα,AMPK,phosph-AMPK in rat hepatic tissues
3 讨论
非酒精性脂肪肝是与胰岛素抵抗(insulin resistance,IR)和遗传易感密切相关的代谢性肝损伤。关于NAFLD的发病机制尚不明确。到目前为止,“二次打击”学说[10]仍被认为是最好地解释了NAFLD的发生发展过程的理论。Zhou等[11]研究表明NAFLD患者的胰岛素抵抗与脂联素低表达相关,脂联素单核苷酸多态性(SNP)位点与NAFLD发病易感性存在相关性。脂联素(adiponectin,APN)是一种脂肪组织特异性分泌蛋白,能抑制氧化应激、改善胰岛素抵抗及炎症反应,具有广泛的信号转导及代谢调控效应[12]。脂联素受体目前发现有3种,分别是2003年Yamauchi等发现的AdipoR1和AdipoR2,以及后续发现的T钙黏素,介导脂联素生物学功能的受体主要是AdipoR1和AdipoR2。脂联素受体在不同部位的表达程度各异且受诸多因子调控,提示其存在不同的调节机制。Handa等[13]的研究结果显示,在严重NAFLD时,脂联素水平明显降低,本课题研究结果与之一致,提示脂联素有保护肝脏的作用。
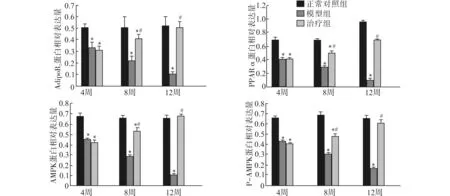
与同周次正常对照组比较,*P<0.05;与同周次模型组比较,#P<0.05图4 大鼠肝组织AdipoR2、PPARα、AMPK蛋白表达及AMPK蛋白磷酸化的变化Fig.4 Expression of AdipoR2,PPARα,AMPK and phospho-AMPK protein in rat hepatic tissues
在脂联素及其受体的信号转导研究中,有2条比较重要的传导通路:过氧化物酶体增殖物激活受体(PPARα)通路和腺苷酸活化蛋白激酶(AMPK)转导途径。PPARα下游诸多靶点和脂类、脂联素受体紧密联系,与脂肪酸的获取、结合、转运、氧化效应以及脂蛋白质的装配等有关。如果PPARα及其信号通路的相关基因表达发生紊乱,可导致与脂质代谢有关的基因转录水平的降低,出现脂肪酸氧化减少,脂蛋白合成代谢障碍,肝脏脂质沉积,引起肝细胞损伤。Yamauchi等[14]在C2C12细胞中,通过脂联素及gAcrp30干预C2C12细胞约7 h,结果显示PPARα活性显著增强,明显增强脂肪酸的氧化及葡萄糖摄取。还有报道指出PPARα激动剂可激活PPARα增强脂肪酸氧化,治疗脂肪性肝病[15]。王焱等[16]研究证实前胡甲素可通过激活PPARα有效抑制肝脏的炎症反应。腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)是机体细胞内主要的能量传感器[17],参与脂肪酸氧化与葡萄糖转运,甘油三酯的合成与代谢、氧化应激、线粒体功能等多种细胞代谢过程,也是APN信号通路的重要下游通路。脂联素通过激活AMPK,从而激活下游靶点MAPK,增强PPARα转录活性及靶基因的表达水平,增加骨骼肌脂肪的氧化,减少游离脂肪酸进入肝脏。胰岛素介导的AdipoR2-AMPK通路还可有效改善肝脏炎症及胰岛素抵抗[18]。赵霞等[19]研究表明,α-促黑色素主要通过CAMP-PKA-AMPK-ACC的途径促进C2C12成肌细胞中的脂肪酸氧化。Tian等[20]对脂联素刺激人海马神经干细胞增殖机制的研究证实,AdipoR1及AdipoR2发挥提高脂肪酸氧化及葡萄糖代谢的机制可能是通过增加脂联素对AMPK、PPARα受体活性的调节来实现的。
Caspase-3是细胞凋亡过程中发挥主要效应的因子[21],激活的Caspase-3启动Caspases级联反应,将细胞内的重要蛋白降解,引起细胞凋亡。我们前期的研究工作表明,银杏总黄酮可通过其抗氧化应激及改善微循环等作用,抑制实验性大鼠肝组织核因子κB(NF-κB)的活化;抑制肝星状细胞(hepatic stellat cells,HSC)激活和增殖;已证实银杏黄酮可促进活化的HSC凋亡,降低NAFLD大鼠血清TG、TCHOL含量,提高血清脂联素水平,降低Caspase-3蛋白活化,抑制肝细胞的凋亡,减轻NAFLD大鼠的肝损伤。本实验结果显示:随着时间延长,NAFLD模型组大鼠体质量与肝指数水平逐渐增高,大鼠肝脏AdipoR2 mRNA、PPARα mRNA的表达水平下降,AdipoR2、PPARα、AMPK蛋白及AMPK蛋白磷酸化水平逐渐下降。银杏总黄酮治疗组大鼠体质量及肝指数逐渐接近正常对照组,大鼠肝脏AdipoR2 mRNA、PPARα mRNA的表达水平逐渐增高,肝脏AdipoR2、PPARα、AMPK蛋白及AMPK蛋白磷酸化水平逐渐回升。我们推测这一作用机制可能为:银杏总黄酮提高大鼠血清脂联素水平,一方面可降低Caspase-3蛋白活化水平,因为活化Caspase-3可促进肝细胞凋亡,所以银杏总黄酮可降低肝细胞异常凋亡,从而保护肝细胞。另一方面,PPARα水平及AMPK磷酸化水平升高,可促使线粒体内脂肪酸的氧化,从而发挥降脂作用。总之,银杏总黄酮能有效干预脂联素的表达模式及调节其信号通路,有望为NAFLD的治疗提供新的途径和思路。
[1] Fan J G.Epidemiology of alcoholic and nonalcoholic fatty liver disease in China[J].J Gastroenterol Hepatol,2013,28(S1):11-17.
[2] 胡中杰,张晶.我国非酒精性脂肪性肝病的研究现状[J].临床肝胆病杂志,2016,32(3):552-556.
[3] 李檬,厉有名.细颗粒物与非酒精性脂肪肝[J].中华肝脏病杂志,2016,24(9):713-715.
[4] Targher G,Byrne C D.Non-alcoholic fatty liver disease:an emerging driving force in chronic kidney disease[J].Nat Rev Nephrol,2017,13(5):297-310.
[5] Sinn D H,Kang D,Chang Y,et al.Non-alcoholic fatty liver disease and progression of coronary artery calcium score:a retrospective cohort study[J].Gut,2017,66(2):323-329.
[6] 李良平.非酒精性脂肪性肝病与肝细胞癌[J].临床肝胆病杂志,2016,32(3):432-436.
[7] Fierbinteanu-Braticevici C,Negreanu L,Tarantino G,et al.Is fatty liver always benign and should not consequently be treated?[J].J Physiol Pharmacol,2013,64(1):3-9.
[8] 胡晓娜,周灿灿,保志军.非酒精性脂肪性肝病及肝细胞癌的相关性研究进展[J].中华消化杂志,2016,36(12):864-866.
[9] 李强,傅继华.非酒精性脂肪肝动物模型研究进展[J].实用中西医结合临床,2013,13(3):92-94.
[10] Mehta K,Van Thiel D H,Shah N,et al.Nonalcoholic fatty liver disease:pathogenesis and the role of antioxidants[J],Nutr Rev,2002,60(9):289-293.
[11] Zhou Y J,Li Y Y,Nie Y Q,et al.Influence of polygenetic polymorphisms on the susceptibility to non-alcoholic fatty liver disease of Chinese people[J].J Gastroenterol Hepatol,2010,25(4):772-777.
[12] Bao Z,Yuan X,Duan S,et al.Clinical implication of changes in serum adiponectin in patients with hepatogenic diabetes[J].Sci Rep,2014,4(6):5560.
[13] Handa P,Maliken B D,Nelson J E,et al.Reduced adiponectin signaling due to weight gain results in nonalcoholic steatohepatitis through impaired mitochondrial biogenesis[J].Hepatology,2014,60(1):133-145.
[14] Yamauchi T,Kamon J,Minokoshi Y,et al.Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase[J].Nat Med,2002,8(11):1288-1295.
[15] Kim Y I,Hirai S,Takahashi H,et al.9-oxo-10(E),12(E)-octa-decadienoic acid derived from tomato is a potent peroxisome proliferator-activated receptoraagonist to decrease triglyceride accumulation inmouse primary hepatocytes[J].Mol Nutr Food Res,2011,55(4):585-593.
[16] 王炎,杨翠,常贺,等.前胡甲素通过PPARα抑制LPS诱导的内皮细胞的炎症反应[J].中国药理学通报,2012,28(11):1594-1597.
[17] Cavaglieri R C,Day R T,Feliers D,et al.Metformin prevents renal interstitial fibrosis in mice with unilateral ureteral obstruction[J].Mol Cell Endocrinol,2015,412:116-122.
[18] Sim M O,Lee H I,Ju R H,et al.Long-term supplementation of esculetin ameliorates hepatosteatosis and insulin resistance partly by activating adipoR2-AMPK pathway in diet-induced obese mice[J].J Funct Foods,2015,15:160-171.
[19] 赵霞,董津男,林良妍,等.α-促黑色素促进脂肪的氧化的信号传导通路研究[J].中国临床药理学杂志,2013,29(5):364-366.
[20] Tian X Q,Yang Y J,Li Q,et al.Globular adiponectin inhibits the apoptosis of mesenchymal stem cells induced by hypoxia and serum deprivation via the AdipoR1-mediated pathway[J].Cell Physiol Biochem,2016,38(3):909-925.
[21] 王锴,郁云龙,刘阳阳,等.蟾蜍毒素对人胃癌细胞凋亡的诱导机制[J].世界华人消化杂志,2011,19(2):116-120.
EffectofTotalGinkgoFlavone-glycoidesonAdiponectinSignallingPathwayinRatswithNonalcoholicFattyLiverDisease
Zhou Xiaoli,Zhang Shu,Shu Lei et al
DepartmentofGastroenterology,WuhanFirstHospital,Wuhan430022,China
ObjectiveTo examine the effect of total ginkgo flavone-glycoides on the adiponectin signalling pathy in rats with nonalcoholic fatty liver disease(NAFLD).MethodsThe NAFLD rat model was established by high-fat diet.Seventy-two SPF male rats were randomly divided into normal control group,NAFLD model group and total ginkgo flavone-glycoides group,with 24 in each group.The body weight and liver index were measured.The morphological changes of the liver were observed under the light microscope.RT-PCR was used to detect the expression of AdipoR2 and PPARα mRNA in liver tissue and Western blotting to detect the expression of AdipoR2,PPARα,AMPK,phospho-AMPK.ResultsThe NAFLD model was successfully established.At the fourth weekend,the body mass and liver index were significantly increased,the levels of AdipoR2and PPARα mRNA,and those of AdipoR2,PPARα,AMPK,and phospho-AMPK protein were signficantly decreased in the NAFLD model group and total ginkgo flavone-glycoides group as compared with the normal control group(P<0.05).There were no significant differences in the levels of AdipoR2 and PPARα mRNA and the levels of AdipoR2,PPARα,AMPK,phospo-AMPK protein between the NAFLD model group and total ginkgo flavone-glycoides group(P>0.05).At the eighth and twelfth weekend,the body mass and liver indexes were further increased and the levels of AdipoR2 and PPARα mRNA,and those of AdipoR2,PPARα,AMPK,and phospho-AMPK protein were signficantly decreased in the NAFLD model group.However,these indicators were significantly improved in total ginkgo flavone-glycoides group.ConclusionTotal ginkgo flavone-glycoides can mitigate the hepatic injury and hinder the progression of NAFLD by inhibiting the hepatocyte apoptosis,promoting the oxidation of fatty acid in mitochondria,increasing the activity of adiponectin signalling pathway in the NAFLD rats.
total ginkgo flavone-glycoides; nonalcoholic fatty liver disease; adiponectin; signalling pathway
*武汉市卫生计生委临床医学科研资助项目(No.2014-92-WX14C05)
周晓黎,女,1975年生,副主任医师,E-mail:1195019687@qq.com
△通讯作者,Corresponding author,E-mail:zhaohshi@126.com
R285.5
10.3870/j.issn.1672-0741.2017.05.008
(2017-05-25 收稿)
