绿色合成苯并吡喃并四氢噻吩衍生物
2017-11-14丁晨浩谢建武
丁晨浩,谢建武
(浙江师范大学化学与生命科学学院,浙江 金华321004)
绿色合成苯并吡喃并四氢噻吩衍生物
丁晨浩,谢建武
(浙江师范大学化学与生命科学学院,浙江 金华321004)
以2-苯基-3-硝基-2H-苯并吡喃和2,5-二羟基-1,4-二噻烷为原料,在乙醇中,无催化剂条件下,加热回流,通过sulfa-Michael/aldol串联反应,提供了一条简单高效、原子经济性高的方法合成苯并吡喃并四氢噻吩衍生物。该无催化剂绿色合成方法以高收率得到了一系列苯并吡喃并四氢噻吩衍生物。
2,5-二羟基-1,4-二噻烷;无催化剂;绿色合成;苯并吡喃并四氢噻吩衍生物
噻吩杂环是有机合成中引人注目的目标分子,其结构广泛存在于天然产物中,并且表现出高度的生物活性,因此常被应用于药物[1]、农药[2]、染料[3]等非天然化合物的合成中,例如含有手性噻吩环结构的Salacinol[4-5]是印度传统医学中记载的一种有效的天然α-葡萄糖苷酶抑制剂;Biotin[6]作为一种水溶性维生素B,在脂肪酸合成,支链氨基酸分解代谢和糖质新生中,都起到了重要的作用。正是噻吩环的这些应用,其合成方法也得到了广泛的研究[7-10]。目前,合成噻吩环的方法众多,但这些方法基本都是基于有机碱或金属催化剂催化反应,而且大部分反应溶剂均为二氯甲烷。本文提供了一种绿色合成四氢噻吩稠环化合物的方法,该方法具有以下优点:无催化剂,溶剂绿色环保,反应时间短且收率高。
1 实验部分
1.1 药品仪器说明
本文所使用试剂均为CP或AR级。TLC监测使用薄层硅胶板GF254。分离提纯产物使用硅胶(200~300目),洗脱剂使用石油醚和乙酸乙酯以不同比例配合。NMR的测定使用德国Broker DRX-600MHz(四甲基硅烷为内标,DMSO-d6作为溶剂);熔点测定使用熔点仪(YRT-3)。
1.2 苯并吡喃并四氢噻吩衍生物的合成
2-芳基-3-硝基-2H-苯并吡喃2a(0.2 mmol)与2,5-二羟基-1,4-二噻烷3(0.1 mmol)置于1 mL无水乙醇中,加热回流2 h。反应结束后,将体系旋干,柱层析分离产物得到白色固体4a。
4a:白色固体,产率85%,m.p.188.0℃~190.1℃。1H NMR(600 MHz,DMSO) δ 7.49~7.44(m,3H),7.44~7.39(m,2H),7.32(dd,J=7.7,1.3 Hz,1H),7.26~7.21(m,1H),7.06~7.04(m,1H),6.98(d,J=8.1 Hz,1H),6.46(d,J=5.2 Hz,1H),5.71(s,1H),5.36(s,1H),4.50(t,J=4.0 Hz,1H),3.75(dd,J=12.0,3.8 Hz,1H),2.95(d,J=11.9 Hz,1H);13C NMR(151 MHz,DMSO) δ 152.6,134.8,129.9,129.6,128.9,128.5,127.8,122.9,122.8,117.3,98.6,76.0,75.5,43.1,35.0。
4b:淡黄色固体,产率76%,m.p.204.1℃~205.0℃。1H NMR(600 MHz,DMSO)δ 7.49~7.43(m,4H),7.39(dd,J=6.6,2.9 Hz,2H),7.28(dd,J=8.7,2.6 Hz,1H),7.01(d,J=8.7 Hz,1H),6.46(d,J=5.1 Hz,1H),5.71(s,1H),5.35(s,1H),4.49(t,J=4.2 Hz,1H),3.74(dd,J=12.0,3.8 Hz,1H),2.95(d,J=11.8 Hz,1H);13C NMR(151 MHz,DMSO) δ 151.4,134.4,129.7,129.3,128.8,128.6,127.7,126.3,125.0,119.2,98.2,75.9,75.6,42.7,35.0。
4c:淡黄色固体,产率80%,m.p.209.8℃~210.5℃。1H NMR(600 MHz,DMSO)δ 7.57(d,J=2.3 Hz,1H),7.46(dd,J=5.1,1.6 Hz,3H),7.41(d,J=2.4 Hz,1H),7.39(dd,J=6.5,3.0 Hz,2H),6.96(d,J=8.7 Hz,1H),6.47(d,J=5.0 Hz,1H),5.70(s,1H),5.35(s,1H),4.48(t,J=4.2 Hz,1H),3.74(dd,J=12.0,3.8 Hz,1H),2.95(d,J=12.0 Hz,1H);13C NMR(151 MHz,DMSO) δ 151.9,134.4,132.1,131.7,129.8,128.6,127.7,125.5,119.6,114.0,98.2,75.9,75.6,42.7,35.0。
4d:白色固体,产率61%,m.p.170.3℃~171.5℃。1H NMR(600 MHz,DMSO) δ 7.49~7.44(m,3H),7.43~7.38(m,2H),7.22(d,J=8.6 Hz,1H),6.64(dd,J=8.5,2.5 Hz,1H),6.56(d,J=2.5 Hz,1H),6.42(d,J=5.2 Hz,1H),5.69(s,1H),5.30(s,1H),4.48(t,J=4.3 Hz,1H),3.76~3.71(m,4H),2.93(d,J=11.9 Hz,1H);13C NMR(151 MHz,DMSO) δ 159.8,153.5,134.8,130.4,129.6,128.5,127.8,114.8,109.7,102.2,98.5,76.0,75.6,55.8,42.9,34.9。
4e:白色固体,产率85%,m.p.175.4℃~176.8℃。1H NMR(600 MHz,DMSO)δ 7.57~7.54(m,1H),7.51(t,J=7.8 Hz,1H),7.43(d,J=1.6 Hz,1H),7.39(d,J=7.7 Hz,1H),7.32(dd,J=7.6,1.4 Hz,1H),7.26~7.22(m,1H),7.07~7.04(m,1H),7.00(d,J=7.6 Hz,1H),6.48(d,J=5.1 Hz,1H),5.75(s,1H),5.35(s,1H),4.49(t,J=4.0 Hz,1H),3.77(dd,J=12.1,3.8 Hz,1H),2.95(d,J=11.9 Hz,1H);13C NMR(151 MHz,DMSO)δ 152.3,137.3,133.3,130.5,129.9,129.7,128.9,127.4,126.7,123.0,122.7,117.3,98.7,76.0,74.6,43.0,34.9。
4f:白色固体,产率83%,m.p.164.1℃~165.3℃。1H NMR(600 MHz,DMSO) δ 7.57~7.51(m,2H),7.46~7.39(m,2H),7.32(dd,J=7.7,1.5 Hz,1H),7.26~7.21(m,1H),7.0~7.04(m,1H),6.98(d,J=8.2 Hz,1H),6.45(d,J=4.9 Hz,1H),5.75(s,1H),5.33(s,1H),4.46(t,J=4.0 Hz,1H),3.74(dd,J=12.0,3.8 Hz,1H),2.94(d,J=12.0 Hz,1H);13C NMR(151 MHz,DMSO)δ 152.4,134.3,133.8,129.9,129.7,128.9,128.6,122.9,122.8,117.3,98.6,76.0,74.7,42.9,34.9。
4g:白色固体,产率88%,m.p.198.5℃~199.8℃。1H NMR(600 MHz,DMSO)δ 7.70~7.67(m,1H),7.55(s,1H),7.45~7.42(m,2H),7.32(dd,J=7.7,1.4 Hz,1H),7.27~7.22(m,1H),7.07~7.04(m,1H),7.00(d,J=8.2 Hz,1H),6.46(d,J=4.8 Hz,1H),5.74(s,1H),5.34(s,1H),4.48(t,J=4.1 Hz,1H),3.76(dd,J=12.0,3.8 Hz,1H),2.94(d,J=11.9 Hz,1H);13C NMR(151 MHz,DMSO)δ 152.3,137.5,132.6,130.7,130.2,129.9,128.9,127.1,123.90,122.7,121.8,117.3,98.7,76.0,74.5,42.9,34.9。
4h:白色固体,产率84%,m.p.163.9℃~1 65.0℃。1H NMR(600 MHz,DMSO)δ 7.67(d,J=8.5 Hz,2H),7.36(d,J=8.5 Hz,2H),7.32(dd,J=7.7,1.4 Hz,1H),7.25~7.21(m,1H),7.06~7.03(m,1H),6.97(d,J=7.4 Hz,1H),6.46(d,J=5.1 Hz,1H),5.73(s,1H),5.33(s,1H),4.46(t,J=4.0 Hz,1H),3.73(dd,J=12.0,3.8 Hz,1H),2.93(d,J=11.9 Hz,1H);13C NMR(151 MHz,DMSO)δ 152.3,134.2,131.5,130.0,129.9,128.9,123.0,122.9,122.7,117.3,98.6,76.0,74.8,43.0,34.9。
4j:淡黄色固体,产率72%,m.p.180.6℃~181.5℃。1H NMR(600 MHz,DMSO)δ 7.32~7.21(m,6H),7.05~7.02(m,1H),6.96(d,J=8.1 Hz,1H),6.40(s,1H),5.65(s,1H),5.32(s,1H),4.47(t,J=4.1 Hz,1H),3.72(dd,J=12.0,3.8 Hz,1H),2.93(d,J=11.9 Hz,1H),2.36(s,3H);13C NMR(151 MHz,DMSO)δ 152.6,139.1,131.8,129.9,129.1,128.8,127.7,123.0,122.7,117.3,98.6,76.0,75.4,43.1,34.9,21.3。
4k:淡黄色固体,产率70%,m.p.134.1℃~135.6℃。1H NMR(600 MHz,DMSO)δ 7.47~7.43(m,1H),7.31(dd,J=7.7,1.3 Hz,1H),7.24~7.20(m,1H),7.19~7.14(m,2H),7.07~7.02(m,2H),6.93(d,J=8.1 Hz,1H),6.38(d,J=5.3 Hz,1H),5.99(s,1H),5.35(s,1H),4.42(t,J=4.5 Hz,1H),3.87(s,3H),3.67(dd,J=11.6,4.2 Hz,1H),2.89(d,J=11.5 Hz,1H);13C NMR(151 MHz,DMSO) δ 156.3,152.6,130.9,129.7,128.8,128.7,122.8,122.6,120.9,117.2,111.4,99.7,76.1,69.4,56.0,43.5,34.9。
4l:淡黄色固体,产率67%,m.p.150.6℃~151.5℃。1H NMR(600 MHz,DMSO)δ 7.38(t,J=8.0 Hz,1H),7.31(dd,J=7.7,1.4 Hz,1H),7.26~7.21(m,1H),7.05~7.03(m,2H),7.00~6.95(m,2H),6.93(d,J=1.9 Hz,1H),6.41(d,J=5.2 Hz,1H),5.65(s,1H),5.31(s,1H),4.51(t,J=4.0 Hz,1H),3.79(s,3H),3.74(dd,J=12.0,3.8 Hz,1H),2.93(d,J=11.8 Hz,1H);13C NMR(151 MHz,DMSO) δ 159.4,152.5,136.2,129.8,129.7,128.9,122.9,122.8,120.0,117.3,114.7,113.8,98.5,76.0,75.3,55.7,43.1,34.9。
4m:淡黄色固体,产率68%,m.p.156.8℃~157.9℃。1H NMR(600 MHz,DMSO)δ 7.30(dd,J=11.1,5.0 Hz,3H),7.24~7.20(m,1H),7.04(dd,J=7.5,1.0 Hz,1H),7.01(dd,J=8.3,4.9 Hz,2H),6.95(d,J=8.1 Hz,1H),6.38(d,J=5.1 Hz,1H),5.62(s,1H),5.30(s,1H),4.43(t,J=4.0 Hz,1H),3.81(s,3H),3.70(dd,J=11.9,3.8 Hz,1H),2.91(d,J=11.8 Hz,1H);13C NMR(151 MHz,DMSO) δ 160.3,152.7,129.9,129.1,128.8,126.5,122.9,122.7,117.3,113.9,98.6,76.0,75.3,55.7,43.1,34.9。
2 结果和讨论

苯并吡喃并四氢噻吩衍生物溶剂及温度筛选见表1。
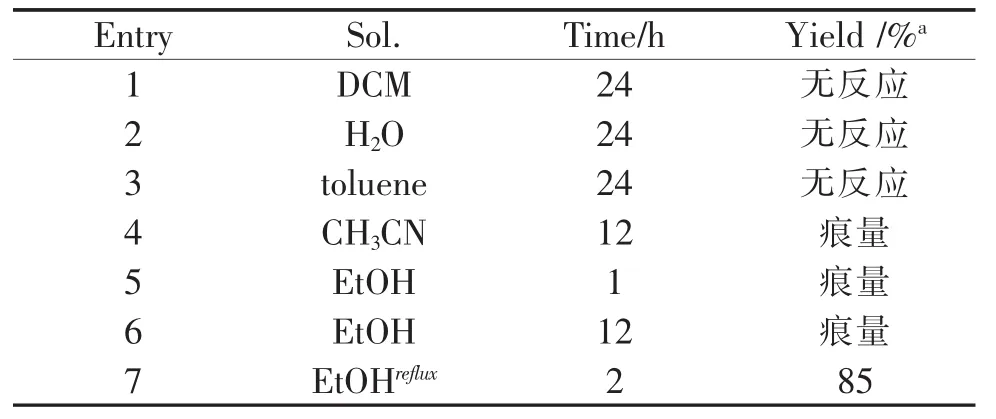
表1 苯并吡喃并四氢噻吩衍生物溶剂及温度筛选
首先,我们对该反应的溶剂进行了筛选。在室温无碱条件下,该反应在极性溶剂乙醇和乙腈中都生成了痕量的4a,但在非极性溶剂二氯甲烷和甲苯中没有发生任何转化。我们猜测乙醇作为质子型溶剂,可以解离出活泼质子,进而提高了苯并吡喃硝基烯烃的亲电性,故促进了反应的进行。而在水相中,由于底物的溶解性能极差,反应没有检测到理想产物4a。因此,我们选择了极性质子型溶剂乙醇作为该反应的最佳溶剂进行进一步的研究。当反应在乙醇中升高至回流温度反应2 h,该反应便可分离提纯得到85%产率的4a,于是,我们确定该反应的最优反应条件:无催化剂,乙醇加热回流2 h。

苯并吡喃并四氢噻吩衍生物底物拓展见表2。

表2 苯并吡喃并四氢噻吩衍生物底物拓展
在确定了最佳反应条件后,我们通过改变R1和Ar2基团来研究该反应对2-芳基-3-硝基-2H-苯并吡喃2a的适用性。经研究发现3与不同的苯并吡喃硝基烯烃反应时,取代基性质和位置对该反应都有一定的影响。当Ar2基团为Ph,改变R1基团为吸电子基团-Cl和-Br时,对该反应产率并没有产生太大的影响,都可以取得高的产率。但是当改变R1为供电子基团-OMe时,该反应的产率明显下降,只有达到61%。当R1为H,改变Ar2基团,相同取代基无论是邻位、间位还是对位对该反应产率的影响都是极小的。但Ar2取代基的性质对该反应收率影响较大,吸电子基团-Cl,-Br的产率优于供电子基团-Me,-OMe,但反应整体都可以达到中等以上收率。
3 结论
本文报道了苯并吡喃并四氢噻吩的绿色合成方法。该方法以乙醇作为溶剂,无碱条件下,2-苯基-3-硝基-2H-苯并吡喃和2,5-二羟基-1,4-二噻烷加热回流,通过sulfa-Michael/aldol串联反应,得到了一系列高产率苯并吡喃并四氢噻吩衍生物。该方法操作简单,条件温和,原子经济性高,完全符合绿色有机合成的要求,为合成多官能团四氢噻吩稠环化合物提供了一条新的途径。
[1]Wei P S,Wang M X,Xu D C,et al.Synthesis of 2,3-dihydrothieno(2,3-b)quinolines and thieno(2,3-b)-quinolines via an unexpected domino Aza-MBH/Alkylation/Aldol Reaction[J].J.Org.Chem.,2016,81:1216-1222.
[2]Tsygankova V A,Blume Y B.Screening and peculiarity of the biological action of synthetic plant growth regulators[J].Biopolim.Kletka.,1997,13:484-492.
[3]Hallas G,Towns A D.Synthesis of Some nitro-substituted thiophene-based Azo disperse dyes[J].Dyes&Pigments,1997,33:319-336.
[4]Yoshikawa M,Murakami T,Shimada H,et al.potent antidiabetic principle with unique thionsugar sulfonium sulfate structure from the ayurvedic traditional medicine salacia reticulate in Srilanka and India[J].Tetrahedron Lett.,1997,38:8367-8370.
[5]Yuasa H,Takada J,Hashimoto H.Glycosidase inhibition by cyclic sulfonium compounds[J].Bioorg.Med.Chem.Lett.,2001,11:1137-1139.
[6]Benetti S,Risi C D,Pollini G P,et al.Synthetic routes to chiral nonracemic and racemic dihydro-and tetrahydrothiophenes[J].Chem.Rev.,2012,112:2129-2163.
[7]Dzhemilev U M,Ibragimov A G,Gilyazev R R,et al.Zirconium-catalyzed preparation of aluminacyclopentanes and synthesis of five-membered carbo-and heterocycles[J].Tetrahedron.,2004,60:1281-1286.
[8]Barco A,Baricordi N,Benetti S R,et al.Convenient‘one pot’synthesis of 3,4-substituted tetrahydrothiophenes through tandem Michael-Henry and Michael-Michael reactions[J].Tetrahedron Lett.,2006,47:8087-8090.
[9]Connor C,Roydhouse M D,Przybyl A M,et al.Facile synthesis of 3-nitro-2-substituted thiophenes[J].J.Org.Chem.,2010,75:2534–2538.
[10]Xu C,Du J,Ma L,et al.Tertiary amine functionalized polyacrylonitrile fiber catalyst for the synthesis of tetrahydrothiophenes[J].Tetrahedron.,2013,69:4749-4757.
Green Synthesis of Benzopyrano tetrahydrothiophene Derivatives
DING Chen-hao,XIE Jian-wu
(College of Chemistry and Life Science,Zhejiang Normal University,Jinhua,Zhejiang 321004,China)
A simple,highly efficient and atom economical green protocol has been developed for the catalyst-free synthesis of benzopyrano tetrahydrothiophene derivatives by sulfa-Michael/aldol reaction in EtOH at reflux temperature.This catalyst-free green approach provided a series of the addition products in high yields.
1,4-dithiane-2,5-diol;catalyst-free;green synthesis;benzopyrano tetrahydrothiophene derivatives
1006-4184(2017)10-0027-04
2017-05-14
丁晨浩(1991-),男,浙江绍兴人,硕士,研究方向:不对称合成。E-mail:373659576@qq.com。
