直肠癌伴同时性多发性肺转移患者的多学科临床决策探讨*
2017-11-14袁瑛徐栋杨琦贝迪恺刘月张苏展丁克峰
袁瑛 徐栋 杨琦 贝迪恺 刘月 张苏展 丁克峰
·MDT论坛·
直肠癌伴同时性多发性肺转移患者的多学科临床决策探讨*
袁瑛①徐栋②杨琦②贝迪恺②刘月②张苏展②丁克峰②
结直肠癌患者中肺是继肝脏之后最常见的远处转移器官之一,但由于肺转移发病率较低且生物学侵袭性相对温和,因而与结直肠癌肝转移相比,结直肠癌肺转移无论是关注程度、综合治疗理念还是相关的临床和基础研究都相对匮乏。本文现介绍1例直肠癌伴同时性多发性肺转移患者在浙江大学医学院附属第二医院大肠癌诊治中心的多学科综合治疗(multidisciplinary team,MDT)经过,以探讨该类患者的临床病理特征、预后影响因素、合理的综合治疗决策以及现有的诊治争议与共识,以期促进临床诊疗的规范化和个体化,使患者更多获益。
直肠癌 肺转移 多学科讨论 临床完全缓解 观察等待 局部治疗 维持治疗
1 病例简介
患者男性,71岁,因“反复里急后重2个月,加重伴便血1个月”于2015年5月18日就诊于浙江大学医学院附属第二医院大肠癌诊疗中心。既往原发性高血压20余年,口服药物控制尚可。否认家族肿瘤病史。
入院评估:BMI为26.26 kg/m2,营养风险评分0分,ADL评级Ⅰ级,ECOG评分0分。体格检查:血压132/79 mmHg,心肺腹查体无殊。肛门指检:进指6 cm可及隆起型肿块,环壁近1周,管腔狭窄,质地较硬,活动度差,退指染血。
实验室查示:大便OB(+),血CEA为15.8 ng/mL。
肠镜检查示:距肛10~15 cm可见隆起凹陷性病变,距肛18 cm可见2.0 cm×3.0 cm黏膜隆起糜烂病变,距肛30 cm可见直径0.6 cm息肉。活检病理提示(距肛10 cm)低分化腺癌、(距肛18 cm)低分化腺癌、(距肛30 cm)低级别上皮内瘤变。RAS基因检测示:K-RAS、N-RAS和B-RAF均为野生型。肠镜检查如图1。
影像学评估:1)直肠MRI DISTANCE评估:直肠中段癌(T3bN2),距肛下缘6 cm,肿瘤骑跨腹膜反折,环周切缘阳性,壁外血管侵犯(图2A);2)腹部增强CT:直肠癌,腹腔未见明显转移(图2B);3)胸部增强CT:两上肺尖段及左上肺舌段多个空洞结节,右肺中叶外侧段实性结节,符合转移(图2C)。
初步诊断:1)直肠癌伴肺转移(cT3bN2M1a);2)原发性高血压。
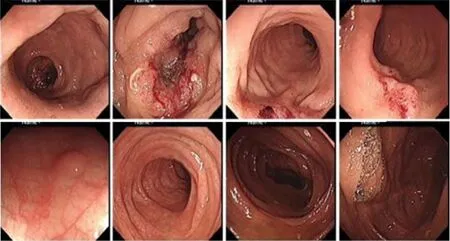
图1 初诊肠镜检查(2015年5月)Figure 1 Colonoscopy at first diagnosis(May 2015)
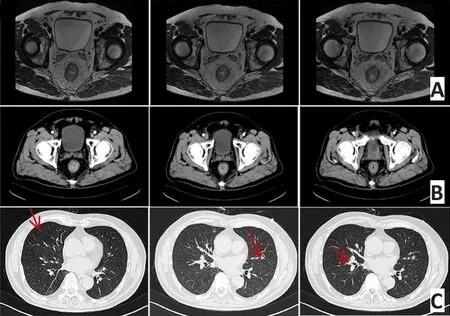
图2 初诊影像学检查(2015年5月)Figure 2 Imaging results of the first diagnosis(May 2015)
2 讨论要点
1)明确该例患者的诊断与分期以及初始治疗分组;2)转移病灶不可切除的无症状转移性结直肠癌的治疗策略;3)肺转移癌的局部治疗手段及选择;4)该例患者一线化疗后原发病灶临床完全缓解,转移病灶接近临床完全缓解患者的肿瘤生物学特征演化过程及其对临床的启示。
3 临床讨论
3.1 第1次多学科综合治疗(multidisciplinary team,MDT)
3.1.1 第1次MDT讨论(2015年5月26日) 蒋飚主任医师(放射科):阅患者影像片综合评估如下:直肠中上段壁增厚,局部肠腔狭窄,增强后不均匀强化,直肠癌明确,在直肠MRI中可见肿瘤下极距肛下缘约6 cm,穿透肌层,直肠系膜区5枚淋巴结显影,DWI高信号,T2WI呈高、低信号混杂,肿瘤左见侵犯血管,DWI高信号。影像学检查未能发现肠镜所见距肛18 cm肿块。胸部增强CT见两上肺尖段及左上肺舌段多个空洞结节,右肺中叶外侧段实性结节,符合肿瘤转移。全腹增强CT未见明确转移。影像学评估:cT3bN2M1a。
沈钢主任医师(胸外科):患者肺CT所见符合转移。由于病灶多发,且累及左右两肺和多个肺段,不可切除,无转移病灶手术指征。
徐栋副主任医师(肿瘤外科):患者直肠癌病理活检明确,目前诊断直肠癌伴多发肺转移cT3bN2M1a,原发病灶出血有限,无穿孔及梗阻征象,两肺转移病灶评估为不可切除,暂无直肠手术指征。建议内科全身治疗。
袁瑛主任医师(肿瘤内科):患者目前诊断明确:直肠癌伴不可切除多发肺转移,治疗目标为控制肿瘤发展、尽可能延长生命,患者一般情况良好,ESMO分组为FIT组,外科认为目前无手术指征,同意首选内科全身治疗,结合基因检测为全RAS野生型,可行mFOLFOX6或FOLFIRI加西妥昔单抗治疗,或联合贝伐单抗。每2个月评价疗效。
魏启春主任医师(放疗科):患者诊断为直肠癌肺转移,肺转移病灶多发且不可切除,原发病灶无大出血、穿孔及梗阻,建议先行化疗联合靶向治疗,视全身治疗效果而定是否进一步行放疗。
张苏展教授(肿瘤外科):结合团队专家意见,患者诊断明确,直肠癌伴多发肺转移,转移病灶不可切除,RAS野生型,原发病灶目前无外科干预指证。同意内科全身治疗为先,治疗期间密切监测病灶变化。
3.1.2 治疗情况 患者考虑经济因素,选择mFOLFOX6+贝伐单抗治疗。第1次在本院治疗,后续回到当地医院继续治疗,完成4次治疗后来本院复查。
2015年9月22日第1次复查:肛门指检:进指6 cm未及明显肿块,局部略增厚,退指无染血。肠镜示:距肛8~18 cm黏膜血管纹理紊乱,距肛8 cm见一浅凹陷,边缘黏膜扁平隆起。肠镜检查见图3,内镜医生认为无法活检。胸部增强CT:比较前片(2015年5月21日)所示两上肺尖段空洞结节消失,左肺上叶舌段空洞结节呈囊状改变、壁薄(图4A)。腹部增强CT:直肠癌化疗后,对照前片(2015年5月19日)直肠上段管壁增厚、强化好转,系膜淋巴结缩小(图4B)。复查结论:疗效评价部分缓解(接近完全缓解),建议继续行原方案治疗4次后再次复查。患者又返回当地医院,因经济因素,自行停用贝伐单抗,继续mFOLFOX6化疗。
2015年11月25日第2次复查:肛门指检:进指6 cm未及明显肿块,局部略增厚,退指无染血。胸部增强CT:右肺上叶前段见3 mm结节状高密度影,边界清,左上叶尖段及上舌叶段圆形透光区,下舌段4 mm致密结节(图5A)。腹部增强CT:直肠癌化疗后,直肠中上段管壁增厚,增强后强化不明显,直肠系膜见数枚细小淋巴结(图5B)。
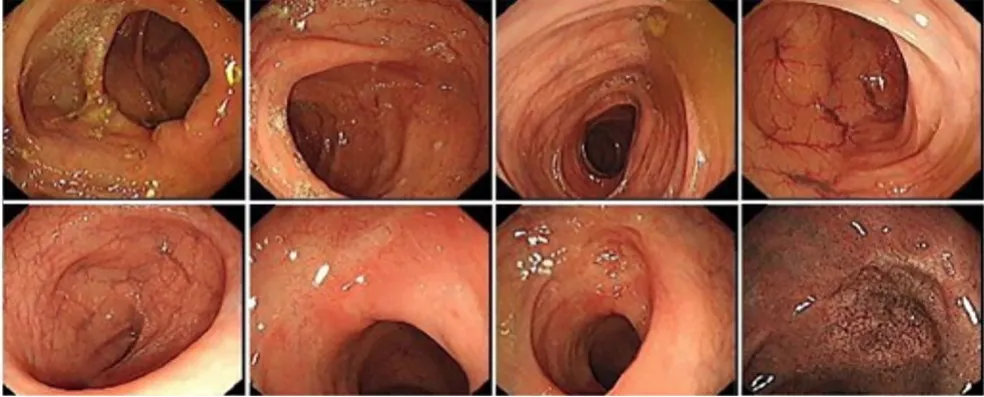
图3 第1次肠镜复查(2015年9月)Figure 3 Colonoscopy at first referral(September 2015)
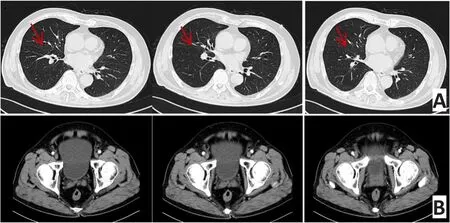
图4 第1次影像学复查(2015年9月)Figure 4 Imaging results of the first referral(September 2015)
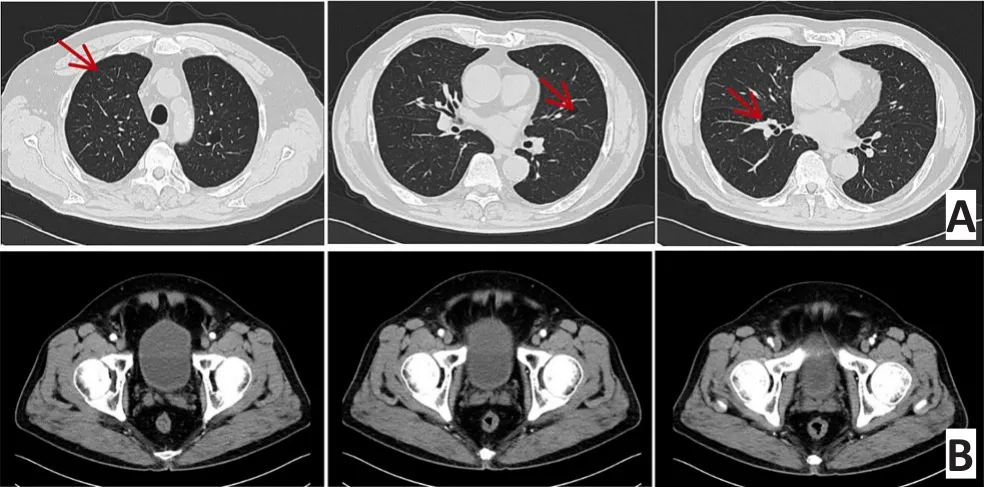
图5 第2次影像学复查(2015年11月)Figure 5 Imaging results of the second referral(November 2015)
治疗耐受性评价:化疗耐受性总体较好,无明显血压变化,无蛋白尿。化疗相关不良反应为Ⅰ度神经毒性,Ⅰ~Ⅱ度骨髓抑制。
3.2 第2次MDT讨论及治疗
3.2.1 第2次MDT讨论(2015年12月1日) 王六红副主任医师(放射科):阅患者本次CT,与初治和第1次复查比较,综合评估如下:右肺上叶前段及左下舌段增殖灶与前片(2015年9月22日)相仿,转移病灶接近消失;腹部增强CT见直肠癌化疗后改变,与第1次复查比较进一步缩小。影像学评估:ycT2~3aN0M1a,疗效评价部分缓解(接近完全缓解)。
丁克峰主任医师(肿瘤外科):患者经mFOLFOX6+贝伐单抗治疗4个周期、mFOLFOX6治疗3个周期后,再次全面评估:原发病灶明显退缩,便血症状消失,肛诊肿块完全退缩已无法触及,仅局部黏膜有增厚感,肠镜下肉眼病灶也基本退缩完全,仅见距肛8 cm一浅凹陷,边缘黏膜扁平隆起。肺转移病灶接近消失。建议手术切除原发病灶,术后继续mFOLFOX6化疗5次,肺部病灶暂不处理。
袁瑛主任医师(肿瘤内科):患者经前期治疗,原发病灶和转移病灶都已接近完全缓解,也均无任何症状。如仅手术切除原发病灶而肺部病灶不积极处理,仍无法达到R0的结果,原发病灶手术的价值将难以体现。建议继续mFOLFOX6化疗完成12个周期,之后进入随访期或卡培他滨单药维持治疗。
张苏展教授(肿瘤外科):患者治疗至此,内、外科处理意见争议较大,无法从现有指南共识中寻求答案。个人倾向内科的意见,在肺部病灶无法做到R0的情况下,对于无症状的原发病灶不建议行手术治疗。但是患者手术意愿强烈,建议与患者再做详尽沟通。
3.2.2 治疗情况 经充分沟通,患者手术意愿强烈,于2015年12月2日行直肠前切除术。术中见:全腹未见转移结节;直肠未见明显肿块,浆膜面未见明显挛缩或充血水肿。切除后大体标本见直肠黏膜面一浅小凹陷,直径为0.3 cm。术后病理(图6):(直肠)黏膜层及肌层内可见少量异型细胞浸润,浆膜下脂肪组织内可见黏液湖聚集,符合肿瘤化疗后改变,两端切缘阴性;系膜淋巴结0/3阳性;提示病理完全缓解(pathological complete response,pCR)。
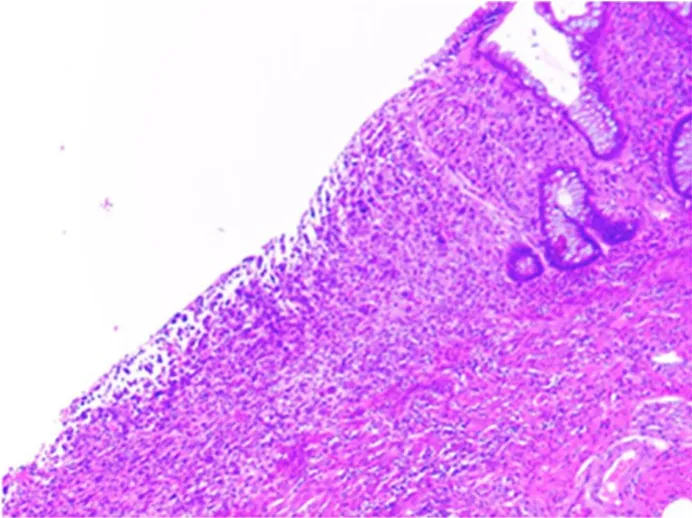
图6 直肠原发病灶术后病理TRG1(H&E×40)Figure 6 Pathologic diagnosis of the primary site of tumor regression grades(TRG)1(H&Ex40)
3.2.3 术后治疗 患者术后恢复可。出院后至当地医院继续完成mFOLFOX6方案化疗5次,定期复查术后原发病灶、肺部病灶及肝脏。随访至今无复发进展。
4 文献复习与讨论
结直肠癌肺转移发生率为10%~25%[1-5],其中90%为多发或双肺转移[6-7],无初始手术机会,故化疗±靶向,联合手术、射频、立体定向放疗等局部处理手段的综合治疗已成为初治不可切除直肠癌肺转移的重要治疗模式[8-9]。一项长达30年的人群调查发现,结直肠癌同时性肺转移的5年生存率为6.9%[3],其预后受转移瘤大小、直径的异质性、数目、分化、淋巴结转移、CEA等[10-15]影响。本例患者即为直肠癌伴同时性多发肺转移,处置过程中,许多地方值得讨论,结合文献讨论如下。
4.1 原发病灶切除在转移病灶不可切除的无症状转移性结直肠癌患者中的应用
关于转移性结直肠癌患者无症状的原发病灶是否切除的争论已久。赞同者认为原发病灶切除避免了今后可能发生的出血、梗阻等相关并发症,少了靶向药物的使用顾忌;且目前腔镜手术和术后快速康复不延误全身治疗。反对者认为原发病灶存在并不增加后续化疗中出现肠道并发症风险[16],发生需要外科干预并发症的总体风险<15%[17],而原发病灶姑息切除本身也可引起相关并发症,且尚无前瞻性随机对照研究结果支持原发病灶切除将改善患者总生存。多项前瞻性随机对照研究正在进行,包括德国的SYNCHRONOUS研究、荷兰的CAIR04研究[18]和正在进行的中山大学肿瘤防治中心的308研究,期待上述研究可为原发病灶是否切除提供更多循证医学依据。
本例患者为无症状转移性结直肠癌,一线化疗后原发病灶临床完全缓解,转移病灶接近临床完全缓解,原发病灶术后达pCR。对于该患者,手术的必要性与获益值得探讨。患者肿瘤位于中上段直肠,保肛难度较小,化疗联合靶向治疗效果明显,原发病灶及转移病灶肿瘤几乎完全退缩,在肠镜活检的具体定位存在困难的情况下,手术切除原发病灶可能是较为稳妥的决策。但是,2016年美国国立综合癌症网络(NCCN)指南对直肠癌新辅助放化疗后治疗手段增加了“临床完全缓解患者watch-and-wait”选项。Habr-Gama等[19]最早在2004年首次提出watch and-wait策略,即对术前放化疗后达临床完全缓解患者,可暂不手术,而是密切观察随访,长期预后不亚于根治性手术[20],同时可避免手术并发症及永久造瘘。但采取该策略的患者需经过严格的评价体系[21-22]的筛选。2017年美国临床肿瘤学会(ASCO)GI上报告了国际直肠癌观察等待数据库(IWWD)的更新数据[23],截止2016年8月,共计679例临床完全缓解不手术的患者,中位随访2.6年,复发率28%,远处转移率7%,3年总生存率为92%。生存数据与既往报道的手术患者相当[17]。但“watch-and-wait”的数据均来源于局部晚期直肠癌,目前对转移病灶和原发病灶均达到临床完全缓解的患者该如何处理仍无明确指引,需依赖MDT讨论制定出适合每位患者的个体化决策,本中心主张对于保肛意愿强烈但必须切除肛门的患者,更多的考虑不手术;而对于复发风险高、全身治疗计划一线使用贝伐单抗且原发病灶发生梗阻、出血并发症风险大的患者仍建议行手术。此外“watch-and-wait”策略需要密集随访,由于大部分复发转移出现在前2年,患者前2年需要每3个月接受1次查体、肠镜和MRI检查,因此也要评估患者的依从性和其经济效益。
4.2 肺转移病灶的局部处理手段与适应证
借鉴结直肠癌肝转移的经验,肺转移病灶行根治术可延长生存这一理念越来越受认可。回顾性分析表明,与保守治疗相比,肺转移病灶切除无论是无进展生存还是总生存均有获益[6]。一项前瞻、随机、对照研究欧洲PulMiCC[24]正在进行中,期待其能够回答肺转移病灶切除的获益问题。2016年欧洲临床肿瘤协会年会(ESMO)指南[3]推荐初始技术可R0切除且生物学行为较好的肺转移患者可考虑直接切除。2017年NCCN指南中结直肠癌肝、肺转移的处理流程相同。中国结直肠癌诊疗规范(2015版)与欧美指南类似,同时强调无论肺转移瘤能否切除,均应考虑围术期化疗,并推荐MDT讨论后的综合治疗。
肺转移病灶其他局部处理手段包括射频消融和立体定向放疗等,前者适用于3 cm以内的肺转移病灶[25-27],后者适用于分布范围局限在肺段且其他局部治疗困难的患者[28],Scorsetti等[29]研究证实立体定向放疗3年局部有效率>70%,且患者多能耐受[30]。
本例患者肺转移病灶初始不可切除,全身治疗后部分缓解,但分布双肺多段,且治疗后呈薄壁空腔状,难以准确判断是否达临床完全缓解,对于这些疑似的小残留病灶,手术、射频或立体定向放疗等局部干预均较困难。
4.3 术后化疗及维持治疗方案
维持治疗指一线治疗一段时间后,达到最佳疗效且处于疾病稳定状态时,采用低强度、低毒性的药物持续治疗,以延长患者的无进展生存期,提高生存质量。Kosugi等[31]研究显示维持治疗与持续治疗疗效相当,但前者能够有效减少不良反应;且维持治疗组患者的疾病控制时间、无进展生存期和总生存期均优于间歇治疗组。关于维持治疗的方案,对于化疗和靶向药物联合治疗有效的转移性结直肠癌患者,推荐毒性较低的化疗药物(氟尿嘧啶类)和靶向药物维持治疗,其中贝伐珠单抗+卡培他滨维持治疗的证据最为明确[32]。本例患者原发病灶切除后,如果判定仍存在肺部病灶,5-FU联合贝伐珠单抗应为一种较好的选择,但考虑患者71岁,维持治疗耐受时间可能有限,对生存质量要求高,有文献报道患者可获益于完全的化疗休假[33],结合患者一线化疗反应非常好,肺转移病灶接近临床完全缓解,考虑患者肿瘤生物学行为相对较好,预后较乐观,可尝试完成6个月的一线化疗后暂停化疗,密切随访。
5 小结
本例患者初诊经过MDT讨论,诊断为直肠癌伴肺多发性转移(cT3bN2M1a);原发病灶环周切缘阳性,有便血、无穿孔、无梗阻等症状;肺转移病灶累及左右两肺和多个肺段,为不可切除;基因检测提示全RAS野生型。综合结直肠外科、肿瘤内科、放疗科、胸外科及放射科等多个学科的专家医师意见,判定是1例转移病灶不可切除的Ⅳ期直肠癌,首先选择以全身化疗联合靶向药物为主的治疗方案,并根据治疗效果,再决定是否行直肠癌放疗。事实证明,先行全身治疗的决策使患者受益。该患者经过8个周期的mFOLFOX6+/-贝伐单抗治疗,原发病灶明显退缩,转移病灶几乎消失,疗效评价为部分缓解(接近完全缓解)。但是随后的治疗,内科和外科争议较大。尊重患者选择,行原发病灶切除,肺部转移病灶暂无特殊处理。
本例处置过程中几处值得讨论的地方:1)患者接受了原发病灶手术,但手术后的常规病理结果提示pCR。因此,对于该患者,手术的必要性值得思考。局部晚期直肠癌已有较多研究支持“watch-andwait”策略,但对转移病灶和原发病灶均达到临床完全缓解的患者仍无指南参照,需依赖MDT讨论制定出适合每位患者的个体化决策;2)患者行原发病灶切除手术后,后续治疗方案的选择以及肺部病灶是否达到临床完全缓解需要仔细斟酌。对于这些可疑的小残留病灶,一些局部干预如手术、射频或立体定向放疗等也是困难的。该病例的探讨,不仅让专业人员对国内相对少见的直肠癌多发性肺转移的综合性诊疗有了较为全面的理解,也对局部晚期直肠癌的“watch-and-wait”策略有了比较深入的认识,并且对于其适应证的选择提供了宝贵的经验。对此类直肠癌伴多发性肺转移治疗优化还有待于今后进一步深入研究。
[1]Miller KD,Siegel RL,Lin CC,et al.Cancer treatment and survivorship statistics,2016[J].CA Cancer J Clin,2016,66(4):271-289.
[2]Van Cutsem E,Cervantes A,Adam R,et al.ESMO consensus guidelines for the management of patients with metastatic colorectal cancer[J].Ann Oncol,2016,27(8):1386-1422.
[3]Mitry E,Guiu B,Cosconea S,et al.Epidemiology,management and prognosis of colorectal cancer with lung metastases:a 30-year population-based study[J].Gut,2010,59(10):1383-1388.
[4]Heerva E,Lavonius M,Jaakkola P,et al.Overall survival and metastasis resections in patients with metastatic colorectal cancer using electronic medical records[J].J Gastrointest Cancer,2017.[Epub ahead of print].
[5]Riihimaki M,Hemminki A,Sundquist J,et al.Patterns of metastasis in colon and rectal cancer[J].Sci Rep,2016,(6):29765.
[6]Kanzaki R,Inoue M,Kimura T,et al.Role of pulmonary metastasectomy in colorectal cancer in the era of modern multidisciplinary therapy[J].Surg Today,2017,47(9):1111-1118.
[7]Limmer S,Unger L.Optimal management of pulmonary metastases from colorectal cancer[J].Expert Rev Anticancer Ther,2011,11(10):1567-1575.
[8]Dromain C,Caramella C,Dartigues P,et al.Liver,lung and peritoneal metastases in colorectal cancers:is the patient still curable?What should the radiologist know[J].Diagn Interv Imaging,2014,95(5):513-523.
[9]Ibrahim T,Tselikas L,Yazbeck C,et al.Systemic versus local therapies for colorectal cancer pulmonary metastasis:what to choose and when[J]?J Gastrointest Cancer,2016,47(3):223-231.
[10]Iizasa T,Suzuki M,Yoshida S,et al.Prediction of prognosis and surgical indications for pulmonary metastasectomy from colorectal cancer[J].Ann Thorac Surg,2006,82(1):254-260.
[11]Maniwa T,Mori K,Ohde Y,et al.Heterogeneity of tumor sizes in multiple pulmonary metastases of colorectal cancer as a prognostic factor[J].Ann Thorac Surg,2017,103(1):254-260.
[12]Gonzalez M,Poncet A,Combescure C,et al.Risk factors for survival after lung metastasectomy in colorectal cancer patients:a systematic review and meta-analysis[J].Ann Surg Oncol,2013,20(2):572-579.
[13]Irshad K,Ahmad F,Morin JE,et al.Pulmonary metastases from colorectal cancer:25 years of experience[J].Can J Surg,2001,44(3):217-221.
[14]Saito Y,Omiya H,Kohno K,et al.Pulmonary metastasectomy for 165 patients with colorectal carcinoma:a prognostic assessment[J].J Thorac Cardiovasc Surg,2002,124(5):1007-1013.
[15]Park HS,Jung M,Shin SJ,et al.Benefit of adjuvant chemotherapy after curative resection of lung metastasis in colorectal cancer[J].Ann Surg Oncol,2016,23(3):928-935.
[16]McCahill LE,Yothers G,Sharif S,et al.Primary mFOLFOX6 plus bevacizumab without resection of the primary tumor for patients presenting with surgically unresectable metastatic colon cancer and an intact asymptomatic colon cancer:definitive analysis of NSABP trial C-10[J].J Clin Oncol,2012,30(26):3223-3228.
[17]Kong JC,Guerra GR,Warrier SK,et al.Outcome and salvage surgery following"watch and wait"for rectal cancer after neoadjuvant therapy:a systematic review[J].Dis Colon Rectum,2017,60(3):335-345.
[19]Habr-Gama A.Assessment and management of the complete clinical response of rectal cancer to chemoradiotherapy[J].Colorectal Dis,2006,8(Suppl 3):21-24.
[20]Martens MH,Maas M,Heijnen LA,et al.Long-term outcome of an organ preservation program after neoadjuvant treatment for rectal cancer[J].J Natl Cancer Inst,2016,108(12).
[21]Habr-Gama A,Perez RO,São Julião GP,et al.Nonoperative approaches to rectal cancer:a critical evaluation[J].Semin Radiat Oncol,2011,21(3):234-239.
[22]Habr-Gama A,São Julião GP,Perez RO.Nonoperative management of rectal cancer:identifying the ideal patients[J].Hematol Oncol Clin North Am,2015,29(1):135-151.
[23]Beets GL,Figueiredo NL,Habr-Gama A,et al.A new paradigm for rectal cancer:Organ preservation:Introducing the International Watch&Wait Database(IWWD)[J].Eur J Surg Oncol,2015,41(12):1562-1564.
[24]Treasure T.Surgery and ablative techniques for lung metastases in the Pulmonary Metastasectomy in Colorectal Cancer(PulMiCC)trial:is there equivalence[J]?J Thorac Dis,2016,8(Suppl 9):S649-651.
[25]de Baere T,Auperin A,Deschamps F,et al.Radiofrequency ablation is a valid treatment option for lung metastases:experience in 566 patients with 1037 metastases[J].Ann Oncol,2015,26(5):987-991.
[26]Akhan O,Guler E,Akinci D,et al.Radiofrequency ablation for lung tumors:outcomes,effects on survival,and prognostic factors[J].Diagn Interv Radiol,2016,22(1):65-71.
[27]Hiraki T,Gobara H,Iguchi T,et al.Radiofrequency ablation as treatment for pulmonary metastasis of colorectal cancer[J].World J Gastroenterol,2014,20(4):988-996.
[28]Takeda A,Sanuki N,Kunieda E.Role of stereotactic body radiotherapy for oligometastasis from colorectal cancer[J].World J Gastroenterol,2014,20(15):4220-4229.
[29]Scorsetti M,Clerici E,Navarria P,et al.The role of stereotactic body radiation therapy(SBRT)in the treatment of oligometastatic disease in the elderly[J].Br J Radiol,2015,88(1053):20150111.
[30]Ricco A,Davis J,Rate W,et al.Lung metastases treated with stereotactic body radiotherapy:the RSSearch(R)patient Registry's experience[J].Radiat Oncol,2017,12(1):35.
[31]Kosugi C,Koda K,Tanaka K,et al.Evaluation of preoperative chemotherapy with modified optimox-1 plus bevacizumab in patients with advanced rectal cancer with factors contraindicative of curative surgery[J].Hepatogastroenterology,2015,62(140):868-872.
[32]Turan N,Benekli M,Dane F,et al.Adjuvant systemic chemotherapy with or without bevacizumab in patients with resected pulmonary metastases from colorectal cancer[J].Thorac Cancer,2014,5(5):398-404.
[33]Hashida H,Satake H,Kaihara S.A complete response case in a patient with multiple lung metastases of rectal cancer treated with bevacizumab plus XELIRI therapy[J].Case Rep Oncol,2017,10(1):81-85.
Multidisciplinary decision on a rectal cancer patient with multiple synchronous pulmonary metastasis
Ying YUAN1,Dong XU2,Qi YANG2,Dikai BEI2,Yue LIU2,Suzhan ZHANG2,Kefeng DING2
1Department of Medical Oncology,2Department of Surgical Oncology,The Second Affiliated Hospital of Zhejiang University,School of Medicine,Hangzhou 310009,China
Ying YUAN;E-mail:yuanying1999@zju.edu.cn
Lungs are the second most common distant metastatic organs of colorectal cancer,following the liver.However,clinical researches on lung metastasis are insufficient comparing with that on liver metastasis due to its low occurrence and relatively mild biological behavior.This paper aims to investigate the clinicopathological characteristics and prognostic factors of rectal cancer patients with multiple synchronous lung metastases.The patient was from the Second Affiliated Hospital of Zhejiang University,School of Medicine underwent multi-disciplinary diagnosis and treatment.Moreover,this article aims to discuss the related existing consensus and controversies on this issue.
rectal cancer,lung metastasis,multidisciplinary team(MDT),clinical complete remission,watch-and-wait,local therapy,maintenance chemotherapy
10.3969/j.issn.1000-8179.2017.19.334
①浙江大学医学院附属第二医院肿瘤内科(杭州市310009);②肿瘤外科
*本文课题受国家自然科学基金项目(编号:81272455,81472664)、中国国家卫生行业公益性基金项目(编号:201402015)、浙江省自然科学基金项目(编号:LY14H160019)和十二五国家科技支撑计划项目(编号:2014BAI09B07)资助
袁瑛 yuanying1999@zju.edu.cn
This work was supported by National Natural Science Foundation of China(No.81272455,81472664),China National Health Industry Public Welfare Fund Project(No.201402015),Natural Science Foundation of Zhejiang Province(No.LY14H160019),and National Science&Technology Pillar Program during the Twelfth Five-year Plan Period(No.2014BAI09B07)
(2017-03-24收稿)
(2017-09-26修回)

袁瑛 专业方向为基于分子检测的肿瘤个体化治疗,遗传性大肠癌的发病机制及临床诊治。
E-mail:yuanying1999@zju.edu.cn
