胃混合性腺神经内分泌癌临床病理特征分析*
2017-11-14李志彬柯彬孙琳刘宁梁寒
李志彬 柯彬 孙琳 刘宁 梁寒
·临床研究与应用·
胃混合性腺神经内分泌癌临床病理特征分析*
李志彬①②柯彬①孙琳③刘宁①梁寒①
目的:探讨胃混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)的临床病理特征。方法:回顾性分析2011年1月至2016年12月天津医科大学肿瘤医院收治的35例胃MANEC患者的临床病理资料,采用EnVision法检测嗜铬蛋白A(synaptophysin,Syn)、突触素(chromogranin A,CgA)、CEA、CK8/18和Ki-67的表达情况。结果:本研究35例胃MANEC患者中男性32例,女性3例,平均年龄为(61.6±7.5)岁。肿瘤位于贲门17例、胃体9例、胃窦8例、残胃1例。该病无特异性临床表现,术前易被误诊为腺癌,诊断主要依赖病理。肿瘤由腺癌和神经内分泌癌成分构成,免疫组织化学结果显示腺癌成分中CEA(+)32例,CK8/18(+)33例;神经内分泌癌成分中Syn(+)33例,CgA(+)27例。所有患者均行手术治疗,术后3年内17例患者死亡,且均为Ⅲ期或Ⅳ期。结论:胃MANEC多见于中老年男性,发病率低,发病时多为中晚期。在结构形态上由两种肿瘤成分构成,确诊依赖于病理及免疫组织化学检查。手术是其主要的治疗方式,但预后较差。
胃肿瘤 混合性腺神经内分泌癌 临床 病理学 预后
2010年世界卫生组织(WHO)将消化系统肿瘤分类中对神经内分泌肿瘤(neuroendocrine neoplasms,NENs)的命名进行了修订和规范,将含有腺癌和神经内分泌癌两种成分的肿瘤命名为混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)[1]。胃MANEC是一种罕见的肿瘤,国内外报道较少,关于其生物学特征、病理特点、临床表现及预后目前尚缺乏定论。本研究回顾性分析35例胃MANEC患者临床病例资料,并结合文献对其临床病理特点进行分析,旨在为提高胃MANEC的临床诊疗水平提供参考。
1 材料与方法
1.1 病例资料
回顾性分析天津医科大学肿瘤医院2011年1月至2016年12月收治的35例胃MANEC患者的临床病例资料,所有患者均行手术治疗,且病理均符合2010年WHO对消化系统肿瘤中NENs的分类规定。所有患者术前均行胃镜及CT检查明确肿瘤部位、大小、形态等,所有患者术前均未接受化疗和放疗。临床资料完整,可进行TNM分期评价;病理组织资料完整,可进行组织学诊断及嗜铬蛋白A(synaptophysin,Syn)、突触素(chromogranin A,CgA)、CEA、CK8/18、Ki-67表达水平的免疫组织化学检测。
1.2 方法
1.2.1 实验试剂及方法 本研究患者均行胃肿瘤切除手术治疗,术后根据2010年WHO消化系统肿瘤的分类规定进行TNM分期。术后所有标本均经4%甲醛固定,常规取材,石蜡包埋,0.4 μm厚切片,H&E染色,免疫组织化学采用EnVision二步法。Syn、CgA、CEA、CK8/18和Ki-67一抗及EnVision二步法试剂盒均购自北京中杉金桥生物技术有限公司,严格按照说明书进行操作,免疫组织化学结果经同一病理科医师复查确诊证实。
1.2.2 随访 随访资料通过患者门诊复查、电话随访和信函调查结合的方式获得。2016年12月31日为随访结束时间。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析。应用Kaplan-Meier法绘制生存曲线。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床病理特征
35例胃MANEC患者,其中男性32例,女性3例,年龄为45~76岁,平均年龄为(61.6±7.5)岁。发病部位在胃近端1/3为17例、胃中部1/3为9例、胃远端1/3为8例、残胃1例。常见的临床症状为腹痛(10例)、进食哽咽(9例)及腹胀(8例)等;从发病到疾病诊断的时间是0.5~8个月,平均2.5个月。全组患者均全麻下行胃切除手术治疗,其中根治性切除32例,姑息性切除3例;联合脾切除1例,联合横结肠切除1例。肿瘤直径为1.0~10.0 cm,平均4.8 cm。全组共清扫淋巴结6~49枚,平均每例21.5枚;其中25例患者合并淋巴结转移,平均每例转移5.6枚。患者TNM分期为:Ⅰ期为2例、Ⅱa期1例、Ⅱb期2例、Ⅲa期5例、Ⅲb期22例、Ⅳ期3例;其中远处转移1例为小肠系膜转移,2例为大网膜种植转移。详细临床病理资料见表1。术后26例患者接受化疗,其中EP方案8例、IP方案3例、FOLFOX4方案6例、XELOX方案7例、SOX方案2例。
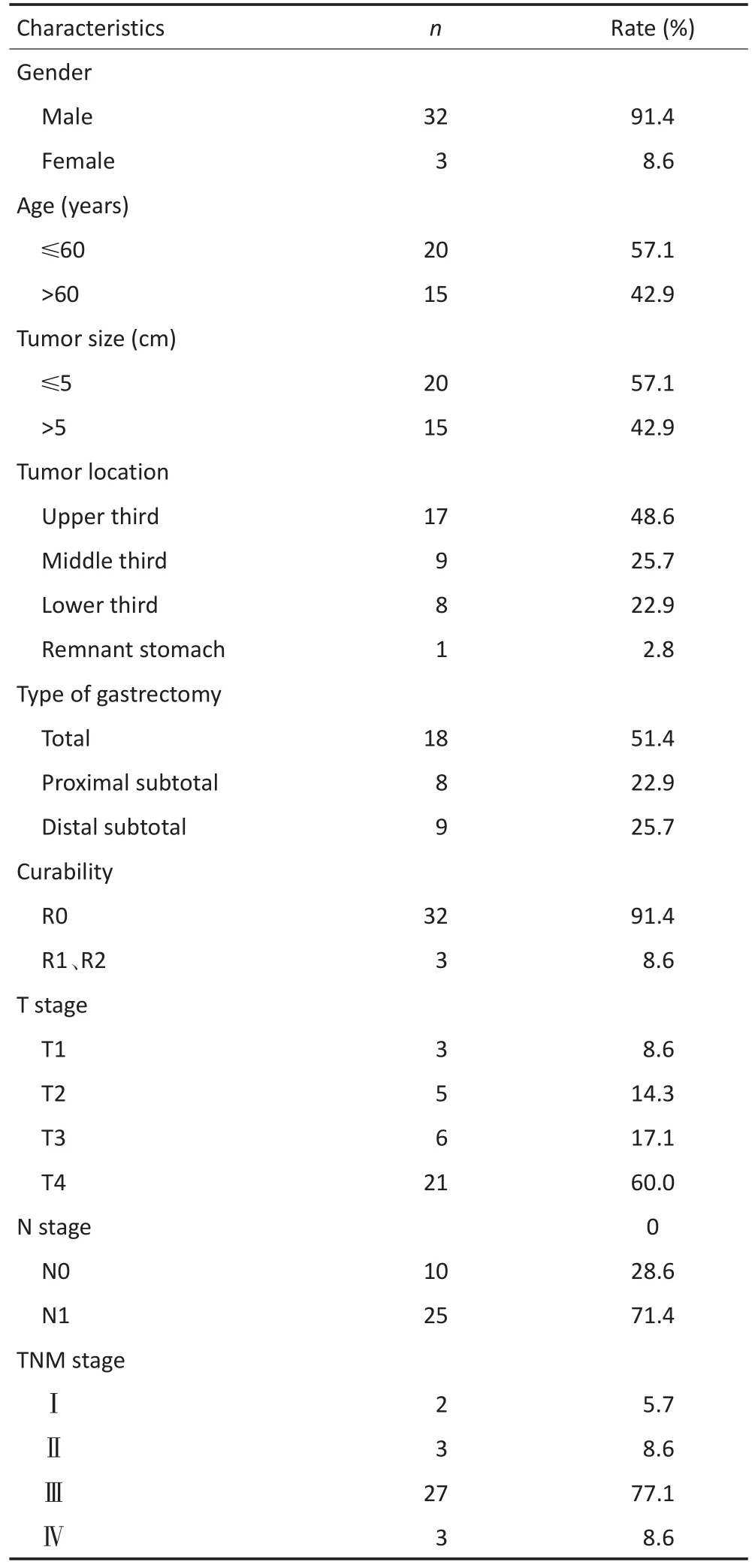
表1 35例胃MANEC患者临床病理特征Table 1 Clinicopathologic characteristics of 35 gastric MANEC patients
2.2 镜下及免疫组织化学特点
所有患者术前均行胃镜活检检查,其中3例诊断为腺神经内分泌癌,4例神经内分泌癌,3例低分化癌,25例腺癌。所有患者术后病理均证实为胃MANEC,镜下均由腺癌和神经内分泌癌两种不同的成分构成,其中内分泌性肿瘤细胞的数量超过整个肿瘤细胞群的30%。两种细胞成分之间常相互交叉,无明确分界,某些区域以腺癌成分为主,而另一些区域则以神经内分泌癌成分为主。另外可见部分肿瘤两种成分紧密相邻,互相独立,无或仅有少量的交叉。腺癌区域细胞异型性明显,细胞大小不等,核呈多形性,染色质粗颗粒状,细胞排列呈乳头状、腺管状、筛状或小巢状分布;神经内分泌癌区域肿瘤细胞大小常一致,呈立方状或低柱状,胞质少,核圆形或卵圆形,排列成巢索样、花带样、腺管样或菊形团样。
免疫组织化学结果显示CEA、CK8/18、Syn、CgA在肿瘤细胞阳性表达时呈棕黄色或棕褐色颗粒,在细胞内呈弥漫性表达。35例胃MANEC患者中,腺癌成分中CEA(+)32例,CK8/18(+)33例;神经内分泌癌成分中Syn(+)33例,CgA(+)27例。Ki-67阳性指数为20%~90%,其中23例>50%(图1)。

图1 胃MANEC患者病理切片H&E及免疫组织化学结果 (×400)Figure 1 The Hematoxylin and Eosin(H&E)-staining and immunostaining of gastric MANEC(×400)
2.3 随访情况
本研究35例胃MANEC患者均获得随访,随访时间为3~36个月,中位随访时间为22.0个月。35例患者中有18例存活,其中2例患者合并转移,分别为肝转移和腹膜后淋巴结转移。17例死亡患者的生存时间为3~36个月,中位生存时间为18.0个月,其中1年内死亡5例,1~2年死亡9例,2~3年内死亡3例(图2)。

图2 35例胃MANEC患者的生存曲线Figure 2 Kaplan-Meier survival curve of 35 patients with gastric MANEC
3 讨论
NENs为一组起源于内胚层神经内分泌细胞的肿瘤[2],可发生于全身多个组织和器官,其中以消化系统胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms,GEP-NENs)最常见,约占全部NENs的55%~70%,其中胃NENs占所有NENs的4.10%[3]。WHO在2010年重新修订了消化系统肿瘤NENs的分类及命名规范,根据肿瘤分化程度(核分裂数和Ki-67指数),将NENs分为神经内分泌瘤(G1级和G2级)、神经内分泌癌(G3级)和MANEC。
3.1 胃MANEC的发生机制
胃MANEC是一种特殊类型的胃癌,肿瘤在表型上含有神经内分泌癌和腺癌两种成分,两种成分以不同比例混合,而且每种成分至少各占肿瘤的30%。如果腺癌中含有散在的神经内分泌细胞,则被称为腺癌伴神经内分泌分化,并归为腺癌一类。关于胃MANEC的组织学起源尚未明确,一种观点认为腺癌和神经内分泌癌分别起源于不同细胞系,腺癌细胞起源于胃腺峡部的多潜能干细胞,神经内分泌癌细胞起源于胚胎神经嵴细胞[4];另一种观点认为腺癌细胞和神经内分泌癌细胞均起源于内胚层多潜能干细胞,在肿瘤发生发展过程中分别向腺癌和神经内分泌癌细胞分化[5]。既往在研究胃和结肠MANECs的克隆起源时发现两种肿瘤细胞在多个染色体位点上LOH的改变基本一致,并且神经内分泌细胞还存在一些其他位点的缺失,提示可能是同一干细胞不同方向分化形成的,并且神经内分泌癌是腺癌进一步的发展转化[6-7]。在本研究中,大多数病例中腺癌成分和神经内分泌癌成分均是混杂存在的,且在部分肿瘤成分内存在CEA、CK8/18和Syn、CgA阳性细胞的相互交叉,结果显示更倾向于第二种假说,但具体的发病机制有待进一步的研究证实。
3.2 胃MANEC的临床病理特点
既往研究认为,胃MANEC发病率低,较少见,主要发生于老年男性,平均年龄在60岁[8]。本研究中,35例胃MANEC患者占同期本院收治全部胃部肿瘤病例总数的1.0%(35/3 442),平均年龄为61.6岁,男女比例为10.6:1。近年来胃贲门部肿瘤发病率明显增高,在本研究中有17例(48.6%)发生在贲门,这与梁晶等[9]的结果相似。研究结果提示,胃MANEC易发生在贲门部,且在中老年男性患者中多见。胃MANEC常缺乏特异性的临床症状,基本以胃肠道症状为主入院。本组病例主要表现为腹痛(10例)、进食哽咽(9例)及腹胀(8例)等消化道症状,文献报道认为MANEC 属于无功能性 NENs[10],本研究中所有患者均未见明显类癌综合征样临床表现。
由于胃MANEC的肿瘤细胞形态差异较大,且大体标本以溃疡型为主,与胃腺癌区别不明显。术前胃镜活检由于取材受限,术前活检与术后病理的符合率较低,本组35例患者中仅3例患者术前胃镜病理为胃MANEC,术前病理误诊率高达91.4%,其中绝大多数均误诊为胃低分化腺癌。由于在胃MANEC中,腺癌成分和神经内分泌癌成分尚无明确的分界,混杂存在,因此最终的确诊需要根据术后病理组织的多点取材,并联合特异性的免疫组织化学检测结果进行明确诊断。《中国胃肠胰神经内分泌肿瘤病理学诊断共识》(2013年版)[11]中规定Syn和CgA是NENs必须检测的免疫组织化学指标,CD56可以作为辅助标记,联合检测可以提高神经内分泌成分的检出率;CEA、CK8/18、CK7等上皮肿瘤标志物检测则有助于证实MANEC中的上皮性肿瘤成分。在本研究病例中Syn的阳性率为94.3%,CgA的阳性率为77.1%,两者结合后则能100%判定MANEC中肿瘤细胞的神经内分泌性质。NENs中Ki-67指数检测有助于判定肿瘤细胞的增殖活性,是肿瘤分级的重要指标,但是在MANEC中Ki-67表达意义尚无确切的规定。在本研究病例中23例患者的Ki-67指数均>50%,提示胃MANEC的恶性程度高,肿瘤细胞增殖较快,肿瘤进展迅速。
3.3 胃MANEC的治疗与预后
由于胃MANEC较少见,因此在治疗上缺乏足够的经验,对局限期的患者治疗一般与胃腺癌相似,以根治性手术切除为主,应进行标准的淋巴结清扫,本研究25例患者术后伴有淋巴结转移。既往研究结果显示MANEC的淋巴结转移可以是单一成分转移,也可见混合性转移[12]。在临床工作中需对转移的淋巴结进行Syn和CgA检测,明确淋巴结转移的成分,以指导临床治疗。进展期患者术后需辅以化疗,而对于晚期转移患者则首选化疗。目前MANEC化疗无标准方案,常以EP作为一线的化疗方案[13],有研究认为伊立替康及顺铂可以覆盖腺癌及神经内分泌癌,IP方案也有一些小样本的研究报道[14],另外也有文献报道用FOLFOX、FOLFIRI等腺癌常用方案化疗[15-16]。虽然文献认为在胃肠神经内分泌癌(WHO G3)中Ki-67指数与铂类药物化疗敏感性有关,当Ki-67指数<55%时铂类药物疗效差,可考虑替换为替莫唑胺为基础的化疗方案[17],但对于MANEC中Ki-67指数与化疗方案的选择尚缺乏相关报道,需要进一步研究证实。本研究临床工作中常根据肿瘤成分构成比例及淋巴结转移的成分进行综合判定,当肿瘤成分中NENs为主或转移淋巴结为神经内分泌癌时,多以神经内分泌癌方案EP、IP行化疗治疗;但当肿瘤以腺癌成分为主及淋巴结转移成分为腺癌时,可考虑按腺癌方案进行术后辅助化疗。胃MANEC目前暂无标准的化疗方案,未来需要进行更多的临床研究进一步明确。
目前,认为MANEC的预后一般较差,且就诊时多为进展期,合并淋巴结及远处转移。La等[7,18]报道认为肿瘤内不同成分的构成比例及肿瘤分期是影响MANEC预后的关键因素,胃MANEC的预后较胃神经内分泌癌预后差,且肿瘤分期是影响预后的因素。Nie等[19]的研究发现,胃MANEC中神经内分泌癌和腺癌的肿瘤细胞分化程度能影响患者预后,细胞分化程度越低则患者预后越差。Watanabe等[20]在研究结直肠MANEC时发现MANEC的生存期短于腺癌患者,中位生存期仅为18.1个月。本研究17例(48.5%)患者术后3年内死亡,其中Ⅲa期1例、Ⅲb期14例、Ⅳ期2例,死亡患者均为Ⅲ期或Ⅳ期,提示肿瘤分期与患者预后可能相关;但由于术后随访时间较短,病例总数较少,胃MANEC的远期预后尚有待于进一步长时间随访评估。
综上所述,胃MANEC是一种临床上较为少见的特殊类型胃NENs,发病率较低,多见于中老年男性,临床表现缺乏特异性。在诊断时应注意掌握WHO规定的任何一种癌成分需超过30%的标准,且免疫组织化学染色是确诊的必要手段。以手术治疗为主,联合化疗的模式为主要的治疗方式,但疗效尚不满意,预后较差。在临床中推荐采用多学科综合治疗(multidisciplinary team,MDT)的方法,结合病理学特点,进行个体化治疗,以提高患者预后。
[1]Bosman FT,Carneiro F,Hruban RH,et al.WHO classification of tumours of the digestive system[M].IARC Press,Lyon,2010:64-68.
[2]Yao JC,Hassan M,Phan A,et al.One hundred years after"carcinoid":epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J].J Clin Oncol,2008,26(18):3063-3072.
[3]Modlin IM,Lye KD,Kidd M.A 5-decade analysis of 13 715 carcinoid tumors[J].Cancer,2003,97(4):934-959.
[4]Mondolfi AE,Slova D,Fan W,et al.Mixed adenoneuroendocrine carcinoma(MANEC)of the gallbladder:a possible stem cell tumor[J].Pathol Int,2011,61(10):608-614.
[5]Huang Z,Xiao WD,Li Y,et al.Mixed adenoneuroendocrine carcinoma of the ampulla:Two case reports[J].World J Gastroenterol,2015,21(7):2254-2259.
[6]Furlan D,Cerutti R,Uccella S,et al.Different molecular profiles characterize well-differentiated endocrine tumors and poorly differentiated endocrine carcinomas of the gastroenteropancreatic tract[J].Clin Cancer Res,2004,10(3):947-957.
[7]La RS,Marando A,Sessa F,et al.Mixed adenoneuroendocrine carcinomas(MANECs)of the gastrointestinal tract:an update[J].Cancers,2012,4(1):11-30.
[8]Park SC,Chun HJ.Clinical aspects of gastric and duodenal neuroendocrine neoplasms[J].J Gastroenterol Hepatol Res,2012,1(8):139-146.
[9]Liang J,Liu SM.Clinicopathological features of the primary gastric neuroendocrine neoplasms[J].Chin J Oncol,2014,36(7):522-527.[梁晶,刘尚梅.胃原发性神经内分泌肿瘤的临床病理特征[J].中华肿瘤杂志,2014,36(7):522-527.]
[10]Fukuba N,Yuki T,Ishihara S,et al.Gastric mixed adenoneuroendocrine carcinoma with a good prognosis[J].Intern Med,2014,53(22):2585-2588.
[11]Chinese pathologic consensus group for gastrointestinal and pancreatic neuroendocrine neoplasms.Standardization in diagnosis of gastrointestinal and pancreatic neuroendocrine neoplasms:the Chinese consensus[J].Chin J Pathol,2013,42(10):691-694.[中国胃肠胰神经内分泌肿瘤病理专家组.中国胃肠胰神经内分泌肿瘤病理学诊断共识(2013版)[J].中华病理学杂志,2013,42(10):691-694.]
[12]Lindholm EB,Anthony CT,Boudreaux JP,et al.Do primary neuroendocrine tumors and metastasis have the same characteristics[J]?J Surg Res,2012,174(2):200-206.
[13]Vanacker L,Smeets D,Hoorens A,et al.Mixed adenoneuroendocrine carcinoma of the colon:molecular pathogenesis and treatment[J].Anticancer Res,2014,34(10):5517-5521.
[14]Okita NT,Kato K,Takahari D,et al.Neuroendocrine tumors of the stomach:chemotherapy with cisplatin plus irinotecan is effective for gastric poorly-differentiated neuroendocrine carcinoma[J].Gastric Cancer,2011,14(2):161-165.
[15]Rahal AK,Truong PV,Kallail KJ.Oxaliplatin-induced tonic-clonic seizures[J].Case Rep Oncol Med,2015,(2015):879217.
[16]Fazio N,Spada F,Giovannini M.Chemotherapy in gastroenteropancreatic(GEP)neuroendocrine carcinomas(NEC):a critical view[J].Cancer Treat Rev,2013,39(3):270-274.
[17]Sorbye H,Welin S,Langer S W,et al.Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma(WHO G3):the NORDIC NEC study[J].Ann Oncol,2013,24(1):152-160.
[18]La RS,Inzani F,Vanoli A,et al.Histologic characterization and improved prognostic evaluation of 209 gastric neuroendocrine neoplasms[J].Hum Pathol,2011,42(10):1373-1384.
[19]Nie L,Li M,He X,et al.Gastric mixed adenoneuroendocrine carcinoma:correlation of histologic characteristics with prognosis[J].Ann Diagn Pathol,2016,(25):48-53.
[20]Watanabe J,Suwa Y,Ota M,et al.Clinicopathological and prognostic evaluations of mixed adenoneuroendocrine carcinoma of the colon and rectum:A case-matched study[J].Dis Colon Rectum,2016,59(12):1160-1167.
Clinicopathological features of gastric mixed adenoneuroendocrine carcinoma
Zhibin LI1,Bin KE2,Lin SUN3,Ning LIU2,Han LIANG2
1Department of Gastric Cancer,Tianjin Medical University Cancer Institute and Hospital;National Clinical Research Center for Cancer,Key Laboratory of Cancer Prevention and Therapy,Tianjin;Tianjin's Clinical Research Center for Cancer,Tianjin 300060,China;2Department of General Surgery,The First People's Hospital of Shangqiu,Shangqiu 476100,China;3Department of Pathology,Tianjin Medical University Cancer Institute and Hospital,Tianjin 300060,China
Han LIANG;E-mail:tj_lianghan@126.com
Objective:To explore the clinicopathologic characteristics of gastric mixed adenoneuroendocrine carcinoma(MANEC).Methods:From January 2011 to December 2016,the clinical and pathological data of 35 patients with gastric MANEC who were diagnosed and surgically treated in Tianjin Medical University Cancer Institute and Hospital were analyzed retrospectively.Results:The average age of the 32 men and 3 women in this study was 61.6±7.5 years.Tumor locations were as follows:17 related to gastric cardia,9 related to gastric body,8 related to gastric antrum,and 1 related to gastric stump.Clinical symptoms were non-specific and the diagnosis relies on postoperative pathological examination.Using the histological microscope,the affected structures were detected in neuroendocrine systems and tissue linings.Immunohistochemical staining showed that carcinoembryonic antigen(CEA)and cytokeratins 8 and 18(CK8/18)were expressed in 32 and 33 adenocarcinoma-related cases,respectively,whereas synaptophysin(Syn)and chromogranin A(CgA)were revealed in33and27neuroendocrine-relatedcases,respectively.All patients
surgical resection.Atotal of 17incidentsof deathwerereported at three years after the operation,and most of the patients were at clinical stageⅢorⅣ.Conclusion:Gastric MANEC is a rare neoplasm and is often diagnosed at its advanced stage and mainly occurs in the aged population.Neuroendocrine structures and glandular tissues are the most frequent location of such condition.Diagnosis relies on both immunohistochemical and histological examinations.Surgical resection is the most effective treatment,but the prognosis of this condition remains poor.
stomach neoplasms,mixed adenoneuroendocrine carcinoma,clinical,pathology,prognosis
10.3969/j.issn.1000-8179.2017.19.252
①天津医科大学肿瘤医院胃部肿瘤科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心(天津市300060);②河南省商丘市第一人民医院胃肠肝胆外科;③天津医科大学肿瘤医院病理科
*本文课题受国家自然科学基金项目(编号:81401952)和天津市卫生局科技基金项目(编号:2014KZ082)资助
梁寒 tj_lianghan@126.com
This work was supported by the National Natural Science Foundation of China(No.81401952),and the Science and Technology Research Projects of Tianjin Municipal Health Bureau(No.2014KZ082)
(2017-03-06收稿)
(2017-09-20修回)
(编辑:武斌 校对:周晓颖)

李志彬 专业方向为胃肠、肝胆外科疾病的诊断治疗。E-mail:lizbshangqiu@163.com
