ASCL-1在肺腺癌组织中的表达及与预后相关性研究
2017-11-14林振中张智弘
林振中 张智弘
ASCL-1在肺腺癌组织中的表达及与预后相关性研究
林振中 张智弘
目的:ASCL-1基因表达与肺神经内分泌肿瘤(小细胞癌、非典型类癌、典型类癌、大细胞神经内分泌癌)密切相关。本研究旨在分析ASCL-1蛋白在肺腺癌组织中的表达情况及与预后的相关性。方法:采用免疫组织化学法检测南京医科大学附属肿瘤医院2008年1月至2010年1月283例肺腺癌组织中ASCL-1、神经内分泌标志物嗜铬蛋白A(chromogranin A,CgA)、突触素(synaptophysin,Syn)和CD56的表达并进行对比分析,采用Western blot法检测对肺腺癌及癌旁组织中ASCL-1的表达进行检测。采用单因素χ2检验和Logistic多因素回归分析探究影响ASCL-1表达的相关因素,并采用Kaplan-Meier法对肺腺癌患者进行预后评估。结果:ASCL-1在肺腺癌中的表达阳性率为16.9%(48/283),与神经内分泌标志物的表达呈正相关(0<r<1,P<0.05)。采用Western blot法检测63例患者的肺腺癌组织,9例ASCL-1蛋白表达,而对应癌旁肺组织均无蛋白表达。经单因素χ2检验和多因素Logistic回归分析,发现ASCL-1的表达与肺腺癌患者的吸烟、肿瘤分化程度、TNM分期、淋巴结转移相关。经Kaplan-Meier生存分析显示,ASCL-1蛋白表达阳性组患者总生存期(overall survival,OS)低于阴性组。结论:ASCL-1蛋白表达可能是肺腺癌患者预后的危险因素之一。
肺腺癌 ASCL-1 免疫组织化学 蛋白免疫印迹 预后
人类ASCL-1基因最先是从甲状腺髓样癌cDNA文库中克隆出来的,是转录因子家族bHLH中重要成员之一[1-2]。人类ASCL-1基因位于第12号染色体长臂12q23.2,编码区全长约711 bp,编码分子量为34 kDa的肽链并由236个氨基酸组成的。目前,研究认为ASCL-1基因编码的蛋白是一种转录因子,在肿瘤的神经内分泌分化过程中发挥重要调控作用[1-2]。Kazanjian等[3]报道,ASCL-1与肺神经内分泌肿瘤密切相关,在神经内分泌细胞和神经内分泌肿瘤中大部分表达呈阳性。本研究通过检测肺腺癌及对应癌旁肺组织中ASCL-1蛋白表达情况,研究其与神经内分泌标志物嗜铬蛋白A(chromogranin A,CgA)、突触素(synaptophysin,Syn)和CD56的相关性,并分析ASCL-1对患者预后的影响。
1 材料与方法
1.1 材料
1.1.1 临床资料 收集283例南京医科大学附属肿瘤医院2008年1月至2010年12月手术切除TNM分期的肺腺癌组织及对应癌旁正常肺组织蜡块。选取其中肺腺癌新鲜组织标本63例,术中切除后的组织保存于-70℃的冰箱,用于蛋白提取。283例肺腺癌中男性206例,女性77例;年龄≤60岁111例,年龄>60岁172例;有吸烟史者212例,无吸烟史者71例;中高分化腺癌128例,低分化腺癌155例;TNM分期Ⅰ期140例、Ⅱ期62例、Ⅲ期81例;术后病理有淋巴结转移112例,无淋巴结转移171;全部病例术前未行放化疗,临床资料完整及病理诊断明确,随访时间为5~82个月,中位随访时间为41个月。本研究经南京医科大学附属肿瘤医院伦理委员会批准,得到全部研究对象及其家属知情同意。
1.1.2 主要试剂和来源 ASCL-1兔抗人单克隆抗体购自中国台湾省Abnova公司。即用型鼠抗人CgA单克隆抗体、鼠抗人CD56单克隆抗体、鼠抗人Syn单克隆抗体均购自江苏凯基生物技术股份有限公司。即用型SP试剂盒、0.05%DAB显色试剂盒、山羊抗兔及山羊抗鼠抗体均购自上海索莱宝生物科技有限公司。ECL超敏发光液及RIPA裂解液购自上海索莱宝生物科技有限公司。
1.2 方法
1.2.1 免疫组织化学检测 选取肺腺癌组织和癌旁肺组织,经固定、脱水透蜡后包埋成蜡块,再切片、烘干,用枸橼酸盐缓冲液在微波下修复抗原,3%过氧化氢灭活内源性酶40 min,PBS洗片3次,山羊血清封闭30 min,滴加ASCL-1兔抗人单克隆抗体,稀释浓度为1:100,抗体4℃过夜,甩除一抗,PBS洗片3次,每次5min,滴加二抗(稀释浓度1:100),室温孵育30 min,洗片3次,DAB染色,脱水透明,封片,显微镜下观察结果。同理检测CgA、CD56与Syn的表达情况。对每次染色均设立阳性对照,并以PBS代替一抗作阴性对照。
1.2.2 Western blot检测 组织称重,取待测组织50 mg,经冷冻、粉碎等处理后,加入500 μL裂解液中后离心(2 000 r/min、1 min),冰上孵育30 min,移入离心管,低温高速离心(4℃、2 000 r/min、15 min),收集上清。采用bradford法测定出所提取的蛋白含量。取总蛋白量80μg上样,进行SDS-PAGE电泳分离。垂直电泳分离出目的的蛋白条带,将SDS丙烯酰胺中的蛋白通过水平电泳的方式转移到PVDF膜上,山羊血清封闭2h,加稀释的兔抗人ASCL-1抗体(浓度为1:300),4℃孵育过夜,TTBS(500 mmol/L NaCl,20 mmol/L Tris-HCL)漂洗3次后,加入稀释的山羊抗兔(1:5000)二抗后温育120 min,TTBS漂洗3次后行ECL显色,X线胶片曝光成像,并以β-actin为内参照,最后通过成像分析仪采集图像。
1.2.3 结果判定 1)免疫组织化学结果判定ASCL-1在细胞核、CD56在细胞膜和细胞质、CgA与Syn在细胞质中均呈现棕黄色细小颗粒为阳性染色。镜下随机观察5~10个视野(×400),观察细胞染色强度,计算阳性细胞所占的百分比并评分:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。评分方法:染色强度为无着色、淡黄色、棕黄色、棕褐色分别为0、1、2和3分。上述两项结果相加<2分为阴性(-),2~3分为弱阳性(+),4~5分为中度阳性(++),6~7分为强阳性(+++)。定义:≥3分为阳性,<3分为阴性。2)Western blot结果判定ASCL-1的条带在25 kDa处,用图像分析软件测定各样品灰度值,并将ASCL-1与β-actin的比值作为相对表达量。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。四格表资料相关分析ASCL-1与CgA、Syn、CD56在肺腺癌组织中表达的相关性。计数资料采用百分率表示,单因素分析采用χ2检验,多因素采用Logistic分析,以临床特征为自变量,以ASCL-1表达程度为因变量,以比值比(odds ratio,OR)表示两者间的联系强度(OR>1为危险因素,OR<1为保护因素)各因素赋值情况(表1)。对预后影响采用Kaplan-Meier法进行分析,并绘制生存曲线,应用Log-rank检验差异性。以P<0.05为差异具有统计学意义。

表1 各因素赋值情况Table 1 Assignment of various factors
2 结果
2.1 免疫组织化学检测
2.1.1 ASCL-1的表达情况 283例手术切除肺腺癌组织中48例肺腺癌呈阳性表达,阳性率为16.9%,对应癌旁肺组织均未发现ASCL-1表达(图1)。
2.1.2 神经内分泌标志物在肺腺癌中的表达及与ASCL-1的关系 四格表资料相关分析显示ASCL-1与CgA、Syn、CD56均呈正相关(0<r<1,P<0.05,表2)。

图1 ASCL-1在肺腺癌中的表达情况 (SP×400)Figure 1 ASCL-1 protein expression in lung adenocarcinoma(SP×400)

表2 在肺腺癌中ASCL-1与CgA、Syn、CD56表达的关系Table 2 Correlation of ASCL-1 expression with CgA,Syn,and CD56 expression in AD
2.2 采用Western blot法检测ASCL-1在肺腺癌中蛋白的表达
63例肺腺癌新鲜组织中有9例表达ASCL-1蛋白,而对应癌旁肺组织均无蛋白表达(图2)。
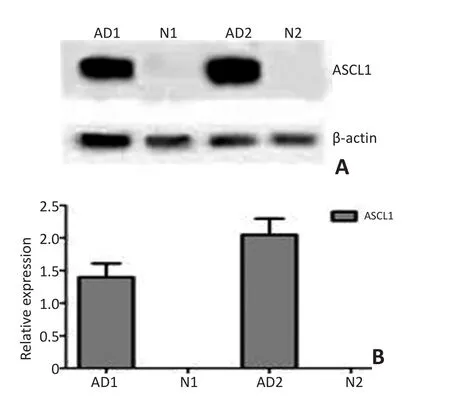
图2 采用Western blot法检测ASCL-1在肺癌组织中的表达Figure 2 ASCL-1 protein expression in AD tissues by Western blot
2.3 ASCL-1在肺腺癌中表达与临床特征的关系
经单因素χ2分析,有吸烟史、低分化肿瘤、TNM分期高、有淋巴结转移及死亡患者的ASCL-1表达阳性率高于无吸烟史、高分化肿瘤、TNM分期低、无淋巴结转移及生存患者,差异均具有统计学意义(P<0.05,表3)。经多因素Logistic回归分析,有吸烟史、低分化肿瘤、TNMⅢ期和淋巴结转移均为影响ASCL-1在肺腺癌中表达的因素(表4)。

表3 ASCL-1表达与283例肺腺癌患者重要临床指标关系Table 3 Correlation between ASCL-1 expression and clinicopathological parameters in 283 patients with AD

*.P<0.05
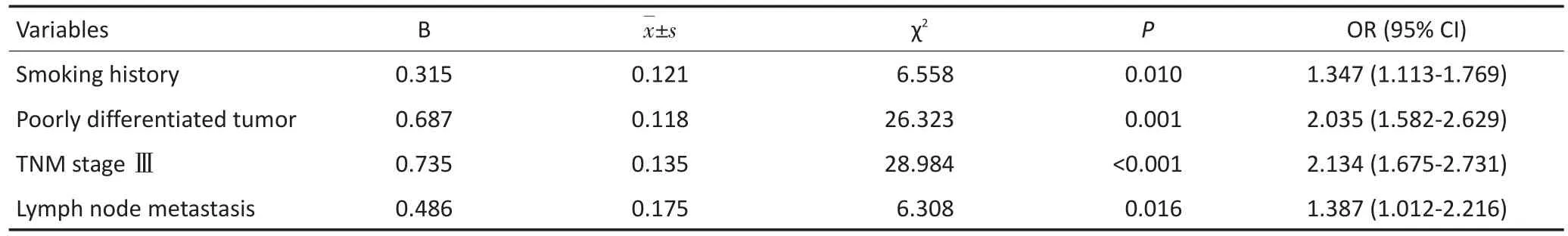
表4 影响ASCL-1在肺腺癌组织中表达的多因素Logistic回归分析 (n=283)Table 4 Multivariable Logistic regression analysis of ASCL-1 expression in AD(n=283)
2.4 ASCL-1蛋白表达与患者预后关系
从生存曲线中显示ASCL-1蛋白表达阳性患者总生存期(OS)低于阴性患者,差异具有统计学意义(P<0.05),提示ASCL-1表达是影响患者预后的重要危险因素(图3)。

图3 ASCL-1蛋白表达与患者预后关系Figure 3 Relationship between ASCL-1 protein expression and prognosis
3 讨论
众所周知,胚胎期以后的成体细胞被认为是已经完全分化的细胞,具有不可塑性与不可逆性。但生物学干细胞的研究使人们对生物的进化有了新的了解。Takahashi等[4]报道证实ASCL-1作为重要的转录因子之一,参与调控成纤维细胞直接转化为功能性神经元,成纤维细胞可能在ASCL-l等因子的作用下先退回至神经元前体细胞状态,然后再向神经元分化,但该机制研究尚未清晰[5]。研究表明,ASCL-l广泛参与细胞谱系决定、细胞增殖分化等生理过程,ASCL-l在早期阶段的神经前体细胞分化发挥重要的调控作用,对诱导神经细胞生成作用也是不可或缺[6]。在鼠胚胎发育过程中,如果敲除ASCL-1基因,会直接影响细胞神经内分泌分化,导致肺神经内分泌细胞的缺失,然而肺神经内分泌细胞与小细胞肺癌的发生密切相关[7]。反之,在转基因鼠中过度表达ASCL-1能够促进气道上皮细胞的增生,ASCL-1与SV40大T抗原共同转染能够促进伴有神经内分泌分化的肺肿瘤的发生[8]。Osada等[9]报道,在ASCL-1表达的肺癌细胞系中以RNAi的方式抑制ASCL-1的表达能够引起肿瘤细胞在G2-M期细胞周期停滞甚至是细胞凋亡,其分子机制可能与半胱天冬酶-9和半胱天冬酶-7的激活相关。人体活组织实时定量RT-PCR检测发现ASCL-1基因在包括胎儿肺的神经内分泌细胞、甲状腺髓样癌(medullary thyroid cancer,MTC)肺神经内分泌肿瘤中均有表达,但在无神经内分泌细胞的肿瘤与正常组织中却未发现ASCL-1表达[10]。上述现象均表明,ASCL-1基因与具有神经内分泌分化特征的肿瘤密切相关。Jiang等[11]研究报道,ASCL-1在典型类癌中的阳性表达率为13.3%(4/30),在非典型类癌中的阳性表达率为84.6%(11/13),在小细胞肺癌中的阳性表达率为71.8%(56/78),在大细胞神经内分泌癌中的阳性表达率为56.7%(38/67)。Ye等[12]研究报道,通过免疫组织化学法检测ASCL-1对区分小细胞肺癌与其他肺神经内分泌癌有较大帮助。本研究在肺腺癌中ASCL-1表达情况,免疫组织化学结果表明ASCL-1在肺腺癌中的表达阳性率为16.9%(48/283)。采用Western blot法检测63例肺腺癌新鲜组织其中9例表达ASCL-1蛋白,而对应癌旁肺组织均无蛋白表达。相关性分析表明ASCL-1与神经内分泌标志物(CgA、Syn、CD56)的表达呈正相关(0<r<1,P<0.05)。可见ASCL-1基因对肺腺癌伴神经内分泌肿瘤具有高度特异性和敏感性,可与CgA、Syn、CD56联合检测提高诊断水平。
李菲等[13]研究报道ASCL-1基因在典型类癌中表达较低(12.5%),而在非典型类癌和小细胞肺癌中的表达阳性率均较高(75%和77.5%),差异具有统计学意义。典型类癌分化较好,属于低度恶性,一般核分裂像罕见,无坏死,预后较好;非典型类癌分化较典型类癌差,属于中度恶性,癌巢中有坏死,核分裂像多见,较典型类癌预后差;小细胞肺癌是肺癌中恶性程度最高的一种类型,生长迅速、转移早、预后最差。Jiang等[11]研究报道的ASCL-1在典型类癌、非典型类癌、小细胞肺癌中的阳性表达率也提示分化程度越低,ASCL-1蛋白表达率越高。本研究结果显示,分化差的比分化相对较好的腺癌中ASCL-1蛋白表达率高,ASCL-1在肺神经内分泌癌和肺腺癌不同分化程度的肿瘤表达高低近一致。Jiang等[11]同时对ASCL-1蛋白表达阳性小细胞肺癌与阴性小细胞肺癌患者生存期进行比较两者差异具有统计学意义(P<0.05)。Kosari等[14]报道ACSL-1几乎表达于有吸烟史的肺腺癌患者,并与RET融合基因表达有相关性,通过其对肺腺癌患者总生存期(overall survival,OS)产生影响。本研究结果显示,经多因素Logistic回归分析,有吸烟史患者为影响ASCL-1在肺腺癌中表达的因素,与此前报道结果基本一致,部分ASCL-1蛋白表达阳性无吸烟史患者有无被动吸烟史,还有待研究。本研究显示,ASCL-1蛋白表达阳性患者OS低于阴性患者,推测ASCL-1蛋白表达阳性可能是影响肺腺癌患者预后不良的危险因素之一。由于在肺腺癌患者组织中ASCL-1蛋白表达率较低,所以与患者预后的相关性还亟需结合大量临床数据进一步验证。
[1]Kageyama R,Nakanishi S.Helix-loop-helix factors in growth and differentiation of the vertebrate nervous system[J].Curr Opin Genet Dev,1997,7(5):659-665.
[2]Naizhen X,Linnoila RI,Kimuar S.Co-expression of achaete-scute homologue-1 and calcitonin gene-related peptide during NNK-Induced pulmonaryneuroendocrinehyperplasiaandcarcinogenesisinhamsters[J].J Cancer,2016,7(14):2124-2131.
[3]Kazanjian A,Wallis D,Au N.Growth factor independence-1 is expressed in primary human neuroendocrine lung carcinomas and mediates the differentiation of murine pulmonary neuroendocrine cells[J].Cancer Res,2004,64(19):6874-6482.
[4]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[5]Sareen D,Svendsen CN.Stem cell biologists sure play a mean pinball[J].Nat Biotechnol,2010,28(4):333-335.
[6]Cau E,Casarosa S,Guillemot F.Mash and Ngn control distinct steps of determination and differentiation in the olfactory sensory neuron lineage[J].Development,2002,129(8):1871-1880.
[7]Borges M,Linnoila RI,vande Velde HJ,et al.An achaete-scute homologue essential for neuroendocrine differentiation in the lung[J].Nature,1997,386(6627):852-855.
[8]Linnoila RI,Zhao B,DeMayo JL,et al.Constitutive achaete-scute homologue-1 promotes airway dysplasia and lung neuroendocrine tumors in transgenic mice[J].Cancer Res,2000,60(15):4005-4009.
[9]Osada H,Tatematsu Y,Yatabe Y,et al.ASH1 gene is a specific therapeutic target for lung cancers with neuroendocrine features[J].Cancer Res,2005,65(23):10680-10685.
[10]Westerman BA,Neijenhuis S,Poutsma A,et al.Quantitative reverse transcription polymerase chain reaction measurement of HASH1(ASCL1),a marker for small cell lung carcinomas with neuroendocrine features[J].Clin Cancer Res,2002,8(4):1082-1086.
[11]Jiang SX,Kameya T,Asamura H,et al.hASH1 expression is closely correlated with endocrine phenotype and differentiation extent in pulmonary neuroendocfine tumors[J].Med Pathol,2004,17(2):222-229.
[12]Ye B,Cappel J,Findeis-Hosey J,et al.hASH is a specific immunohistochemical marker for lung neuroendocrine tumors[J].Human Pathology,2016,(48):142-147.
[13]Li F,Zhong ZY,Li R,et al.Expression and clinicopathologic significance of human achaete-scute homolog 1 in pulmonary neuroendocrine tumors[J].Chin J Lung Cancer,2010,13(4):317-321.[李菲,钟志永,李锐,等.hASH1在肺神经内分泌肿瘤中的表达及其临床意义[J].中国肺癌杂志,2010,13(4):317-321].
[14]Kosari F,Ida CM,Aubry MC,et al.ASCL1 and RET expression defines a clinically relevant subgroup of lung adenocarcinoma characterized by neuroendocrine differentiation[J].Oncogene,2014,33(29):3776-3783.
ASCL-1 protein expression in lung adenocarcinoma and its correlation with prognosis
Zhenzhong LIN,Zhihong ZHANG
Department of Pathology,Affiliated Cancer Hospital of Nanjing Medical University,Jiangsu Cancer Hospital,Jiangsu Institute of Cancer Control,Nanjing 210009,China
Zhihong ZHANG;E-mail:zhangzhih2001@aliyun.com
Objective:ASCL-1 gene expression is closely related to pulmonary neuroendocrine(NE)tumors,such as small cell carcinoma,atypical carcinoid,carcinoid,and large cell NE carcinoma.This study aimed to analyze ASCL-1 protein expression in lung adenocarcinoma(AD)and its correlation with prognosis.Methods:ASCL-1 protein expression in 283 cases of AD was determined through immunohistochemical analysis and compared with the expression of traditional NE markers,including chromogranin A,CD56,and synaptophysin.Western blot was performed to detect the ASCL-1 protein expression levels in AD.Single factor Chi-square test and Logistic multiple factor regression analysis were conducted to explore the factors related to ASCL-1 expression.Kaplan-Meier survival analysis was applied to evaluate the prognosis of patients with AD.Results:Immunohistochemical analysis showed that ASCL-1 expression was positive in 48/283(16.9%)AD and positively correlated with NE markers(0<r<1,P<0.05).Western blot revealed that ASCL-1 protein was expressed in 63 cases of AD,in their tumor-adjacent normal samples,and in 9 cases of AD.By contrast,this protein was not expressed in tumor-adjacent normal tissues.Single factor Chi-square test and multivariate logistic regression analysis indicated that ASCL-1 protein expression was associated with smoking,tumor differentiation,TNM staging,and lymph node metastasis.Kaplan-Meier survival analysis demonstrated that overall survival(OS)time was shorter in the ASCL-1-positive group than in the ASCL-1-negative group(P<0.05).Conclusion:ASCL-1 protein expression may serve as an independent prognostic factor for patients with lung AD.
lung adenocarcinoma,ASCL-1,immunohistochemistry,Western blot,prognosis
10.3969/j.issn.1000-8179.2017.19.444
南京医科大学附属肿瘤医院病理科,江苏省肿瘤医院,江苏省肿瘤防治研究所病理细胞室(南京市210009)
张智弘 zhangzhih2001@aliyun.com
(2017-04-14收稿)
(2017-06-18修回)
林振中 专业方向为病理细胞学诊断。E-mail:linzhenzhong0518@.sina.com
