发酵前包被布拉迪酵母生长代谢及其抗逆性机理
2017-11-13秦腾飞贠婷婷王春玲綦文涛
秦腾飞,贠婷婷,王春玲*,綦文涛,*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.国家粮食局科学研究院,北京 100037)
发酵前包被布拉迪酵母生长代谢及其抗逆性机理
秦腾飞1,2,贠婷婷2,王春玲1,*,綦文涛2,*
(1.天津科技大学食品工程与生物技术学院,天津 300457;2.国家粮食局科学研究院,北京 100037)
以布拉迪酵母为研究对象,以海藻酸盐为制备材料,基于内源乳化凝胶化法,对酵母菌进行了发酵前包被和包被后培养。以未包被游离酵母菌为对照,研究了其包被后的生长和代谢特点,并探讨其抗逆性机理。结果表明,相对于游离培养,微胶囊化包被的布拉迪酵母最终活菌数显著增多,并有更多的乙醇生成;微胶囊化布拉迪酵母的胞外甘油浓度下降明显,而胞内甘油浓度则显著升高,可比游离条件下高出157.3%;此外,微胶囊化布拉迪酵母的胞内海藻糖含量比游离条件显著提高110.3%。结论:微胶囊内部微环境为布拉迪酵母提供了更稳定的增殖空间,并使其代谢向着有利于甘油和海藻糖积累的途径进行,从而提高了细胞的抗胁迫能力。
布拉迪酵母;微胶囊化发酵前包被;生长和代谢;抗逆性
随着生活水平不断提高,越来越多的消费者想通过饮食而达到保健的目的,为迎合人们的需求,市场上出现了各式各样的益生菌食品及微生态制剂。益生菌是人体肠道重要的生理菌,具有形成生物屏障阻止有害菌的入侵和感染、改善肠道菌群结构、提高机体免疫力等作用[1];此外,还具有缓解乳糖不耐症、减轻遗传性过敏症状、抑制结肠癌等生理功能[2]。然而,益生菌产品在制备、贮藏过程中以及通过人体胃酸、胆碱、胰酶等不利环境后活菌率大大下降[3]。为解决上述问题,研究者也在积极探索提高益生菌制剂有效性的方法,包括新菌种的筛选和新剂型的构建等[4-5]。在新剂型的构建方面,微胶囊技术一直是比较热门的选择,研究也较多[6-7]。目前针对微生物细胞的微胶囊包被可分为发酵前包被和发酵后包被,发酵前包被的特点是,将少量微生物细胞作为种子包被入微胶囊后,再次进行发酵,使微生物在微胶囊形成的微环境中继续增殖代谢,从而实现其高密度和高活性的目的。由于这种发酵前包被细胞的高密度团块式生长,更有利于微生物细胞抵抗外界胁迫等不利环境[8]。
发酵前包被微胶囊化益生菌的抗胁迫能力已有诸多报道[9-10],然而对其抗胁迫的机理还需要深入研究。在微胶囊环境中,由于微生物细胞成团块状增殖和代谢[11],有研究报道,这种高密度的团块式生长会引起微生物细胞间的群体感应[12],而群体感应是引起微生物细胞诸多特殊现象的根本原因,如菌体发光、抗生素的合成、生物膜的形成抗外界胁迫、胞外多糖的合成及黏附宿主肠表皮细胞等[13]。还有研究报道,高压静电法制备的微胶囊化酵母菌,其胞内海藻糖和甘油的浓度会发生变化,从而会提高酵母菌对高渗透压、长时间贮存等不利条件的影响[14]。相对于高压静电法,乳化凝胶化更适合于规模化发酵前包被益生菌的生产过程[15]。基于此,本研究以布拉迪酵母为研究对象,以海藻酸盐为制备材料,研究了酵母菌在基于内源乳化凝胶化法制备的微胶囊内的生长和代谢特点,并对其胞内抗胁迫相关物质的变化进行了检测,以探讨其抗胁迫的机理。
1 材料与方法
1.1 材料与试剂
布拉迪酵母由国家粮食局科学研究院实验室保藏;海藻酸钠、碳酸钙、冰醋酸、氯化钙、石蜡、Span 80、吐温80、酵母提取物蛋白胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)、柠檬酸三钠、蒽酮、浓硫酸、三氯乙酸(均为分析纯)、海藻糖标准品 国药集团化学试剂有限公司;葡萄糖试剂盒、甘油试剂盒 南京建成生物工程研究所;乙醇试剂盒美国BioAssays公司。
1.2 仪器与设备
M LS-3781L-PC高压蒸汽灭菌器 日本Panasonic公司;离心机 德国Eppendorf公司;Multiskan FC型酶标仪、超净工作台 塞默飞世尔(上海)仪器有限公司;精密增力电动搅拌器 常州国华电器有限公司;振荡培养箱 哈尔滨市东联电子技术开发有限公司。
1.3 方法
1.3.1 布拉迪酵母微胶囊的制备
益生菌微胶囊的制备参考梁新晓等[16]方法,以海藻酸钠为主要材料,按碳酸钙与海藻酸钠质量比1∶4称取碳酸钙,分散于少量蒸馏水中,加入1 m L 2.1×109CFU/m L布拉迪酵母种子液,补充无菌水,使海藻酸钠的终质量分数为2%,搅拌均匀,作为水相;表面活性剂Span 80充分分散于液体石蜡中作为油相,按水油体积比1∶3~1∶4,向油相中加入水相,以400 r/m in搅拌5 m in形成稳定的乳化液;向其中加入180 μL冰酸醋酸使碳酸钙解离出Ca2+,与海藻酸钠产生凝胶化反应,并固定10 m in形成海藻酸钙微胶囊;最后用去离子水多次冲洗,通过分液漏斗分离沉降含有布拉迪酵母菌的海藻酸钙微胶囊。通过光学显微镜进行微胶囊在培养前后的形态学观察。
1.3.2 布拉迪酵母生长曲线的绘制
以未包被游离布拉迪酵母作为对照,以微胶囊化布拉迪酵母为实验组,实验组和对照组分别做3个平行,培养基为YPD(其中包含20 g/L葡萄糖、10 g/L蛋白胨、5 g/L酵母膏),置于温度为30 ℃的摇床中振荡培养,并分别于不同培养时间取样分析活菌数。布拉迪酵母生长曲线采用活菌计数法,即首先将包被布拉迪酵母的微胶囊用破囊液进行破壁,以释放酵母菌细胞,其中破囊液的成分为pH 6.5、0.055~0.060 mol/L的柠檬酸三钠溶液;然后通过振荡将成团块的酵母菌尽可能分散成单个细胞,并通过常规涂布法进行酵母菌活细胞的计数;最后以培养时间为横坐标,以活菌数的对数值为纵坐标,绘制布拉迪酵母生长曲线。
1.3.3 布拉迪酵母葡萄糖消耗量的测定
葡萄糖消耗量的测定采用葡萄糖测定试剂盒测定。原理:葡萄糖经葡萄糖氧化酶(glucose oxidase,GOD)作用生成葡萄糖酸和过氧化氢,后者在过氧化物酶(peroxidase,POD)的作用下,将还原性4-氨基安替比林与酚偶联合成红色的醌类化合物,用酶标仪检测OD值。检测方法:工作液的配制:R1试剂(苯酚)与R2试剂(磷酸氢二钠、磷酸二氢钾、4-氨基安替比林、POD、NaN3、GOD)等量混合均匀。在37 ℃条件下,将1 000 μL工作液与10 μL酵母发酵上清液充分混匀,置于37 ℃水浴15 m in。显色后颜色稳定2 h。在波长505 nm处,以空白调零,读取校准管和样品管的OD值。以葡萄糖浓度为横坐标,以OD505nm为纵坐标,绘制布拉迪酵母的葡萄糖消耗曲线。葡萄糖浓度计算如下式所示:

1.3.4 布拉迪酵母乙醇生成量的测定
发酵液中乙醇含量采用乙醇试剂盒进行测定,即基于乙醇脱氢酶催化氧化乙醇,生成的NADH与噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium b rom ide,M TT)发生反应,并伴随着颜色的变化,生成灰色物质,利用酶标仪测在560 nm波长处的OD值,其具体操作如下:1)按质量分数0.10%、0.06%、0.03%、0%配制乙醇标准品;2)取10 μL样品于酶标孔内,然后加入90 μL 工作液(80 μL Assay Buffer、1 μL Enzyme M ix、2.5 μL NAD和14 μL MTT混合),在室温下反应30 m in,后终止反应,利用酶标仪于560 nm条件下测其OD值。得出乙醇的标准曲线和回归方程(y=4.356 3x+0.002 4,R2=0.999),并根据样品的OD560nm和标准品曲线计算出样品的乙醇质量分数。以培养时间为横坐标,以乙醇质量分数为纵坐标,绘制布拉迪酵母乙醇代谢曲线。
1.3.5 布拉迪酵母胞内外甘油浓度的测定
甘油浓度采用酶试剂盒测定。即在ATP存在条件下甘油被甘油激酶磷酸化为3-磷酸甘油,再被甘油磷酸氧化酶氧化产生过氧化氢;在POD的作用下生成有色底物转化为苯醌亚胺,在550 nm波长条件下的OD值与甘油浓度成正比。操作方法具体为:1)按照1 000、500、250、125、62.5、31.25、15.625、7.812 5 μmol/L的浓度配制甘油标准品;2)取50 μL标准品加入150 μL工作液于酶标板孔内,37 ℃反应20 m in,利用酶标仪在550 nm波长下检测其OD值,并绘制其标准曲线和回归方程(y=0.000 8x+0.004 9,R2=0.999);3)胞外发酵液中甘油的测定:取1 m L发酵液,4 000 r/m in转速下离心10 m in,取50 μL上清液,加入150 μL工作液于酶标板孔,37 ℃反应20 m in,于550 nm波长条件下检测其OD值,根据甘油标准曲线计算胞外发酵液中甘油浓度;4)离心收集细胞,沸水浴10 m in提取胞内甘油,并采用上述方法检测其浓度。
1.3.6 布拉迪酵母胞内海藻糖含量的测定
胞内海藻糖含量的测定采用海藻糖试剂盒,基于硫酸蒽酮比色法测定[17]。即糖类在硫酸作用下,脱水生成糠醛或羟甲基糠醛,然后蒽酮与糠醛或羟甲基糠醛经过脱水缩合,产生蓝绿色的糠醛衍生物,颜色的深浅即可作为定量的依据。过程如下:1)按照200、100、50、25、12.5、6.25、0 mg/L的质量浓度配制海藻糖标准品溶液,分别取上述海藻糖溶液0.5 m L,加入2.5 m L蒽酮溶液,95 ℃水浴加热10 m in,冷却后用酶标仪测定在620 nm波长条件下的OD值,得到标准曲线和回归方程(y=0.004 6+0.026 8,R2=0.996);2)海藻糖提取:4 000 r/m in离心分离酵母菌细胞,加入4 m L 0.5 mol/L三氯乙酸溶液,振荡均匀后置于带有冰块的冰水混合物中进行萃取,此时所得溶液中仅有海藻糖存在[18],将提取液3 000 r/m in离心分离10 m in,取0.5 m L稀释好的提取液,加入2.5 m L 蒽酮溶液,充分混匀,沸水煮10 m in,冷却后用酶标仪测定其在波长620 nm条件下的OD值,最后根据海藻糖标准曲线计算其含量。
1.4 数据处理和统计分析
实验数据表示为 ±s(n=3)。各检测指标采用Excel 2007进行统计分析,以P小于0.05为差异有统计学意义。
2 结果与分析
2.1 发酵前与发酵后布拉迪酵母微胶囊形态

图1 酵前包被布拉迪酵母微胶囊的光学显微镜图(×40)Fig. 1 Pre-m icroencapsulated Saccharomyces boulardii under optical m icroscope (×40)
通过乳化凝胶化法制备布拉迪酵母微胶囊,发酵前(图1A)布拉迪酵母细胞均匀分散于微胶囊内部,由于细胞未增殖,因此密度低,微胶囊成透明球型。发酵24 h后(图1B),布拉迪酵母细胞充满了整个微胶囊内部,且呈大小不一的团块状分布于微胶囊内部(图1C)。
2.2 微胶囊化布拉迪酵母生长和代谢特点

图2 布拉迪酵母生长曲线对比图Fig. 2 G row th curves of free and m icroencapsulated Saccharomyces bou lardii
如图2所示,游离培养条件下的布拉迪酵母,24 h内呈现出标准的S型增长过程,其最终活菌数为4.7×1010CFU/m L,相对于游离培养,微胶囊化的布拉迪酵母生长延迟期较短,并体现出了显著更高最终活菌数(P<0.05),其最终活菌数可达2.4×1012CFU/m L,但其对数生长期的生长速率略低于游离培养。

图4 布拉迪酵母乙醇生成曲线对比图Fig. 4 Ethanol generation curves of free and m icroencapsulated Saccharomyces boulardii
由图3可见,与游离组相比,微胶囊化布拉迪酵母的初始葡萄糖代谢速率较快,这与其较短的延迟期有关,但游离培养条件下葡萄糖在第14小时消耗完全,而微胶囊条件下,第16小时消耗完全,两者最终都能将葡萄糖代谢完全。图4表明,微胶囊化布拉迪酵母菌的乙醇生成量要显著高于游离培养,但其初始生成速率低于游离培养。这与Westman等[10,19]的报道一致。其主要原因为包被后的酿酒酵母上调了其胞内酒精脱氢酶的表达,从而增加了乙醇合成的产量[10]。

图5 布拉迪酵母甘油代谢对比图Fig. 5 G lycerin metabolism of free and m icroencapsulated Saccharomyces boulardii
2.3 微胶囊化布拉迪酵母的胞内、外甘油变化如图5A所示,0~14 h两种培养条件下胞外甘油的浓度均呈缓慢降低趋势,且两者之间甘油浓度差异不明显。从第16小时开始,微胶囊化布拉迪酵母的胞外甘油浓度迅速降低,而此时游离培养条件下的胞外甘油浓度变化仍不显著。进一步检测第18小时和第24小时两个时间点布拉迪酵母细胞内的甘油浓度,如图5B所示,游离组和微胶囊化布拉迪酵母的胞内甘油含量在第18小时分别为14.2 nmol/109CFU和17.9 nmol/109CFU,第24小时分别为8.2 nmol/109CFU和21.1 nmol/109CFU。两个时间点,微胶囊化条件下酵母菌胞内甘油浓度分别比游离组条件下显著高出26.1%和157.3%(P<0.05)。这种与游离组相比,发酵前包被组酵母胞内甘油含量有所提高与Sun Zhijie等[20]研究结果一致。
2.4 包被对布拉迪酵母胞内海藻糖的影响
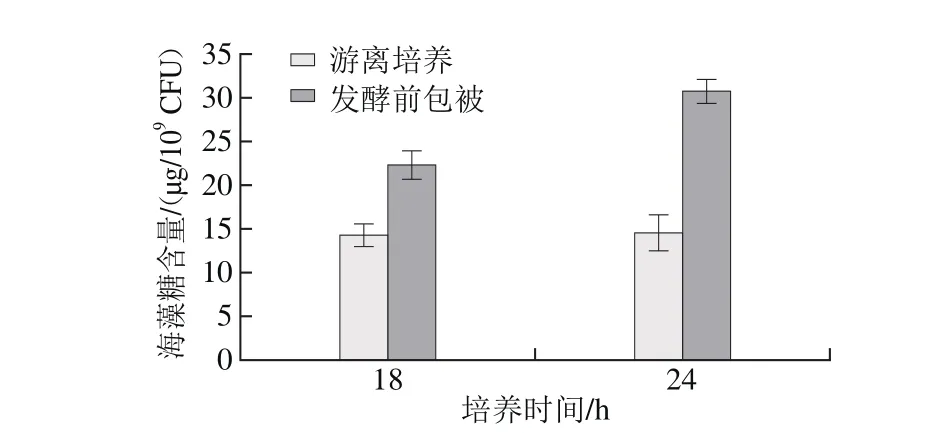
图6 培养18 h和24 h后布拉迪酵母胞内海藻糖含量对比Fig. 6 Intracellular trehalose production of free and m icroencapsulated Saccharomyces bou lardii after 18 h and 24 h incubation
如图6所示,游离组和微胶囊化布拉迪酵母的胞内海藻糖含量在第18小时分别为14.3 μg/109CFU和22.1 μg/109CFU,第24小时分别为14.5 μg/109CFU和30.6 μg/109CFU。两个时间点,微胶囊化条件下酵母菌胞内海藻糖含量分别比游离条件下显著高出54.6%和110.3%(P<0.05),这种与游离组相比,发酵前包被组酵母胞内海藻糖含量增多与Sun Zhijie等[20]研究结果也一致。
3 讨论与结论
基于乳化凝胶化原理的益生菌微胶囊化过程,由于设备简单、操作容易很适合大规模工业生产等优势,因此也备受益生菌微胶囊化研究者的关注[21]。但该技术也存在乳化过程和制备材料会影响益生菌本身生理活性的问题[10]。本研究首先通过乳化凝胶化原理对布拉迪酵母细胞进行了发酵前包被,经包被后培养发现布拉迪酵母细胞生长良好,可充满整个微胶囊内部,且呈大小不一的团块状分布于微胶囊内部。这种集团式的增长不但提高了微生物细胞的密度,也容易诱导细胞间的群体感应,从而提高其对外界胁迫的抵抗能力[22-24]。
有报道表明,微胶囊可通过避免因搅拌而带来的剪切力,为其内部的细胞提供更加稳定的微环境,因而也更利于细胞的增殖和代谢[25]。本研究得到了微胶囊化条件下更高的布拉迪酵母密度,进一步证明了这一点。然而,微胶囊相对于游离条件是一个崭新的环境,且相对于游离条件,构成微胶囊的介质也会对传质的速率造成一定的影响。因此,本研究结果也发现,虽然微胶囊条件下布拉迪酵母的延迟期段,最终活菌数高,但其微生物细胞对数生长期得的增殖(图2)和代谢速率(图3和图4)并没体现出优势,相反,略低于游离培养条件。
甘油在胞内快速合成和积累是布拉迪酵母细胞中一种重要的高渗压胁迫环境调节策略[26]。当酵母细胞处于高渗透压胁迫状态时,代谢流迅速转向甘油合成途径并大量在胞内积累以平衡外界渗透压,从而保护细胞免受渗透脱水的损伤,并保证酵母菌细胞在高渗透压培养环境中的正常生长;反之,细胞内甘油合成速率过低,则酵母菌对高渗透压环境的耐受力降低,细胞的正常生长也会受到抑制[25]。本研究结果表明,在葡萄糖代谢完全后,微胶囊化酵母菌的胞外甘油浓度迅速降低,这部分甘油来自源于培养基本身,从而保证了细胞的正常生长;同时胞内的甘油浓度也迅速提高,从而提高了其对高渗透压环境的耐受力。此外,胞内甘油的聚集也有利于微生物细胞的低温或常温保存,这也可能是微胶囊化酵母菌更耐受贮存的原因之一[26]。而游离培养条件下,布拉迪酵母并没有进一步启动甘油代谢途径,其胞内甘油浓度也相对较低。
酿酒酵母在以葡萄糖为碳源的培养环境中遇到由高盐引起的外界渗透压的升高时,除甘油是最主要的生物相容性物质外,海藻糖也常用来调节酵母胞内的渗透压平衡[27]。本研究结果表明,乳化凝胶化制备的发酵前包被布拉迪酵母,其细胞内部海藻糖含量显著高于游离培养。进一步验证了上述甘油结果分析所得结论。有报道还表明,作为细胞内的储能物质酵母胞内海藻糖,还可以增强细胞抵抗高温、低温和高酒精浓度等极端恶劣环境的能力,使处于逆境下的细胞仍能维持其生命活性[28]。
总之,本研究结果表明,与游离细胞相比,发酵前微胶囊化培养的布拉迪酵母活菌积累量明显提高,乙醇生成量显著增加;其胞外甘油浓度下降明显,而胞内甘油浓度则显著升高;此外,微胶囊化布拉迪酵母的胞内海藻糖含量也显著提高。因此,微胶囊内部微环境为布拉迪酵母提供了更稳定的增殖空间,并使其代谢途径沿着有利于甘油和海藻糖积累的途径进行,从而在提高活菌数的同时,提高了细胞的抗渗透压和耐贮存等抗胁迫能力。
[1] PARVEZ S, MALIK K A, AH K S, et al. Probiotics and their fermented food products are beneficial for health[J]. Journal of Applied Microbiology, 2006, 100(6): 1171-1185. DOI:10.1111/j.1365-2672.2006.02963.x.
[2] SANDERS M E, GUARNER F, GUERRANT R, et al. An update on the use and investigation of probiotics in health and disease[J]. Gut,2013, 62(5): 787-796. DOI:10.1136/gutjnl-2012-302504.
[3] ROKKA S, RANTAMÄKI P. Protecting probiotic bacteria by microencapsulation: challenges for industrial applications[J]. European Food Research and Technology, 2010, 231(1): 1-12. DOI:10.1007/s00217-010-1246-2.
[4] GISMONDO M R, DRAGO L, LOMBARDI A. Review of probiotics available to modify gastrointestinal fl ora[J]. International Journal of Antim icrobial Agents, 1999, 12(4): 287-292. DOI:10.1016/S0924-8579(99)00050-3.
[5] D’O RAZIO G, DI G P, BOCCARUSSO M, et al. M icroencapsulation of new p robiotic formulations for gastrointestinal delivery: in vitro study to assess viability and biological properties[J]. Applied M icrobiology and Biotechnology, 2015, 99(22): 9779-9789.DOI:10.1007/s00253-015-6853-1.
[6] PRISCO A D, MAURIELLO G. Probiotication of foods: a focus on m icroencapsulation tool[J]. Trends in Food Science & Technology,2015, 48(1): 48-52. DOI:10.1016/j.tifs.2015.11.009.
[7] CHEOW W S, K IEW T Y, HADINOTO K. Controlled release of Lactobacillus rhamnosus biofilm probiotics from alginate-locust bean gum m icrocapsules[J]. Carbohydrate Polymers, 2014, 103(4):587-595. DOI:10.1016/j.carbpol.2014.01.036.
[8] CHEOW W S, HADINOTO K. Biofi lm-like Lactobacillus rhamnosus probiotics encapsulated in alginate and carrageenan m icrocapsules exhibiting enhanced thermotolerance and freeze-drying resistance[J].Biomacromolecules, 2013, 14(9): 3214-3222. DOI:10.1021/bm400853d.
[9] SONG H, YU W, LIU X, et al. Improved probiotic viability in stress environments w ith post-culture of alginate-chitosan m icroencapsulated low density cells[J]. Carbohydrate Polymers, 2014, 108(7): 10-16.DOI:10.1016/j.carbpol.2014.02.084.
[10] WESTMAN J O, TAHERZADEH M J, FRANZÉN C J. Proteom ic analysis of the increased stress tolerance of Saccharomyces cerevisiae encapsulated in liquid core alginate-chitosan capsules[J]. PLoS ONE,2012, 7(11): 65. DOI:10.1371/journal.pone.0049335.
[11] MAEDA T, WURGLERMURPHY S M, SAITO H. A two-component system that regulates an osmosensing MAP kinase cascade in yeast[J].Nature, 1994, 369: 242-245. DOI:10.1038/369242a0.
[12] ROSSELLÓ G A M, BOUZA J M E. Quorum sensing, en bacterias y levaduras[J]. Medicina Clinica, 2013, 141(8): 353-357. DOI:10.1016/j.medcli.2013.02.031.
[13] FEDERLE M J, BASSLER B L. Interspecies communication in bacteria[J]. M olecular Oral M icrobiology, 2003, 112(9): 1291-1299.DOI:10.1172/JCI20195.
[14] TALEBNIA F, TAHERZADEH M J. Physiological and morphological study of encapsulated Saccharomyces cerevisiae[J]. Enzyme &M icrobial Technology, 2015, 41(6/7): 683-688. DOI:10.1016/j.enzmictec.2007.05.020.
[15] PONCELET D, DE SMET B P, BEAULIEU C, et al. Production o f alginate beads by em u lsification/in ternal gelation. Ⅱ.Physicochem istry[J]. Applied M icrobiology and Biotechnology, 1995,43(4): 644-650. DOI:10.1007/BF00164768.
[16] 梁新晓, 贠婷婷, 田科雄, 等. 内源乳化凝胶化法制备海藻酸钙微胶珠的工艺优化[J]. 食品科学, 2014, 35(12): 35-40. DOI:10.7506/spkx1002-6630-201412007.
[17] LESLIE S B, TETER S A, CROWE L M, et al. Trehalose low ers membrane phase transitions in dry yeast cells[J]. Biochim ica et Biophysica A cta (BBA)-Biomembranes, 1994, 1192(1): 7-13.DOI:10.1016/0005-2736(94)90136-8.
[18] TREVELYAN W E, HARRISON J S. Studies on yeast metabolism.Ⅰ. Fractionation and m icrodeterm ination of cell carbohydrates[J].Biochem ical Journal, 1952, 50(3): 298-303. DOI:10.1042/bj0500298.
[19] WESTMAN J O, YLITERVO P, FRANZÉN C J, et al. Effects of encapsulation of m icroorganisms on product formation during m icrobial fermentations[J]. Applied Microbiology and Biotechnology,2012, 96(6): 1441-1454. DOI:10.1007/s00253-012-4517-y.
[20] SUN Z J, LV G J, LI S Y, et al. Probing the role of m icroenvironment for m icroencapsulated Sacchromyces cerevisiae under osmotic stress[J]. Journal o f Biotechno logy, 2007, 128(1): 150-161.DOI:10.1016/j.jbiotec.2006.09.001.
[21] 张琳, 贠婷婷, 綦文涛, 等. 乳化凝胶化法微囊化益生菌抗胁迫作用研究[J]. 动物营养学报, 2015, 27(11): 3636-3642. DOI:10.3969/j.issn.1006-267x.2015.11.038.
[22] GAO M, SONG H, LIU X, et al. Im p roved quorum sensing capacity by culturing Vibrio harveyi in m icrocapsules[J]. Journal of Bioscience & Bioengineering, 2015, 121(4): 406-412. DOI:10.1016/j.jbiosc.2015.08.010.
[23] GAO M, SONG H, ZHENG H, et al. Culture of low density E. coli cells in alginate-chitosan m icrocapsules facilitates stress resistance by up-regulating luxS/AI-2 system[J]. Carbohydrate Polymers, 2016, 141:160-165. DOI:10.1016/j.carbpol.2016.01.011.
[24] KIEW T Y, CHEOW W S, HADINOTO K. Importance of biofilm age and grow th medium on the viability of probiotic capsules containing Lactobacillus rhamnosus GG, biofilm[J]. Lebensm ittel-W issenschaft und-Technologie, 2014, 59(2): 956-963. DOI:10.1016/j.lw t.2014.07.053.
[25] TOM ASZEW SKAHETM AN L, RYW IŃSKA A. Ery th rito l biosynthesis from glycerol by Yarrow ia lipo lytica yeast: effect of osmotic pressure[J]. Chem ical Papers, 2015, 70(3): 272-283.DOI:10.1515/chempap-2015-0201.
[26] HOHMANN S. Osmotic stress signaling and osmoadaptation in yeasts[J]. M icrobiology & Molecular Biology Reviews, 2002, 66(2):300-372. DOI:10.1128/MMBR.66.2.300-372.2002.
[27] 陈献忠, 王正祥, 诸葛健. 酵母细胞甘油代谢与生理功能研究进展[J]. 中国生物工程杂志, 2010, 30(5): 140-148. DOI:10.13523/j.cb.20100524.
[28] CHI Z, LIU J, JI J, et al. Enhanced conversion of soluble starch to trehalose by a mutant of Saccharomycopsis fibuligera sdu[J]. Journal of Biotechnology,2003, 102(2): 135-141. DOI:10.1016/S0168-1656(03)00021-X.
Grow th and Metabolism of Microencapsulated Saccharomyces boulardii and Mechanisms of Its Increased Stress Tolerance
QIN Tengfei1,2, YUN Tingting2, WANG Chunling1,*, QI Wentao2,*
(1. College of Food Engineering and Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China;2. Academy of State Adm inistration of Grain, Beijing 100037, China)
Saccharomyces boulardii was entrapped in alginate m icrocapsules by the emulsification/internalgelation method and was cultured in YPD liquid medium. The characteristics of grow th and metabolism of microencapsulated yeast were studied and the mechanism for its increased stress resistance was elucidated w ith the free non-encapsulated one as control.The results showed that more living cells of S. boulardii were obtained and more ethanol was generated in the form of m icrocapsules compared w ith the control group. Extracellular glycerin concentration decreased, while intracellular glycerol concentration increased significantly in m icroencapsulated culture; the extracellular glycerin concentration of microencapsulated cells was 157.3% higher than that of free non-encapsulated cells. Furthermore, compared to free culture,the intracellular trehalose content of m icroencapsulated S. boulardii was significantly increased by 110.3%. In conclusion,the microcapsule could provide a microenvironment that enabled encapsuled S. boulardii to grow stably, and facilitated the accumulation of glycerol and trehalose inside the cells, resulting in an improvement of their stress resistance.
Saccharomyces boulardii; microencapsulation; grow th and metabolism; stress resistance
10.7506/spkx1002-6630-201722021
TS201.3
A
1002-6630(2017)22-0137-06
秦腾飞, 贠婷婷, 王春玲, 等. 发酵前包被布拉迪酵母生长代谢及其抗逆性机理[J]. 食品科学, 2017, 38(22): 137-142.DOI:10.7506/spkx1002-6630-201722021. http://www.spkx.net.cn
QIN Tengfei, YUN Tingting, WANG Chunling, et al. Grow th and metabolism of m icroencapsulated Saccharomyces boulardii and mechanisms of its increased stress tolerance[J]. Food Science, 2017, 38(22): 137-142. (in Chinese w ith English abstract)
10.7506/spkx1002-6630-201722021. http://www.spkx.net.cn
2016-11-30
动物营养学国家重点实验室开放课题(2004DA125184F1306);国家自然科学基金面上项目(31471591)
秦腾飞(1989—),女,硕士研究生,主要从事食品科学研究。E-mail:715160941@qq.com
*通信作者:王春玲(1977—),女,教授,博士,主要从事功能性食品、酿造食品的研究开发。E-mail: wangchunling@tust.edu.cn綦文涛(1979—),男,副研究员,博士,主要从事微囊化细胞培养开发与利用。E-mail:qw t@chinagrain.org
