MKP1对他莫昔芬耐药MCF7细胞耐药性的影响研究*
2017-11-13白静静何建军潘怡霞
白静静,马 刚△,何建军,潘怡霞
1.陕西省人民医院(西安 710068),2.西安交通大学医学部(西安 710061)
MKP1对他莫昔芬耐药MCF7细胞耐药性的影响研究*
白静静1,马 刚1△,何建军2,潘怡霞2
1.陕西省人民医院(西安 710068),2.西安交通大学医学部(西安 710061)
目的:研究MKP1对他莫昔芬耐药MCF7细胞耐药性的影响及其分子机制。方法:应用Real-time PCR和Western blot 分析MKP1在MCF7和他莫昔芬耐药MCF7细胞中的表达变化;Western blot 分析MKP1 siRNA在他莫昔芬耐药MCF7细胞中对他莫昔芬诱导MAPK成员活化的影响;MTT比色法分析细胞活力;流式细胞仪分析细胞凋亡;SP600125抑制JNK活化。结果:与MCF7细胞相比,MKP1在他莫昔芬耐药MCF7细胞中表达上调;MKP1 siRNA可增加他莫昔芬对耐药MCF7细胞活力的抑制作用;MKP1 siRNA组与对照组相比,他莫昔芬介导的耐药MCF7细胞的凋亡显著增加;siRNA组与对照组相比,他莫昔芬诱导的JNK活化显著增强;SP600125抑制JNK活化后,MKP1 siRNA 组他莫昔芬耐药MCF7对他莫昔芬的耐药性部分恢复。结论:MKP1通过抑制他莫昔芬诱导的JNK活化维持MCF7他莫昔芬耐药细胞对他莫昔芬的耐药性。
乳腺癌是女性发病率最高的恶性肿瘤,近年来发病率逐渐上升,且有年轻化趋势[1]。乳腺癌可分为三种基本类型:ER阳性型,Her2基因扩增型和三阴性型,其中ER阳性型乳腺癌约占总乳腺癌发病率的70%以上[2]。他莫昔芬是治疗ER阳性型乳腺癌的经典药物,但ER阳性乳腺癌对他莫昔芬的耐药限制了其应用。已有研究显示,他莫昔芬耐药机制复杂多变[3]。因此,从分子水平探寻他莫昔芬耐药机制,筛选新的分子指标,为其耐药的ER阳性乳腺癌提供新的分子治疗靶标,仍是目前乳腺癌研究的热点之一。
MKP1是丝裂原活化蛋白激酶磷酸酶家族(Mitogen-activated protein kinase phosphatase family,MKPs)成员。MKPs可将MAPKs共有模体TXY中的磷酸化酪氨酸和色/苏氨酸残基去磷酸化,从而负性调节 MAPKs信号[4]。包括MKP1在内的多个MKPs成员在肿瘤中存在表达异常,且与肿瘤的发生发展密切相关。已有研究表明,MAPKs及其下游信号通路参与诱导ER阳性乳腺癌细胞产生他莫昔芬耐药[5]。而作为MAPKs的负性调节因子,MKP1在他莫昔芬耐药机制中的作用尚未有人阐明。本研究发现MKP1在他莫昔芬耐药MCF7细胞中表达增高;利用siRNA沉默MKP1基因表达,分析MKP1对他莫昔芬耐药性的影响;观察MKP1沉默后,他莫昔芬作用下MAPKs活化水平的变化,探讨MKP1参与MCF7细胞他莫昔芬耐药的分子机制。
材料与方法
1 材 料 人乳腺癌MCF7细胞系购自中科院上海细胞库,他莫昔芬耐药的MCF7细胞系由北京中医药大学的陈信义教授惠赠[6]。无酚红的DMEM培养基及活性炭处理过的胎牛血清购自PAA。4-hydroxy tamoxifen(TAM,H7904),SP600125购自Sigma;逆转录及实时定量PCR试剂盒购自TAKARA; 转染试剂TurboFect购自Fermentas;MKP1 siRNA pool(UGGAGCAUAUCGUGCCGAA;AAGAUAUGCUCGACGCCUU), Scrambled siRNA(CGTACGCGGAATACTTCGA)购自Dharmacon;MKP-1(sc-370)多克隆抗体购自Santa Cruz;兔抗人MAPKs,p-MAPKs,p-c-jun,PARP单抗,均购自CST; CCK-8试剂盒购自同仁研究所;细胞凋亡检测试剂盒购自南京凯基;BCA蛋白定量试剂盒购自Thermo。
2 细胞培养 MCF7 细胞培养于含胎牛血清100ml/L,青霉素100 U/ml,链霉素100μg/ml的DMEM培养基中。他莫昔芬耐药的MCF7细胞(MCF7-TR)在含5μmol/L TAM(溶媒为DMSO)的培养基中维持培养8月。所有细胞置于37℃、50ml/L CO2及饱和湿度条件下长期培养,2~3d 换液,细胞融合至 80%~90%时传代。
3 MTT吸光度实验 收集对数生长期细胞,调整细胞密度为1×104/ml,接种于 96 孔板内,200μl/孔,置于37℃、50ml/L CO2培养箱内,孵育过夜后更换培养基。实验组加入药物,每个药物浓度设 6 个复孔;溶媒对照组加入含等体积溶媒的培养基;以无血清培养液作空白调零。细胞活力检测:将细胞培养48h后,每孔加入含有10ml/L CCK-8的培养液100μl,继续培养2h后酶标仪检测450nm波长处各孔吸光度(OD)值。细胞活力(%)=(实验组OD值/对照组OD值)×100%。生长曲线:各组细胞平行培养 1、3、5、7d后,如上法检测450nm波长处各孔吸光度(OD)值,绘制细胞生长曲线。
4 Annexin-PI染色检测细胞凋亡 取对数生长期细胞以细胞数2×106个/孔接种于6cm培养皿中,培养24h后加入TAM使终浓度分别为0μmol/L、5μmol/L、10μmol/L。继续培养48h后胰酶消化为单细胞悬液,置入10ml离心管,预冷PBS洗涤2次,1000r/min离心5min收集细胞。弃上清,加入500μl Binding Buffe→5μl Annexin V-FITC→5 μl Propidium Iodide。室温避光反应5~15min,进行流式细胞检测。
5 MKP1 siRNA瞬时转染细胞 按照TurboFect转染说明书,MCF7-TR细胞用无抗生素含活性炭滤过胎牛血清的无酚红DMEM培养液重悬,调整细胞密度,接种于96或6孔板中,于37℃培养箱中贴壁培养过夜后,将MKP1 siRNA pool和Scrambled siRNA瞬时转染MCF7-TR 细胞,6h后更换培养基,继续培养48h后备用。
6 Real-time PCR检测MKP1 mRNA表达 Trizol 法提取总RNA,取总RNA 1.0μg利用TaKaRa 逆转录试剂盒进行反转录。设计人MKP1 序列实时定量PCR引物,MKP1引物:上游5’-GGGACGCGCGGTGAAG-3’,下游5'-GATCTTGTGCGGTTTTTTGTGG-3’;18S引物,上游5’-TCTCAAAGATTCGCCATG-3’,下游5’-TCACCAACGGAGACCTT-3’。实时定量扩增条件:94℃ 90s;94℃ 30s,60℃ 30s,72℃60s,30个循环;60℃延伸5min。2-ΔΔCt法对实时定量PCR结果进行相对定量统计。
7 Western blot 细胞由RIPA裂解液冰上裂解。离心去除沉淀,加5×SDS Loading Buffer后100℃水浴5min。各取等量蛋白在100g/L的SDS-PAGE 胶上电泳,半干法转印至PVDF膜,用含50g/L BSA的PBST室温封闭 1 h,一抗4℃孵育过夜后PBST洗膜,二抗室温孵育 1 h,PBST 洗膜。加入发光剂,于ChemiDocTM MP成像系统检测并拍照。应用该系统自带的条带分析软件计算条带积分吸光度值并进行半定量分析。
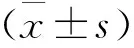
结 果
1 MKP1在他莫昔芬敏感和耐药的MCF7细胞系中的表达 比较MCF7 和MCF7-TR细胞经TAM处理后的生长曲线,提示MCF7-TR细胞对TAM耐药(t3d=-16.817,P3d<0.01;t5d=-31.224,P5d<0.01;t7d=-56.764,P7d<0.01)(图1A)。与MCF7细胞相比,MCF7-TR中MKP1 mRNA 表达显著上调(t=-9.196,P<0.01)(图1B);MKP1蛋白表达也明显升高(图1C)。
2 MKP1敲低对MCF7-TR细胞他莫昔芬敏感性的影响 利用MKP1 siRNA转染MCF7-TR细胞后,Western blot 检测MKP1敲低水平(图2A)。MTT法检测不同浓度TAM(5μmol/L,10μmol/L)处理48h后,MKP1敲低组和对照组MCF7-TR细胞的存活率(图2B)。结果显示在5μmol/L、10μmol/L TAM浓度组别中,MKP1敲低组MCF7-TR细胞存活率均较对照组显著降低(F1=40.908,P1<0.01;F2=58.153,P2<0.01)。说明MKP1改变能影响MCF7-TR细胞的TAM敏感性。
A :TAM作用下MCF7-TR细胞的生长曲线,与MCF7细胞比较,*P3d<0.01;★P5d<0.01; #P7d<0.01;B:MCF7-TR细胞中MKP1 mRNA表达,与MCF7细胞比较,*P<0.01;C:Western blot结果,E2,E2 50nmol/L组;TAM,TAM 5 μmol/L组
图1 MKP1在人乳腺癌MC7和MCF7-TR细胞中的表达

与对照组比较,*P1<0.01, ** P2<0.01
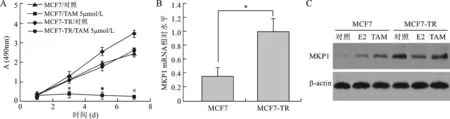
3 MKP1敲低对他莫昔芬诱导MCF7-TR细胞凋亡的影响 应用不同浓度TAM处理MKP1 siRNA转染组与对照组MCF7-TR细胞48h后,采用 Annexin V+PI试剂盒在流式细胞仪上检测细胞凋亡(图3)。结果显示,与对照组细胞相比,TAM 诱导MKP1敲低组细胞发生凋亡的比例显著增加(t1=-6.789,P1<0.01;t2=-9.611,P2<0.01)(图4)。
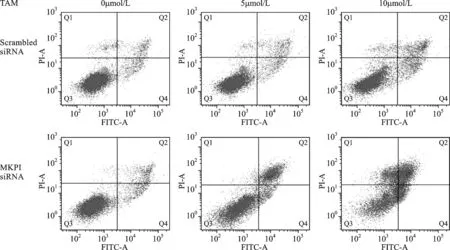
4 MKP1敲低可增加TAM诱导的JNK活化 因MKP1可抑制MAPKs成员的磷酸化,所以我们利用Western blot检测了MKP1 siRNA转染组与对照组MCF7-TR细胞在不同浓度TAM处理24h和48h后,其MAPKs的磷酸化水平。结果显示,敲低MKP1后,TAM诱导MAPKs活化增加,其中JNK活化增加尤其显著(图5)。
A:流式细胞术鉴定各组MCF7-TR细胞经TAM处理后凋亡; B:各组细胞凋亡率比较,*P1<0.01, ** P2<0.01
图3 TAM诱导各组MCF7-TR细胞凋亡比较
5 MKP1通过调节JNK活性保护细胞 为明确JNK活化是否与MKP1敲低的MCF7-TR细胞对TAM敏感性恢复相关,我们在用TAM处理细胞之前,用JNK特异性抑制剂SP600125预处理细胞3h。结果显示SP600125显著降低MKP1 siRNA转染的MCF7-TR细胞的JNK信号通路的激活(图6);也显著减少了TAM诱导的细胞凋亡(t=4.902,P<0.01)(图6)。

图4 各组细胞凋亡比较
A: Scrambled siRNA转染的MCF7-TR细胞,蛋白上样量50μg,15s;B: MKP1 siRNA转染的MCF7-TR细胞,蛋白上样量50μg
图5 Western blot 检测 TAM诱导各组MCF7-TR细胞p-MAPKs 表达
讨 论
MAPKs信号通路是调节哺乳动物细胞生长和死亡的重要信号通路,有多种机制参与其活性的调控,MKPs即是此通路重要的负性调节因子[4]。MAPKs信号通路的失调与多种疾病相关,特别是在肿瘤的发生发展过程中发挥重要作用。累积的研究提示,MKPs与MAPKs信号失调相关,且其多个成员能够通过对MAPKs信号的调节参与肿瘤的发生和发展[7]。

A:各组细胞JNK通路活性及cleaved-PARP表达;B:JNK抑制剂处理后TAM诱导各组细胞凋亡比较,*P<0.01
图6 JNK抑制剂对TAM诱导各组MCF7-TR细胞凋亡的影响
MKP-1是研究最多的MKP家族成员,其与肿瘤的相关性研究也最为深入。MKP-1在多种肿瘤中表达改变[8]。研究报道MKP1在早期前列腺癌、结肠癌和膀胱癌中呈过表达;但随着肿瘤分级增高和出现转移,MKP1的表达呈进行性丢失。在肝细胞肝癌、卵巢癌中,MKP1在肿瘤细胞中的表达较正常细胞明显下调。而在乳腺癌、非小细胞肺癌和胰腺癌中,MKP1表达则明显上调。本研究亦显示,与母代MCF7细胞相比,他莫昔芬耐药的MCF7细胞中MKP1的表达上调。由此可见,MKP1参与肿瘤发生发展的机制复杂。在不同肿瘤中或肿瘤发展的不同阶段,MKP1往往显示出特异性的作用。
MKP-1与肿瘤耐药的相关性研究的最多。最早的证据源于对顺铂耐药的研究。顺铂杀伤肿瘤细胞的机制之一是诱导JNK介导的凋亡通路活化。而MKP-1却能对JNK实施去磷酸化从而抑制JNK的活性,最终导致顺铂耐药。当利用siRNA敲低MKP-1表达后,顺铂诱导的细胞凋亡会明显增加[9]。MKP-1也与其他抗肿瘤药物的耐药相关。有研究显示,MKP-1在乳腺癌中的过表达能够保护肿瘤细胞免于遭受多种化疗药物如多柔比星,氮芥和紫杉醇类诱导的细胞凋亡[10]。最近的一项临床研究更显示, MKP-1过表达可能与靶向药物西妥昔单抗耐药相关[11]。本研究中,采用RNA干扰技术对MKP1进行基因沉默后,他莫昔芬作用下的MCF7-TR细胞活力减低,凋亡增加,部分恢复了对他莫昔芬的敏感性,提示MKP1参与维持MCF7-TR细胞的他莫昔芬耐药性。
他莫昔芬联合同步放化疗可有效减轻放化疗引起的骨髓抑制、消化道反应、放射性损伤等毒副反应[12];同时,其联合乳癖消、散瘀化瘀方治疗乳腺增生可取得较好的疗效[13-14]。作为经典的雌激素受体调节剂,他莫昔芬主要通过与雌激素竞争性结合雌激素受体并抑制其活化,从而下调雌激素受体信号通路活性,达到抑制细胞增殖的作用[15]。研究亦报道,他莫昔芬也可激活JNK等信号通路,从而抑制乳腺癌细胞增殖,诱导细胞凋亡[16]。导致他莫昔芬耐药的机制复杂,因素多变。主要机制可能为雌激素受体信号通路与活化的激酶信号通路之间形成串话调节,导致雌激素受体非配体性激活,引起下游通路活化增加。另外雌激素受体缺失、核受体共调节因子失衡、表皮生长因子受体信号通路过度活化等均可导致他莫昔芬耐药[17]。本研究利用siRNA敲低MKP1后,他莫昔芬明显促进MCF7-TR细胞JNK的磷酸化,显示在MCF7-TR细胞中,MKP1主要对JNK实施去磷酸化,从而抑制JNK活性。在应用JNK特异性抑制剂SP600125预处理细胞后,他莫昔芬诱导MKP1敲低MCF7-TR细胞凋亡的能力降低。提示MKP1能通过抑制JNK活性维持MCF7-TR对他莫昔芬的耐受性。
总之,MKP1在他莫昔芬耐药的MCF7细胞中表达上调,并可抑制他莫昔芬介导的JNK凋亡通路活化,从而维持细胞对他莫昔芬的耐药。但是,他莫昔芬耐药MCF7细胞中上游信号如何调节MKP1表达,其他MKPs家族成员是否也参与维持他莫昔芬耐药性,尚需进一步研究。
[1] emal A,Bray F,Center MM,etal. Global cancer statistics [J]. CA Cancer J Clin,2011,61(2): 69-90.
[2] Musgrove EA,Sutherland RL. Biological determinants of endocrine resistance in breast cancer [J]. Nat Rev Cancer,2009,9(9): 631-643.
[3] Osborne CK,Schiff R. Mechanisms of endocrine resistance in breast cancer [J]. Annu Rev Med,2011,62(233-247.
[4] Caunt CJ,Keyse SM. Dual-specificity map kinase phosphatases (mkps): Shaping the outcome of map kinase signalling [J]. FEBS J,2013,280(2): 489-504.
[5] Ghayad SE,Vendrell JA,Ben-Larbi S,etal. Endocrine resistance associated with activated erbb system in breast cancer cells is reversed by inhibiting mapk or pi3k/akt signaling pathways [J]. Int J Cancer,2010,126(2): 545-562.
[6] 谌海燕,陈信义. 粉防己碱抗人乳腺癌细胞mcf-7/tam对三苯氧胺的耐药性研究 [J]. 中国中西医结合杂志,2013,33(4): 489-491.
[7] Wu GS. Role of mitogen-activated protein kinase phosphatases (mkps) in cancer [J]. Cancer Metastasis Rev,2007,26(3-4): 579-585.
[8] Shen J,Zhang Y,Yu H,etal. Role of dusp1/mkp1 in tumorigenesis,tumor progression and therapy [J]. Cancer Med,2016,5(8): 2061-2068.
[9] Wang Z,Xu J,Zhou JY,etal. Mitogen-activated protein kinase phosphatase-1 is required for cisplatin resistance [J]. Cancer Res,2006,66(17): 8870-8877.
[10] Small GW,Shi YY,Higgins LS,etal. Mitogen-activated protein kinase phosphatase-1 is a mediator of breast cancer chemoresistance [J]. Cancer Res,2007,67(9): 4459-4466.
[11] Montagut C,Iglesias M,Arumi M,etal. Mitogen-activated protein kinase phosphatase-1 (mkp-1) impairs the response to anti-epidermal growth factor receptor (egfr) antibody cetuximab in metastatic colorectal cancer patients [J]. Brit J Cancer,2010,102(7): 1137-1144.
[12] 韦 凤,杨志祥.他莫昔芬联合同步放化疗对局部晚期非小细胞肺癌的治疗效果分析[J].陕西医学杂志,2015,44(12):1599-1600.
[13] 高飞钰,张玉莲.乳癖消配合他莫昔芬治疗乳腺囊性增生症96例[J].陕西中医,2009,30(4):444-445.
[14] 黄遵宇.散瘀化痰方联合他莫昔芬治疗乳腺增生疗效观察[J].陕西中医,2015,36(3):267-268.
[15] 邢婉莹,李 强,孙 光,等. Ccnd1基因与乳腺癌tam耐药的关系 [J]. 吉林大学学报医学版,2009,(2): 389-392.
[16] Bogush T,Dudko E,Bogush E,etal. Tamoxifen non-estrogen receptor mediated molecular targets [J]. Oncol Rev,2012,6(2): e15.
[17] Dixon JM. Endocrine resistance in breast cancer [J]. New J Sci,2014,(1):1-27.
EffectsofMKP1onthedrugsensitivityoftamoxifenresistantMCF7cells
Bai Jingjing,Ma Gang,He Jianjun,et al.
Shaanxi Provincial People’s Hospital(Xi’an 710068)
Objective:To investigate the effects of mitogen-activated protein kinase phosphatase 1(MKP-1) on the drug sensitivity of tamoxifen resistance breast cancer MCF7 cells and the molecular mechanisms. Methods:The expression of MKP1 in MCF7 and tamoxifen resistant MCF7 cells were analyzed by Real-time PCR and Western Blot. Effects of MKP1 siRNA on the activation of MAPKs mediated by tamoxifen in tamoxifen resistant MCF7 cells were analyzed by Western Blot. MTT assy was used to analyze the effects of MKP1 siRNA on survival rate of tamoxifen resistant MCF7 cells after tamxoifen treatment. The effects of MKP1 siRNA on apoptosis induced by tamoxifen in tamoxifen resistant MCF7 cells were analyzed with flow cytometer. JNK inhibitor SP600125 was used to treat MKP1 siRNA group cells. Results:MKP1 expression level was higher in tamoxifen resistant MCF7 cells compared with parental MCF7 cells. MKP1 siRNA enhanced the tamoxifen sensitivity of tamoxifen resistant MCF7 cells,and promoted the apoptosis induced by tamoxifen. Tamoxifen-induced activation of JNK significantly increased in MKP1 siRNA group tamoxifen resistant MCF7 cells compared with control group cells. SP600125 recovered tamoxifen resistant capacity in MKP1 siRNA group tamoxifen resistant MCF7 cells. Conclusion:MKP1 maintains tamoxifen resistant capacity in tamoxifen reisistant MCF7 cells through blocking JNK activation.
Drug tolerance Mitogen-activated protein kinase phosphatase Tamoxifen @MCF7 cells Apoptosis
*陕西省科技攻关项目(2011K13-01-08)
△通讯作者
药物耐受性 丝裂原活化蛋白激酶磷酸酶 他莫昔芬 @MCF7 细胞凋亡
R392.5
A
10.3969/j.issn.1000-7377.2017.11.006
(收稿:2017-05-04)
