免疫组织化学双标在肿瘤侵犯判断中的应用
2017-11-13林蓁刘德纯杨文圣
林蓁,刘德纯,杨文圣
(厦门大学附属成功医院病理科,厦门 361003)
免疫组织化学双标在肿瘤侵犯判断中的应用
林蓁,刘德纯*,杨文圣
(厦门大学附属成功医院病理科,厦门 361003)
目的探讨免疫组织化学双标法在判断肿瘤侵犯中的应用。方法应用以DAB和快红(fast red, FR)作为呈色剂的EnVision法免疫组织化学双标技术标记肿瘤组织33例,观察肿瘤组织中肿瘤细胞、血管淋巴管与神经及其相互关系。结果肿瘤组织中肿瘤细胞被标记成棕色(DAB显色),血管淋巴管内皮与神经纤维被标记成玫瑰红色(FR显色);可疑肿瘤侵犯血管淋巴管的30例中,有28例可见标记成棕色的肿瘤细胞侵入标记成瑰红色的血管、淋巴管中(肿瘤侵犯血管淋巴管阳性),阳性率为93.3%;可疑神经侵犯的12例中,有10例可见标记成棕色的肿瘤细胞侵入标记成瑰红色的神经纤维中(肿瘤侵犯神经纤维阳性),阳性率为83.3%。结论以DAB和快红作为呈色剂的免疫组织化学双标法观察肿瘤是否侵犯血管淋巴管与神经组织,结果清晰可靠,可作为判断肿瘤有无侵袭性生长的重要依据。
免疫组织化学;双标法;肿瘤侵犯
免疫组织化学双标染色是指用免疫组织化学染色方法在同一张组织切片上同一部位同时显示两种抗原。这种方法可以直接观察到不同细胞之间的相互关系、相同部位不同细胞的分布情况,或同一细胞内不同抗原定位与相互关系。肿瘤侵袭性生长,如突破基底膜、基底细胞或肌上皮细胞,浸润到间质组织中,侵犯神经和血管淋巴管等,都是判断恶性肿瘤的重要依据。在HE染色下不易判断时,免疫组织化学双标记可起到有效的辅助诊断作用。目前对于如何运用免疫组织化学双标记技术判断癌细胞侵犯血管淋巴管与神经,尚未见专门报道。我科探索应用以DAB和快红(fast red, FR)作为呈色剂的免疫组织化学双标技术,显示肿瘤细胞与神经纤维、肿瘤细胞与血管淋巴管内皮细胞的相互关系,以判断肿瘤有无侵袭性生长。
材料和方法
1 材料
收集厦门大学附属成功医院病理科2015年1月至2016年6月间,经病理医生以HE染色观察怀疑有肿瘤血管淋巴管或神经侵犯的标本33例。其中男性12例,女性21例,平均年龄56岁;病种包括结直肠癌11例,胃癌7例,宫颈癌4例,食管癌3例,肺癌2例,甲状腺癌2例,乳腺癌2例,肾癌1例,涎腺癌1例。
2 主要仪器
罗氏BenchMark全自动免疫组织化学染色仪。
3 主要试剂
鼠抗人即用型单克隆抗体CKpan(AE1/AE3)(标记上皮性肿瘤细胞)、鼠抗人即用型单克隆抗体CD34(QBEnd/10)(标记血管内皮细胞)、鼠抗人即用型单克隆抗体D2-40(D2-40)(标记淋巴管内皮细胞)、鼠抗人即用型单克隆抗体S-100(4C4.9)(标记神经纤维细胞),抗体均购自福州迈新公司;Ultra View Universal DAB Detection Kit(DAB染色液),主要试剂包含:3%过氧化氢液,通用 HRP 多聚体(包含有HRP标记的抗体混合物:山羊抗小鼠IgG,山羊抗小鼠IgM和山羊抗兔IgM,<50μg/ml),DAB呈色剂,5g/L硫酸铜液;Ultra View Universal AP Red Detection Kit (AP染色液),主要试剂包含:通用 AP 聚合体(包含有AP标记的抗体混合物:山羊抗小鼠IgG,山羊抗小鼠IgM和山羊抗兔IgM,<50μg/ml),2g/L快红(fast red, FR)A、2g/L快红B呈色剂,11%氯化镁液;抗原修复液Tris(pH 8.5);缓冲液Tris(pH值7.2~7.4);染色液、修复液、缓冲液均购自罗氏诊断产品(上海)公司。
4 组织蜡块分组
在上述33例中,每例选出需要做免疫组织化学检测的蜡块1块。可疑肿瘤血管淋巴管侵犯的30例为第一组,可疑神经侵犯的12例为第二组(部分病例疑同时有血管淋巴管和神经侵犯)。第一、第二组中随机选10例做为对照组。将蜡块3μm切片,裱在防脱载玻片上,65℃烤片30min待用。组织切片二甲苯脱蜡,经梯度乙醇至水化。打印条形码,将需检测组织切片分组贴好条形码,开始上机扫描操作。
5 组织免疫组织化学染色
5.1 免疫组织化学双标记染色
使用罗氏BenchMark全自动免疫组织化学染色仪,用EnVision法进行双标记。仪器染色程序:pH 8.5修复液Tris 98℃抗原修复60min;第一次标记,一抗37℃孵育;二抗(通用 HRP 多聚体,即用型)37℃孵育8min;以DAB呈色8min;94℃抗体变性灭活4min;第二次标记一抗37 ℃孵育;二抗(通用 AP 聚合体,即用型)37℃孵育8min;以FR呈色8min。其中第一组切片,第一次标记一抗CKpan(37℃孵育40min),第二次标记一抗CD34(37℃孵育32min)或标记一抗D2-40(37℃孵育48min)。第二组切片,第一次标记一抗CKpan(37℃孵育40min),第二次标记一抗S-100(37℃孵育52min)。染色程序结束后,少许稀释洗洁精去除油膜,清水将切片清洗干净。苏木素复染,电吹风微风吹干,二甲苯透明,中性树胶封固。
5.2 免疫组织化学单标记
使用罗氏BenchMark全自动免疫组织化学染色仪,用EnVision法进行单标记。仪器染色程序:pH 8.5修复液Tris 98℃抗原修复60min;一抗37℃孵育;二抗(通用 HRP 多聚体,即用型)37℃孵育8min;以DAB呈色8min。将对照组20例切片,分别进行CKpan、CD34、D2-40、S-100单标记,其中一抗CKpan(37℃孵育40min)、一抗CD34(37℃孵育32min)、一抗D2-40(37℃孵育48min)、一抗S-100(37℃孵育52min)。染色程序结束后,少许稀释洗洁精去除油膜,清水将切片清洗干净。苏木素复染,无水乙醇脱水,电吹风微风吹干,二甲苯透明,中性树胶封固。
6 统计学方法
所得数据均采用Excel进行统计学检验,计数资料采用频数分布计算。
结 果
免疫组织化学双标标记结果显示,CKpan阳性颗粒定位在上皮细胞(在此为上皮性肿瘤细胞,即癌细胞)的胞质,DAB呈色阳性颗粒为棕褐色,CD34(D2-40)阳性颗粒定位在血管(淋巴管)内皮细胞的胞膜/胞质,FR呈色阳性颗粒为玫瑰红色(图1、图2);S-100阳性颗粒定位在神经纤维细胞的胞核/胞质,FR显色阳性颗粒为玫瑰红色(图3)。肿瘤侵犯血管淋巴管染色结果显示,被侵犯的标记成瑰红色的血管、淋巴管中,可见标记成棕色的肿瘤细胞。肿瘤侵犯神经纤维染色结果显示,被侵犯的标记成瑰红色的神经纤维中,可见标记成棕色的肿瘤细胞。单标记免疫组织化学染色显示,CKpan阳性颗粒定位在上皮细胞的胞质(图4),CD34阳性颗粒定位在血管内皮细胞的胞膜/胞质(图5),D2-40阳性颗粒定位在淋巴管内皮细胞的胞膜/胞质(图6),S-100阳性颗粒定位在神经纤维细胞的胞核/胞质,DAB呈色阳性颗粒为棕褐色(图7)。
在对照组中,CKpan、CD34(或D2-40)、S-100免疫组织化学单标记不能显示癌细胞与血管淋巴管及神经之间的相互关系,必须将标记肿瘤组织细胞的切片与标记血管淋巴管或神经的切片在显微镜下反复观察比对,在无法确定肿瘤组织是否存在血管淋巴管或神经纤维中,就无法确定肿瘤是否侵犯。
对双标标本统计分析显示,在可疑肿瘤血管淋巴管侵犯的30例中,肿瘤血管淋巴管侵犯阳性28例,阳性率为93.3%;可疑神经侵犯的12例中,肿瘤侵犯神经纤维阳性10例,阳性率为83.3%。
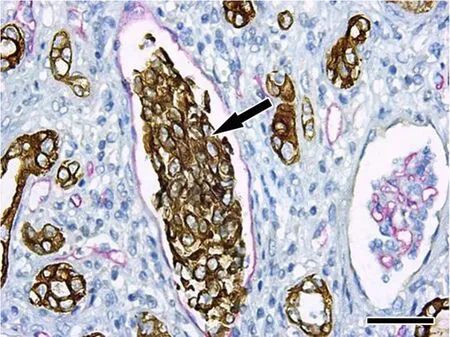
图1 CKpan和CD34免疫组织化学双标染色,显示肾盂尿路上皮癌细胞侵犯血管。棕色为癌细胞(箭头)CKpan阳性,玫瑰红色为血管内皮细胞CD34阳性;标尺,100μmFig. 1 CKpan and CD34 double-stain immunohistochemistry of renal pelvis cancer. Urothelial carcinoma cells which were positive for CKpan and stained brown (arrowhead) were visible in surrounding blood vessel where vascular endothelial cells were positive for CD34 and stained as rose red; scale bar, 100μm

图2 CKpan和D2-40免疫组织化学双标染色,显示胃癌细胞侵犯淋巴管。棕色为癌细胞(箭头)CKpan阳性,玫瑰红色为淋巴管内皮细胞D2-40阳性;标尺,100μmFig. 2 CKpan and D2-40 double-stain immunohistochemistry of gastric cancer. Gastric cancer cells that were positive for CKpan and stained brown (arrowhead) were evident in surrounding lymphatic vessel where lymphatic endothelial cells were positive for D2-40 and stained rose red;scale bar, 100μm

图3 CKpan和 S-100免疫组织化学双标染色,显示胃癌细胞侵犯神经。棕色为癌细胞CKpan阳性,玫瑰红色为神经纤维(箭头)S-100阳性;标尺,50μmFig. 3 CKpan and S-100 double-stain immunohistochemistry of gastric cancer. Gastric adenocarcinoma cells that were positive for CKpan and stained brown were found in neighboring nerve fiber (arrowhead) which were positive for S-100 and stained rose red; scale bar, 50μm
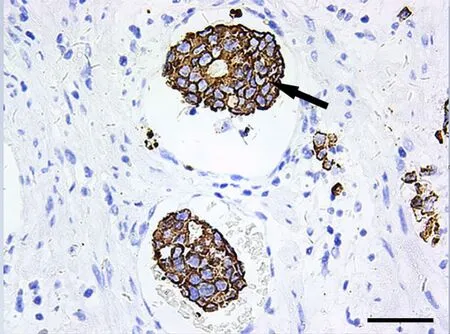
图4 CKpan免疫组化单标记染色,显示胃癌可疑侵犯毛细血管。棕色为癌细胞(箭头)CKpan阳性;标尺,100μmFig. 4 CKpan single-stain immunohistochemistry of gastric cancer. Gastric cancer cells suspected to invade capillary were positive for CKpan and stained as brown (arrowhead); scale bar, 100μm
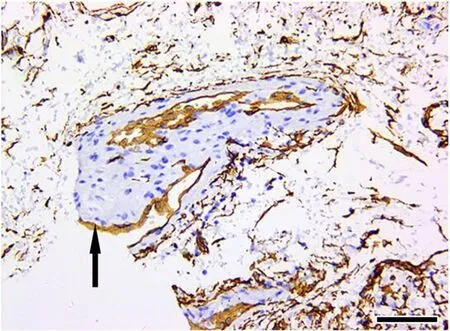
图5 CD34免疫组化单标记染色,显示可疑胃癌侵犯血管。棕色为血管内皮细胞(箭头)CD34阳性;标尺,50μmFig. 5 CD34 single-stain immunohistochemistry of blood vessel. Gastric cancer cells were suspected to invade blood vessel where vascular endothelial cells were positive for CD34 and stained brown; scale bar, 50μm
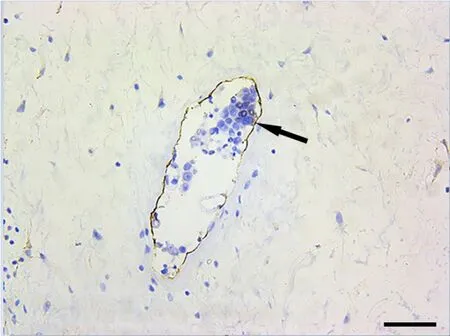
图6 D2-40免疫组化单标记染色,显示胃癌细胞可疑侵犯淋巴管。棕色为淋巴管内皮细胞(箭头)D2-40阳性;标尺,50μmFig. 6 D2-40 single-stain immunohistochemistry of lymphatic vessel.Gastric cancer cells were suspected to invade lymphatic vessel where lymphatic endothelial cells were positive for D2-40 and stained brown(arrowhead); scale bar, 50μm
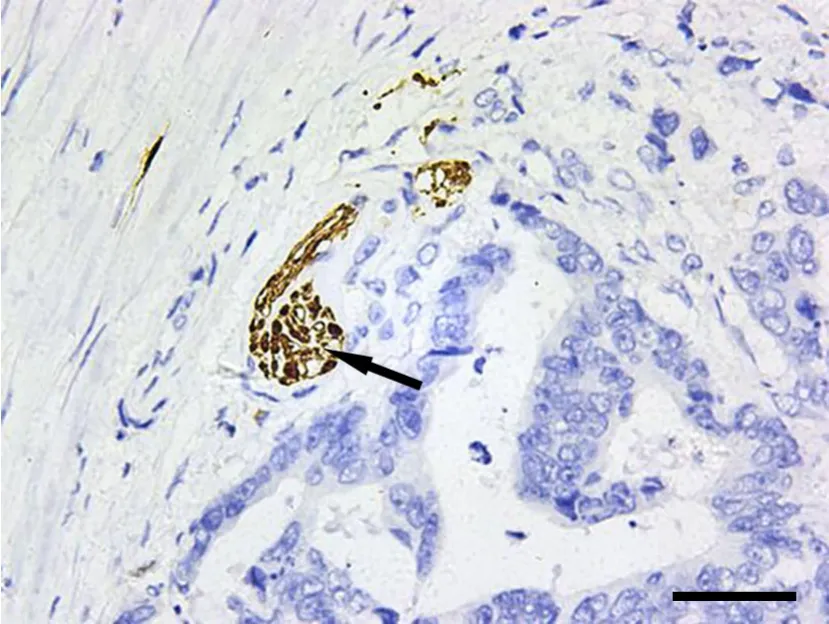
图7 S-100免疫组化单标记染色,显示直肠癌细胞可疑侵犯神经纤维。棕色为神经纤维(箭头)S-100阳性;标尺,50μmFig. 7 S-100 single-stain immunohistochemistry of nerve fibers. Rectal cancer cells were suspected to invade nerve fibers which were positive for S-100 and stained brown (arrowhead); scale bar, 50μm
讨 论
免疫组织化学双标法较早应用于前列腺上皮与基底细胞的双重染色,对于鉴定基底细胞是否存在,有无浸润性生长,确定病变性质,具有重要意义[2-3]。后来推而广之,应用于消化道肿瘤、乳腺肿瘤中[4-7],对确定细胞类型、确定肿瘤性质及微转移灶等有很大帮助。肿瘤组织是否突破基底膜、基底细胞或肌上皮细胞、侵犯神经和血管淋巴管等,是判断恶性肿瘤的重要依据。在HE染色下不易判断时,可运用免疫组织化学双标法确定肿瘤有无侵袭性生长;如组织空隙中见异型细胞,是人工假象还是血管淋巴管内癌栓,通过双标法可以明确判断癌细胞有无侵犯血管淋巴管或神经等。与传统免疫组织化学单标法比较,阳性定位清晰,标记颜色对比鲜明,一目了然,对病理诊断很有帮助。
关于癌细胞侵犯血管淋巴管与神经的免疫组织化学双标法,目前尚未见专门报道,亦无统一操作规范和流程。我们为此进行了探索。根据既往经验,除了单标法中需要注意的质控细节,更要关注到免疫组织化学双标染色独特的方面,特别是要避免两种显色方法的互相干扰。本文免疫组织化学双标法的目的是观察同一区域中不同细胞类型的不同染色反应以及它们之间的相互关系,不同颜色显示抗原定位表达非常直观。抗体组合选择尽量避免使用同源抗体结合(如鼠与鼠或兔与兔同源抗体),而选择不同源抗体结合(鼠源性抗体与兔源性抗体结合等),以减少同源抗体间的交叉反应。同时要考虑抗体组合在标记中过程中的相互作用,包括灭活、抗原修复条件及抗体标记的先后搭配等程序,防止相互干扰影响染色效果。多重标记用特定酶的集中色原,每一种都产生一种不同的有色反应终产物,多种技术可用于相同切片的定位。如果一抗体来自相同种属并有相同的亚类,就必须清除其间的交叉反应。使用不同种属或不同亚类的一抗的方法要简单很多[1]。
必须考虑双标法组合中两抗原修复条件、表达强弱、显色先后等染色过程中可能相互影响的因素,如尽量选择两种抗原修复程度相对一致的抗体组合。不同抗体表达的强弱有异,选择抗体标记的先后也十分关键,两种显色方法,颜色或许会发生重叠,因此需要将不容易显色、显色较弱的标记先显色,而比较容易显色的标记在后面。显色的顺序一般以着色稳定、不易褪色的底物先染,避免后续染色对前面的染色造成影响,常规建议先染DAB[8]。FR显色后需水洗,接触乙醇可使标记的红色褪去,令实验失败。
为保证质量,我们对每组预定抗体组合进行反复预试验,以探索最佳的染色方案,优化双标程序。经过一定数量的组织检测,对结果进行重复性的对比,及阴、阳性对照。待达到满意结果后,才将优化程序相对固定下来,在诊断实践中推广应用,并将在以后的染色中观察变化,不断完善。
免疫组织化学双色标记的判读,在光学显微镜下观察,先确定阴性、阳性对照表达清晰易辨,定位正确,才可对检测标本进行判读。免疫组织化学双标记与单标记阳性判读有所不同,需先了解标记组合的中每种抗体阳性定位,同时确定每种抗体的显色反应,对每种单项抗体标记进行判读。同时关注组合抗体之间表达的相互关系,客观对表达结果的正确性进行分析。对定位或显色不正确的应重新进行标记。
免疫组织化学双标法使用要有目的性,盲目运用可导致结果无说服力而失去意义。近年来,我们在工作实践中不断探索和尝试,规范操作控制质量,逐渐形成了一些相对固定的免疫组织化学双标法程序,即前述操作程序,为病理确诊提供很大帮助,但还需进一步改进与完善。
[1] 班克罗夫特,著.组织学技术的理论与实践. 周小鸽,刘勇,主译. 第6版.北京大学医学出版社,2010:375-378.
[2] 王翠芝,周小鸽,黄受方,等. 混合型p504s/34βE12/p63抗体在前列腺癌诊断中的应用价值.临床与实验病理学杂志,2006,22(3):325-328.
[3] Srinivasan M, Parwani AV. Diagnostic utility of p63/P501S double sequential immunohistochemical staining in differentiating urothelial carcinoma from prostate carcinoma.Diagnostic Pathology, 2011, 6∶ 67-73.
[4] 郭群,卫爱军,王艳煜,等.多种标记免疫组织化学技术在消化道肿瘤研究中的应用.南通大学学报(医学版),2007,27(4):247- 251.
[5] 兰竞丽,胡兆鹏,胡湘萍,等. 免疫组织化学双标记法P63/SMA在乳腺肿瘤中的表达及意义.江西医学检验,2006,24(1):51- 52.
[6] 徐薇苓,朱雄增,涂小予,等. 乳腺疾病的SMA/CK免疫组织化学双标记法.诊断病理学杂志,2000,7(3):189- 190.
[7] 高福平,刘筱韵,魏谨,等. 细胞角蛋白及CD68在胃肠道淋巴结微小转移癌中的表达及意义.实用医技杂志,2014,21(11):1154- 1155.
[8] 林婷,陈惠玲,李萍,等. 免疫组织化学双重染色的应用及体会. 诊断病理学杂志,2013,20(6):383.
Application of immunohistochemical double staining in detection of tumor invasion
Lin Zhen, Liu Dechun*, Yang Wensheng
(Department of pathology, Affiliated Chenggong Hospital of Xiamen University, Xiamen 361003, China)
Object To explore the application of immunohistochemical double staining in detection of tumor invasion. Method 33 cases of tumor tissue specimens were double stained using EnVision method in which DAB and Fast Red were the substrates and chromogens. The method was evaluated based on its ability to distinguish tumor cells from surrounding vascular or lymphatic vessels and nerve fibers. Result In tissue sections, tumor cells were stained brown (DAB), while vascular endothelium and nerve fibers were stained rose red (FR). Among 30 cases that likely had tumor invasion into vascular and lymphatic vessels, 28 cases were found to have brown tumor cells visible in rose red regions of vascular and lymphatic vessels, resulting a positive rate of 93.3%. Among 12 cases that were suspected to have nerve fiber invasion, 10 were found to have tumor cells staining brown presence in nerve fibers staining rose red, giving a positive rate of 83.3%.ConclusionImmunohistochemical double staining with DAB and Fast Red as chromogens could be used to evaluate tumor invasion of nerve tissues, vascular and lymphatic vessels as well as provide measurement for its invasive growth.
Immunohistochemistry; double staining; tumor invasion
R322.74
A DOI:10.16705/ j. cnki. 1004-1850. 2017. 05. 016
2017-04-21
2017-10-10
林蓁,女(1971年),汉族,副主任技师
*通讯作者(To whom correspondence should be addressed):ahbbldc@sina.com
