基于心脏腔式结构的心电图元胞自动机建模∗
2017-11-12张学良谭惠丽唐国宁邓敏艺
张学良 谭惠丽 唐国宁 邓敏艺
(广西师范大学物理科学与技术学院,桂林 541004)
基于心脏腔式结构的心电图元胞自动机建模∗
张学良 谭惠丽 唐国宁 邓敏艺†
(广西师范大学物理科学与技术学院,桂林 541004)
元胞自动机,跨膜电位,心电图,心肌缺血
建立了包含心房肌、心室肌、房室腔、室间隔并考虑心室肌分层结构的心电图元胞自动机模型.利用所建立的模型,仿真了电信号在心脏中的传导,计算了正常和缺血情况下的场点电势走势.数值结果表明:正常情况下,模拟所得的场点电势呈现与标准心电图一致的P波、QRS波群、T波和J波;在心内膜下肌细胞缺血情况下,出现T波倒置的现象;在心外膜下肌细胞缺血情况下,T波变得高耸;在透壁缺血情况下,T波提前形成,QT间期缩短.将正常和异常情况下的场点电势走势与临床结果进行了对比,并分析了其形成与持续机制.研究结果可为准确阐明心电图与心肌细胞电活动之间的关系、探讨心电图的产生与持续机制提供参考.
1 引 言
心脏是重要的器官,其出现纤维性震颤将在短时间内危及生命.在临床上通常借助心电图(electrocardiogram,ECG)来诊断心脏疾病[1].ECG是心肌电信号在场点形成的总电势随时间变化的走势,是心肌细胞电活动的总体外在表现.正常ECG由一组波组成,每一个心动周期通常都有P波、QRS波群和T波,典型的心电图波形如图1所示,其中两心房的除极过程形成P波,心室除极过程产生QRS波群,而T波是QRS波群后的第一个向上波,由心室复极过程形成[2].长期以来,临床ECG诊断常常依赖于经验,即由临床病例、实验数据总结出某心脏疾病的ECG波形特点,然后再根据该特点诊断相应的心脏疾病.例如由持续的上斜式ST段压低判断心肌缺血的存在[3];由患者在其心电图出现尖刺头盔式信号后死亡,得到该信号意味着心脏病预后不良的结论,并用于临床诊断[4];根据临床数据得到心肌梗死的诊断标准[5]等.由于缺乏对心脏疾病与ECG波形关系的形成机制的认识,很多心脏病的ECG诊断标准处于模棱两可的境地,例如对心脏再同步治疗中心房、心室起搏患者,分别有约70%和90%患者的心电图出现可见尖峰,于是研究者提出对于心脏再同步治疗患者,心电图中没有可见尖峰并不能排除起搏节律来源[6];只有在上斜式ST段压低的现象持续1 h以上的情况下,才能诊断为心肌缺血,否则就不能排除缺血以外的情况[3].准确阐明心肌电活动与ECG波形的关系,有助于认识心脏疾病下ECG的形成机制,改善ECG临床诊断对经验的依赖局面.实验方法虽然直观、可靠,但实验方法不仅容易损伤实验对象、难以重复、成本较高,而且还难以排除其他因素而探讨特定因素对ECG的影响.数值模拟方法可利用模型中的不同参量对应模拟对象的不同因素,因而可以方便地研究特定因素的影响.因此,建立能反映心肌电活动与ECG之间定量关系的数值模型,就成为心电图学研究的重要辅助手段.
研究心脏电生理问题的数值模拟方法主要有两类,分别是基于微分方程的反应扩散模型和基于演化规则的元胞自动机模型(cellular automaton,CA)[7].利用反应扩散模型,研究者探讨了多个可激发障碍[8]、局部周期刺激驱动[9]、小世界网络连接[10]等因素对螺旋波电信号运动规律的影响,提出了交替对流场[11]、局部低能量驱动[12]、旋转电场[13]、分布式电流刺激[14]以及在缺陷上激发新的兴奋波[15]等螺旋波控制方法,模拟了心电图QRST区间的产生[16],分析了心肌缺血下心电图改变的细胞电生理学机制[17],仿真了十二导联心电图[18]等.反应扩散模型接近真实系统,结果较准确,但计算量巨大,即使在多处理器上模拟1—2 s的电活动也会消耗数小时的计算时间[7].本文采用CA模型从细胞水平上探讨心电图形成与持续机制.CA是时间、空间、状态均离散的数值模拟方法[19].由于CA具有完全并行性,可在计算机上大幅度提高计算效率,同时能方便地实现各种边界条件,不存在传统方法的截断误差,因此CA在研究复杂系统方面有着独特优势.人们早就开始了用CA方法研究心肌组织电活动,先后建立了心房肌[20]、心室肌[21]和窦房结[22]的CA模型,但缺乏ECG的CA建模与研究.我们已经对一片矩形心室肌建立了考虑心室肌层式结构的二维CA模型,并仿真出ECG的R波、S波和T波[23],但因该模型只包含心室肌而过于简单,不能仿真出ECG的所有波形,需要进一步建立包含更多心脏结构、更接近真实的心电图CA模型.
本文对ECG进行CA建模研究,探索ECG波形走势与心肌细胞电活动之间的关系.首先构建包含左右心房、左右心室、室间隔并考虑心室肌组织分层结构的二维心脏CA模型;然后利用该模型数值模拟正常ECG,分析正常ECG各波形的形成机制;接着数值模拟三种缺血情况下的ECG,将模拟结果与临床结果进行对比,并从细胞水平上解释异常ECG的产生机制.
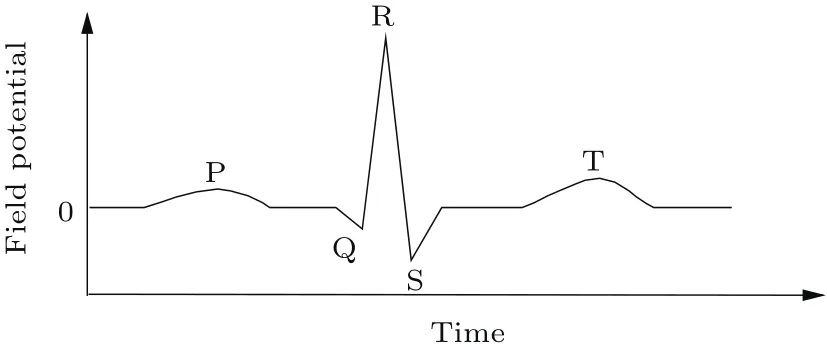
图1 包含P波、QRS波群和T波的典型心电图Fig.1.Schematic plot of a normal ECG illustrating the P wave,the QRS complex,and the T wave.
2 二维心肌组织的CA模型
心脏主要包括左右心房、左右心室、室间隔及各种传导组织,其中的心室肌可根据电学性质分为三层:心内膜下肌层、中层肌和心外膜下肌层.心室肌各层细胞厚度不相同,内层最厚,其次是中间层,外层细胞最薄[24].考虑这些因素后,构造如图2所示的二维心脏切片的简化结构,切片包含心房腔、心室腔和室间隔,其中心房腔简化为半圆球、心室腔简化为半椭球;心室肌的心内膜下肌层、中层肌和心外膜下肌层分别用绿、红和蓝色显示.在下文分析不同层次间跨膜电位V的差异时分别选图2中A,B,C,D,E五个位置的的膜电位进行对比,这五个点的细胞分别是心房肌、室间隔、心内膜下肌层、中层肌和心外膜下肌层细胞.F点为场点.为简单起见,本文忽略室间隔的分层,将室间隔的细胞都作为心室肌内膜下肌层细胞处理,下文可以看到,这样的简化处理不影响室间隔对心电图Q波的形成作用.
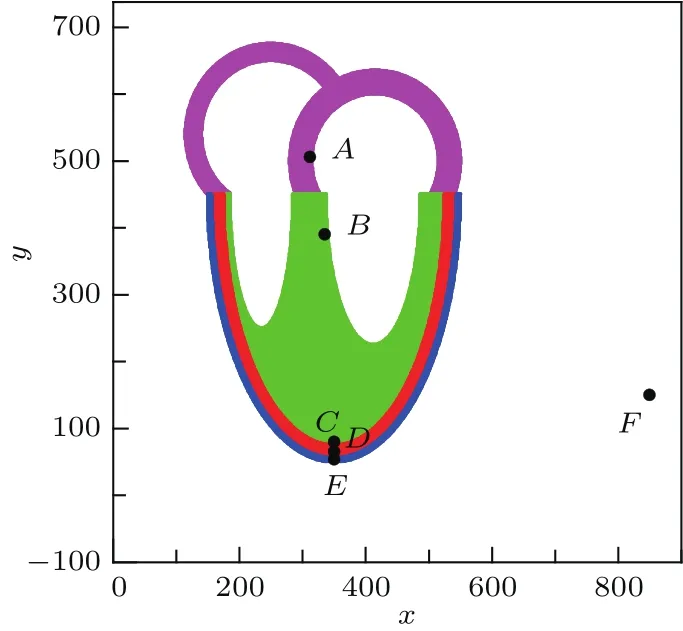
图2 包含房室腔并考虑心室分层的二维心脏简化剖面结构A,B,C,D,E是分别位于心房、室间隔、心室心内膜下肌层、心室中层肌和心室心外膜下肌层的细胞,F点是场点Fig.2.The two-dimensional simpli fi ed longisection of heart including the atrial and ventricular cavity.The cells at points A,B,C,D,E are the cells of atria,ventricular septum,endocardial wall,subepicardial wall,and epicardial wall,respectively,and F is the fi eld point.
将简化后的心脏切片放在二维直角坐标系中,如图2,细胞位于整数坐标(x,y)上,称为元胞.t时刻位置(x,y)处元胞状态用函数ϕ(x,y,t)表示,ϕ(x,y,t)在集合{0,1,2,3,···,n−1}中取值(n为整数),ϕ(x,y,t)=0表示元胞处于静息态,ϕ(x,y,t)=1表示元胞处于激发态,ϕ(x,y,t)=2,3,···,n−1表示元胞处于不应态.n为元胞的状态数,其大小反映了动作电位时程的长短.不同状态之间的演化规则如下:
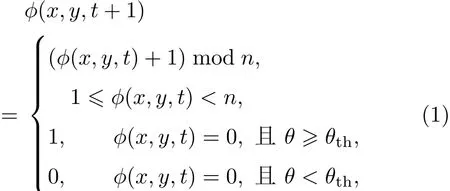
式中θ代表邻域范围内激发态邻居个数,本文采用半径为20的扩展Moore型邻居;θth为激发阈值,本文取θth=2.在边界处理上,本文采用映射边界条件.在利用(1)式进行迭代演化时,一个时步对应的时间间隔为10 ms.
现在将元胞状态ϕ与心肌细胞跨膜电位V对应起来.根据临床实验所得的心房肌细胞跨膜电位及心室肌心内膜下肌细胞、中层细胞和心外膜下肌细胞的跨膜电位随时间变化关系[25](图3的实线),将这些曲线每隔10 ms(对应CA模型的一个时步)取一个跨膜电位值,每个离散的跨膜电位值对应一个元胞状态(图3的实心点).图3表明,本文CA模型将正常心房肌的跨膜电位离散为23个元胞状态,且心房肌元胞处于静息态ϕ(x,y,t)=0时的跨膜电位为V=−80 mV,处于激发态ϕ(x,y,t)=1时的跨膜电位为V=56 mV;将心室肌心内膜下肌细胞、中层细胞和心外膜下肌细胞的跨膜电位分别离散为26,27,23个元胞状态,所有心室肌元胞处于静息态ϕ(x,y,t)=0时的跨膜电位都为V=−90 mV,处于激发态ϕ(x,y,t)=1时的跨膜电位都为V=30 mV.因为本文将所有室间隔细胞都作为心室肌心内膜下细胞处理,因此图3没有单独显示室间隔细胞的动作电位离散关系.

图3 正常心肌细胞跨膜电位的离散 (a)心房肌细胞;(b)心室心内膜下肌细胞;(c)心室中层肌细胞;(d)心室心外膜下肌细胞;实线代表实验数据,实心点代表在CA模型中的离散状态Fig.3.Discrete-transmembrane potential diagram of(a)atria cell,(b)endocardial cell,(c)subepicardial cell,and(d)epicardial cel under healthy condition.The lines are the experimental data,and the dots represent the discrete states in CA model.
在数值模拟中,将二维心肌组织分成109916个格点,相邻格点之间水平与竖直方向距离均为单位1,对角方向的距离均为.根据电兴奋在心脏内的传导顺序[26],设计的心电信号传导过程如下:开始时(t=1时步)让右心房窦房结周围细胞胞激发,激发范围见图4(a);激发信号按(1)式沿心房肌传导,并在t=5时步将信号传递给右心房,见图4(b);在t=13时步左右心房除极完成,见图4(c);左右心房除极完成进入复极后,室间隔细胞在t=20时步开始被激发,见图4(d);考虑到浦肯野纤维可以将电信号几乎同时传给各心室肌心内膜下肌细胞的特点[26],在t=22时步让心室肌心内膜下肌细胞同时除极,见图4(e);然后让心室肌中层细胞和心外膜下肌细胞按(1)式先后开始除极,最后才是左、右室的基底部除极,见图4(f).可见,模型中电信号的传递顺序与真实心脏的电兴奋传递顺序一致[26].
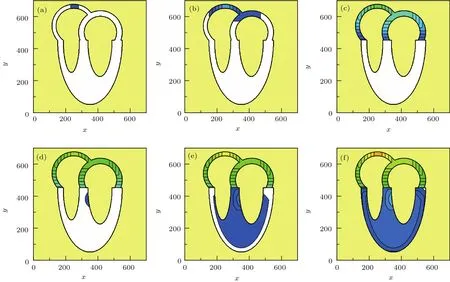
图4 电信号在心脏中的传递过程 (深蓝色显示的是处于激发态的细胞,白色显示的是处于静息态的细胞,黄色是在心肌组织之外的介质,其他颜色表示细胞复极过程的不同状态) (a)t=1时步,窦房结除极;(b)t=5时步,左心房开始除极;(c)t=13时步,心房除极完成;(d)t=20时步,室间隔开始除极;(e)t=22时步,心内膜下肌细胞除极;(f)t=24时步,心室基底部除极Fig.4.The conduction process of electrical signal in the heart:(a)t=1 step,sinoatrial node depolarization;(b)t=5 steps,starting of the left atria depolarization;(c)t=13 steps, fi nishing of the atria depolarization;(d)t=20 steps,starting of the ventricular septum depolarization;(e)t=22 steps, fi nishing of the endocardium depolarization;(f)t=24 steps, fi nishing of the ventricle depolarization.The oxford blue and white represent the excited and the rest state,respectively,and the other colors represent the different states during the repolarization.
在利用CA模型确定每一时步每一个心肌细胞的跨膜电位V的数值后,采用Zhu等[27]提出的公式计算场点电势φ:

式中σin为细胞内液的电导率,设系统内所有细胞内液的电导率相同,σin=1.28 S·m−1[28];S0是一个无量纲的可调参数,取S0=32;N=109916为系统的细胞总数;Vi是系统中第i个细胞的跨膜电位;Vj是系统中第i个细胞的第j个邻居细胞的跨膜电位;σi是系统中第i个细胞到场点之间的平均电导率,模拟时取细胞以外的所有物质的电导率为0.74 S·m−1[28];rj是第i细胞的第j个邻居到场点的距离;若第i个细胞指向其第j个邻居细胞的单位矢量为aij,第i个细胞指向场点的单位矢量为bi,则θij就是aij与bi之间的夹角.这一电势计算式表明,场点电势的产生源自于心肌细胞之间的跨膜电位差异,而非细胞本身的跨膜电位.对于一个固定的场点,如果靠近场点的细胞群的跨膜电位高于远离场点的细胞群的跨膜电位,则场点电势为负值,反之则为正.
3 数值模拟结果
下面研究心肌细胞电活动对场点电势的影响,即心肌细胞电活动与ECG的关系.以(850,150)为场点,此位置相当于心电图机十二导联中V6导联的位置[26].利用所建立的模型并结合(2)式对正常和心肌缺血情况下的ECG进行数值模拟.
3.1 正常心脏电活动下的ECG
图5(a)给出了数值模拟得到的正常情况下场点电势随时间的变化.从图5(a)可以看出,场点电势走势与标准ECG的走势非常符合:在一个心动周期内,场点电势走势包含了P波,QRS波群及T波.有意思的是,在QRS波群结束之后、T波之前还出现了一个上升的波,医学上命名为J波[29].

图5 正常情况下ECG与心肌细胞电活动的关系 (a)场点电势变化曲线;(b)图2中A,B,C,D,E处心肌细胞跨膜电位变化曲线Fig.5.Relationship between cardiac electric activities and ECG under normal condition:(a)The ECG;(b)the transmembrane potentials of cardiac cells at point A,B,C,D,and E de fi ned in Fig.2.
根据(2)式,只有激发态细胞与静息态细胞相邻时,相邻细胞的跨膜电位差才达到最大值,对场点电势贡献才为最大,其他情况下相邻细胞的跨膜电位差都比较小,对场点电势贡献也就较小.基于此,图5(b)给出了不同部位心肌细胞跨膜电位随时间变化的曲线,以便分析图5(a)中各种波的产生机制.各种波的产生机制分析如下.
1)P波产生机制.通过与图1显示的典型心电图比较,可以看出图5(a)中t=9—11时步的波为P波.从图5(b)可以看出,t=9—11时步对应着心房肌细胞除极过程,在这一除极过程中,因为心房壁比较薄、心房肌细胞数量少的缘故,同时处于激发态的细胞数量不多,所以此时整个系统对场点电势贡献小,于是产生的P波幅度较小.
2)Q波产生机制.图5(a)显示,t=21时步的波形为Q波,而图5(b)显示,室间隔除极过程发生于20,21时步,此时靠近场点的室间隔细胞群的跨膜电位高于远离场点的室间隔细胞群的跨膜电位,因此对场点贡献为一个负电势,于是得到向下的Q波.
3)R波产生机制.图5(a)显示t=22时步为R波;而图5(b)显示心内膜下肌细胞在t=22时步除极.由于除极的心内膜下肌细胞数量大且与中层细胞接触多,所以此时对场点电势的贡献非常大,导致R波的幅度非常大.
4)S波产生机制.与图1的典型心电图比较可知,图5(a)中t=24时步的波形为向下的S波;图5(b)显示,在t=24时步,心内膜下肌细胞、中层肌细胞都已进入复极态,但心外膜下肌细胞刚进入除极态,形成心外膜下肌细胞的跨膜电位高于其他两层肌细胞的新局面,导致此时步场点电势为负;又由于虽然心外膜下肌细胞除极后电位为+30 mV,但心内膜下肌细胞和中层细胞的跨膜电位也大于零,所以心外膜下肌细胞的跨膜电位虽然高于另外两层心室肌细胞,但幅度相差并不是很大,因此S波的波幅比较小.
5)J波产生机制.尤其值得注意的是图5(a)中的J波,即第27时步的小波形.在图5(b)中,第27时步时三层心室肌的细胞均已进入复极态,但由于心外膜下肌细胞的跨膜电位存在一个小波谷,导致此时其跨膜电位略低于心内膜下肌细胞和中层细胞,从而对场点贡献了一个较小的正电势,即形成了J波.可见J波的产生根源是心外膜下肌细胞跨膜电位小波谷的存在.这样的小波谷只存在于少部分人的心外膜下肌细胞中,J波在正常ECG中出现的概率只占1%—25%[29].正因为本文的CA模型体现了心外膜下肌细胞动作电位的小波谷,才能仿真出ECG中极少出现的J波,这是前面的工作所未能实现的[23].
6)T波产生机制.根据典型心电图中T波的定义,图5(a)中t=38—48时步的波形为T波.图5(b)显示,t=38—48时步属于心室复极期间,在此期间三层心室肌细胞的跨膜电位分离且出现V中层>V心内膜>V心外膜的关系,导致心室肌中层肌细胞与心外膜下肌细胞的跨膜电位梯度对场点贡献一个正的电势,同时中层肌细胞与心内膜下肌细胞的跨膜电位梯度对场点贡献一个负的电势.从图5(b)可以看出在t=38—48时步期间心室肌中层肌细胞与心外膜下肌细胞的跨膜电位梯度要大于中层肌与心内膜下肌细胞的跨膜电位梯度,所以对场点贡献一个净值为正的电势,于是得到的T波为一个向上的波形.
3.2 心室肌缺血情形下的ECG
一些外源性因素会导致心肌缺血,缺血细胞表现为动作电位时程缩短和静息电位抬高[30].根据缺血位置的不同,临床医学上划分了三种类型的心肌缺血:心内膜下肌细胞缺血、心外膜下肌细胞缺血和透壁缺血.本文采用所建立的CA模型对三种缺血情形下的场点电势进行数值模拟,并分析其波形走势的形成机制.
3.2.1 心室肌心内膜下肌层缺血的ECG仿真及形成机制分析
为模拟心室肌心内膜下肌细胞缺血的情况,令所有心内膜下肌层细胞的状态数由正常情形下的26个减少为20个、静息态跨膜电位由正常情形下的−90 mV提高为−80 mV,同时保持心室肌中层肌和心外膜下肌层的细胞为正常状态.数值模拟得到心内膜下肌细胞缺血情况下场点电势走势如图6(a)所示.
从图6(a)可以看出:心室肌心内膜下肌细胞缺血会导致T波倒置.通过心内膜下肌细胞缺血情形下心室肌不同层细胞之间跨膜电位关系分析此现象的产生机制,见图6(b).由于心房细胞跨膜电位不影响心室肌缺血下的电势走势,因此为清晰起见,图6(b)不显示心房细胞的跨膜电位,后面的图中做类似处理.从图6(b)可以看出,心室肌心内膜下肌细胞发生缺血后,其动作电位时程缩短,导致其复极完成的时间远早于心外膜下肌细胞和中层肌细胞,因此在三层细胞完成除极后的跨膜电位线分离的期间,心室肌心内膜下肌细胞跨膜电位都明显低于心外膜下肌细胞和中层细胞,虽然心室肌中层肌细胞和心外膜下肌细胞之间的跨膜电位梯度仍会在场点产生与正常情况相同的正电势,但心室肌中层肌细胞和心内膜下肌细胞的电势梯度会产生一个幅度更大的负电势,两者产生的电势之和为负,从而导致了T波倒置.这一结果与实验上发现的现象是一致的[31].
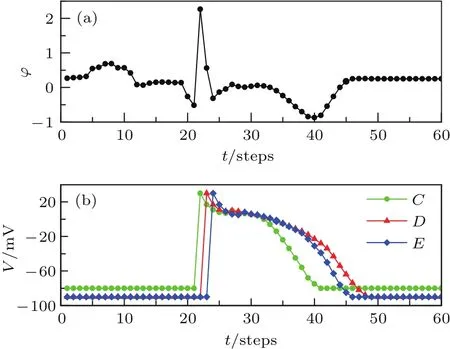
图6 心内膜下肌细胞缺血时ECG与心肌细胞电活动的关系 (a)场点电势变化曲线;(b)图2中C,D,E处心肌细胞跨膜电位变化曲线Fig.6.The relationship between cardiac electric activities and ECG under endocardium ischemia:(a)The ECG;(b)the transmembrane potentials of cardiac cells at point C,D,and E de fi ned in Fig.2.
3.2.2 心室肌心外膜下肌层缺血的ECG仿真及形成机制分析
为模拟心室肌心外膜下肌细胞缺血的情况,令所有心室肌心外膜下肌细胞的状态数由正常情形下的23个减少为17个、静息态跨膜电位由正常情形下的−90 mV提高为−80 mV,同时保持心室肌中层肌和心内膜下肌层的细胞保持为正常状态.数值模拟所得的场点电势走势见图7(a).
从图7(a)可以看出,心室肌心外膜下肌细胞缺血时,T波保持正立但波峰更加高耸.通过心外膜下肌细胞缺血情形下心室肌不同层的细胞之间跨膜电位关系来分析此现象的产生机制,见图7(b).从图7(b)可以看出,心室肌心外膜下肌细胞缺血时,心室肌心外膜下肌层缺血细胞动作电位时程缩短使得其复极大大提前,导致心室肌中层肌与心外膜细胞的跨膜电位梯度变大,因此对场点贡献一个数值更大的正电势,从而使得T波不仅保持正立,而且波峰更加高耸.以上的分析能够用于解释Roger等[32]在实验上发现的心室肌心外膜下肌层缺血情况下T波的改变现象.
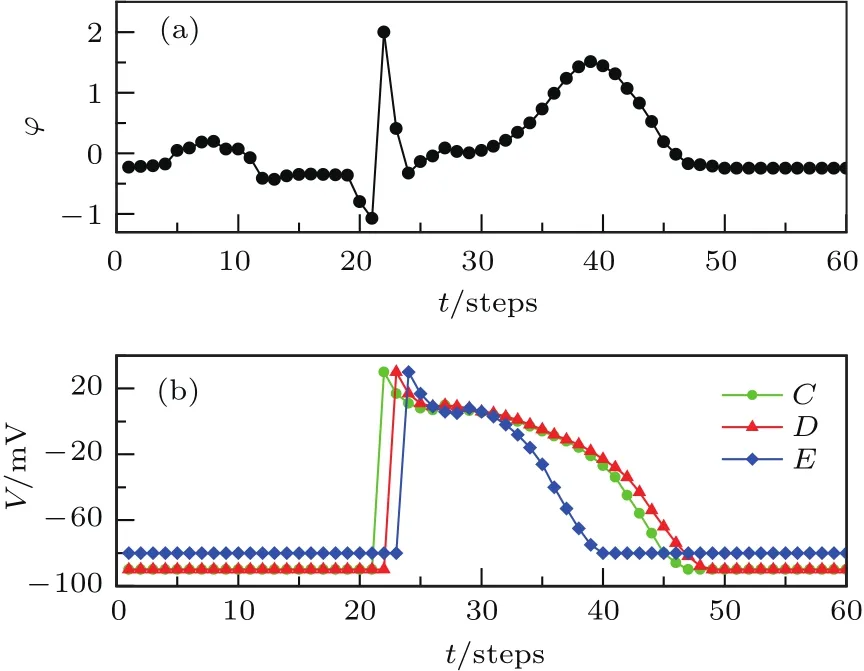
图7 心外膜下肌层缺血时ECG与心肌细胞电活动的关系 (a)场点电势变化曲线;(b)图2中C,D,E处心肌细胞跨膜电位变化曲线Fig.7.The relationship between cardiac electric activities and ECG under epicardium ischemia:(a)The ECG;(b)the transmembrane potentials of cardiac cells at point C,D,and E de fi ned in Fig.2.
3.2.3 透壁缺血情形下的ECG仿真及形成机制分析
透壁缺血也称全局缺血,即整个心室肌组织细胞全部缺血.透壁缺血时,心室肌三层细胞的动作电位都缩短,但动作电位时程关系仍满足APD中层>APD心内膜>APD心外膜.为模拟心室肌透壁缺血的情况,令心室肌心内膜下肌层、中层肌、心外膜下肌层细胞状态数分别由26,27,23减小为20,21,17,静息态跨膜电位都由正常情形下的−90 mV提高为−80 mV.数值模拟所得的场点电势走势见图8(a).

图8 透壁缺血时ECG与心肌细胞电活动的关系 (a)场点电势变化曲线;(b)图2中C,D,E处心肌细胞跨膜电位变化曲线Fig.8.The relationship between cardiac electric activities and ECG under transmural ischemia:(a)The ECG;(b)the transmembrane potentials of cardiac cells at point C,D,and E de fi ned in Fig.2.
临床结果表明,当心脏发生透壁缺血时,ECG的QT间期缩短,T波提前出现[33].本文数值模拟所得透壁缺血下ECG(图8(a))表明,当发生透壁缺血时,T波确实比正常情况下出现得更早,且QT长度明显缩短.可以通过图8(b)所显示的透壁缺血情况下心室肌三层细胞跨膜电位变化曲线解释以上现象:由于发生透壁缺血时所有心室肌细胞的动作电位都缩短,因此心室肌三层细胞的动作电位提前分离,于是T波提前形成.因为透壁缺血不会影响Q波的出现时间,所以T波的提前出现当然也就缩短了Q波与T波之间的时长,从而导致QT间期缩短.
4 结 论
构建了心电图的二维CA模型,该模型不仅考虑了不同层次心室细胞的动作电位差异,更包含了心脏的左右心房、左右心室、房室腔和室间隔.利用该模型,数值模拟研究了正常情况和三种缺血情况下心肌细胞电活动对场点电势走势的影响.数值模拟结果表明:1)正常情况下,场点电势走势呈现出与经典ECG一致的波形,即存在P波、QRS波群和T波,有趣的是还出现了少见的J波;心肌细胞的跨膜电位变化关系表明,P波产生于心房除极,Q波源自室间隔除极,R波出现于心室除极,S波标志着心室除极结束,T波为心室复极波,J波则是由于心外膜下肌细胞的跨膜电位存在一个小波谷而导致;2)心内膜下肌细胞缺血时电势走势呈现T波倒置现象,其原因是缺血心内膜下肌细胞的动作电位时程大大缩短,导致心内膜下肌细胞与相邻的中层细胞之间的电位差异在场点贡献较大的负电势;3)心外膜下肌细胞缺血时电势走势的T波波峰变得更加高耸,原因则是心室肌心外膜下肌细胞缺血时动作电位时程的缩短导致其复极大大提前,于是心外膜下肌细胞与心室肌中层肌细胞之间的跨膜电位梯度增大,此电势梯度对场点贡献一个数值更大的正电势,从而使得T波更加高耸;4)透壁缺血时,T波提前出现,是因为透壁缺血时所有心室肌细胞的动作电位都缩短,因此心室肌三层细胞的动作电位提前分离,于是T波提前形成.以上数值模拟结果与临床及实验结果定性一致,表明本文所建立的二维心脏模型不仅能反映电信号的传递,还能在细胞水平上探讨心肌电活动对ECG的影响,可为进一步采用数值模拟方法探讨心血管疾病与ECG关系提供参考.
[1]Yang X L,Liu G Z,Tong Y H,Yan H,Xu Z,Chen Q,Liu X,Zhang H H,Wang H B,Tan S H 2015J.Geriatr.Cardiol.12 448
[2]Singh R,Murphy J J 2015Anaesthesia and Intensive Care Medicine16 220
[3]Khalid U,Birnbaum Y 2016Ann.Noninvas.Electr.21 202
[4]Namana V,Patel J,Tripathi N,Mathur P 2016QJMInt.J.Med.109 559
[5]Hwang C,Levis J T 2014Perm.J.18 e133
[6]Andersson H B,Hansen M B,Thorsberger M,Sørensen T B,Nielsen J B,Gra ffC,Pehrson S,Svendsen J H 2015J.Electrocardiol.48 834
[7]Atienza F A,Carrión J R,Alberola A G,Alvarez J R,Muñoz J J S,Sánchez J M,Chávarri M V 2005Rev.Esp.Cardiol.58 41
[8]Yuan G Y,Zhang H,Wang G R 2013Acta Phys.Sin.62 160502(in Chinese)[袁国勇,张焕,王光瑞 2012物理学报61 160502]
[9]Liu G Q,Ying H P 2014Chin.Phys.B23 050502
[10]He D H,Hu G,Zhan M,Ren W,Gao Z 2002Phys.Rev.E65 055204
[11]Zhang H,Chen J X,Li Y Q,Xu J R 2006J.Chem.Phys.125 204503
[12]Liu G Q,Ying H P,Luo H L,Liu X X,Yang J H 2016Int.J.Bifurcat.Chaos26 1650236
[13]Chen J X,Mao J W,Hu B B,Xu J R,He Y F,Li Y,Yuan X P 2009Phys.Rev.E79 066209
[14]Wang C N,Ma J 2013Acta Phys.Sin.62 084501(in Chinese)[王春妮,马军 2013物理学报62 084501]
[15]Chen J X,Peng L,Ma J,Ying H P 2014Europhys.Lett.107 38001
[16]Trudel M C,Dubé B,Potse M,Gulrajani R M,Leon L J 2004IEEE Trans.Bio-med.Eng.51 1319
[17]Aslanidi O V,Clayton R H,Lambert J L,Holden A V 2005J.Theor.Biol.237 369
[18]Schenone E,Collin A,Gerbeau J F 2016Int.J.Numer.Meth.Bio.32 1
[19]Wolfram S 1984Nature311 419
[20]Moe G K,Rheinboldt W C,Abildskov J A 1964Am.Heart J.67 200
[21]Bollacker K D,Simpson E V,Johnson G A,Walcott G P 199113th Annual International Conference of the IEEE Engineering in Medicine and Biology SocietyOrlando,Florida,USA,October 31–November 3,1991 p627
[22]Makowiec D 2010Int.J.Mod.Phys.C21 107
[23]Deng M Y,Dai J Y,Zhang X L 2015Chin.Phys.B24 142
[24]Drouin E,Charpentier F,Gauthier C,Laurent K,Le M H 1995J.Am.Coll.Cardiol.26 185
[25]Antzelevitch C 2001Cardiovasc.Res.50 426
[26]Yu C G,Bai R,Chen D L,Huang Y 2008Cardiac Electrophysiology Foundation and Clinic(Wuhan:Huazhong University of Science&Technology Press)p168(in Chinese)[余承高,白融,陈栋梁,黄勇 2008心脏电生理学基础与临床(武汉:华中科技大学出版社)第168页]
[27]Zhu H,Sun Y,Rajagopal G,Mondry A,Dhar P 2004Biomed.Eng.Online3 29
[28]Tinniswood A D,Furse C M,Gandhi O P 1998Phys.Med.Biol.43 2361
[29]Hlaing T,DiMino T,Kowey P R,Yan G X 2005Ann.Noninvas.Electro.10 211
[30]Yan G X,Joshi A,Guo D L,Hlaing T,Martin J,Xu X P,Kowey P R 2004Circulation110 1036
[31]Di Diego J M,Antzelevitch C 2014J.Electrocardiol.47 486
[32]Holland R P,Brooks H 1977Am.J.Cardiol.40 110
[33]Zhao S Y,Wang D W,Shen Y,Li L,Zhang H 2008J.Clin.Exp.Med.7 89(in Chinese)[赵淑艳,王道伟,沈毅,李莉,张红2008临床和实验医学杂志7 89]
A cellular automaton model for electrocardiogram considering the structure of heart∗
Zhang Xue-Liang Tan Hui-LiTang Guo-Ning Deng Min-Yi†
(College of Physical Science and Technology,Guangxi Normal University,Guilin 541004,China)
9 April 2017;revised manuscript
10 July 2017)
The electrocardiogram(ECG)has broad applications in clinical diagnosis and prognosis of cardiovascular diseases.The accurate description for the question how the ECG come from the cardiac electrical activity is helpful for understanding the corresponding relation between the ECG waveform and cardiovascular disease.Experience is the primary method of studying the ECG,but the computer simulation method makes it more convenient to explore the e ff ect of given factor for ECG waveform.Cellular automaton is a simple and e ff ective computer simulation method.However,the cellular automaton model considering the main structure of the heart is not yet established.Therefore,we propose a cellular automaton model for the ECG considering the atria,the ventricle,and the ventricular septum.With this model,the conduction of the myocardial electrical activation is simulated by following the fi eld potentials under healthy and diseased conditions,and the underlying mechanisms are analyzed.Through the computer simulations and analyses the results are obtained as follows.First,the conduction process of the electrical signal in this model is the same as that in the real heart.Second,under the healthy conditions,the behavior of the fi eld potential appears as normal ECG,in which the P wave and the QRS wave group come from the depolarization of the atria and ventricle,respectively,on the other hand,the T wave and J wave come from the repolarization of the ventricle.The computer results support the conclusion that the J wave appears just because the existence of the notch in the epicardial transmembrane potential curve.Third,the endocardium ischemia conditions result in the T wave inversion.The mechanism is that the action potential duration of the ischemic endocardial cells is shorter than that under normal conditions,which makes larger the transmembrane potential gradient between the endocardium and the subepicardium,and then contributes a more negative value to the fi eld potential.Fourth,the epicardium ischemia leads to the higher T wave,and this is because the shorter action potential duration of the ischemic epicardial cells brings in a larger transmembrane potential gradient between the epicardium and subepicardium,which makes the fi eld voltage larger.Fifth,the T wave appears earlier under the through-wall ischemia.The action potential durations of cells of the endocardium,the epicardium,and the subepicardium all become shorter under the through-wall ischemia,then the repolarization processes of all of these three walls are ended earlier,which leads to the earlier T wave.The cellular automaton model proposed in this paper provides a reference for the further study of ECG.
cellular automaton,transmembrane potential,electrocardiogram,ischemia
(2017年4月9日收到;2017年7月10日收到修改稿)
10.7498/aps.66.200501
∗国家自然科学基金(批准号:11365003,11565005,11647309)资助的课题.
†通信作者.E-mail:dengminyi@mailbox.gxnu.edu.cn
©2017中国物理学会Chinese Physical Society
http://wulixb.iphy.ac.cn
PACS:05.45.–a,87.18.HfDOI:10.7498/aps.66.200501
*Project supported by the National Natural Science Foundation of China(Grant Nos.11365003,11565005,11647309).
†Corresponding author.E-mail:dengminyi@mailbox.gxnu.edu.cn
