芦荟提取物对脂多糖诱导的人牙周膜细胞炎性反应的抑制作用
2017-11-11张双高鹰李黎仙杜俊蓉
张双 高鹰 李黎仙 杜俊蓉
芦荟提取物对脂多糖诱导的人牙周膜细胞炎性反应的抑制作用
张双 高鹰 李黎仙 杜俊蓉
目的探讨芦荟(AVE)提取物对脂多糖(LPS)诱导人牙周膜细胞(hPDLCs)炎性反应的作用。方法将hPDLCs分为对照组,模型组(1 μg/ml LPS)和AVE组,浓度为0.05,0.1, 0.2 mg/ml的AVE分别处理AVE组的hPDLCs; MTT法测定各组细胞存活率; ELISA法检测细胞上清中IL-6含量;用免疫细胞化学染色检测TLR4的表达情况;免疫荧光染色检测NF-κB-p65的核转情况。结果各组细胞存活率差异没有显著性,模型组上清液中的IL-6含量显著升高, TLR4表达及 NF-κB-p65的核转均明显上调;与模型组相比,芦荟提取物呈剂量依赖性抑制细胞上清液中IL-6的分泌,下调TLR4表达及NF-κB-p65的核转移。结论芦荟提取物能有效抑制人牙周膜细胞的炎症反应,其机制与TLR4/NF-κB-p65信号通路有关。
芦荟提取物(AVE); 人牙周膜细胞(hPDLCs); 脂多糖(LPS)
牙周炎是细菌引起的慢性炎症,往往引发牙周支持组织的炎性破坏。人牙周膜细胞(human periodontal ligament cells,hPDLCs)免疫应答是牙周组织结构完整或者破坏的重要决定因素[1]。牙周炎主要是由革兰氏阴性菌引起的[2-3],而脂多糖(Lipopolysaccharides,LPS)是革兰氏阴性菌外膜的主要成分。Toll 样受体(Toll like receptors, TLRs)是一类天然免疫受体,TLR4是其主要成员之一,研究表明hPDLCs被 LPS 刺激后,经一系列信号转导,激活细胞核转录因子κB(nuclear factor-kappa B,NF-κB)从而调节各种炎症因子的表达[4],参与牙周组织破坏。因此如何调控hPDLCs炎症反应的发生,对牙周炎的防治具有重要意义。
芦荟为百合科芦荟属多年生肉质草本植物,集食用、药用、美容、观赏于一身。文献报道,该植物具有抗炎、促进伤口愈合、增强免疫功能、降血糖等多种药理活性[5-6]。目前,芦荟提取物对牙周炎的防治作用鲜有报道,本研究从细胞水平探讨芦荟提取物对LPS诱 导下的hPDLCs炎症的抑制作用并探讨其作用机制。
1 材料与方法
1.1 细胞与药物来源
1.2 主要仪器与试剂
LPS(E.coliO55:B5,Sigma,美国);IL-6 Elisa试剂盒(北京达科为生物技术有限公司);α-MEM培养基(Hyclone,美国);胎牛血清(民海生物);DMSO,MTT(Amresco,美国);兔抗TLR4单克隆抗体、羊抗兔FITC、抗荧光衰减封片剂、4, 6-联脒-2-苯基吲哚(DAPI)染色剂、SABC试剂盒、DAB显色试剂盒(武汉博士德生物技术有限公司);羊抗兔NF-κB p65单克隆抗体(北京中杉金桥生物技术有限公司);倒置式生物显微镜(重庆奥特光学仪器有限公司);酶标仪(Bio-RAD Model 550,美国);显微镜及照片获取系统(Olympus,日本)。
1.3 细胞培养
将冻存的hPDLCs复苏,用含10%胎牛血清和1%青霉素、1%链霉素的α-MEM培养基,在37 ℃、5%CO2孵箱中进行培养, 1∶3比例进行传代,选取4~6 代细胞用于实验。
1.4 实验分组
实验分为5组,包括对照组,模型组(1 μg/ml LPS),芦荟提取物低剂量组(0.05 mg/ml),中剂量组(0.1 mg/ml),高剂量组(0.2 mg/ml)。
1.5 MTT法检测细胞活性
从DDoS攻击的发展历程,我们不难看出,在如今这个虚拟网络已经嵌入我们现实生活的社会里,DDoS攻击无疑是一个巨大的安全隐患。伴随着DDoS工具的廉价性、易获取性,以及各僵尸网络家族的快速增长,利用物联网设备组建僵尸网络发起攻击的现象日益严峻,与此同时,移动端的僵尸网络亦处于萌芽阶段,网络安全之路可谓任重道远。
将对数生长期的hPDLCs(1×105/ml) 接种于96 孔板,于37 ℃、 5% CO2培养箱中培养24 h,按各组浓度进行造模或给药,每组3 个复孔,继续培养24 h后,每孔加入10 μl 5 mg/ml MTT,继续培养4 h,弃上清,每孔加入150 μl DMSO,常温下摇床摇10 min,在酶标仪490 nm 波长测吸光度值,取3 孔平均值,计算细胞存活率(实验组A490/空白组A490×100%)。重复3 次。
1.6 ELISA法检测IL-6的含量
将对数生长期的hPDLCs(1×105/ml) 接种于96 孔板,于37 ℃、 5% CO2培养箱中培养24 h,按照各组浓度预防给药1 h, 1 μg/ml LPS造模作用24 h, 每组9 个复孔,收集培养上清,根据Elisa试剂盒说明书测定细胞上清液中IL-6含量。
1.7 免疫染色法测定TLR4的表达
将对数生长期的hPDLCs(3×104/ml) 接种24 孔板爬片,于37 ℃、5% CO2培养箱中培养24 h,取对照组、模型组、高剂量组,预防给药1 h,每组3 个复孔,1 μg/ml LPS造模作用24 h后,SABC免疫细胞染色法进行DAB染色,苏木素染核,脱水透明后,中性树脂封片,光学显微镜下观察TLR4表达情况。
1.8 免疫荧光染色法检测NF-κB-p65的核转状况
将对数生长期的hPDLCs(3×104/ml)接种24 孔板爬片,于37 ℃、 5% CO2培养箱中培养24 h,取高剂量组预防给药1 h。 1 μg/ml LPS造模1 h后, PBS清洗,4%多聚甲醛固定30 min, PBS洗3 次,1 min/次,0.3% Triton X-100打孔30 min,PBS漂洗3 次, 1 min/次,3% H2O230 min氧化内源性过氧化物酶, PBS洗3 次,1 min/次,5% 牛血清 37 ℃封闭1 h,一抗(1∶50)4 ℃过夜,PBS洗3 次,荧光二抗37 ℃避光孵育1 h, DAPI染核1 min,抗荧光衰减封片剂封片,荧光显微镜下观察NF-κB-p65的表达情况。每组3 个复孔。
1.9 统计学分析
2 结 果
2.1 芦荟提取物对hPDLCs细胞活性的影响
与对照组比较,模型组、芦荟提取物低、中、高剂量组中细胞活力无显著差异(P>0.05, 表 1)。

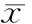

注: 与对照组比较, ①P>0.05
2.2 芦荟提取物对细胞上清液中IL-6 含量的影响
与正常组比较,模型组中IL-6含量显著提高(P<0.05)。与模型组比较,芦荟提取物低、中、高剂量组hPDLCs细胞上清中IL-6 含量均显著下降(P<0.05),并且呈剂量依赖性(表 2)。

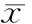

注: 与模型组比较, ①P<0.01, ②P<0.05
2.3 芦荟提取物对LPS诱导的hPDLCs中TLR4蛋白的影响
与对照组相比,模型组的TLR4阳性表达明显上调。与模型组相比,芦荟提取物高剂量组TLR4阳性表达颜色明显变浅,表达下调(图 1)。
2.4 芦荟提取物对NF-κB-p65的作用
对照组NF-κB-p65基本分布在胞浆中,模型组NF-κB-p65核转明显增多,芦荟提取物高剂量组NF-κB-p65的核转明显减少(图 2)。
3 讨 论
牙周炎是常见的口腔感染性疾病,已成为突出的口腔保健问题。 据报道, 芦荟具有抗炎作用[5], 本研究就芦荟提取物对LPS诱导hPDLCs炎症的抑制效果进行了探讨。研究结果表明,芦荟提取物能够抑制LPS诱导hPDLCs分泌IL-6,其抗炎机制可能与抑制TLR-4介导的NF-κB信号通路有关,提示芦荟提取物可能是牙周疾病预防与治疗的有效药物。

A: 对照组; B: 模型组; C: 高剂量组
图 1 芦荟提取物对牙周膜细胞TLR4表达的影响 (×200)
A: Control group; B: Model group; C: AVE of 0.2 mg/ml
Fig 1 The effects of AVE on TLR4 expression in LPS-induced hPDLCs (×200)

图 2 芦荟提取物对LPS诱导牙周膜细胞NF-κB-p65核内转的作用 (×400)
Fig 2 The effects of AVE on the transfer of NF-κB-p65 into the nucleus in LPS-induced hPDLCs (×400)
hPDLCs在牙周炎的发生及发展过程中发挥着重要作用[1]。牙周炎的主要致炎因子LPS能促进如IL-6、TNF-α等炎症因子的表达,参与牙周组织的破坏。因此,抑制炎症因子的产生有益于减缓牙周疾病的发展进程[7]。IL-6具有多种生物学效应,在牙周疾病中参与局部炎症反应及牙周组织的破坏。研究表明,IL-6不仅在牙周组织中能够诱导破骨细胞的生成[8],还与牙周袋的深度密切相关[9]。牙周炎患者龈沟液中IL-6的含量显著高于健康人龈沟液中IL-6的含量,表明IL-6在某种程度上是牙周炎的严重程度的重要标志[10]。本研究中,芦荟提取物对LPS诱导hPDLCs分泌IL-6有明显的抑制作用,并呈剂量依赖性。这些结果提示,芦荟提取物对LPS诱导的hPDLCs的炎症反应有较好的抗炎效果。
TLR4是LPS的主要受体,二者结合后,通过相关信号转导激活NF-κB,从而诱发一系列炎症因子如IL-1β、IL-6等的产生[3]。正常状态下,NF-κB-p65在胞浆中与 NF-κB 抑制蛋白(Inhibitor of NF-κB,IκB)相结合[11],处于非活化状态。在LPS刺激下,TLR4与髓样分化因子88结合,活化后的髓样分化因子88使得IL-1受体相关激酶发生一系列磷酸化反应[12],IκB 磷酸化后,与NF-κB-p65形成的蛋白复合体解离,游离的 NF-κB-p65 进入细胞核,与相关位点的DNA链结合,从而发挥其调节转录功能[13-14],调节多种炎症介质和细胞因子的表达,引起一系列炎症因子产生,促进牙周病的发生和发展。本实验探究了芦荟提取物对LPS诱导下hPDLCs中TLR4及NF-κB-p65的影响,结果显示库拉索芦荟凝胶冻干粉能够抑制LPS诱导的TLR4蛋白的表达以及NF-κB-p65的核转,进而抑制下游靶基因IL-6的生成。
综上所述,本研究选用的芦荟提取物对LPS诱导的hPDLCs炎症反应有一定抑制效应,其机制可能与抑制TLR4/NF-κB通路有关。但值得注意的是,在本课题组同步进行的LPS诱导人牙龈成纤维细胞炎症反应研究中,芦荟提取物并没有抗炎活性(组内结果)。为何库拉索芦荟凝胶冻干粉对hPDLCs和人牙龈成纤维细胞炎症反应的影响有明显差异,值得进一步深入研究以阐明其药理学机制,为芦荟提取物在口腔保健产品中的合理应用提供可靠的实验依据。
[1] Wu X, Zhang G, Wang X, et al. Endotoxin tolerance induction in human periodontal ligament fibroblasts stimulated with different bacterial lipopolysaccharides[J]. Arch Oral Biol, 2015, 60(3): 463-470.
[2] Sun Y, Shu R, Li CL, et al. Gram-negative periodontal bacteria induce the activation of toll-like receptors 2 and 4, and cytokine production in human periodontal ligament cells[J]. J Periodontol, 2010, 81(10): 1488-1496.
[3] Padilla C, Lobos O, Hubert E, et al. Periodontal pathogens in atheromatous plaques isolated from patients with chronic periodontitis[J]. J Periodontal Res, 2006, 41(4): 350-353.
[4] Herath TD, Darveau RP, Seneviratne CJ, et al. Tetra- and penta-acylated lipid A structures ofPorphyromonasgingivalisLPS differentially activate TLR4-mediated NF-κB signal transduction cascade and immuno-inflammatory response in human gingival fibroblasts[J]. PLoS One, 2013, 8(3): e58496.
[5] Davis RH, Rosenthal KY, Cesario LR, et al. Processed Aloe vera administered topically inhibits inflammation[J]. J Am Podiatr Med Assoc, 1989, 79(8): 395-397.
[6] Pradeep AR, Garg V, Raju A, et al. Adjunctive local delivery of aloe vera gel in patients with type 2 diabetes and chronic periodontitis: A randomized, controlled clinical trial[J]. J Periodontol, 2016, 87(3): 268-274.
[7] Wei C, Tan CK, Xiaoping H, et al. Acanthoic acid inhibits LPS-Induced inflammatory response in human gingival fibroblasts[J]. Inflammation, 2015, 38(2): 896-901.
[8] Bakker AD, Kulkarni RN, Klein-Nulend J, et al. IL-6 alters osteocyte signaling toward osteoblasts but not osteoclasts[J]. J Dent Res, 2014, 93(4): 394-399.
[9] Geivelis M, Turner DW, Pederson ED, et al. Measurements of interleukin-6 in gingival crevicular fluid from adults with destructive periodontal disease[J]. J Periodontol, 1993, 64(10): 980-983.
[10]Zhang Q, Chen B, Zhu D, et al. Biomarker levels in gingival crevicular fluid of subjects with different periodontal conditions: A cross-sectional study[J]. Arch Oral Biol, 2016, 72: 92-98.
[11]Gloire G, Legrand-Poels S, Piette J. NF-kappaB activation by reactive oxygen species: Fifteen years later[J]. Biochem Pharmacol, 2006, 72(11): 1493-1505.
[12]Roy A, Srivastava M, Saqib U, et al. Potential therapeutic targets for inflammation in toll-like receptor 4(TLR4)-mediated signaling pathways[J]. Int Immunopharmacol, 2016, 40: 79-89.
[13]Oeckinghaus A, Ghosh S. The NF-kappaB family of transcription factors and its regulation[J]. Cold Spring Harb Perspect Biol, 2009, 1(4): a000034.
[14]Gutiérrez-Venegas G, Contreras-Sánchez A. Luteolin and fisetin inhibit the effects of lipopolysaccharide obtained fromPorphyromonasgingivalisin human gingival fibroblasts[J]. Mol Biol Rep, 2013, 40(1): 477-485.
Theinhibitoryeffectsofaloeveraextractonlipopolysaccharide-inducedinflammatoryresponseinhumanperiodontalligamentcells
ZHANGShuang1,GAOYing2,LILixian2,DUJunrong1.
1. 610041Chengdu,DepartmentofPharmacology,WestChinaCollegeofPharmacy,SichuanUniversity,China; 2.YunnanBaiyaoGroupCo.,Ltd,Kunming
Objective: To explore the effects of aloe vera extra(AVE) on lipopolysaccharide(LPS)-induced inflammatory response of human periodontal ligament cells(hPDLCs).MethodshPDLCs were induced with LPS at 1 μg/ml for the simulation of periodontitis model(model group) and then treated by AVE at 0.05, 0.1, 0.2 mg/ml respectively(AVE group). Cell viability was examined by MTT assay. The level of interleukin-6(IL-6) from cell culture medium was measured by ELISA. The expression of Toll like receptor 4(TLR4) protein was detected by immunocytochemistry staining and the transfer of nuclear factor-kappa B p65(NF-κB-p65) was observed by immunofluorescence staining.ResultsThere was no significant difference of the cell viabilities among the groups. IL-6 in culture medium, the expression of TLR4 protein and the transfer of NF-κB-p65 into the nucleus were increased in model group. AVE at 0.05-0.2 mg/ml inhibited the secretion of IL-6 in the cell culture supernatant down-regulated the TLR4 expression, attenuated the transfer of NF-κB-p65 into the nucleus in a concentration-dependent manner.ConclusionAloe vera extract can inhibit the inflammation response of hPDLCs induced by LPS through TLR4/ NF-κB-p65 signaling pathway.
Aloeveraextract(AVE);Humanperiodontalligamentcells(hPDLCs);Lipopolysaccharide(LPS)
610041, 四川大学华西药学院药理学系(张双 杜俊蓉); 云南白药集团股份有限公司(高鹰 李黎仙 )
杜俊蓉 E-mail: dujr_1@163.com
R781.4
A
10.3969/j.issn.1001-3733.2017.04.020
(收稿: 2016-10-18 修回: 2016-12-19)
