糖尿病型牙周炎牙龈组织中炎症因子表达及与细胞凋亡关系
2017-11-11陈铁楼张新海徐尔理唐大海赵海军徐逸敏张晓莉栾玮刘进陈骏马丽婷
陈铁楼 张新海 徐尔理 唐大海 赵海军 徐逸敏 张晓莉 栾玮 刘进 陈骏 马丽婷
糖尿病型牙周炎牙龈组织中炎症因子表达及与细胞凋亡关系
陈铁楼 张新海 徐尔理 唐大海 赵海军 徐逸敏 张晓莉 栾玮 刘进 陈骏 马丽婷
目的探讨糖尿病型牙周炎(diabetes associated periodontitis,DAP)牙龈组织中凋亡细胞发生及与IL-1β和TNFα表达的关系。方法纳入DAP患者和健康龈(H)受试者各20 例,用HE染色和Tunnel法观察牙龈细胞凋亡,透射电镜观察凋亡细胞超微结构;用免疫组化(IHC)检测牙龈组织炎症因子IL-1β和TNFα表达。结果DAP组牙龈上皮棘细胞层和基底细胞层见明显细胞凋亡,固有层凋亡细胞较少;DAP组牙龈上皮棘细胞和基底细胞凋亡百分率高于H 组(P<0.01);IHC染色发现DAP组IL-1β和TNFα表达明显高于H组,主要阳性表达细胞为巨噬细胞、浆细胞和淋巴细胞。结论DAP患者牙龈组织中IL-1β和TNFα在细胞凋亡中起重要作用。
细胞凋亡; 糖尿病型牙周炎(DAP); 炎症因子; 机制
糖尿病型牙周炎(diabetes associated periodontitis,DAP)可因血糖升高和糖耐量降低引起机体对牙周局部刺激因子抵抗力降低,出现牙龈炎症、牙槽骨吸收和组织愈合缓慢[1]。糖尿病患者发生牙周炎危险性比非糖尿病者高2.8~3.4 倍[2]。研究发现,在糖尿病高糖状态时可影响牙周炎凋亡相关蛋白表达,并可通过调节凋亡相关蛋白表达促进胰岛细胞凋亡和胰岛分泌功能,影响牙周炎发生和发展,老年患者牙周炎牙龈组织中凋亡细胞增加[3]。白细胞介素1β(IL-1β)可刺激人牙周韧带细胞中胶原酶合成,诱导基质金属蛋白酶13(MMP-13)表达,调控人成骨细胞扩增和凋亡,MMP-13在牙周组织愈合和牙槽骨再生中起一定作用[4]。本文通过对DAP龈组织中IL-1β和TNFα分泌细胞、含量及与细胞凋亡和临床指标关系分析,以探讨IL-1β和TNFα与DAP牙龈细胞凋亡关系。
1 材料与方法
1.1 病例选择
DAP组20 例,年龄55~76 岁,平均69.5 岁,男11 例,女9 例,要求患者附着丧失(attachment loss,AL)大于5 mm,牙槽骨吸收大于根长1/2;患者空腹血糖7.0 mmol/L,口服葡萄糖耐量2 h≥11.1 mmol/L[5];健康组(H组)20 例,年龄13~18 岁,平均15.2 岁,男12 例,女8 例,AL为0,为正畸拔除牙。受检者无心血管疾病及遗传病,就诊前6 月内未做牙周治疗,3 个月内未用抗生素及免疫抑制剂,妇女未妊娠。
1.2 主要试剂
兔抗IL-1β抗体和TNFα抗体(南京凯基生物科技有限公司),免疫组化(IHC)SABC试剂盒(武汉博士德生物工程有限公司),DAB显色剂(北京中杉金桥生物技术有限公司)。
1.3 样本采集
拔牙时,腭侧取牙龈组织,一部分立即放入4%甲醛固定作HE染色、Tunul染色和IHC染色;另一部分用4%多聚甲醛固定制作电镜标本。
1.4 指标测定
1.4.1 临床指标测定 拔牙前测定SBI,GI,刻度探针测定PD和AL。
1.4.2 HE染色和TUNNEL染色法检测凋亡细胞
取经4%甲醛固定24 h牙龈组织,石蜡包埋切5 μm切片。①HE染色观察牙龈上皮和固有层细胞凋亡情况;②Tunnel 染色观察凋亡细胞比率,细胞凋亡阳性表达位于细胞核,阳性染色为棕黄色或褐色,每张切片阳性细胞计数标准相同。高倍镜(×40)下,用10×10网格分别对牙龈上皮阳性细胞和视野下细胞总数计数,每张切片观察5 个视野,计算基底层和棘层凋亡阳性细胞表达百分率,PI=阳性细胞数/细胞总数×100%。
1.4.3 IL-1β和TNFα的IHC染色和显微分光光度计定量 对固定包埋牙龈组织,5 μm连续切片,脱蜡,3%过氧化氢孵育,滴加山羊血清封闭非特异性抗体,加一抗(1∶100),4 ℃冰箱过夜。滴加生物素标记二抗、辣根酶标记链霉卵白素工作液,室温孵育各15 min;DAB显色,苏木素复染,固定封片;以PBS代替一抗做空白对照。阳性细胞胞质内见黄褐色颗粒,高倍镜下每切片选5 个视野,计数200 个细胞中阳性细胞数,计算阳性细胞率=阳性细胞数/细胞总数×100%。
用MPV-3 型显微分光光度计对IHC染色切片测定牙龈上皮层和固有层IL-1β和TNFα表达量,测定方法参照陈铁楼[6]方法。
1.4.4 透射电镜观察[7]将4%多聚甲醛固定牙龈组织脱水和树脂包埋,常规超薄切片,醋酸铀、枸橼酸铅染色,透射电镜观察。
1.5 统计学处理
用SPSS 13.0软件分析,2 组间比较采用两样本t检验和方差分析,P<0.05为有统计学意义。
2 结 果
2.1 牙周临床指标
DAP组SBI,GI,PD,AL均高于H组(P<0.01,表 1)。

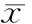

注: 与H组比, ①P<0.01
2.2 HE染色结果
DAP组牙龈上皮钉突增生并连接呈网状,上皮层基底细胞和棘细胞凋亡细胞较多(图 1A),固有层大量炎症细胞浸润,以巨噬细胞和淋巴细胞多见。胶原纤维排列紊乱,部分纤维断裂、水肿变性,血管增生;H组牙龈上皮未见明显细胞凋亡,固有层炎细胞少,胶原纤维排列整齐(图 1B)。
2.3 超微结构变化
DAP组凋亡细胞核固缩与胞质分离出现间隙,内质网疏松形成空泡,细胞质浓缩,线粒体肿胀(图 1C),严重时胞膜内陷形成凋亡小体。H组胶原纤维排列整齐,成纤维细胞内线粒体和内质网未见明显水肿和变性,无明显核固缩(图 1D)。
2.4 TUNEL结果
DAP组阳性细胞位于基底细胞层和棘细胞层,染为强阳性(图 1E),阳性细胞数明显多于H组(图 1F);DAP组牙龈上皮层凋亡细胞指数(57.9%)显著高于H组(25.3%,表 2)。

图 1 2 组牙龈组织中凋亡细胞 (A、D: ×400; C: ×600; F: ×200)
Fig 1 Cell apoptosis of human gingival tissue of the 2 groups (A,D: ×400; C: ×600; F: ×200)
表 2 2 组牙龈上皮层凋亡细胞率比较

Tab 2 Comparison of apoptosis cell ratio in gingival epithelium between 2 groups
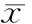
(±s,%)
注: ①与H组比,P<0.01

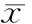

注: ①与H组比,P<0.01
2.5 IHC染色定量
DAP组牙龈固有层IL-1β和TNFα染色均显示强阳性,阳性细胞为巨噬细胞、浆细胞和淋巴细胞(图 2A~C),TNFα在上皮基底细胞层也有阳性细胞(图 2C);H组炎细胞少,IHC染色IL-1β和TNFα呈阴性(图 2D)或弱阳性。根据Lamber-Beer定律,组织中IL-1β和TNFα含量可用吸光度值来反映,DAP组牙龈组织中IL-1β和TNFα吸光度值明显大于H组(表 3)。

图 2 IHC染色测定2 组牙龈IL-1β和 TNFα表达 (×200)
Fig 2 IL-1β and TNFα expression in human gingival tissue examined by IHC staining (×200)
3 讨 论
Kerr[8]于1972 年首次提出细胞凋亡为细胞收缩和核浓缩,伴有特异蛋白降解。据报道,伴放线放线杆菌可导致牙龈上皮细胞凋亡[9],牙龈卟啉菌产生蛋白酶可诱导牙龈成纤维细胞凋亡[10]。本研究发现,DAP组牙龈上皮层基底细胞和棘细胞凋亡,牙龈组织凋亡细胞比率明显大于对照组;电镜发现凋亡细胞体积变小,线粒体肿胀,胞膜内陷,核染色体固缩,表明DAP牙龈上皮细胞出现明显凋亡。
Alikhani[11]报道,细菌脂多糖在TNFα作用下可增加Caspase-8活性,促进成纤维细胞凋亡。牙龈卟啉单胞菌侵入牙龈上皮2h时,凋亡促进蛋白Bax瞬时增加。牙周厌氧菌能激活人单核细胞产生IL-1β,刺激成纤维细胞产生胶原酶和前列腺素E2,诱导骨吸收。炎症时中性粒细胞浸润和激活,合成和释放TNFα和IL-1β增多,促进炎症反应。糖尿病长期高血糖导致活性氧族生成,直接损伤牙周组织或胰岛β细胞,激活氧化应激敏感信号通路,包括NF-kB、蛋白激酶C(protein kinase C,PKC)等通路,导致TNFα等炎性细胞因子产生并激活胶原酶和破骨细胞引起牙周组织破坏[12]。本研究发现DAP牙龈固有层IL-1β和TNFα表达增强,主要阳性细胞为巨噬细胞、浆细胞、淋巴细胞;牙龈IL-1β和TNFα表达与SBI和GI显著正相关。
我们知道,IL-1β和TNFα为炎症细胞因子可促进炎细胞浸润,正反馈调节炎症因子加重牙周炎。He等[13]将牙眼叶啉单胞菌接种于糖尿病小鼠颅骨发现糖尿病组新骨形成被抑制。AI-Mashat等[14]报道,糖尿病可增加前凋亡基因表达和caspase活性,促进成纤维细胞和成骨细胞凋亡,引起DAP牙周组织破坏。DAP长期高血糖导致高级糖基化终产物增加,通过丝裂原活化蛋白激酶刺激细胞凋亡与细胞表面受体结合导致IL-1β和TNFα分泌,促进成纤维细胞凋亡,影响牙周组织修复[15]。本组资料表明DAP细胞凋亡和炎症组织破坏与组织中IL-1β和TNFα过表达相关。
[1] Chen TL, Xu EL, Xu H, et al. The influence of diabetes enhanced inflammation on cell apoptosis and periodontitis[J]. Adv Biosci Biotechnol, 2012, 3(6): 712-719.
[2] 孟焕新. 牙周病学[M]. 4版. 北京: 人民卫生出版社, 2013: 172-174.
[3] 吴嘉怡, 徐喆, 倪佳, 等. 牙周炎对Ⅱ型糖尿病大鼠胰岛细胞凋亡相关蛋白表达的影响[J].实用口腔医学杂志, 2014, 30(4): 464-468.
[4] Ozeki N, Kawai R, Yamaguchi H, et al. IL-1β-induced matrix metalloproteinase-13 is activated by a disintegrin and metalloprotease-28-regulated proliferation of human osteoblast-like cells[J]. Exp Cell Res, 2014, 323(1): 165-177.
[5] Expert committee on the diagnosis and classification of diabetes mellitus. Report of the expert committee on the diagnosis and classification of diabetes mellitus[C]. Diabetes Care, 2003, 26(Suppl 1): S5-S20.
[6] 陈铁楼, 周以钧, 吴织芬, 等. 牙周病患者牙龈组织中PGE2放免测定及免疫组化定量分析[J]. 牙体牙髓牙周病学杂志, 1995, 5(3): 141-143.
[7] 陈铁楼, 刘景昌, 王晓熙, 等. 高压氧对豚鼠实验性牙周炎作用的组织病理学研究[J]. 实用口腔医学杂志, 2002, 18(5): 418-420.
[8] Kerr JF, Wyllie AH, Currie AR. Apoptosis: A basic biological phenomenon with wide ranging implication in tissue kinetics[J]. Br J Cancer, 1972, 26(4): 239-257.
[9] Muro M, Koseki T, Akifusa S, et al. Role of CDl4 molecules in internalization of Actinobacillus actinomycetemcomitans by macrophages and subsequent induction of apoptosis[J]. Infect Immun, 1997, 65(4): 1147-1151.
[10] Wang PL, Shirasu S, Shinohara M, et al. Induction of apoptosis in human gingival fibroblasts by a Porphyromonas gingivalis protease preparation[J]. Arch Oral Biol, 1999, 44(4): 337-342.
[11]Alikhani M, Alikhani Z, Graves DT. Apoptotic effects of LPS on fibroblasts are indirectly mediated through TNFR1[J]. J Dent Res, 2004, 83(9): 671-676.
[12]赵海军, 陈铁楼, 张新海. 氧化应激诱发糖尿病性牙周炎作用及机制[J]. 口腔医学, 2016, 36(3): 273-276.
[13]He H, Liu R, Desta T, et al. Diabetes causes decreased osteoclastogenesis, reduced bone formation, and enhanced apoptosis of osteoblastic cells in bacteria stimulated bone loss[J]. Endocrinology, 2004, 145(1): 447-452.
[14] Al-Mashat HA, Kandru S, Liu R, et al. Diabetes enhances mRNA levels of proapoptotic genes and caspase activity, which contribute to impaired healing[J]. Diabetes, 2006, 55(2): 487-495.
[15] Liu R, Bal HS, Desta T, et al. Diabetes enhances periodontal bone loss through enhanced resorption and diminished bone formation[J]. J Dent Res, 2006, 85(6): 510-514.
Therelationshipbetweeninflammatoryfactorexpressionandcellapoptosisingingivaltissueofthesubjectswithdiabetesassociatedperiodontitis
CHENTielou1,ZHANGXinhai1,XUErli2,TANGDahai3,ZHAOHaijun1,XUYimin1,ZHANGXiaoli4,LUANWei1,LIUJin1,CHENJun1,MALiting1.
1. 200081Shanghai,DepartmentofPeriodontal,OralResearchCenterofPLA, 2.DepartmentofEndocrinology, 3.DepartmentofMedicalLaboratory, 4.DepartmentofPathology,Hospital411ofPLA,China
Objective: To study the relationship between IL-1β and TNFα expression and cell apoptosis in gingival tissue of the subjects with diabetes associated periodontitis(DAP).Methods20 cases of DAP(group DAP) and 20 cases of health controls(group H) were included. The cell apoptosis and the ultrastructural changes in gingival tissue were observed by Tunnel staining and transmission electron microscope(TEM). IL-1β and TNFα expression in gingival tissue were detected by immunohistochemical staining. SBI, GI,PD and AL of the subjects were measured. The relationship between the level of IL-1β,TNFα and the cell appotosis was analyzed.ResultsApoptosis was obvious in prickle cells and basal cells of gingival tissue of DAP group. The percentage of apoptosis cells of DAP group was significantly higher than that of group H(P<0.01). The expression of IL-1β and TNFα in group DAP was significant higher than that of group H(P<0.01), and the mainly positive expression cells were macrophages, plasmocytes and lymphocytes.ConclusionIL-1β and TNFα play a role in cell apoptosis in the gingival tissue of the patients with DAP.
Cellapoptosis;Diabetesassociatedperiodontitis(DAP);Inflammatorycytokine;Mechanism
总后面上项目(编号: CHJ13J035); 上海市卫计委项目(编号: 20134418); 上海市区重点课题(编号: 1002-04); 上海市区面上课题(编号: 1503-31)
200081 上海, 解放军411医院全军口腔中心牙周科(陈铁楼 张新海 赵海军 徐逸敏 栾玮 刘进 陈骏 马丽婷), 内分泌科(徐尔理), 医学检验科(唐大海), 病理科(张晓莉)
陈铁楼 021-81867179 E-mail: chentielou2010@sina.com
R780.2
A
10.3969/j.issn.1001-3733.2017.04.019
(收稿: 2016-10-12 修回: 2017-03-04)
